分析化学(第六版)总结
第二章 误差和分析数据处理
第一节 误差
定量分析中的误差就其来源和性质的不同,可分为系统误差、偶然误差和过失误差。
一、系统误差
定义:由于某种确定的原因引起的误差,也称可测误差
特点:①重现性,②单向性,③可测性(大小成比例或基本恒定)
分类:
1. 方法误差: 由于不适当的实验设计或所选方法不恰当所引起。
2. 仪器误差: 由于仪器未经校准或有缺陷所引起。
3. 试剂误差: 试剂变质失效或杂质超标等不合格 所引起
4. 操作误差: 分析者的习惯性操作与正确操作有一定差异所引起。
操作误差与操作过失引起的误差是不同的。
二、偶然误差
定义:由一些不确定的偶然原因所引起的误差,也叫随机误差. 偶然误差的出现服从统计规律,呈正态分布。
特点:
①随机性(单次)
②大小相等的正负误差出现的机会相等。
③小误差出现的机会多,大误差出现的机会少。
三、过失误差
1、过失误差:由于操作人员粗心大意、过度疲劳、精神不集中等引起的。其表现是出现离群值或异常值。
2、过失误差的判断——离群值的舍弃
a) 在重复多次测试时,常会发现某一数据与平均值的偏差大于其他所有数据,这在统计学上称为离群值或异常值。
b) 离群值的取舍问题,实质上就是在不知情的情况下,区别两种性质不同的偶然误差和过失误差。
离群值的检验方法:
(1)Q 检验法:该方法计算简单,但有时欠准确。
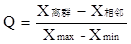 设有n个数据,其递增的顺序为x1,x2,…,xn-1,xn,其中x1或xn可能为离群值。
设有n个数据,其递增的顺序为x1,x2,…,xn-1,xn,其中x1或xn可能为离群值。
当测量数据不多(n=3~10)时,其Q的定义为
具体检验步骤是:
1) 将各数据按递增顺序排列;2)计算最大值与最小值之差;3)计算离群值与相邻值之差;
4) 计算Q值;5)根据测定次数和要求的置信度,查表得到Q表值;6)若Q >Q表,则舍去可疑值,否则应保留。
该方法计算简单,但有时欠准确。
(2)G检验法:该方法计算较复杂,但比较准确。
具体检验步骤是:
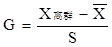
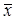 1)计算包括离群值在内的测定平均值
1)计算包括离群值在内的测定平均值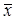 ;2)计算离群值与平均值 之差的绝对值
;2)计算离群值与平均值 之差的绝对值
3)计算包括离群值在内的标准偏差S4)计算G值。
5)若G > Gα,n ,则舍去可疑值,否则应保留
第二节 测量值的准确度和精密度
一、准确度与误差
1.准确度:指测量结果与真值的接近程度,反映了测量的正确性,越接近准确度越高。系统误差影响分析结果的准确度 。
2.误差:准确度的高低可用误差来表示。误差有绝对误差和相对
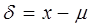 误差之分。
误差之分。
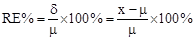 (1)绝对误差:测量值x与真实值μ之差
(1)绝对误差:测量值x与真实值μ之差
(2)相对误差:绝对误差占真实值的百分比
3.真值与标准参考物质
任何测量都存在误差,绝对真值是不可能得到的,我们常用的真值是
1) 理论真值:如三角形的内角和为180°等。
2) 约定真值:由国际权威机构国际计量大会定义的单位、数值,如 时间、长度、原子 量、物质的量等,是全球通用的
3) 相对真值:由某一行业或领域内的权威机构严格按标准方法获得的测量值,如卫生部药品检定所派发的标准参考物质,应用范围有一定的局限性。
4) 标准参考物质:具有相对真值的物质,也称为标准品,标样,对照品。应有很好的均匀性和稳定性,其含量测量的准确度至少要高于实际测量的3倍。
二、精密度与偏差
1.精密度:平行测量值之间的相互接近程度,反映了测量的重现性,越接近精密度越高。偶然误差影响分析结果的精密度,
2.偏差精密度的高低可用偏差来表示。
 偏差的表示方法有
偏差的表示方法有
(1)绝对偏差 :单次测量值与平均值之差: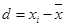
 (2)平均偏差:绝对偏差绝对值的平均值
(2)平均偏差:绝对偏差绝对值的平均值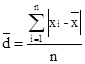
(3)相对平均偏差:平均偏差占平均值的百分比: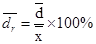

 (4)标准偏差
(4)标准偏差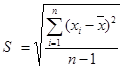
(5)相对标准偏差(RSD, 又称变异系数CV )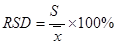
 (必考相关大题)例:用邻二氮菲显色法测定水中铁的含量,结果为10.48, 10.37, 10.47, 10.43, 10.40 mg/L; 计算单次分析结果的平均偏差,相对平均偏差,标准偏差、相对标准偏差和置信区间(95%和99%)。(相关题目,此题做不成)
(必考相关大题)例:用邻二氮菲显色法测定水中铁的含量,结果为10.48, 10.37, 10.47, 10.43, 10.40 mg/L; 计算单次分析结果的平均偏差,相对平均偏差,标准偏差、相对标准偏差和置信区间(95%和99%)。(相关题目,此题做不成)
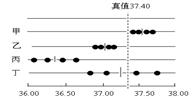 三、准确度与精密度的关系
三、准确度与精密度的关系
1. 准确度高,一定要精密度好
2. 精密度好,不一定准确度高。只有在消除了系统误差的前提下,精密度好,准确度才会高
四、误差的传递:误差的传递分为系统误差的传递和偶然误差的传递。
1.系统误差的传递
①和、差的绝对误差等于各测量值绝对误差的和、差
R = x + y -z δR=δx+δy-δz
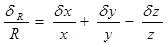 ②积、商的相对误差等于各测量值相对误差的和、差
②积、商的相对误差等于各测量值相对误差的和、差
R = x y / z
2.偶然误差的传递
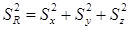 ①和、差结果的标准偏差的平方,等于各测量值的标准偏差的平方和。
①和、差结果的标准偏差的平方,等于各测量值的标准偏差的平方和。
R = x + y -z
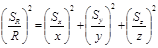 ②积、商结果的相对标准偏差的平方,等于各测量值的相对标准偏差的平方和。
②积、商结果的相对标准偏差的平方,等于各测量值的相对标准偏差的平方和。
R = x y / z
3.测量值的极值误差
在分析化学中,若需要估计一下整个过程可能出现的最大误差时,可用极值误差来表示。它假设在最不利的情况下各种误差都是最大的,而且是相互累积的,计算出结果的误差当然也是最大的,故称极值误差。
五、提高分析结果准确度的方法
1、系统误差的判断与评估
(1)对照试验:选用组成与试样相近的标准试样,在相同条件下进行测定,测定结果与标准值对照,判断有无系统误差,又可用此差值对测定结果进行校正。
(2)回收试验:其结果用于系统误差的评估,不能用于结果的校正。
2、消除系统误差的方法
(一)选择恰当的分析方法,消除方法误差:不同方法,其灵敏度、准确度、精密度和选择性是不相同的,应根据待测组分的含量、性质、试样的组成及对准确度的要求来选择,还要考虑现有条件和分析成本。
(二)校准仪器,消除仪器误差:对砝码、移液管、酸度计等进行校准,消除仪器引起的系统误差
(三)采用不同方法, 减小测量的相对误差
(四)空白实验,消除试剂误差:在不加试样的情况下,按试样分析步骤和条件进行分析实验,所得结果为空白值,从试样测定结果中扣除即可以消除试剂、蒸馏水和容器引入的杂质。
(五)遵守操作规章,消除操作误差
3、减小偶然误差的方法:增加平行测定次数,用平均值报告结果,一般测3~5次。
第三节 有效数字及其运算法则
一、有效数字
1.定义:为实际能测到的数字。有效数字的位数和分析过程所用的测量仪器的准确度有关。
有效数字=准确数字+ 最后一位欠准的数(±1)
如滴定管读数23.57ml,4位有效数字。称量质量为6.1498g,5位有效数字
2. “0”的作用:作为有效数字使用或作为定位的标志。
例:滴定管读数为20.30毫升, 有效数字位数是四位。表示为0.02030升,前两个0是 起定位作用的,不是有效数字,此数据仍是四位有效数字。
3. 规定
(1)改变单位并不改变有效数字的位数。20.30ml 0.02030L
(2)在整数末尾加0作定位时,要用科学计数法表示。
例:3600 → 3.6×10 3 两位 → 3.60×10 3三位
(3)在分析化学计算中遇到倍数、分数关系时,视为无限多位有效数字。
(4)pH、pC、logK等对数值的有效数字位数由小数部分数字的位数决定。
[H+]= 6.3×10 -12 [mol/L] → pH = 11.20 两位
(5)首位为8或9的数字,有效数字可多计一位。例92.5可以认为是4位有效数;
二、有效数字的修约规则
1. 基本规则:四舍六入五成双:当尾数≤4时则舍,尾数≥6时则入;尾数等于5而后面的数都为0时,5前面为偶数则舍,5前面为奇数则入;尾数等于5而后面还有不为0的任何数字,无论5前面是奇或是偶都入。
例:将下列数字修约为4位有效数字。
0.526647--------0.5266 10.23500--------10.24 250.65000-------250.6
18.085002--------18.09 3517.46--------3517
2. 一次修约到位,不能分次修约
错误修约:4.1349 → 4.135 → 4.14 正确修约:4.1349 → 4.13
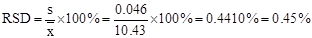 3. 在修约相对误差、相对平均偏差、相对标准偏差等表示准确度和精密度的数字时,一般取1~2位有效数字,只要尾数不为零,都可先多保留一位有效数字,从而提高可信度
3. 在修约相对误差、相对平均偏差、相对标准偏差等表示准确度和精密度的数字时,一般取1~2位有效数字,只要尾数不为零,都可先多保留一位有效数字,从而提高可信度
三、有效数字的运算法则
(一)加减法:以小数点后位数最少的数为准(即以绝对误差最大的数为准)
例: 50.1 + 1.45 + 0.5812 = 52.1
δ ±0.1 ±0.01 ±0.0001
(二)乘除法:以有效数字位数最少的数为准(即以相对误差最大的数为准)
δ ±0.0001 ±0.01 ±0.00001
例: 0.0121 × 25.64 × 1.05782 = 0.328
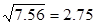
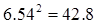 RE ±0.8% ±0.4% ±0.009%
RE ±0.8% ±0.4% ±0.009%
(三)乘方、开方:结果的有效数字位数不变
(四)对数换算:结果的有效数字位数不变
[H+]= 6.3×10 - 12 [mol/L] → pH = 11.20 两位
四、在分析化学中的应用
1.数据记录:如在万分之一分析天平上称得某物体重0.2500g,只能记录为0.2500g,不能记成0.250g或0.25g。又如从滴定管上读取溶液的体积为24mL时,应该记为24.00mL,不能记为24mL或24.0 mL。
2.仪器选用:若要称取约3.0g的样品时,就不需要用万分之一的分析天平,用十分之一的天平即可。
3.结果表示:如分析煤中含硫量时,称样量为3.5g。两次测定结果:
甲为0.042%和0.041%;乙为0.04201%和0.04199%。显然甲正确,而乙不正确。
第四节 分析数据的统计处理
 一、偶然误差的正态分布
一、偶然误差的正态分布
偶然误差符合正态分布, 正态分布的概率密度函数式:
正态分布的两个重要参数:
(1)μ为无限次测量的总体均值,表示无限个数据的集中趋势(无系统误差时即为真值)
(2)σ是总体标准偏差,表示数据的离散程度
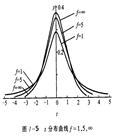
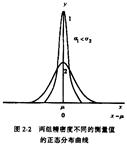 特点:
特点:
1. x =μ时,y 最大
2. 曲线以x =μ的直线为对称
3. 当x →﹣∞或﹢∞时,曲线以x 轴为渐近线
4. σ↑,y↓, 数据分散,曲线平坦;σ↓,y↑, 数据集中,曲线尖锐
5. 测量值都落在-∞~+∞,总概率为1
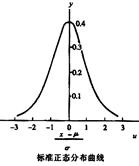
 为了计算和使用方便,作变量代换
为了计算和使用方便,作变量代换
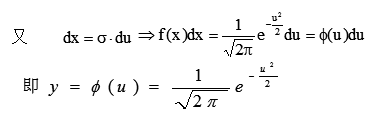
 以u为变量的概率密度函数表示的正态分布曲线称为标准正态分布曲线(u分布),此曲线的形状与σ大小无关
以u为变量的概率密度函数表示的正态分布曲线称为标准正态分布曲线(u分布),此曲线的形状与σ大小无关
二、t分布曲线
在t分布曲线中,纵坐标仍为概率密度,横坐标是统计
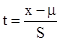
 量t而不是u。t定义为 或
量t而不是u。t定义为 或
t分布曲线随自由度f=n-1变化,当n→∞时,t分布曲线即是正态分布。
三、平均值的精密度和置信区间
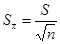 (一)平均值的精密度
(一)平均值的精密度
 平均值的标准偏差
平均值的标准偏差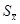 与样本的标准偏差(即单次测量值的标准偏差)S的关系:
与样本的标准偏差(即单次测量值的标准偏差)S的关系:
(二)平均值的置信区间
我们以x为中心,在一定置信度下,估计μ值所在的范围(x±tS),称为单次测量值的置信区间: μ=X±ts
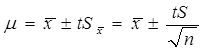
 我们以
我们以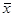 为中心,在一定置信度下,估计μ值所在的范围
为中心,在一定置信度下,估计μ值所在的范围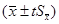 称为平均值的置信区间:
称为平均值的置信区间:
注意:
1. 置信度越大且置信区间越小时,数据就越可靠
2. 置信度一定时,减小偏差、增加测量次数以减小置信区间
3. 在标准偏差和测量次数一定时,置信度越大,置信区间就越大
四、显著性检验
在分析工作中常碰到两种情况:1用两种不同的方法对样品进行分析,分析结果是否存在显著性差异; 2不同的人或不同单位,用相同的方法对试样进行分析,分析结果是否存在显著性差异。这要用统计的方法加以检验。
(一) F检验:比较两组数据的方差(S2),确定它们的精密度是否存在显著性差异,用于判断两组数据间存在的偶然误差是否显著不同。(用来做什么?考点)
 检验步骤:
检验步骤:
计算两组数据方差的比值F,
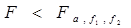
 查单侧临界临界值
查单侧临界临界值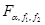 比较判断:
比较判断:
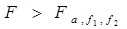 两组数据的精密度不存在显著性差别,S1与S2相当。
两组数据的精密度不存在显著性差别,S1与S2相当。
两组数据的精密度存在着显著性差别,S2明显优于S1。
(二)t 检验:将平均值与标准值或两个平均值之间进行比较,以确定它们的准确度是否存在显著性差异,用来判断分析方法或操作过程中是否存在较大的系统误差。(用来做什么?考点)
1. 平均值与标准值(真值)比较
检验步骤:
a)  计算统计量t,
计算统计量t,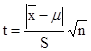 b)查双侧临界临界值
b)查双侧临界临界值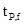
比较判断:
1) 当t ≥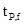 时,说明平均值与标准值存在显著性差异,分析方法或操作中有较大的系统误差存在,准确度不高;
时,说明平均值与标准值存在显著性差异,分析方法或操作中有较大的系统误差存在,准确度不高;
2) 当t <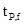 时,说明平均值与标准值不存在显著性差异,分析方法或操作中无明显的系统误差存在,准确度高。
时,说明平均值与标准值不存在显著性差异,分析方法或操作中无明显的系统误差存在,准确度高。
2. 平均值与平均值比较:两个平均值是指试样由不同的分析人员测定,或同一分析人员用不同的方法、不同的仪器测定。
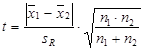 检验步骤:
检验步骤:
计算统计量t,

式中SR称为合并标准偏差:
查双侧临界临界值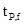 (总自由度 f =n1+n2-2)
(总自由度 f =n1+n2-2)
比较判断:
当t ≥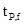 时,说明两个平均值之间存在显著性差异,两个平均值中至少有一个存在较大的系统误差;
时,说明两个平均值之间存在显著性差异,两个平均值中至少有一个存在较大的系统误差;
当t < 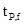 时,说明两个平均值之间不存在显著性差异,两个平均值本身可能没有系统误差存在,也可能有方向相同、大小相当的系统误差存在。
时,说明两个平均值之间不存在显著性差异,两个平均值本身可能没有系统误差存在,也可能有方向相同、大小相当的系统误差存在。
注意:要检查两组数据的平均值是否存在显著性差异,必须先进行 F 检验,确定两组数据的精密度无显著性差异。如果有,则不能进行 t 检验。

第二篇:分析化学中的误差及解决办法
西 部 煤 化 工 20xx年 第 1 期
分析化学中的误差及解决办法
屈志英
(陕西渭河煤化工集团有限责任公司, 陕西渭南,714000)
摘 要
在分析检验工作中,最终目的是报出准确可靠的分析数据。不准确的分析结果会导致产品报废,资源浪费,甚至在
科学上得出错误结论。但是在分析过程中,即使技术很熟练的人,用同一方法对同一试样仔细进行多次分析,也不能得到完全一致的分析结果,这就是说分析过程中误差是客观存在的。作为一名分析工作者,必须掌握和了解误差产生的原因和规律,掌握分析数据的科学处理方法,尽可能减少误差提高分析结果的准确度。
关键词 分析化学; 分析误差; 允许差值; 准确度
即为中位数。能简便直观说明一组数据的结果。 2.4 准确度和精密度
分析结果和真实值之间的差值称为误差。误差越小,分析结果的准确度越高。精密度表示各次分析结果相互接近的程度。在分析化学中,有时用重复性和再现性表示不同情况下分析结果的精密度。准确度高一定需要精密度高,但是精密度高不一定准确度高。 2.5 误差和偏差
测定结果与真实值之间的差值成为误差。误差越小,分析结果的准确度越高;误差越大,分析结果的准确度越低。实际工作中,一般要进行多次平行测定,求得分析结果的算术平均值。 2.6 极差
一组数据中,最大值减去最小值之差称为极差,有成全距或范围误差。 2.7 系统误差和随机误差
系统误差:是由某种固定的原因所造成,具有重复性,单向性,基本恒定不变。系统误差的大小,正负,在理论上讲是可以测定的,所以有称可测误差。
随机误差:又称偶然误差,是由一些随机的偶然的原因造成的。因为由不确定的原因造成,因而是可变的,有时大,有时小,有时正,有时负,又称不定误差。随机误差难以找到原因,似乎没有规律性,但如果进行多次测定,便会发现数据的分布符合一般统计规律,这种规律是“概率统计学研究的内容” 研究的内容。 2.8 置信概率
是一个有一定分布的统计量落在一个接受域
在分析化学中,被测组分的分析结果是根据试样的量,测量所得数据及分析过程中有关的计量关系,通过计算得出的。在分析检验工作中,最终目的是报出准确可靠的分析数据。不准确的分析结果会导致产品报废,资源浪费,甚至在科学上得出错误结论。分析过程中,即使技术很熟练的人,用同一方法对同一试样仔细进行多次分析,也不能得到完全一致的分析结果。这就是说分析过程中误差是客观存在的。因此,在进行定量测定时,必须对分析结果进行评价,判断其准确性,检查产生误差的原因,采取减小误差的有效措施,使测定结果尽量接近真值。
1 分析误差的分类
根据误差产生的性质和原因,可以将误差分为系统误差,偶然误差,过失误差3类。系统误差是可以检定和校正的,偶然误差是可以控制的,过失误差是完全可以避免的。
2 术语 2.1 真值
某一物理量本身具有的客观存在的真实数据,即为该量的真值。一般说来,真值是未知的,但下列情况的真值可以认为是知道的。理论真值,计量学约定真值,相对真值。 2.2 平均值
n次测量数据的算术平均值。虽然不是真值,但比单次测量结果更接近真值。 2.3 中位数
一组测量数据按照大小顺序排列,中间一个数
-60-
西 部 煤 化 工 20xx年 第 1 期 范围内的概率。如置信概率为95%表示在许多次测定结果中,约有95%落在规定的范围内,约有5%次数不在规定范围内。 2.9 公差
公差也称允差,是指某分析方法所允许的平行测定分析结果之间的绝对偏差。
公差的数值是将多次测得的分析数据经过数理统计方法处理而确定的,是生产实践中用以判断分析结果是否合格的依据,若2次平行测定的数值之差在规定允差的绝对值2倍以内,认为该结果有效,如果测定结果超出允许的公差范围,称为结果超差,应重新进行分析。
在各种标准分析方法中,公差的规定不尽相同,除上述表示方法外,还有用相对误差表示,或用绝对误差表示,要看公差的具体规定。
表1 待测组分含量与公差范围的关系 (%)
待测组分的质量分数 公差(相对误差)
90 80 40 20 10 5 1.0 0.1 0.01 0.001 0.3 0.4 0.6 1.0 1.2 1.6 5.0 20 50 100
3 影响公差的因素
公差是生产部门对于分析结果允许误差的一种表示方法,公差范围的确定与许多因素有关。
首先是根据实际情况对分析结果准确度的要求。一般工业分析,允许相对误差在百分之几到千分之几。而对相对原子质量的测定,要求相对误差就小得多。
其次公差范围常依试样组成及待测组分含量而不同。组成愈复杂,引起误差的可能性就愈大,允许的公差范围则宽一些。
此外,各主管部门还对每一项具体的分析项目规定了具体的公差范围,往往以绝对误差来表示。
一般工业分析中,待测组分含量与公差范围的关系见表1。例如,对钢中硫含量分析的允许公差范围规定见表2。
表2 钢中硫含量分析的允许公差范围 (%)
硫的质量分数 公差(绝对误差)
≤0.020 0.020~0.050 0.050~0.100 0.100~0.200 ±0.002
±0.004
±0.006
±0.010
≥0.200 ±0.015
4 允许差值的制定 4.1 重复性
国际标准化组织(ISO)对重复性进行了定性和定量的定义
定性定义:用相同的方法,同一实验材料,在相同条件下获得的一系列结果之间的一致程度。相同的条件指同一操作者,同一设备,同一实验室和短暂的时间间隔。
定量定义:指一个数值,在上述条件下得到的两次实验结果之间的绝对值以某个指定的概率低于这个数值。除非另外指出,一般指定的概率为0.95。 4.2 再现性
国际标准化组织(ISO)对再现性进行了定性和定量的定义
定性定义:用相同的方法,同一实验材料,在不同条件下获得的单个结果之间的一致程度。不同
条件指不同操作者,不同设备,不同实验室,不同或相同的时间。
定量定义:指一个数值,用相同的方法,同一实验材料,在上述的不同条件下得到的两次实验结果之差的绝对值以某个指定的概率低于这个数值。除非另外指出,一般指定的概率为0.95。 4.3 测定结果
在目前的化工产品标准中,一般规定以样品平行测定结果的绝对差值不大于xx值,取其平均值为测定结果。
不同实验室之间测定结果的绝对差值不大于xx值,这个允许差值是根据GB4471---89《化工产品试验方法精密度室间试验重复性和再现性的确定》和GB6379---86《测定方法的精密 通过实验室间实验确定标准测试方法的重复性和再现性》来制定的。
重复性r = 2.83 Sr(重复性标准偏差)
-61-
西 部 煤 化 工 20xx年 第 1 期 重复性含义可以理解为:在重复性条件下,测定同一样品,测得任意两个结果的绝对差值超过r值得可能性只有5%。
再现性R= 2.83 SR(重复性标准偏差) 再现性含义可以理解为:在相同的方法,在不同条件下测定相同的样品,测得任意两个结果的绝对差值超过R值得可能性只有5%。
5 误差实际应用案例
例1:尿素及其测定方法GB2440-2001中缩二脲含量测定 分光光度法 有关分析结果的描述:平行测定结果的绝对差值不大于0.05%;不同实验室测定结果的绝对差值不大于0.08%;多年的分析结果证明,实际工作中基本能控制在0.03%以内(在同一实验室)。
例2:煤的工业分析方法GB/T212-2001中灰分测定的精密度表3
表3 灰分测定的重复性和再现性 (%) 灰分 <15.00 15.00~30.00 >30.00
重复性限Aad
再现性临界差Ad
6 提高分析结果准确度的方法 6.1 选择合适的分析方法
各种分析方法的准确度是不相同的。化学分析法对高含量组分的测定,能获得准确和较满意的结果。例如用K2Cr2O7滴定法测得铁的质量分数为40.20%,若方法的相对误差为0.2%,则铁的质量分数范围是40.12%~40.28%。这一试样如果用直接比色法进行测定,由于方法的相对误差为2%,测得铁的质量分数范围将在41.0%~39.4%之间,误差显然大得多。但对于低含量组分的测定,允许有较大的相对误差,所以这时采用仪器分析法是比较合适的。
所以在选择分析方法时,主要根据组分含量及对准确度的要求,在可能的条件下选择最佳的分析方法。
6.2 增加平行测定次数,减少随机误差
在消除系统误差的前提下,平行测定次数愈多,平均值愈接近真值。在一般化学分析中,要求
2~4次,实际工作中样品平行测定2次,
结果取平均值。在标准滴定溶液浓度的标定中,规定由两人以上各做4次平行样,平行实验次数不少于8次。一些特殊测定要根据实验要求加以具体考虑。
6.3 消除测量中的系统误差 6.3.1 对照实验
6.3.1.1 用已知准确结果的样品与被测样品一起进行对照实验。
其中标准物质和标准样品是极为重要的一种量具。标准物质作为量值的传递工具,是指一种物质其特定物性或组成的标准值已由特定机关或组织确定,用作测定或分析的标准。中国对标准物质的编号为:GBW;标准样品的编号为:GSB;两者都是实物标准,也称为标样。可以用来校正分析仪器,评价分析方法的准确性,协同多个实验室的操作,控制分析质量等多种用途。目前质检部原材料岗位有标准物质30种,标液岗位有标准物质10种,标准气体20种,用于实际分析工作。
在实际工作中,作为一种管理手段,生产单位也可以根据产品情况自制一些“管理样品”来代替标准样品。即经过多人反复多次分析,其中各组分
0.20 0.30 平行测定0.30 0.50 0.50 0.70
例3:两人标定氢氧化钾—乙醇标准滴定溶液的数值见表4(在同一实验室)。
表4 标准滴定溶液误差要求
标定数值和计算数值,mol/L
检验人员1
检验人员2
0.10199 0.10202 0.10203 0.10201 0.10207 0.10199 0.10202 0.10209
极差相对值0.08%
两人极差相对值0.10%
0.10%
从表4看两位检验人员所得极差相对值分别为0.08%和0.10%,其重复性能符合GB/T601-2002《化学试剂标准滴定溶液的制备》的要求,即〔CrR95(4)〕≤0.15;两人极差相对值为0.10%,其室内两人重复性能符合GB/T601-2002《化学试剂标准滴定溶液的制备》的要求,即〔CrR95(8)〕≤0.18。
-62-
西 部 煤 化 工 20xx年 第 1 期 含量相对比较可靠,用来对照不同分析者之间是否存在系统误差,以及当分析仪器,试剂溶液更换时进行对照实验。
例如:水质分析岗位的K,Na等微量离子标准溶液,色谱分析仪使用的液体标准溶液,水中含0.06%甲醇等。
6.3.1.2 用标准方法或不同类型的方法进行对照实验
在分析化学中,由于标准物质的数量限制,以及标准物质集基体常与试样基体相差很大,因此常常采用标准方法或不同类型的方法进行对照试验。一般选用国家颁布的标准方法或工人的经典方法。
例如:使用DL-32水分测定仪和气相色谱分析甲醚产品中水分进行对照实验;使用快速工业分析仪和马弗炉重量法分析煤中灰分等。
分析方法对照试验一般采用试验室内可疑结果的复查判断,试验室间不同分析结果的仲裁,多方参与协作的标准定值以及分析方法的改进和新方法的建立等工作中。
20xx年尿素标准样品参加单位和参加定值单位 研制单位:国家化肥质量监督检验中心(上海) 参加定值单位:锦西天然气化工有限责任公司 陕西渭河煤化工有限责任公司 浙江省化工产品质量检验站有限公司 贵州赤天化股份有限公司 四川天华股份有限公司 山东省产品质量监督检验研究院 江苏省产品质量监督检验中心所 国家化肥质量监督检验中心(上海)
本尿素标准样品采用8个单位进行协同定值。定值单位均通过ISO9000质量保证体系认证的大型尿素生产企业和通过ISO/IEC15000实验室认可的研究院(所)及检测中心。随机抽取8瓶样品,每个定值单位测定一瓶,每瓶测3个项目,每个项目报两个独立数据。经数理统计,计算出标准值和标准偏差。
总氮含量(以湿基计):标准值:46.46% 标准偏差(置信度95%):0.057(%) 总平均值的扩展不确定度:0.020% 缩二脲含量:标准值:0.72% 标准偏差(置信度95%):0.029(%)
+
+
总平均值的扩展不确定度:0.012% 水分含量:标准值:0.24%
标准偏差(置信度95%):0.045(%) 总平均值的扩展不确定度:0.019% 6.3.1.3 加标回收率方法检验
即取两等分试样,在一份中加入一定量待测组分的纯物质,用相同的方法进行测定,计算测定结果和加入纯物质的回收率,以检验分析方法的可靠性。这种方法在实际工作中经常用到。 6.3.2 空白实验
在不加被测组分的情况下,按照试样分析同样的操作步骤和条件进行试验,所得结果为空白值。从试样分析结果中扣除空白值,实际工作中所有的比色分析都有空白值,一些容量分析也要消除滴定空白。当空白值较大时,应通过提纯试剂和选用其它方法来进行分析。
例如;分析脱盐水中的铜和铁离子,就需要高纯水作空白。 6.3.3 校准仪器
分析仪器不准确引起的仪器误差,应当通过校准仪器来消除。
例如:分析天平应定期校准,容量分析中的移液管,容量瓶,滴定管等都应在一定温度下进行校正。实际工作中的氨吸收仪,二氧化碳快速测定仪,氧纯度吸收仪等都需要进行校正;气相色谱仪使用标准气体或液体进行校准,pH计及pNa计等分析仪器要使用标准溶液进行定位校准,才能得到准确数据。
质检部现有A类(强制检定)分析仪器74台,B类(次等重要)分析仪器105台,C类(一般重要)分析仪器39台,全部纳入计量体系运行管理,每台仪器都有校准周期,自校仪器有17类,编写有校准规范,校准周期及各种记录,确保每台分析仪器都在有效管理状态下运行,为得到准确分析结果奠定坚实基础。 6.4 具备高度责任心
主要由粗心,操作错误,不知引起的误差为过失误差,是可以避免和纠正的。
作为分析人员,不但要具备应有的专业知识和操作技能,还要具备虚心学习和积极进取的良好心
【下转第73页】
-63-
西 部 煤 化 工 20xx年 第 1 期 稳定的,这就给档案安全工作带来了很大隐患,要解决这个问题必须从二方面着手:第一方面是硬件设施的配备。配备相适应的档案装具、防火设施、防盗设施、温湿度计、除湿机、防虫药物等。第二方面是加强库房的日常管理。把安全检查与平时的库房管理有机结合起来,做好库房温湿度的测记,防止档案发潮发霉;做好防火防盗工作,对档案库房的防火设施和易产生火源的设施、物品进行认真清理检查,重点检查电力线路、电器设备的安全性能、检查灭火系统、器材的有效性,并做好记录;库房内严禁堆放杂物,禁止把火源带入档案库房内,以防火灾发生;定期对档案库房进行检查,每月对库存档案进行清点、整理、登记造册,做到家底清晰,保证帐目相符,档案齐全完整。
5 强化档案工作人员的安全防范意识,提高应变反应能力
【上接第63页】
态,更要具备精益求精和承担责任的工作作风。在实际工作中,要做到不断学习岗位知识和技能,善于请教和沟通,具备责任心,出色地完成自己的本质工作,协助他人共同完成每一项工作阶段目标。
7 结束语
本文讨论了误差的分类,误差产生的原因,提高分析结果准确度的方法。分析过程中由于一些偶然因素造成的偶然误差,虽然其产生的原因难以说明,但通过数理统计的方法研究其规律后,仍然是可以控制的,如果您有兴趣,可以继续进行误差的分布规律,平均值的可靠性,误差的传递及计算结果的误差,置信概率,不确定度的评定等更深层次的统计学范畴延伸。
作为分析工作者,必须掌握和了解误差产生的原因和规律,科学运用提高分析结果准确度的方法,掌握分析数据的科学处理方法,从了解误差到掌握规律,再到运用合适方法消除误差,尽可能减
社.1997
2 刘 珍. 化验员读本(上册). 化学分析. 北京:化学工业出版社.2008
3 武汉大学. 分析化学(第4版). 北京:高等教育出版社.2002
在有些企业,档案工作人员的安全意识很淡薄,认为档案安全和自己没有关系,针对这种情况,组织一些档案安全知识方面的竞赛,可以全面提高档案工作人员对档案安全知识掌握情况,也能引起他们对档案安全的重视。另外,定期举行消防演练活动,通过实际操作,提高突发事件应变处置能力。
综上所述,档案安全工作已经纳入到我们档案工作者的日常工作,做为企业档案,要与企业的安全相提并论,加大对档案安全的宣传力度,使档案能更好的为企业服务,为企业各项工作保驾护航。W
参考文献
1 宫晓东 主编.企业档案管理学.高等教育出版社:19xx年
2 范园园. 浅议档案风险及安全管理. 兰台世界 .20xx年6月下半月 3 高伟华.谢品贤.黄磊 企业信息安全微探 20xx年第5期
少误差提高分析结果的准确度。更好地为生产服务,真正做到“工艺的眼睛,质量的卫士”。以上所写的都是各位同行和专家做过的和正在做的工作,理论知识运用到实践操作中,需要定期进行归纳和总结,才能做到融会贯通,学以致用,将复杂的知识变得简单。
今年的计量体系审核,对质检部的高度控制测量过程又进行了细化,增加测量过程监视记录和测量设备计量确认记录,测量过程各要素的监视,内容从方法误差到仪器误差,都要有严格的出处和规范,用分析过程保证分析结果。本篇文章也算是一点工作体会和拙见吧。
参考文献
1 化工工人技术理论培训教材. 化学分析. 北京:化学工业出版
-73-
