第一章.定量分析化学概论
§1.1 概述
一.定量分析过程
任务:测定物质中某种或某些组分的含量。
步骤:①取样(选择具有代表性的试样)。
②试样分解和分析试液的制备。
③分离及测定。
④分析结果的计算及评价。
二.分析试样的制备及分解
1.分析试样的采集与制备:
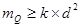
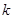 :缩分常数的经验值,试样均匀度越差,
:缩分常数的经验值,试样均匀度越差,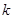 越大,通常
越大,通常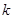 为
为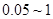
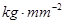 。
。
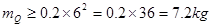
2.试样的分解:
①溶解法:溶剂为水、酸、碱、混合酸等
②熔融法:
三.定量分析结果的表示
1.待测组分的化学表示形式
2.待测组分含量的表示方法
①固体试样:

 (
(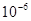 );
);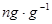 (
(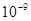 );
); (
( )
)
②液体试样:
a.物质的量浓度: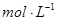
b.质量摩尔浓度:待测组分的物质的量除以溶剂的质量,单位: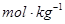
c.质量分数:量纲为1
d.体积分数:
e摩尔分数:
f.质量浓度:单位体积中某种物质的质量, 、
、
③气体试样:
体积分数表示。
§1.2 分析化学中的误差
一.真值(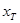 ):某一物理量本身具有的客观存在的真实数值。
):某一物理量本身具有的客观存在的真实数值。
1.理论真值:
2.计量学约定真值: 这些真值可认为是知道的
3.相对真值:
二.平均值(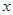 ):
):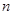 次测量数据的算术平均值。
次测量数据的算术平均值。

三.中位数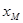 :一组测量数据按大小顺序排列,中间一个数据即为中位数。
:一组测量数据按大小顺序排列,中间一个数据即为中位数。
四.准确度和精密度:
1.精密度:表各次分析结果相互接近的程度。
①重复性;
②再现性。
五.误差和偏差
1.误差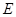 :测定结果与真值(
:测定结果与真值(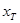 )之间的差值。
)之间的差值。
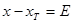
(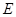 为正值,
为正值,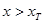 ;
;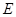 为负值,
为负值,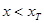 )
)
①绝对误差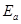 :测定值与真实值之差。
:测定值与真实值之差。
例: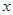 =81.18%,
=81.18%,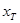 =80.13%
=80.13%
则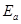 =
=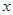 -
-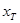 =81.18%-80.13%=+1.05%
=81.18%-80.13%=+1.05%
②相对误差:误差与真实值中所占的百分率
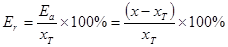
2.偏差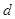 :表测定结果与平均结果之间的差值。
:表测定结果与平均结果之间的差值。
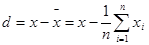
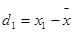 ;
;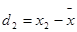 ;……;
;……;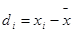 。
。
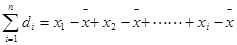

①平均偏差:(表示精密度)
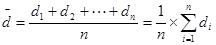
②相对平均偏差:
六.极差R:一组测量数据中,最大值(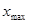 )与最小值(
)与最小值(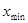 )之差称为极差。(全距或范围误差)
)之差称为极差。(全距或范围误差)
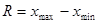
相对极差: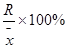
七.系统误差和随机误差
1.系统误差:由某种固定的原因所造成的,具有重复性、单向性。(可测误差)
①方法误差:由分析方法本身所造成的
②仪器和试剂误差;
③操作误差;
④主观误差。
2.随机误差:偶然误差,不定误差。
八.公差
§1.3 有效数字及其运算规则
一.有效数字
二.数字修约规则:四舍六入五成双
三.计算规则:
1.相加减时:应以小数点后位数最少的数字为依据;
2.相乘除时:根据有效数字位数最少的数字来进行修约。
§1.4 滴定分析法概述
一.滴定分析法的特点和主要方法
1.滴定分析法:
2.滴定剂:
3.滴定:
4.化学计量点(Stoichiometric Point)
5.滴定终点(end point)
6.终点误差(Et)
二.滴定分析法对化学反应的要求和滴定方式
1.适合滴定分析法的化学反应应具备的条件:(直接滴定)
①有确定的化学计量关系(即按照一定的反应方程式进行);
②反应必须定量地进行;
③具有较快的反应速度;
④必须有适当简便的方法确定滴定终点。
2.返滴定法:
3.置换滴定法:
4.间接滴定法:
三.基准物质和标准溶液
1.基准物质:能用于直接配制或标定标准溶液的物质。
2.要求:
①试剂的组成与化学式完全相符;
②试剂的纯度足够高(≥99.9%)
③性质稳定;
④有较大的摩尔质量(减小称量时的相对误差)
⑤标定反应时应定量的进行。
3.标准溶液的配制
①直接法
②标定法
四.滴定分析的计算
1.标准溶液浓度的表示方法:
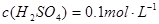
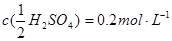
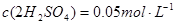

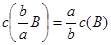
滴定度:指每毫升滴定剂溶液相当于被测物质的质量(克或毫克)或质量分数。
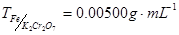
2.滴定剂与被测物质之间的关系
3.标准溶液浓度的计算
①直接配制法
②标定法
4.待测组份含量的计算
第二章.酸碱平衡和酸碱滴定法
§2.1 概述
一.酸碱平衡研究的内容
1.由投料组份的浓度c和相关平衡常数Ka,求算各种形式的浓度c或活度a;
2.从pH和相关的平衡常数Ka,求算分布系数δ,是酸碱平衡讨论的重要内容;
3.如果测出了某些形式的浓度,并且已知投料组份的浓度c,则可以测算相关的平衡常数;
4.缓冲溶液的理论及应用;
5.酸碱指示剂、滴定曲线和终点误差。
二.酸碱平衡的研究手段
1.代数法;
2.图解法;
3.计算机方法。
三.浓度、活度和活度系数
1.浓度与活度
①测定的结果是用浓度还是用活度来表示;
②判断由于离子强度的变化是否会对计算或测量结果产生不可忽略的影响;
③如果这种影响是不可忽略的,如何进行校正。
2.活度系数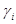 :
: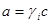
3.德拜—休克儿(Debye—Hückel)公式:
AB型 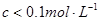
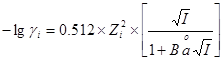
 :电荷
:电荷
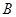 :常数,25℃时,为0.00328
:常数,25℃时,为0.00328
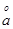 :离子体积系数(pm)
:离子体积系数(pm)
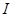 :离子强度,
:离子强度,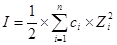
当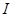 较小时,
较小时,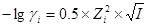
四.酸碱反应的平衡常数—解离常数
1.反应常数:
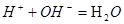

强碱滴定弱酸:
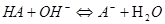
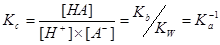
2.活度常数

3. 与
与 的关系
的关系
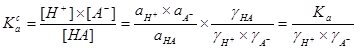
§2.2 分布分数δ的计算
一.分布分数δ:溶液中某酸碱组份的平衡浓度占其总浓度的分数。
二.一元酸溶液:
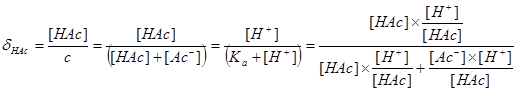
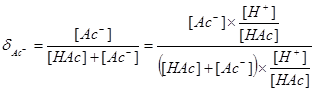

三.多元酸溶液(如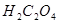 )
) 物料守恒
物料守恒
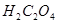 /
/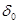 、
、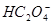 /
/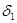 、
、 /
/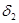 总浓度为
总浓度为
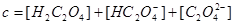
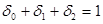
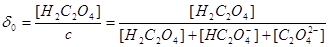
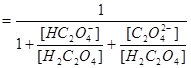
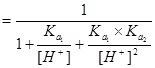

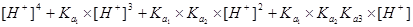
§2.3 质子条件与pH的计算
一.物料平衡、电荷平衡和质子条件
1.物料平衡方程(MBE):
在一个化学平衡体系中,某一给定物质的总浓度,等于各有关形式平衡浓度之和。
①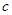
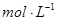 的
的
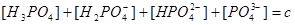
②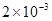
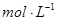
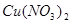 与
与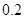
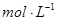
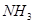
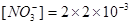
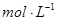
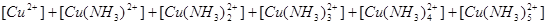
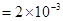
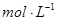
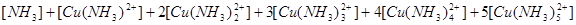
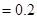
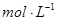
2.电荷平衡方程(CBE)
单位体积溶液中阳离子所带正电荷的量(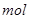 )应等于阴离子所带负电荷的量(
)应等于阴离子所带负电荷的量(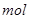 )。
)。
①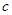
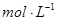 的
的
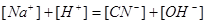
②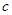
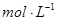 的
的
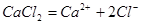
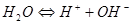

③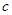
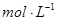 的
的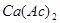
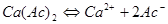
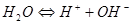
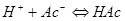
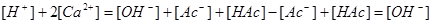
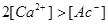
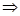
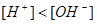
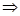 溶液呈碱性。
溶液呈碱性。
3.质子条件(PBE)
在酸碱反应中,碱所得到的质子的量(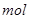 )与酸失去质子的量(
)与酸失去质子的量(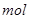 )相等。
)相等。
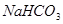 :
:

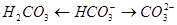
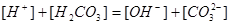
二.pH的计算
1.强酸(碱)溶液
2.一元弱酸(碱)溶液
 :
: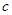
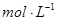
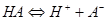
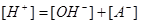
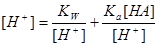
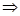
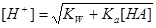

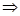
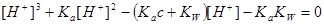
当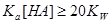 时,
时,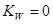
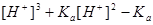
 (
(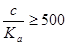 )
)
3.多元酸(碱)溶液
4.弱酸混合溶液
5.两性物质溶液
§2.4 对数图解法
一. 及强酸强碱的浓度对数图
及强酸强碱的浓度对数图
二.一元弱酸的浓度对数图
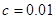
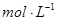
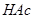 、
、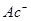 、
、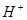 、
、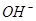
 ~pH
~pH
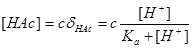
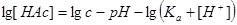
①当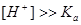 时,
时,
则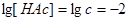
②若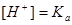
则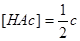
2.绘制浓度对数图的步骤
①确定体系点S( ,
,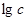 );
);
②通过体系点,绘制斜率为0,-1和+1三条直线;
③校正。
三.多元酸的浓度对数图
四.对数图解法的应用
§2.5 酸碱缓冲溶液
一.pH缓冲溶液
能减缓因外加强酸或强碱以及稀释而引起的pH急剧变化的作用的溶液。
一般组成:
①浓度较大的弱酸及其共轭碱所组成(具有抗外加强酸强碱作用和抗稀释作用);
②强酸(pH<2)和强碱(pH>12)(不具抗稀释作用)。
二.缓冲溶液pH的计算(近似方法)
例: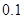
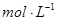
 ~
~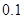
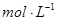


三.缓冲指数
1.定义:
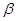 越大,抗缓冲能力越大。
越大,抗缓冲能力越大。
2.物理意义:相关酸碱组份分布线的斜率,具有加和性。
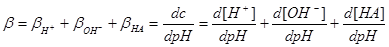
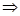
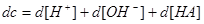
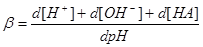
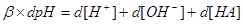
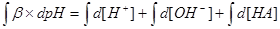
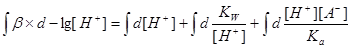
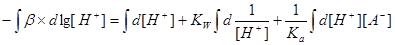
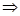
四.缓冲容量
1.缓冲容量: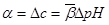
2.物理意义:某缓冲溶液因外加强酸或强碱的量为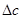 而发生pH的变化,变化的幅度为
而发生pH的变化,变化的幅度为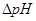 ,
,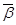 为
为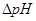 区间缓冲溶液具有的平均缓冲指数。
区间缓冲溶液具有的平均缓冲指数。
五.重要的缓冲溶液
1.标准缓冲溶液;
2.缓冲溶液的选择原则
①对测量没有干扰;
②所需控制的pH应在其缓冲范围之内;
③具有足够的缓冲容量;
④缓冲物质应廉价易得,避免污染。
§2.6 酸碱指示剂
一.酸碱指示剂的原理
二.指示剂的用量
三.离子强度的影响
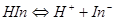
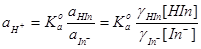
当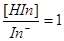 时,
时,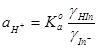
又
所以理论变色点为: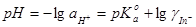
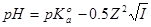
增强离子强度,指示剂的理论变色点变小。
其他因素:温度的改变、胶体的存在等。
四.混合指示剂
1.同时使用两种指示颜色,利用彼此颜色之间的互补作用,使颜色更加敏锐;
2.由指示剂与惰性染料组成。
§2.7 酸碱滴定基本原理
一.用强碱滴定强酸
标准 滴定
滴定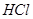
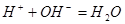 滴定常数:
滴定常数: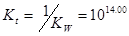
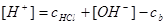
滴定分数:

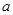 :滴入比,滴入百分率。
:滴入比,滴入百分率。
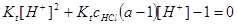
二.用强碱滴定一元弱酸
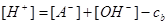
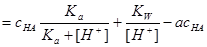
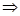
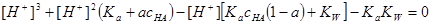
当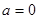 时
时
 为
为
用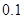
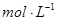
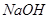 滴定
滴定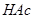 ,突跃范围为7.74~9.70。
,突跃范围为7.74~9.70。
三.多元酸和混合酸的滴定
 :
: ;
;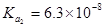 ;
;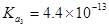
§2.8 终点误差
一.强碱滴定强酸

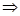
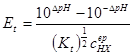
例:以甲基橙为指示剂,计算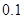
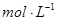
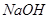 滴定等浓度
滴定等浓度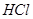 的终点误差。
的终点误差。
解: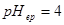 ,
, ,
,
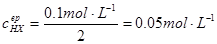
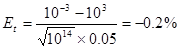
二.强碱滴定一元弱酸
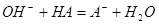


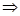
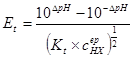
例:用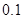
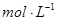
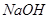 滴定等浓度的
滴定等浓度的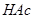 ,以酚酞为指示剂(
,以酚酞为指示剂(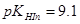 ),计算终点误差。
),计算终点误差。
解: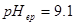 ,
,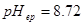 ,
,
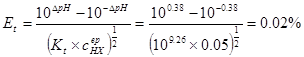
三.强碱滴定多元弱酸
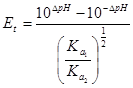
第一化学计量点:
第二化学计量点: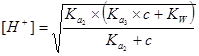
§2.9 酸碱滴定法的应用
一.混合碱的测定
烧碱中 和
和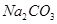 的测定
的测定
①氯化钡法;
②双指示剂法。
二.极弱酸(碱)的测定
1.弱酸强化
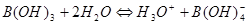
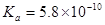
(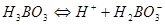 )
)
络合反应、沉淀反应、氧化还原法。
三.铵盐中氮的测定
1.蒸馏法
2.甲醛法
四.酸碱滴定法测定磷
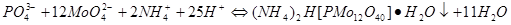
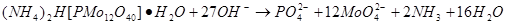

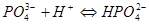
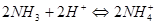
五.氟硅酸钾法测定硅
§2.10 非水溶液中的酸碱滴定
一.非水滴定中的溶剂
1.分类
①两性溶剂:中性、酸性、碱性
②非释质子性溶剂
2.性质
①拉平效应;
②区分效应
二.非水滴定条件的选择
1.溶剂的选择
2.滴定剂的选择
第三章.络合滴定法
§3.1 分析化学中常用的络合物
一.简单络合物
二.螯合物
1.“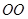 ”型
”型
2.“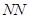 ”型
”型
3.“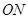 ”型
”型
4.含硫螯合剂“ ”型、“
”型、“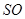 ”型、“
”型、“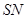 ”型
”型
三.乙二胺四乙酸
四.乙二胺四乙酸的螯合物
§3.2 络合物的稳定常数
一.络合物的稳定常数
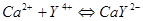
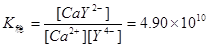

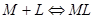
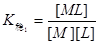
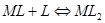

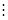
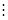


逐级累积稳定常数:
总稳定常数: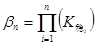
二.溶液中各级络合物的分布
设溶液中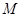 的总浓度为
的总浓度为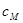 ,
,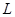 的总浓度为
的总浓度为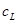
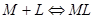
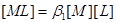
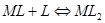
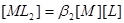
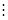
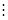

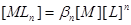
物料平衡:
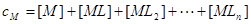
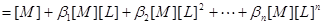
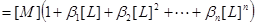
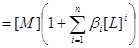
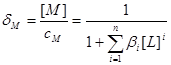
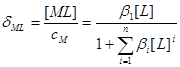
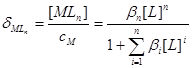
三.平均配位数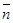 :表金属离子络合配位体的平均数。
:表金属离子络合配位体的平均数。
§3.3 副反应系数和条件稳定常数
一.副反应系数
1.络合剂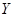 的副反应及副反应系数
的副反应及副反应系数
① 的酸效应与酸效应系数
的酸效应与酸效应系数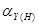
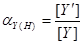
n元酸: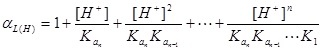
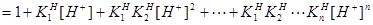
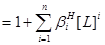
②共存离子效应:
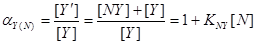
③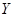 的总副反应系数
的总副反应系数 :
:
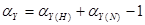
第四章.氧化还原滴定法
§4.1 氧化还原平衡
一.概述
1.可逆与不可逆氧化还原电对
2.对称与不对称电对
二.条件电势
三.氧化还原平衡常数
四.化学计量点时反应进行的程度
五.影响反应速率的因素
1.反应物浓度
2.温度
3.催化剂
六.催化反应和诱导反应
1.催化反应
2.诱导反应
§4.2 氧化还原滴定原理
一.氧化还原滴定指示剂
1.自身指示剂
2.显色指示剂
3本身发生氧化还原反应的指示剂
二.氧化还原滴定曲线
1.对称的氧化还原滴定反应
①滴定曲线方程;
②化学计量电电势的计算;
③滴定突跃范围。
三.氧化还原滴定结果的计算
四.终点误差
设滴定反应为氧化剂 滴定还原剂
滴定还原剂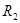 ,即
,即
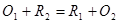
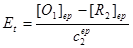 (两个半反应的电子转移数均为1,且两个电对均为对称电对)
(两个半反应的电子转移数均为1,且两个电对均为对称电对)
对于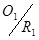 电对,在终点与化学计量点时有如下关系:
电对,在终点与化学计量点时有如下关系:
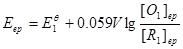 ………………①
………………①
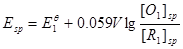 ………………②
………………②
当滴定终点与化学计量点接近时,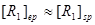
①~②得
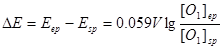
即: 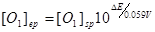 ………………③
………………③
同理可推出:
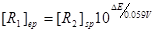 ………………④
………………④
将③与④代入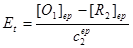 ,且由于在化学计量点时
,且由于在化学计量点时 ,得:
,得:
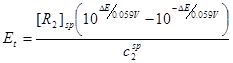 ………………⑤
………………⑤
对于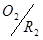 电对,
电对,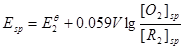 ………………⑥
………………⑥
化学计量点电势为:
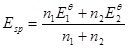 ………………⑦
………………⑦

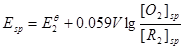
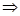
 ………………⑧
………………⑧
化学计量点时: 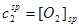 ………………⑨
………………⑨
将⑧、⑨代入⑤式得:
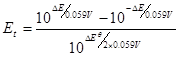
例:在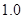
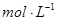
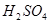 介质中,以
介质中,以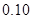
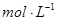
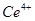 溶液滴定
溶液滴定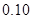
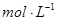
 ,若选用二苯胺磺酸钠为指示剂,计算终点误差。
,若选用二苯胺磺酸钠为指示剂,计算终点误差。
解: ,
,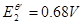 ,
,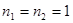 ,二苯胺磺酸钠的条件电位
,二苯胺磺酸钠的条件电位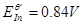 ,故
,故
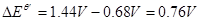
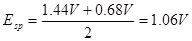
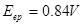
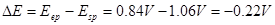
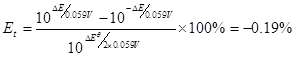
当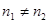 时,但两电对仍为对称电对时,其终点误差公式为:
时,但两电对仍为对称电对时,其终点误差公式为:

§4.3 氧化还原滴定的预处理
一.预处理:
1.预处理:通常将待测组份氧化为高价状态后,用还原剂滴定;或还原为低价状态后,用氧化剂滴定,也就是滴定前使待测组份转变为一定价态的步骤就称为预先氧化或预先还原处理。
2.要求:
①反应进行完全、速率快;
②过量的氧化剂或还原剂易于除去;
③反应具有一定的选择性。
二.氧化剂
1.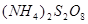 :在酸性介质中为一种强氧化剂,可将
:在酸性介质中为一种强氧化剂,可将 氧化为
氧化为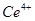 ,
,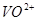 氧化为
氧化为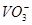 ;在
;在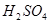 或
或 介质中,有催化剂
介质中,有催化剂 存在时,可将
存在时,可将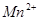 氧化为
氧化为 ,
,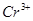 氧化为
氧化为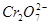 ,过量
,过量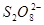 可籍煮沸除去。
可籍煮沸除去。

2.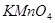
①冷的酸性介质中, 可在
可在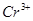 存在下将
存在下将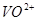 氧化为
氧化为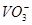 ,但氧化
,但氧化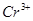 的速率很慢;
的速率很慢;
②碱性溶液中, 可容易将
可容易将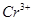 氧化为
氧化为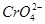 。
。
在有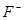 、
、 或
或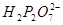 存在时,
存在时, 可将
可将 氧化为
氧化为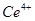 ,
,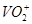 亦同时被氧化,过量的
亦同时被氧化,过量的 可用
可用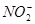 除去。
除去。
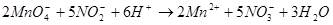
过量的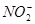 会干扰测定,可以加尿素使之分解。
会干扰测定,可以加尿素使之分解。
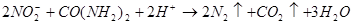
当加入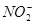 以除去过量的
以除去过量的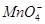 时,已氧化为高价状态的待测组份如
时,已氧化为高价状态的待测组份如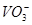 、
、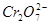 等,也可能被过量的
等,也可能被过量的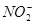 还原。此时,可先加入尿素,再小心滴加
还原。此时,可先加入尿素,再小心滴加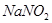 溶液至
溶液至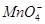 的红色正好褪去。
的红色正好褪去。
3.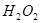 :通常用于在
:通常用于在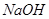 溶液中将
溶液中将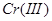 氧化为
氧化为 ,在
,在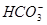 溶液中将
溶液中将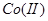 氧化为
氧化为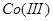 等,过量的
等,过量的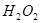 可籍煮沸分解(加入少量的
可籍煮沸分解(加入少量的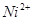 或
或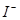 作催化剂,可加速
作催化剂,可加速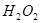 的分解)
的分解)
在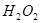 的碱性溶液中,
的碱性溶液中,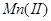 被氧化为
被氧化为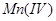 析出
析出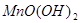 沉淀。
沉淀。
4. :浓热的
:浓热的 具有强氧化性,可将
具有强氧化性,可将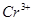 氧化为
氧化为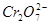 ,
,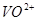 氧化为
氧化为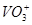 ;当有
;当有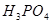 存在时,
存在时,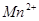 可定量地被氧化为
可定量地被氧化为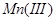 ,生成稳定的
,生成稳定的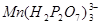 络离子,
络离子, 可直接将
可直接将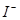 氧化为
氧化为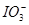 ,过量的
,过量的 经稀释后,即失去氧化能力。
经稀释后,即失去氧化能力。
注意事项:浓热的 遇有机物时,会发生爆炸,所以,对含有有机物的试样,用
遇有机物时,会发生爆炸,所以,对含有有机物的试样,用 处理前应先用
处理前应先用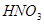 将有机物破坏。
将有机物破坏。
5.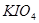 :常用于在热的酸性介质中将
:常用于在热的酸性介质中将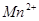 氧化为
氧化为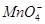 ,此法可用于光度测定微量锰,此时不必除去过量的
,此法可用于光度测定微量锰,此时不必除去过量的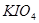 。
。
三.还原剂
1.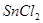 :在
:在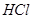 溶液中,
溶液中,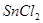 可将
可将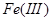 还原为
还原为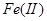 。过量的
。过量的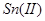 可加入
可加入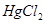 溶液使生成
溶液使生成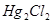 沉淀而除去。早还原时,应避免加入过多的
沉淀而除去。早还原时,应避免加入过多的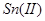 ,因
,因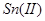 可进一步使
可进一步使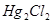 还原为
还原为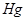 ,
,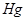 能与氧化剂起反应。
能与氧化剂起反应。
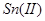 也可以将
也可以将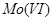 还原为
还原为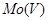 及
及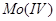 ;将
;将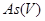 还原为
还原为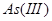 ;当加入
;当加入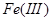 作催化剂时,可将
作催化剂时,可将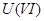 还原为
还原为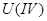 。
。
2.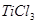 :在无汞定铁中,通常用
:在无汞定铁中,通常用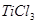 或
或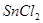 —
—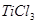 ,联合还原
,联合还原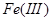 。
。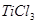 溶液很不稳定,易被空气氧化,用水稀释后,少量过量的
溶液很不稳定,易被空气氧化,用水稀释后,少量过量的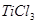 即被水中溶解的
即被水中溶解的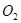 氧化,若于溶液中加入少量
氧化,若于溶液中加入少量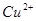 作催化剂,可加速
作催化剂,可加速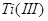 的氧化。
的氧化。
3.金属还原剂:常用的有铝、锌、铁等。金属还原剂最好将其制备成汞齐后,组装成还原柱使用。例如,将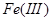 、
、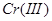 、
、 、
、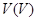 溶液流经锌汞齐还原柱后,能分别还原为
溶液流经锌汞齐还原柱后,能分别还原为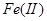 、
、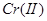 、
、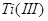 、
、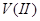 ,用一定过量的氧化剂标准溶液承接还原后的溶液,再用另一种还原剂标准溶液返滴定。
,用一定过量的氧化剂标准溶液承接还原后的溶液,再用另一种还原剂标准溶液返滴定。
4.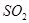 :为弱还原剂,可将
:为弱还原剂,可将 还原为
还原为 ,而不能将
,而不能将 还原为
还原为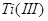 ,在有大量
,在有大量 存在时,反应速率缓慢。但当有
存在时,反应速率缓慢。但当有 共存时,可加速反应的进行。
共存时,可加速反应的进行。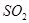 也能将
也能将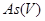 还原为
还原为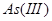 ,将
,将 还原为
还原为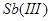 ,将
,将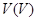 还原为
还原为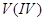 。在有
。在有 存在的情况下,还可将
存在的情况下,还可将 还原为
还原为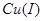 。
。
§4.4 氧化还原滴定法的应用
一.氧化还原的应用
可用于无机物、有机物含量的直接或间接测定。对滴定剂的要求:要求它在空气中保持稳定。
还原滴定剂: 、
、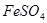 等
等
氧化滴定剂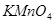 、
、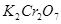 、
、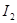 、
、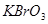 、
、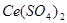 等
等
二.常用的氧化还原方法
1.高锰酸钾法
优点:氧化能力强;本身呈深紫色,用它滴定无色或浅色溶液时,一般不需另加指示剂。
缺点:常含有少量杂质,使溶液不够稳定;由于其强氧化能力,可以和很多还原性物质发生作用,干扰比较严重。
在强酸性溶液中与还原剂作用:
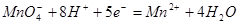
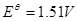
在微酸性、中性或弱碱性溶液中:
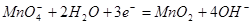
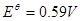
当 浓度大于
浓度大于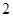
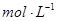 的碱性溶液中,
的碱性溶液中,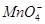 能被很多有机物还原为
能被很多有机物还原为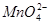 :
:
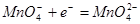
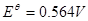
依待测物质的性质不同而选用不同的方法:
①直接滴定法:用于 、
、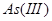 、
、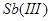 、
、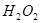 、
、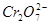 、
、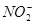 等;
等;
②返滴定法:如测定 含量时,可在
含量时,可在 溶液中加入一定量过量的
溶液中加入一定量过量的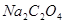 标准溶液,待
标准溶液,待 与
与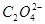 作用完毕后,用
作用完毕后,用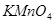 标液滴定过量的
标液滴定过量的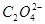 ;
;
③间接滴定法:某些非氧化还原性物质可以用间接滴定法进行测定,如测定 时,可首先将
时,可首先将 沉淀为
沉淀为 ,再用稀
,再用稀 将所得沉淀溶解,用
将所得沉淀溶解,用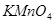 标液滴定溶液中的
标液滴定溶液中的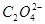 ,从而间接求得
,从而间接求得 的含量。
的含量。
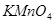 溶液的配制和标定:
溶液的配制和标定:
原因:市售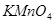 试剂中常含有少量
试剂中常含有少量 和其他杂质,蒸馏水中常含有微量还原性物质,它们可与
和其他杂质,蒸馏水中常含有微量还原性物质,它们可与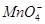 反应而析出
反应而析出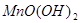 沉淀;这些生成物以及热、光、酸、碱等外界条件的改变均会促进
沉淀;这些生成物以及热、光、酸、碱等外界条件的改变均会促进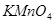 的分解。
的分解。
措施:
①称取稍多于理论量的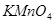 ,溶解在规定体积的蒸馏水中;
,溶解在规定体积的蒸馏水中;
②将配好的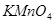 溶液加热至沸,并保持微沸约一小时,然后放置
溶液加热至沸,并保持微沸约一小时,然后放置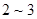 天,使溶液中可能存在的还原性物质完全氧化;
天,使溶液中可能存在的还原性物质完全氧化;
③用微孔玻璃漏斗过滤,除去析出的沉淀;
④将过滤后的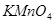 溶液贮于棕色试剂瓶中置于暗处,以待标定。(不宜长期贮存)
溶液贮于棕色试剂瓶中置于暗处,以待标定。(不宜长期贮存)
标定:
标定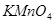 溶液的基准物质有
溶液的基准物质有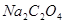 、
、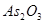 、
、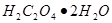 和纯铁丝等。其中以
和纯铁丝等。其中以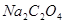 为常用(容易提纯,性质稳定,不含结晶水),在
为常用(容易提纯,性质稳定,不含结晶水),在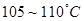 烘干后冷却便可使用。
烘干后冷却便可使用。
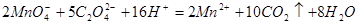 (在
(在 溶液中)
溶液中)
为了使以上反应能定量地比较快地进行,应注意的条件有:
①温度: (若高于
(若高于 ,
,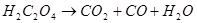 )
)
②酸度:滴定开始时的酸度应控制在
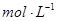 (若酸度过低,
(若酸度过低,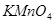 易分解为
易分解为 ;过高,会使
;过高,会使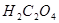 分解)
分解)
③滴定速度:开始滴定时的速度不能太快,否则加入的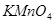 溶液来不及与
溶液来不及与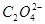 反应,会发生分解:
反应,会发生分解: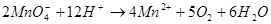 ;
;
④催化剂:可加入几滴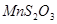 作为催化剂;
作为催化剂;
⑤指示剂: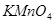 自身可作为滴定时的指示剂。若其浓度低至
自身可作为滴定时的指示剂。若其浓度低至
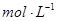 时,以
时,以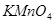 溶液为滴定剂时,应加入二苯胺磺酸钠或
溶液为滴定剂时,应加入二苯胺磺酸钠或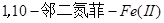 等指示剂来确定终点;
等指示剂来确定终点;
⑥滴定终点:滴定时溶液中出现的粉红色在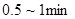 内不褪色。
内不褪色。
应用实例:
①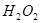 的测定:
的测定:

碱金属及碱土金属的过氧化物可采用同样的方法进行测定;
② 的测定;
的测定;
③软锰矿中 的测定:(可用于
的测定:(可用于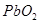 含量测定)
含量测定)
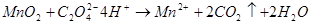
④测定某些有机化合物;
⑤化学需氧量(COD)的测定:Chemical Oxygen Demand
2.重铬酸钾法:
优点:
①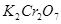 容易提纯,在140~250℃干燥后,可直接标量配制标准溶液;
容易提纯,在140~250℃干燥后,可直接标量配制标准溶液;
②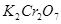 标准溶液非常稳定,可以长期保存;
标准溶液非常稳定,可以长期保存;
③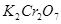 的氧化能力没有
的氧化能力没有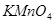 强,在1
强,在1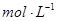
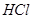 溶液中
溶液中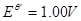 ,室温下不与
,室温下不与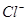 作用(
作用(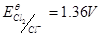 ),受其他还原性物质的干扰也较小。
),受其他还原性物质的干扰也较小。
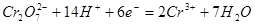
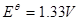
指示剂:二苯胺磺酸钠(其还原产物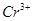 呈绿色,终点时无法辨别出过量的
呈绿色,终点时无法辨别出过量的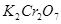 的黄色)
的黄色)
应用实例:
①铁矿石中全铁的测定:(是铁矿石中全铁量测定的标准方法)
试样用热的浓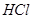 分解,加
分解,加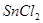 将
将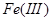 还原为
还原为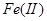 ,过量的
,过量的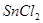 用
用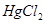 氧化,此时溶液中析出
氧化,此时溶液中析出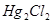 丝状的白色沉淀,然后在1~2
丝状的白色沉淀,然后在1~2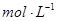
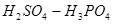 混合酸介质中,以二苯胺磺酸钠作指示剂,用
混合酸介质中,以二苯胺磺酸钠作指示剂,用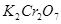 标准溶液滴定
标准溶液滴定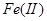 (加入
(加入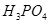 可使
可使 生成无色的稳定的
生成无色的稳定的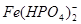 ,增大滴定的突跃范围)。
,增大滴定的突跃范围)。
无汞测铁法:试样溶解后,以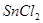 将大部分
将大部分 还原,再以钨酸钠为指示剂,用
还原,再以钨酸钠为指示剂,用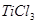 还原
还原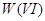 至
至 ,“钨蓝”的出现表示
,“钨蓝”的出现表示 已被还原完全,滴加
已被还原完全,滴加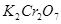 溶液至蓝色刚好消失,最后在
溶液至蓝色刚好消失,最后在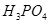 存在下,用二苯胺磺酸钠为指示剂,以
存在下,用二苯胺磺酸钠为指示剂,以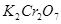 标液滴定。
标液滴定。
②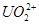 的测定:
的测定:
将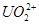 还原为
还原为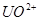 后,以
后,以 为催化剂,二苯胺磺酸钠作指示剂,可直接用
为催化剂,二苯胺磺酸钠作指示剂,可直接用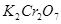 标准溶液滴定:
标准溶液滴定:

此法还可以用于测定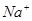 ,即先将
,即先将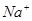 沉淀为
沉淀为 ,将所得沉淀溶于稀
,将所得沉淀溶于稀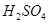 后,再将
后,再将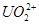 还原为
还原为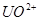 ,用
,用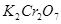 法滴定。
法滴定。
③COD的测定(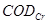 )
)
于水样中加入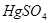 消除
消除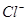 的干扰,加入过量
的干扰,加入过量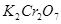 标准溶液,在强酸介质中,以
标准溶液,在强酸介质中,以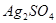 作为催化剂,回流加热,待氧化作用完全后,以
作为催化剂,回流加热,待氧化作用完全后,以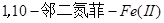 为指示剂,用
为指示剂,用 标准溶液滴定过量的
标准溶液滴定过量的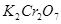 。
。
3.碘量法:(利用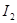 的氧化性和
的氧化性和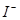 的还原性来进行滴定的方法)
的还原性来进行滴定的方法)
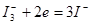
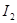 :较若的氧化剂,能与较强的还原剂作用;
:较若的氧化剂,能与较强的还原剂作用;
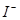 :为中等强度的还原剂,能与许多氧化剂作用。
:为中等强度的还原剂,能与许多氧化剂作用。
直接碘量法:电势比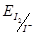 低的还原性物质,可直接用标准溶液滴定的方法,如钢铁中硫的测定,试样在近1300℃的燃烧管通
低的还原性物质,可直接用标准溶液滴定的方法,如钢铁中硫的测定,试样在近1300℃的燃烧管通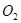 燃烧,使钢铁中的硫化物转化为
燃烧,使钢铁中的硫化物转化为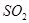 ,再用
,再用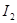 滴定。
滴定。
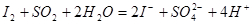
采用淀粉作指示剂,直接碘量法还可以测定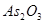 、
、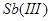 、
、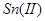 等还原性物质,但不能在碱性溶液中进行(发生歧化反应)。
等还原性物质,但不能在碱性溶液中进行(发生歧化反应)。
间接碘量法:电势比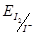 高的氧化性物质,可在一定条件下,用
高的氧化性物质,可在一定条件下,用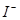 还原,然后用
还原,然后用 标准溶液滴定释放出的
标准溶液滴定释放出的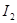 的方法。如:
的方法。如: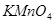 在酸性溶液中,与过量的
在酸性溶液中,与过量的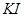 作用析出
作用析出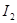 :
:
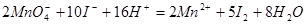
再用 溶液滴定:
溶液滴定:
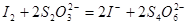
间接碘量法可应用于测定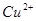 、
、 、
、 、
、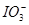 、
、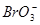 、
、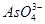 、
、 、
、 、
、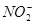 、
、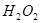 等氧化性物种。
等氧化性物种。
在间接碘量法中必须注意以下两点:
①控制溶液的酸度:滴定必须在中性或弱酸性溶液中进行;在碱性溶液中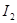 与
与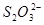 将会发生反应:
将会发生反应: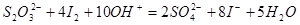 。而且
。而且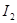 在碱性溶液中会发生歧化反应生成
在碱性溶液中会发生歧化反应生成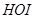 及
及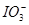 ,在强酸性溶液中,
,在强酸性溶液中, 溶液会发生分解:
溶液会发生分解: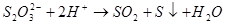 。
。
②防止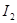 的挥发和空气中的
的挥发和空气中的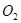 氧化
氧化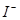 :加入过量的
:加入过量的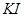 可使
可使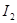 形成
形成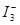 络离子,且滴定时使用碘瓶,不要剧烈摇动,以减少
络离子,且滴定时使用碘瓶,不要剧烈摇动,以减少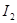 的挥发。
的挥发。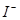 被空气氧化的反应,随光照及酸度增高而加快,因此,在反应时,应置于暗处,滴定前调节好酸度,析出
被空气氧化的反应,随光照及酸度增高而加快,因此,在反应时,应置于暗处,滴定前调节好酸度,析出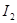 后,立即进行滴定(
后,立即进行滴定(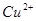 、
、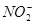 、
、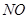 等将催化氧化反应,应注意消除)。
等将催化氧化反应,应注意消除)。
标准溶液的配制和标定:
1. 溶液的配制和标定
溶液的配制和标定
 不是基准物质,
不是基准物质, 溶液不稳定,易分解,在水中微生物、
溶液不稳定,易分解,在水中微生物、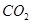 、
、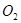 作用下,会发生下列反应:
作用下,会发生下列反应:
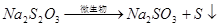

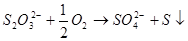
配制:配制时,需用新煮沸(为了除去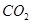 和杀菌)并冷却了蒸馏水,加入少量
和杀菌)并冷却了蒸馏水,加入少量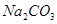 使溶液呈碱性(以抑制细菌生长)。不宜长期保存,弱溶液变浑浊或析出硫,应过滤后标定或新配制
使溶液呈碱性(以抑制细菌生长)。不宜长期保存,弱溶液变浑浊或析出硫,应过滤后标定或新配制 溶液。
溶液。
标定:常使用的基准物质有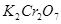 、
、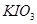 等,称取一定量基准物质,在酸性溶液中与过量
等,称取一定量基准物质,在酸性溶液中与过量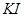 作用,析出的
作用,析出的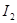 以淀粉为指示剂,用
以淀粉为指示剂,用 溶液滴定:
溶液滴定:
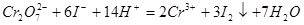
或 
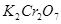 (或
(或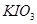 )与
)与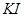 的反应条件:
的反应条件:
①溶液的酸度一般控制在0.2~0.4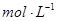 范围。(酸度愈大,反应速度愈快,但过大时,
范围。(酸度愈大,反应速度愈快,但过大时,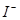 易被空气中的
易被空气中的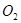 氧化。)
氧化。)
②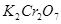 与作用时,应将溶液贮存于碘瓶或锥形瓶中(盖好表面皿),在暗处放置一定时间,待反应完全后,再进行滴定,与作用时,不需放置,宜及时进行滴定。
与作用时,应将溶液贮存于碘瓶或锥形瓶中(盖好表面皿),在暗处放置一定时间,待反应完全后,再进行滴定,与作用时,不需放置,宜及时进行滴定。
所用溶液中不应含有或,如果溶液显黄色,则应事先用溶液滴定至无色后再使用,若滴定至终点后,很快又转变为—淀粉的蓝色,表明与的反应未进行完全,应另取溶液重新标定。
溶液的配制和标定:
配制:升华法可制纯碘。碘不宜在分析天平上称量(碘的挥发性及对天平的腐蚀)。
在托盘天平上称取一定量碘,加入过量,置于研钵中,加少量水研磨,使全部溶解,再将其稀释,倾入棕色瓶中于暗处保存,应避免溶液与橡皮等有机物接触,也要防止溶液见光遇热。
标定:可用已标定好的标准溶液来标定溶液,也可用进行标定。难溶于水,但可溶于碱溶液中:
与的反应:
(中性或微碱性溶液中(),可定量地向右边进行;酸性溶液中,氧化而析出)
碘量法应用示例:
或的测定:
原理:(酸性溶液中)
可以用淀粉为指示剂,用标准溶液滴定(滴定不能在碱性溶液中进行,否则部分将被氧化为:且也会发生歧化反应)。
过程:测定气体中的时,一般用或的氨性溶液吸收,然后加入一定量过量的标准溶液,用将溶液酸化,最后用标准溶液滴定过量的,以淀粉为指示剂。
铜合金中铜的测定:
原理:试样可用分解(但低价氮的氧化物能氧化而干扰测定,需用浓蒸发而初之)和和分解。
过量的可用煮沸除去。调节溶液的酸度(通常用或等缓冲溶液将溶液的酸度控制在),加入过量的使析出:
(:还原剂、沉淀剂、络合剂)
生成的用标准溶液滴定,以淀粉为指示剂。由于沉淀表面吸附,使分析结果偏低,为了减少对的吸附,可在大部分被溶液滴定后,加入,使转化为溶解度更小的:,沉淀吸附的倾向小,可减小误差。
干扰:可氧化为:,从而干扰铜的测定,可加入,使生成稳定的,降低了电对的电势,使不能将氧化为。
溶液的标定:用纯铜标定,以抵消方法的系统误差。
使用范围:铜矿、炉渣、电渡液及胆矾()等试样中的含量。
漂白粉中有效氯的测定:
有效氯:漂白粉的主要成份为,还有、及等;漂白粉的质量以能释放出来的氯量来衡量(称为有效氯),以含的质量分数表示。
原理及过程:使试样溶于稀介质中,加过量的,反应生成,用标准溶液滴定:
某些有机物的测定:(对于能被碘直接氧化的物质,只要反应速度足够快,便可用直接碘量法进行测定,有巯基乙酸、四乙基铅、抗坏血酸及安及近药物等)
原理及过程:于葡萄糖、甲醛、丙酮及硫脲等碱性试液中,加入一定量过量的标准溶液,使有机物被氧化,如:
碱液中剩余的,歧化为及:
溶液酸化后又析出:
最后以滴定析出的。
卡尔费休(Karl Fischer)法测定水:
原理:利用氧化时,需要定量的:
利用此反应,可测定很多有机物或无机物中的水,但对于可逆反应式,要使反应向右进行,需要加入适当的碱性物质以中和反应后生成的酸,通常用吡啶:
生成的可与水反应干扰测定,可加入甲醇避免发生副反应:
费休试剂:滴定时的标准溶液含有、、及的混合溶液。(具有的棕色,与反应时,棕色立即褪去,当溶液中出现棕色时,即为滴定终点)
注意事项:费休法属于非水滴定法,所有容器都需干燥,费休试剂在配制和保存过程中,若混入水,便失效。
四.其他氧化还原滴定法:
1.硫酸铈法:
:强氧化剂,在酸性溶液中,与还原剂作用时,还原为:
在溶液中;在溶液中,此时可使缓慢地还原为,因此用作滴定剂时,常采用溶液,能用滴定的物质,一般也能用滴定。
优点:(用作滴定剂时,可用为指示剂)
稳定,放置教长时间或加热煮沸也不易分解;
可由直接配制标准溶液,不必进行标定;
可在溶液中直接用滴定(与不同):
还原为时,只有一个电子的转移,不生成中间价态的产物,反应简单、副反应少。
注意事项:易水解,生成碱式盐沉淀,所以不适用于在碱性或中性溶液中滴定。
2.溴酸钾法:
:强氧化剂,在酸性溶液中:
且溶液提纯,在烘干后,可以直接配制标准溶液,其溶液的浓度也可以用碘典法进行标定。
在酸性溶液中,一定量与过量作用析出:
应用:主要用于测定苯酚,在苯酚的酸性溶液中加入过量的标准溶液:
生成的可取代苯酚中的氢:
过量的用还原:
析出的用标准溶液滴定。
3.亚砷酸钠—亚硝酸钠法
应用:使用混合溶液进行滴定,可应用于普通钢可低合金钢铁中锰的测定。
原理与过程:试样用酸分解,锰转化为,以作催化剂,用将氧化为,然后用混合溶液滴定:
单独用溶液滴定,在介质中,只被还原为平均氧化数为的。而单独用溶液滴定,在酸性溶液中,可定量地还原为,但和作用缓慢,且不稳定,所以采用混合液进行滴定,此时能使定量地还原为,能加速反应,测量的结果也较准确。但仍不能按理论值计算,需用已知含锰量的标准试样来确定混合液对锰的滴定度。
