第四章 化学平衡
核心内容: 恒T、p、Wˊ=0下,化学反应
自发
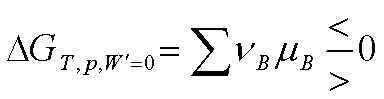 平衡
平衡
反向自发
主要内容:化学反应△G、K的计算及过程方向的判断。
一、内容提要
1、化学反应自发进行和达到平衡的条件
自发
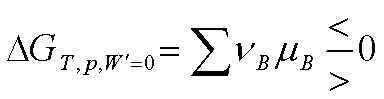 平衡
平衡
反向自发
其中,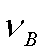 为B的化学计量数,对于产物
为B的化学计量数,对于产物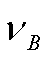 取正值,对于反应物
取正值,对于反应物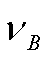 取负值。
取负值。
2、理想气体化学反应的等温方程(分压的影响)和反应方向的具体判据
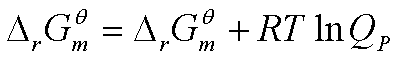
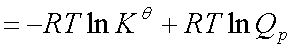
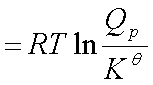 <0 自发 (Qp<
<0 自发 (Qp<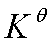 )
)
=0 平衡 (Qp=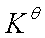 )
)
>0 反向自发(Qp>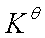 )
)
式中: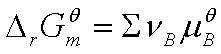 为标准摩尔反应吉布斯函数变化,
为标准摩尔反应吉布斯函数变化,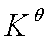 为标准平衡常数,
为标准平衡常数,
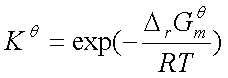 =
=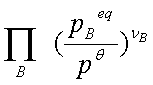 =
= f(T)
f(T)
3、理想气体化学反应平衡常数的其他表示法及其相互关系
除了标准平衡常数外,实际应用中常用经验平衡常数KP 、KC 、Kn 、Ky
(1)KP: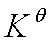 =
=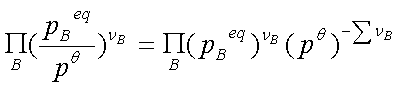
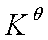 =
=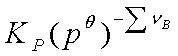
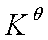 仅是温度的函数,KP也只与温度有关。
仅是温度的函数,KP也只与温度有关。
(2)KC:理想气体PBV=nBRT pB=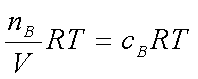
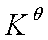 =
=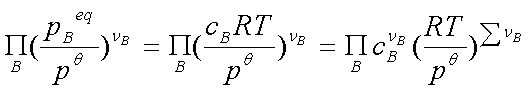
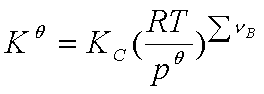
KC也只与温度有关
(3)Ky:pB=pyB

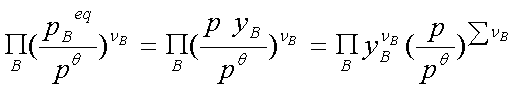
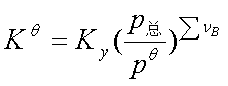
Ky与温度和总压有关
(4)Kn: 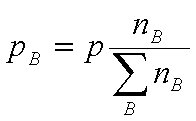
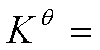
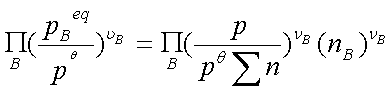
=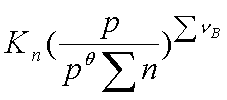
Kn与温度、总压和惰性气体有关。综合以上各式得:
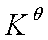 =
=
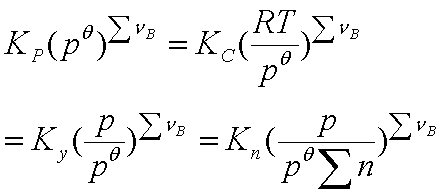
当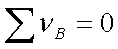 时,
时,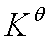 =Kp=Kc=Ky=Kn
=Kp=Kc=Ky=Kn
4、有纯凝聚态物质参加的理想气体反应的标准平衡常数
若理想气体化学反应中有纯固态或纯液态参加时,由于常压下纯凝聚态物质的化学势可近似为标准态化学势,即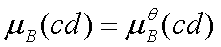 (cd表示凝聚态)
(cd表示凝聚态)
因此 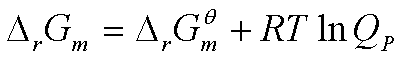
其中 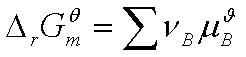 即对参加反应的所有物质包括凝聚态物质求和。
即对参加反应的所有物质包括凝聚态物质求和。
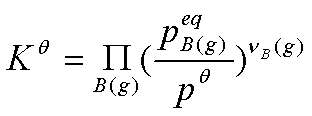
即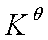 只考虑气相组分的平衡分压。
只考虑气相组分的平衡分压。
5、真实气体化学反应的标准平衡常数
真实气体的化学势表达式为
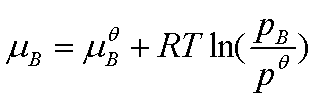 ,
,
代入 可得:
可得:

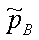 为组分B在指定条件下的逸度,
为组分B在指定条件下的逸度,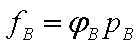 ,
,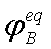 为B的逸度因子,它是温度和总压的函数,
为B的逸度因子,它是温度和总压的函数,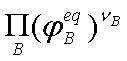 也是温度和压力的函数,对于理想气体
也是温度和压力的函数,对于理想气体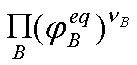 =1
=1  。
。
6、液态混合物或溶液的化学平衡常数
对于液态混合物(或溶液)中的化学反应,由于任一组分的化学势为
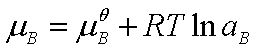 ,代入
,代入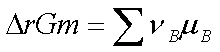 可得:
可得:
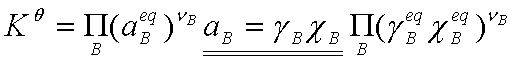
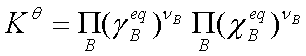
若反应系统为理想液态混合物或理想稀溶液,则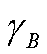 =1,
=1,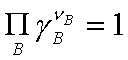
7、标准摩尔吉布斯函数变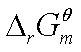 的计算方法
的计算方法
由于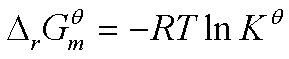 ,因此由
,因此由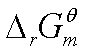 可求得
可求得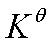 。
。
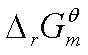 的计算主要有以下三种方法:
的计算主要有以下三种方法:
①由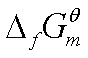 计算
计算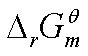 :
: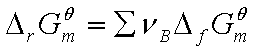
②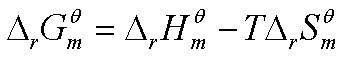 计算
计算
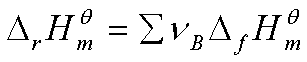

③由相关反应计算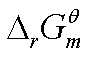
8、化学反应的等压方程(温度的影响)
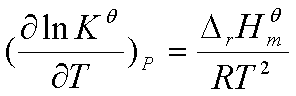
上式是范特霍夫方程的微分式,由此式可进行以下讨论:
若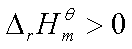 ,即吸热反应,
,即吸热反应,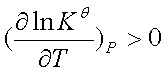 ,说明标准平衡常数随温度升高而增大,平衡右移,有利于反应正向进行。
,说明标准平衡常数随温度升高而增大,平衡右移,有利于反应正向进行。
若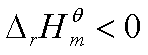 ,即放热反应,
,即放热反应,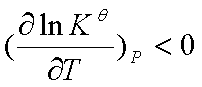 ,说明标准平衡常数随温度升高而减小,平衡左移,不利于反应正向进行。
,说明标准平衡常数随温度升高而减小,平衡左移,不利于反应正向进行。
对范特霍夫方程的微分式进行积分,可进行有关计算:
①若温度变化范围不大,或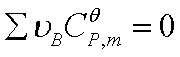 ,
,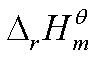 可看作常数时
可看作常数时
不定积分式 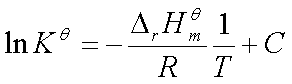
定积分式 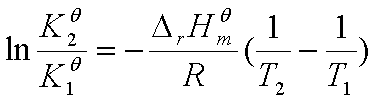
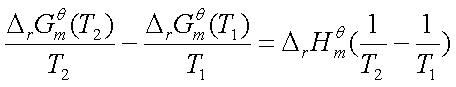 与前两式皆为等价式。
与前两式皆为等价式。
②若温度变化范围不大,或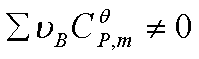 ,
,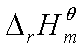 不能看作常数时
不能看作常数时
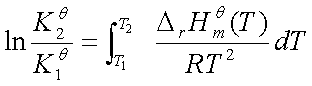
9、平衡移动原理
(1)升高温度,反应向吸热的方向进行;降低温度,反应向放热的方向进行;
(2)升高压力,反应向分子数减少的方向进行;降低压力,反应向分子数增多的方向进行;
(3)引入惰性气体(总压不变),反应向分子数增多的方向进行;
(4)反应物的摩尔比对平衡转化率的影响
当反应物的摩尔比等于化学计量系数之此时,产物的含量最大,但绝对值不一定最大。
第二篇:物理化学学习小结
物理化学学习小结
本学期,我们学习了物理化学这门课程,在这近半年的物理化学学习历程中,对于物理化学这门课程,我自己内心有了属于自己的深深地体会,在刚刚开始学习物理化学这门课程是,由于自己认识的不到位,准备的不充分以及对于老师更替的较长时间的适应,导致自己在学习这门课程上走了不少弯路。
总体来看,首先就是对于即将学习的这门课程的认识认识和把握不充分,由于认为这门课程可能就是大学物理和化学的杂合体,自恃大学物理和化学掌握的还不错的我能一开始并没有给予这门课程有足够的认识,等到了学习一段时间之后,才慢慢觉得这门课程的晦涩与难懂。其次,从最开始,对于这门课程就没有一个宏观的把握,只知道跟随老师的不发而缺乏对于整体的认识,缺乏将知识点彼此串联起来的能力。然后就是在准备方面,从小学时,老师就教导我们,课前要预习,课后要认真复习,可是就玉溪这一方面,自己做的远远不够,也因此有时候上课听不懂老师所讲的内容,从而严重打击了自己的学习物理化学的积极性。对于物理化学课程自己也产生了排斥的情绪。最后就是在学习物理化学的态度方面的问题,曾近有老师哦和我们说,大学里课堂上知识听不完全懂是很正常的现象,但是你还要认真听,课后要针对你所不懂的地方进行复习,但是自己可能只听到发哦了前半句话,而对于后半句话可能并没有留心,虽然物化课堂上自己一直坐在前排听课,但是在课堂上有时候依旧没有认真地听课,课后也没有针对自己所不懂得地方做好复习的工作,等到现阶段真正复习的阶段了,才发现,往往一小块知识点也需要自己花很长一段时间去搞明白,自此才真正觉得得不偿失,上课的时候应该认真听老师讲课,做好课堂知识点的归纳,做好课堂笔记。
总结下来,在本学期的物理化学课程学习中,首先就是在热力学的学习中,我们学习了热力学的三大定律,以及它们之间的相互关系,之后我们就学习了溶液中普遍存在的亨利定律以及拉乌尔定律,在家下来在相平衡这一章中我们认识了很多的相图,包括而组分买三组分以及多组分相图及其应用,最后,我们还重点学习了电化学以及动力学方面的知识,通过对上述内容的学习,也结合前部分对自己在物理化学学习中所犯错误的总结,个人觉得学习物理化学需要有自己的方法,那就是:方法一、勤于思考:重视教科书,把其原理、公式、概念、应用一一认真思考,不粗枝大叶,且眼手并用,不放过细节,如数学运算等。对抽象的概念如熵等千方百计领悟其物理意义,甚至不妨采用形象化的理解。适当地与同学老师交流、讨论,在交流中摒弃错误。二、勤于应用:在学习阶段要有意识地应用原理去解释客观事物,去做好每一道习题,与做物化实验一样,“应用”对加深对原理的理解有神奇的功效,有许多难点是通过解题才真正明白的。做习题不在于多,而在于精。对于典型的题做完后一定要总结和讨论,力求多一点“觉悟”。以我的习惯宁肯精做一题,也不马虎做十题。过分地依赖题解书是十分有害的。 三、勤于对比与总结:这里有纵横二个方面,就纵向来说,一个概念原理总是经历提出、论证、应用、扩展等过程,并在课程中多次出现,进行总结定会给你豁然开朗的感觉。就横向来说,一定存在相关的原理,其间一定有内在的联系,如熵增原理、平衡态稳定性等,通过对比对其相互关系、应用条件等定会有更深的理解,又如把许多相似的公式列出对比也能从相似与差别中感受其意义与功能。除此之外,初学物化一定要有自己的笔记本,在课堂上做笔记,在自习时进行总结,并随时记下自己学习中的问题及感悟书本上的、课堂上的物化都不属于自己,只有经历刻苦学习转化为自己的“觉悟”才是终身有用的。
在物理化学课程的改进方面,个人觉得,老师可以在刚开始上课时对同学们的要求特别严厉,针对于这门课程,我想严厉是应该的,但是老师应该稍微鼓励一下大家,不要老师和我们说这门课程有多么难,有多少多少人挂在了这一科目上,虽然大家都能理解这是老师为了激励我们好好学习物理化学而故意这样说的,但是这些话在另外一个方面则带来了副作用,那就是很多时候当我们在物化学习中遇到了一些挫折之后,则想当然的想起了老师说的话,难是很正常的,挂科很普遍等等,那么我们往往都或出现一种畏难的情绪,除此之外,在后期的教学过程中,注意到老师对于课堂纪律方面有了放松,课堂上特别是后面纪律稍显混乱,我想适量的放松可以,但是老师也应该把握一个度,对于纪律应该自始至终严要求。最后,老师可不可以和我们多一些交流呢,不仅仅局限于课堂上的知识,也不仅仅局限于课堂上的一问一答,虽然老师比较严格,但是我们还是比较钦佩老师的,希望和老师能够真正拉近距离,彼此关于学习,关于生活探讨看法。
关于物理化学知识的应用,比如冬天我们踩在积雪上,会发现,雪被我们的脚给踩得紧实的同时,有部分的雪化了,就是这么一个简单的现象,却体现了克拉佩龙方程的应用,当脚踩在积雪上,雪的体积变小了,但是其熔点却降低了,因此,积雪也就融化了。当然,关于物理化学的应用还有很多,比如溶液的配置等等,这里就不做一一介绍。
总之,现在回看这近半年的物理化学学习,细心加耐心很重要,相信这种好的习惯不仅仅实在物理化学课程的学习上,在其他方面的学习上也将对自己大有裨益。
