第一章 热力学第一定律
一、基本概念
系统与环境,状态与状态函数,广度性质与强度性质,过程与途径,热与功,内能与焓。
二、基本定律
热力学第一定律:ΔU=Q+W。
焦耳实验:ΔU=f(T) ; ΔH=f(T)
三、基本关系式
1、体积功的计算 δW= -pedV
恒外压过程:W= -peΔV
可逆过程: W=nRT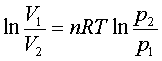
2、热效应、焓
等容热:QV =ΔU(封闭系统不作其他功)
等压热:Qp =ΔH(封闭系统不作其他功)
焓的定义:H=U+pV ; dH=dU+d(pV)
焓与温度的关系:ΔH=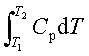
3、等压热容与等容热容
热容定义: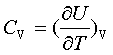 ;
;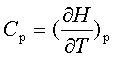
定压热容与定容热容的关系:
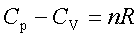
热容与温度的关系:Cp=a+bT+c’T2
四、第一定律的应用
1、理想气体状态变化
等温过程:ΔU=0 ; ΔH=0 ; W=-Q= pedV
pedV
等容过程:W=0 ; Q=ΔU=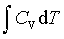 ; ΔH=
; ΔH=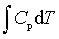
等压过程:W=-peΔV ; Q=ΔH=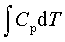 ; ΔU=
; ΔU=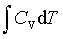
可逆绝热过程:
Q=0 ; 利用p1V1γ=p2V2γ求出T2,
W=ΔU=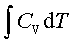 ;ΔH=
;ΔH=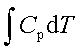
不可逆绝热过程:Q=0 ;
利用CV(T2-T1)=-pe(V2-V1)求出T2,
W=ΔU=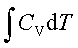 ;ΔH=
;ΔH=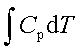
2、相变化
可逆相变化:ΔH=Q=nΔ_H;
W=-p(V2-V1)=-pVg=-nRT ; ΔU=Q+W
3、热化学
物质的标准态;热化学方程式;盖斯定律;标准摩尔生成焓。
摩尔反应热的求算: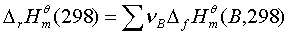
反应热与温度的关系—基尔霍夫定律:
 。
。
第二章 热力学第二定律
一、基本概念
自发过程与非自发过程
二、热力学第二定律
1、热力学第二定律的经典表述
克劳修斯,开尔文,奥斯瓦尔德。实质:热功转换的不可逆性。
2、热力学第二定律的数学表达式(克劳修斯不等式)
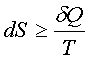 “=”可逆;“>”不可逆
“=”可逆;“>”不可逆
三、熵
1、熵的导出:卡若循环与卡诺定理
2、熵的定义: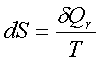
3、熵的物理意义:系统混乱度的量度。
4、绝对熵:热力学第三定律
5、熵变的计算
(1) 理想气体等温过程:
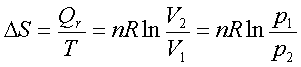
(2)理想气体等压过程: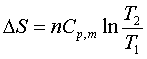
(3)理想气体等容过程: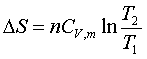
(4)理想气体pTV都改变的过程:
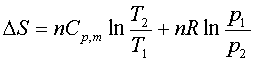
(5)可逆相变化过程: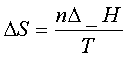
(6)化学反应过程:
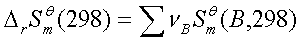
四、赫姆霍兹函数和吉布斯函数
1、定义:A=U-TS;G=H-TS
等温变化:ΔA=ΔU-TΔS;ΔG=ΔH-TΔS
2、应用:不做其他功时,ΔAT,V≤0 ;自发、平衡
ΔGT,V≤0 ;自发、平衡
3、热力学基本关系式
dA=-SdT-Vdp;dG=-SdT+pdV
4、ΔA和ΔG的求算
(1)理想气体等温过程
用公式:ΔA=ΔU-TΔS;ΔG=ΔH-TΔS
用基本关系式:dA=-SdT-Vdp;dG=-SdT+pdV
(2)可逆相变过程
ΔA=ΔU-TΔS=W=-nRT;ΔG=0
(3)化学反应过程的ΔG
标准熵法:ΔG=ΔH-TΔS
标准生成吉布斯函数法: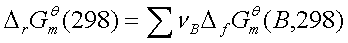
(4)ΔG与温度的关系
ΔG=ΔH-TΔS ,设ΔH、ΔS不遂温度变化。
五、化学势
1、化学式的定义和物理意义
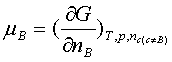 ;在T、p及其他物质的量保持不变的情况下,增加1molB物质引起系统吉布斯函数的增量。
;在T、p及其他物质的量保持不变的情况下,增加1molB物质引起系统吉布斯函数的增量。
2、化学势的应用
在等温等压不作其他功时,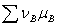 <0自发;=0平衡;>逆向自发
<0自发;=0平衡;>逆向自发
3、化学时表示式
理想气体: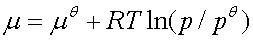
纯固体和纯液体: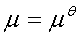
第三章化学平衡
一、化学平衡常数与平衡常数表达式
如:Zn+2HCl(aq)=H2+ZnCl2(aq);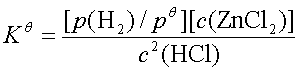
二、标准平衡常数的求算
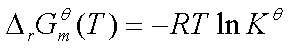
三、范特荷夫等温方程
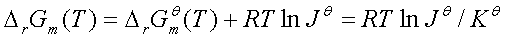
四、平衡常数与温度的关系
 ;
;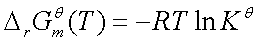
五、各种因素对平衡的影响
分压、总压、惰性气体、温度。
第四章 液态混合物和溶液
一、拉乌尔定律和亨利定律
1、拉乌尔定律
pA=p*xA ;pA=p*ax,A 适用于液态混合物和溶液中的溶剂。
2、亨利定律
pB=kx,BxB=kb,BbB=k%,B[%B] ;pB=kx,Bax,B=kb,Bab,B=k%,Ba%,B 适用于溶液中的溶质。
二、液态混合物和溶液中各组分的化学势
1、理想液态混合物
 标准态为:同温下的液态纯溶剂。
标准态为:同温下的液态纯溶剂。
2、真实液态混合物
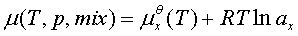 标准态为:同温下的液态纯溶剂。
标准态为:同温下的液态纯溶剂。
3、理想稀溶液
溶剂: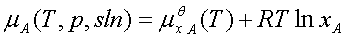 标准态为:同温下的液态纯溶剂。
标准态为:同温下的液态纯溶剂。
溶质: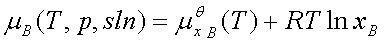 标准态为:同温下xB=1且符合亨利定律的溶质(假想状态)。
标准态为:同温下xB=1且符合亨利定律的溶质(假想状态)。
4、真实溶液
溶剂: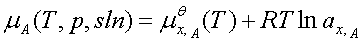 ;ax,A=fx,A x; 标准态为:同温下的液态纯溶剂。
;ax,A=fx,A x; 标准态为:同温下的液态纯溶剂。
溶质: ; ax,B=γx,B xB; 标准态为:同温下xB=1且符合亨利定律的溶质(假想状态)。
; ax,B=γx,B xB; 标准态为:同温下xB=1且符合亨利定律的溶质(假想状态)。
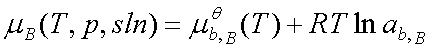 ; ab,B=γb,B bB; 标准态为:同温下bB=1且符合亨利定律的溶质(假想状态)。
; ab,B=γb,B bB; 标准态为:同温下bB=1且符合亨利定律的溶质(假想状态)。
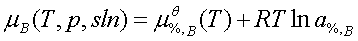 ; a%,B=γ%,B[%B]; 标准态为:同温下[B%]=1且符合亨利定律的溶质(一般为假想状态)。
; a%,B=γ%,B[%B]; 标准态为:同温下[B%]=1且符合亨利定律的溶质(一般为假想状态)。
三、各种平衡规律
1、液态混合物的气液平衡
pA=p ax,A ; pA=p
ax,A ; pA=p ax,A ; p=pA+pB
ax,A ; p=pA+pB
2、溶液的气液平衡
pA=p ax,A;pB=kx,Bax,B=kb,Bab,B=k%,Ba%,B;p=pA+pB
ax,A;pB=kx,Bax,B=kb,Bab,B=k%,Ba%,B;p=pA+pB
3、理想稀溶液的凝固点降低
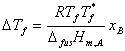
4、分配定律
5、化学平衡
6、西弗特定律
第五章相平衡
一、相律
1、物种数、独立组分数、相数、自由度数
2、相律公式
f=C-φ+2
二、单组分系统
1、克-克方程
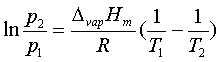
2、水的相图
三面、三线、一点。
三、双组分系统
1、相律分析
根据f=C-φ+1(一般固定压力),φ=2,f=1;φ=3,f=0
2、杠杆规则
3、步冷曲线
四、典型相图
1、Mg-Ge相图
2、Na-K相图
3、Ag-Cu相图
第六章电解质溶液
一、电解质溶液的电导
1、电导
G=1/R ; 单位:S(西门子)
2、电导率
G=κA/l或κ=G l/A ; 单位:S/m
3、摩尔电导率
Λm=κ/c
4、无限稀释摩尔电导率
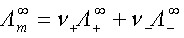
5、离子的电迁移
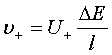 ;
;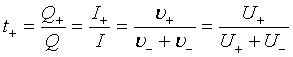 ;
;
二、电解质溶液的活度
1、电解质的化学势(电解质溶液的浓度用mB或bB表示)
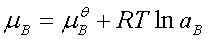
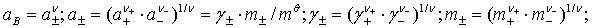
2、离子强度
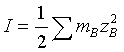
3、德拜—休克尔极限公式
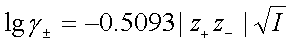 ;适用于25℃时的极稀水溶液。
;适用于25℃时的极稀水溶液。
第七章电化学
一、可逆电池的构成
电池反应互为逆反应;充放电时电流无穷小。
二、可逆电池热力学
1、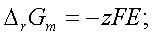
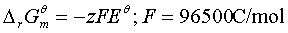
2、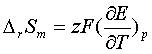
3、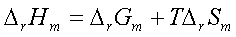
4、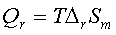 ;电池反应做了其他功。
;电池反应做了其他功。
三、能斯特方程
1、电池反应的能斯特方程
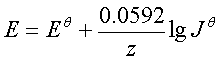 ;常用
;常用
2、电极反应的能斯特方程
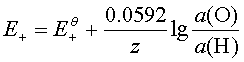 ;不常用
;不常用
四、可逆电极的种类
1、第一类电极
金属电极;气体电极
2、第二类电极
难溶盐电极;难溶氧化物电极
3、氧化还原电极
五、电极电势的应用
1、测定电池反应的热力学函数
2、测定电解质的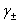
3、测定溶液的pH值
4、浓差定氧
六、极化现象和超电势
1、浓差极化
电极反应速度比离子迁移速度快造成的。
2、电化学极化
电极反应速度比电子移动速度慢造成的。
3、极化结果
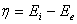 ;对阳极η总为正;对阴极η总为负。
;对阳极η总为正;对阴极η总为负。
七、金属腐蚀与防护
1、金属腐蚀
电化学腐蚀:析氢腐蚀,吸氧腐蚀
2、金属防护
阴极保护法:牺牲阳极法,外加电流法。
阳极保护法:钝化。
涂层保护法:热镀、电镀、有机涂层。
第八章表面现象
一、表面吉布斯函数
1、产生
表面分子与内部分子的差别。
2、定义及单位
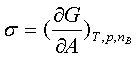 ;J/m2或N/m;因此又称表面张力。
;J/m2或N/m;因此又称表面张力。
3、影响因素
物质本性、温度、相邻相、溶质的种类。
4、表面热力学
在温度、压力、组成不变的情况下,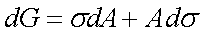
缩小表面积和降低表面张力为自发方向。
二、弯曲液面的表面现象
1、附加压力
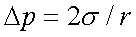
2、饱和蒸气压
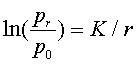
3、毛细管现象
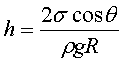
三、新相生成与介安状态
1、过饱和蒸汽与人工降雨
2、过冷现象与晶种
3、过饱和溶液与种盐
4、过热现象与沸石
5、淬火与回火
四、固体表面的吸附作用
1、物理吸附与化学吸附
范德华力与化学键力;又无选择性;单分子层与多分子层。
2、吸附曲线
等温线(判断单多层);等压线(判断吸附类型)、等量线(求吸附热)
3、吸附等温式
弗伦德里希: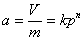
朗格谬尔: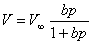
五、溶液表面的吸附
1、溶液的表面张力
各类溶质对表面张力的影响。
2、吉布斯吸附公式
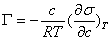
六、润湿现象
1、接触角θ
θ=0°,完全润湿;θ<90°,润湿;θ>90°,不润湿;
θ=180°,完全不润湿。
2、杨氏方程
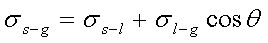
七、表面活性剂
1、定义
溶于水后能显著降低水的表面张力的物质。
2、分类
离子型、非离子型。
3、结构特点
一端亲水基一端亲油基。
4、应用
乳化、去污(增溶)、浮选、改变润湿角。
第九章化学动力学基础
一、关于反应速率的基本概念
1、反应速率的表示
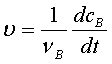
2、反应速率的测定
测定不同时刻的浓度(化学法、物理法),作c~t曲线,t时刻切线的斜率即为t时的反应速率。
3、基元反应和非基元反应
一步完成的反应为基元反应,基元反应遵守质量作用定律。是否基元反应只能通过实验确定。
4、速率方程与速率常数
质量作用定律是速率方程的特殊形式,对于非基元反应也有类似的式子。
速率常数仅与温度和催化剂有关,而与浓度无关。
5、反应级数
速率方程中浓度幂之和称之。基元反应一定为正整数,非基元反应可为0或小数。
二、浓度对反应速率的影响
1、一级反应
微分式: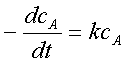 ——反应速率与浓度的一次方成正比;k的单位为S-1;
——反应速率与浓度的一次方成正比;k的单位为S-1;
积分式: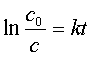 ——以lnc~t作图得一直线;
——以lnc~t作图得一直线;
半衰期: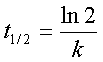 ——与起始浓度无关。
——与起始浓度无关。
2、二级反应与准一级反应
微分式: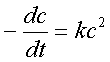 ——反应速率与浓度的二次方成正比;k的单位为浓度-1时间-1;
——反应速率与浓度的二次方成正比;k的单位为浓度-1时间-1;
积分式: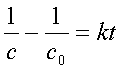 ——以1/c~t作图得一直线;
——以1/c~t作图得一直线;
半衰期: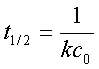 ——与起始浓度的一次方成反比。
——与起始浓度的一次方成反比。
准一级反应:对于A+B==Y+Z,当A大大过量或B大大过量时,可按一级反应处理。
3、反应级数的测定
尝试法:将一组c~t数据代入不同积分公式求k,若k为常数则所代公式正确;
作图法:将一组c~t数据按lnc~t、1/c~t等作图,若得直线可判定反应级数;
半衰期法:根据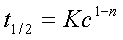 得
得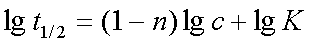 ,以
,以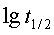 ~
~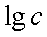 作图可得直线,从斜率可求n。
作图可得直线,从斜率可求n。
微分法:根据 得
得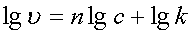 ,以
,以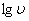 ~
~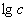 作图可得直线,斜率即为n。
作图可得直线,斜率即为n。
四、温度对反应速率的影响
1、阿仑尼乌斯公式
微分式: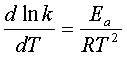
积分式: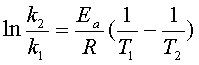
2、活化能
活化分子的平均能量与反应物分子的平均能量之差。
第十章复合反应动力学
一、复合反应基本类型
1、平行反应
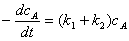 ;
;
2、对行反应
 ;
;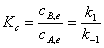
3、连串反应
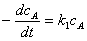 ;
;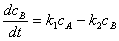 ;
;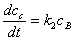
二、复合反应机理近似处理方法
1、平衡态法
对于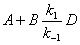
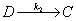 ;若
;若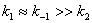 ,则反应物与中间物达成平衡。
,则反应物与中间物达成平衡。
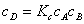 ;
;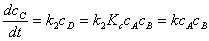
2、稳态法
对于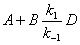
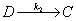 ;若
;若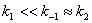 ,则中间物的浓度维持微小量不变。
,则中间物的浓度维持微小量不变。
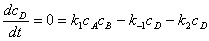 ;
;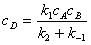
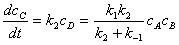
三、链反应与爆炸半岛
1、链反应
分为直链反应和支链反应;链引发、链传递、链终止。
2、爆炸半岛
常见可燃气体在空气中的爆炸限。
第二篇:物理化学公式及概念
物理化学公式及概念
一、气体
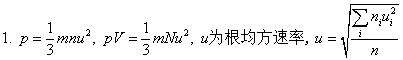
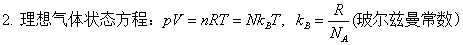

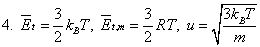

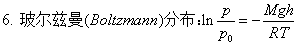


二、热力学第一定律

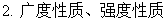
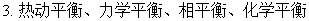
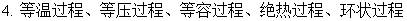
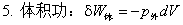

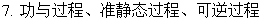
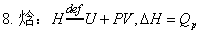
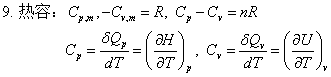
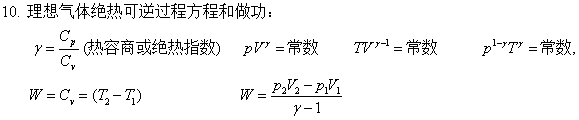
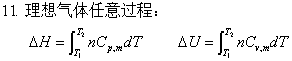
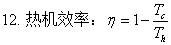
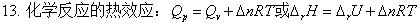
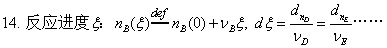
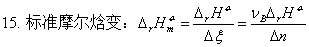
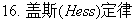
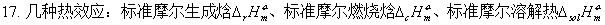
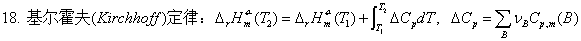

三、热力学第二定律
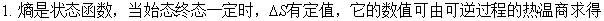
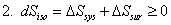

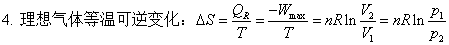

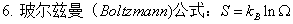
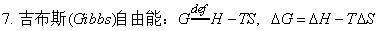
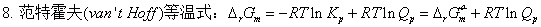

四、多组分系统热力学

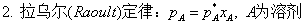
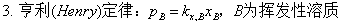
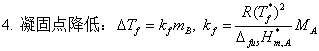
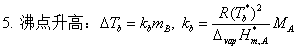
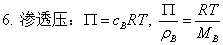
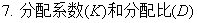
五、相平衡
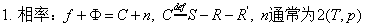

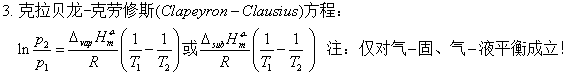

六、化学平衡
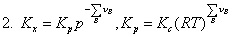
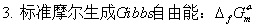
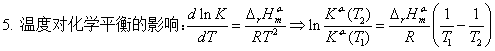

七、电解质溶液
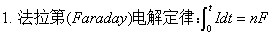
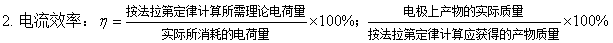
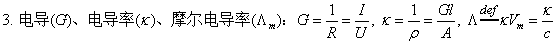
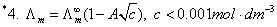
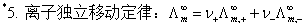
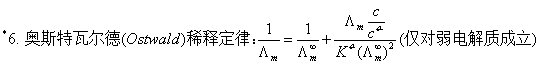
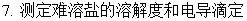
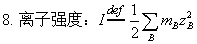

八、可逆电池的电动势及其应用
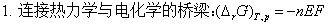

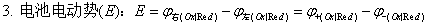

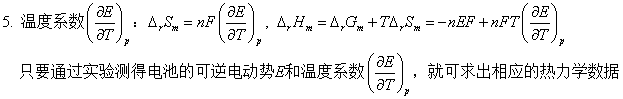
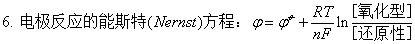
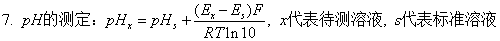
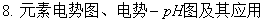
九、化学动力学
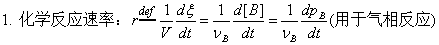
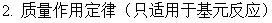
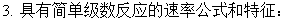


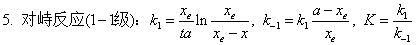





十、表面物理化学
十一、胶体分散系统和大分子溶液
