指出下列各过程中,物系的?U、?H、?S、?A、?G中何者为零?
⑴ 理想气体自由膨胀过程;
⑵ 实际气体节流膨胀过程;
⑶ 理想气体由(p1,T1)状态绝热可逆变化到(p2,T2)状态;
⑷ H2和Cl2在刚性绝热的容器中反应生成HCl;
⑸ 0℃、 时,水结成冰的相变过程;
时,水结成冰的相变过程;
⑹ 理想气体卡诺循环。
(1) ΔU = ΔH = 0; (2) ΔH = 0; (3) ΔS = 0; (4) ΔU = 0;
(5) ΔG = 0; (6) ΔU、ΔH、ΔS、ΔA、ΔG都为 0。
熵差ΔS就是过程的热温商。7. ×; 熵差ΔS是可逆过程的热温商.
在孤立系统中发生的任何过程都是自发过程。√
可逆绝热过程必定是等熵过程。√
卡诺热机的效率只与两个热源的温度有关而与工作物质无关。√
不可逆过程一定是自发过程。×不可逆过程也有非自发过程。
指出下列公式的适用条件
(1)dU = δQ – PdV 1. 封闭体系非膨胀功为0
(2)ΔH = QP; ΔU = QV 2. ΔH=QP, 封闭体系、平衡态,不作非膨胀功,等压过程
ΔU=QV, 封闭体系、平衡态,不作非膨胀功,等容过程
(3)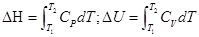
3. 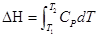 ,封闭体系、平衡态,状态连续变化的等压过程
,封闭体系、平衡态,状态连续变化的等压过程
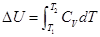 ,封闭体系、平衡态,状态连续变化的等容过程
,封闭体系、平衡态,状态连续变化的等容过程
对于理想气体,适用于一切过程。
(4)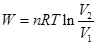 4. 封闭体系、平衡态,不作非膨胀功,理想气体等温可逆过程。
4. 封闭体系、平衡态,不作非膨胀功,理想气体等温可逆过程。
(5)W = -PΔV 5. 封闭体系、平衡态,不作非膨胀功,等外压膨胀过程
(6)PVγ = 常数,P1-γ Tγ= 常数,TVγ -1= 常数
(γ=CP/CV, 单原子Cv=3R/2;Cp=5R/2,双原子 Cv=5R/2;Cp=7R/2,)
6. 封闭体系、平衡态,不作非膨胀功,理想气体绝热可逆过程。
(7)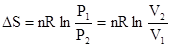
7. 封闭体系、平衡态,理想气体,等温过程,不作其他功。
(8)
8. 封闭体系、平衡态,状态连续变化的等温过程,不作其他功。
(9)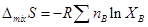
9.封闭体系、平衡态,理想气体,理想溶液等温等压混合。
.例2-12 计算1.00molH2O(1,25°C,101kPa)等温等压汽化过程的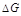 ,并判断此过程是否自发进行。已知H2O(1)在25°C时的饱和蒸气压为3168Pa。
,并判断此过程是否自发进行。已知H2O(1)在25°C时的饱和蒸气压为3168Pa。
解:可设计下列可逆过程:
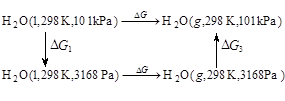
很明显 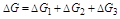
因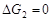 ,液体在改变压力时的
,液体在改变压力时的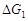 比之气体在改变压力时的
比之气体在改变压力时的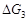 小很多,可以忽略小计。
小很多,可以忽略小计。
因此

因在等温等压下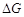 >0,故此过程不能自发进行。
>0,故此过程不能自发进行。
P51 例题1-10 气体氦自0℃,5×105Pa,10dm3的始态,经过一绝热可逆过程膨胀至105Pa,试计算终态的温度为若干?此过程的Q,W,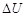 ,
,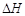 为若干?(假设He为理想气体)
为若干?(假设He为理想气体)
解 此过程的始终态可表示如下
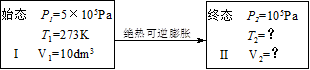
此气体的物质的量为
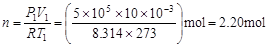
此气体为单原子分子理想气体,故

此气体为单原子分子理想气体,故
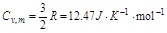
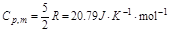
(1)终态温度T2的计算。TV g–1 = 常数 = K PVg = 常数 = K¢
P1–gTg = 常数 = K²
欲计算T2,最好能知道此过程的T、p关系式。由于理想气体的
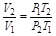
及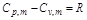 ,将此二式代入(1-69)式,可得
,将此二式代入(1-69)式,可得
 (1-78)
(1-78)
将已知数据代入上式

所以 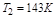
即终态温度为–130℃
(2) Q=0
(3)W的计算
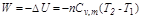
故 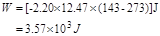
(4)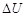 的计算
的计算
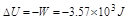
(5)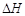 的计算
的计算
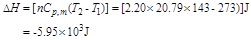
例题1-11 如果上题的过程为绝热不可逆过程,在恒定外压为105Pa下快速膨胀到气体压力为105Pa,试计算T2,Q,W, 及
及 。
。
解 此过程为绝热不可逆过程,始终态可表示如下:

(1)T2的计算
因为是绝热不可逆过程,故(1-69)、(1-70)、(1-72)等式均不能用,而应当用(1-77)式
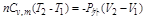
可是其中又有T2、V2两个未知数,还需要一个包括T2、V2的方程式才能解T2,而理想气体的状态方程可满足此要求
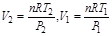
将此二式代入上式可得
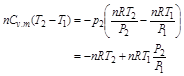
考虑到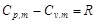 ,代入上式可得
,代入上式可得
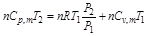
故 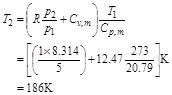
(2) Q=0
(3) W的计算
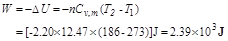
(4)  的计算
的计算
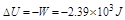
(5)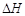 的计算
的计算
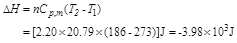
比较此题和上题的结果可以看出,由同一始态出发,经过经热可逆过程和绝热不可逆过程,达不到相同的终态。当两个终态的压力相同时,由于不可逆过程的功做得少些,故不可逆过程终态的温度比可逆过程终态的温度比可逆过程终态的温度要高一些。
2-11 几个热力学函数之间的关系
至今本章主要讨论了S、U、H、F和G五个热力学函数。明确这些热力学函数之间的关系以及微分性质,寻找出这些热力学函数在特定条件下用可直接测量的体系力学量表示的函数形式,具有重要的价值。
一、基本公式
在S、U、H、F和G之间的基本关系式是
H = U + PV
F = U – TS
G = H – TS
这三个公式实际就是H、F、G的定义式。
由热力学第一定律有
dU = dQ – dW
对于封闭体系中发生的无非体积功的变化过程,其热力学函数的变化由可逆途径计算,因此有
dW = –P dV
同时由热力学第二定律有
dQ = T dS
则
dU = T dS – P dV (2-48)
对焓H,由定义式有
dH = dU + P dV + V dP= T dS + V dP (2-49)
对亥姆霍兹自由能F,由定义式有
dF = dU – T dS – S dT= –S dT – PdV (2-50)
对吉布斯自由能G,由定义式有
dG = dH – T dS – S dT = –S dT + V dP (2-51)
以上四个公式,就是这五个热力学函数之间的基本关系式,非常重要,以后的一切公式都是由这四个公式推得。
由上述四个微分关系式,可首先获得关于其中非微分量的表示形式,如对于温度T有
T = 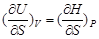 (2-52)
(2-52)
对于熵S有
S =  (2-53)
(2-53)
对于压力P有
P = 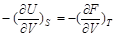 (2-54)
(2-54)
对于体积V有
V = 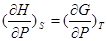 (2-55)
(2-55)
二、麦克斯韦关系式
热力学函数具有全微分的性质,从而对于U、H、F、G可根据微分关系式得出如下关系式。
设函数 z 的独立变量为x,y, z具有全微分性质
所以
对于内能U,根据微分关系式dU = T dS – P dV有
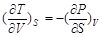 (2-56)
(2-56)
对于焓H,根据微分关系式 dH = T dS + V dP有
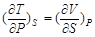 (2-57)
(2-57)
对于亥姆霍兹自由能F,根据微分关系式dF= –S dT – P dV有
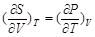 (2-58)
(2-58)
对于吉布斯自由能G,根据微分关系式dG = – S dT + V dP有
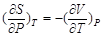 (2-59)
(2-59)
上述四式就称为麦克斯韦关系式。
三、应用
1.等温下体系内能随体积的变化
由dU = T dS – P dV有
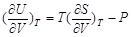
同时由dF = –S dT – P dV知
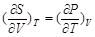
从而
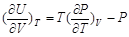 (2-60)
(2-60)
这样根据体系的状态方程,就能求出等温下体系内能随体积的变化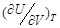 。如对于理想气体,根据状态方程PV=nRT,有
。如对于理想气体,根据状态方程PV=nRT,有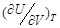 = 0,这就是盖.吕萨克—焦尔实验的结果。
= 0,这就是盖.吕萨克—焦尔实验的结果。
2.等温下焓随压力的变化
由dH = T dS + V dP有

同时由dG = – S dT + V dP有
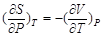
从而
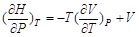 (2-61)
(2-61)
5.等温下CV随体积变化的关系
采用上述类似的方法,可以证明
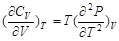
从而有
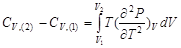 (2-67)
(2-67)
在上述讨论的基础上,可进一步讨论CP–CV的关系。由第一章知道
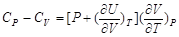
代入关系式
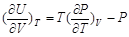
则有
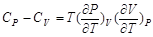 (2-68)
(2-68)
P69例3-1 乙醇和甲醇组成的溶液可看作理想液体混合物。在20℃时,纯乙醇的饱和蒸气压为5.93kPa,纯甲醇的饱和蒸气压为11.83kPa。
(1) 计算甲醇和乙醇各100g组成的溶液中,两种物质的摩尔分数;
(2) 求溶液的总蒸气压和两物质的分压;
(3) 甲醇在气相中的摩尔分数。
解 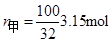
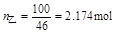

(1) 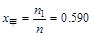
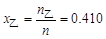
(2) 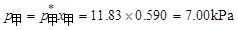

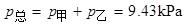
(3) 气相中

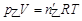
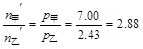
所以
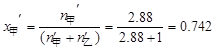
第二篇:物理化学高分考生总结笔记
物理化学总结笔记(常考和容易出错的重点题)
第一章 热力学第一定律
1.“根据道尔顿分压定律p=∑B pB压力具有加和性,因此是广延性质。”这一结论正确否?为什么? 答:不对。压力与温度一样是强度性质。不具有加和性,所谓加和性,是指一个热力学平衡体系中,
某物质的数量与体系中物质的数量成正比,如 Cp=∑nBCp,m(B)。而道尔顿分压定律中的分压pB 是指在一定温度下,组分B单独占有混合气体相同体积时所具有的压力。总压与分压的关系不是同 一热力学平衡体系中物量之间的关系,与物质的数量不成正比关系,故p=∑pB不属加和性。本题 所犯错误是把混和气体中 总压 p与各组分分压 pB 关系误认为是热力学平衡体系中整体与部分的关系。
2.“凡是体系的温度升高时就一定吸热,而温度不变时,体系既不吸热也不放热”,这种说法对否?
举实例说明。
答:不对。例如:绝热条件下压缩气体,体系温度升高,但并未从环境中吸热。又如:在绝热体容器
中,将 H2SO4 注入水中,体系温度升高,但并未从环境吸热。再如:理想气体等温膨胀,从环境 吸了热,体系温度并不变化。在温度不变时,体系可以放热或吸热,相变时就是这样。例如水在 1atm、100℃下变成水蒸气,温度不变则吸热。
3.-p(外)dV与-p(外)ΔV有何不同?-pV就是体积功,对吗?为什么在例2中-pVm(g)是体积功? 答:-p(外)dV 是指极其微小的体积功。-p(外)ΔV 是在指外压不变的过程体积功。即在外压 p 不
变的过程中体积由 V1变化到 V2(ΔV=V2-V1)时的体积功。-pV不是体积功,体积功是指在外压 (p外)作用下,外压p与体积变化值(dV)的乘积。V与 dV 是不同的,前者是指体系的体积,后 者是体积的变化值。体积变化时才有体积功。例2中的-pVm(g)实为-p[Vm(g)-Vm(l)],在这里忽略 了Vm(l),这里的Vm(g)实为ΔV=Vm(g)-Vm(l),因此-pVm是体积功。
4.“功、热与内能均是能量,所以它们的性质相同”这句话正确否?
答:不正确。虽然功、热与内能都有能量的量纲,但在性质上不同,内能是体系的本身性质,是状
态函数。而热与功是体系与环境间交换的能量,是与热力学过程相联系的过程量。功与热是被 “交换”或“传递”中的能量,不是体系本身的性质,不是状态函数,与内能性质不同。热与功 也有区别,热是微粒无序运动而传递的能量,功是微粒有序运动而传递的能量。
5. 为什么本教材中热力学第一定律表达式是:ΔU=Q+W,而有些书中采用ΔU=Q-W, 两者是否有矛盾,为什么?
答:因为本教材规定:体系吸热为正,放热为负;体系对外作功,W为负值,环境对体系作功,
W为正值,总的来说,体系在过程中得到能量为正,失去能量为负。在这个规定下,要满 足能量守衡原理,则必须是体系吸的热加上环境对体系作的功后,才等于体系内能的变化值, 所以是ΔU=Q+W。而有些书上,功的符号与上述规定相反,(体系向环境做功,W 为正值, 环境向体系做功,W 为负值),则就是ΔU=Q-W。
6.一体系由A态到B态,沿途径Ⅰ放热 100J,对体系作功 50J。问(1)由A态沿途径Ⅱ到B态体系
作功 80J,其Q值为多少?(2) 如体系由B态沿途径Ⅲ回到A态得50J功,体系吸热环是放热? Q为多少?
答:(1) ΔUA→B=-100+50=-50J Q=ΔUA→B-W=-50-(-80)=30J
(2) ΔUB→A=-ΔUA→B=50J Q=ΔUB→A-W=50-50=0
体系不吸热也放热
7.已知体系的状态方程式F(T,p,V)=0,由U=f(T,V)写出当压力不变时气体的内能对温度的
变化率的表达式。
答:dU=(U/T)VdT+(U/V)TdV
压力不变时,除以dT:(U/T)p=(U/T)V+(U/V)T(V/T)p
8.为什么无非体积功的等压过程的热,只决定于体系的初、终态?
答:因为无其它功的等压过程中Qp=ΔH,而 ΔH 是体系状态函数的改变值,其大小只决定于体
系的始终态,所以在无其它功的等压过程 Qp 大小只决定于初终态。
9.“因 ΔH=Qp,所以只有等压过程才有 ΔH。”这句话是否正确?
答:不正确。H是状态函数,H=U+pV,凡是体系状态发生变化,不管经过什么过程,体系的焓
值都可能变化,即 ΔH 有可能不等于零。
10.因为“ΔH=Qp,所以Qp 也具有状态函数的性质”对吗?为什么?
答:不对,ΔH=Qp,只说明Qp 等于状态函数H的变化值 ΔH,仅是数值上相等,并不意味着Qp
具有状态函数的性质。ΔH=Qp 只能说在恒压而不做非体积功的特定条件下,Qp 的数值等于体 系状态函数 H 的改变,而不能认为 Qp 也是状态函数。
11.试证明在无非体积功的等容过程中体系的ΔU=QV。
证明:ΔU=Q+W 等容时 ΔV=0,又无其它功,W=0 ∴ ΔU=QV
12.为什么对于理想气体,公式ΔU=nCV,mdT 可用来计算任一过程的ΔU,
并不受定容条件的限制?
答:因为对理想气体,U=f(T),内能仅是温度的函数,从始态出发,不论经什么过程,
达到不同的终态,只要始终态温度分别相同,ΔU 就一定相同。所以公式ΔU=CV,mdT 并不受定容条件的限制。

恒容过程ΔU1=CV,mdT 两者终态的温度相同
恒压过程 ΔU2=ΔU1+ΔU3 ∴ ΔU3=0 ∴ ΔU2=ΔU1=CV,mdp 即 1mol理想气体不论什么过程,只要变到相同温度的终态其ΔU 总是等于CV,mdT
13.为什么理想气体常数R在数值上等于1mol理想气体升高1K时所作的等压体积功? 答:W=-p外ΔV=-p(V2-V1)=-nR(T2-T1)
当 n=1mol T2-T1=1K 时 W=R
14.体系中有100克N2,完全转化成NH3,如按计量方程式N2+3H2→2NH3,Δξ=?,如按计量
方程式N2+H2—→NH3,Δξ=?,如反应前体系中N2的物质的量n(N2)=10mol,分别按 上述二计量方程式所得的Δξ计算反应后的 n'(N2)=?
答:nN2(0)=100/28=3.57mol nN2(ξ)=0
Δξ1=[nN2(ξ)-nN2(0)]/νB=(0-3.57)/(-1)=3.57mol
Δξ2=(0-3.57)/(-1/2)=7.14mol
公式:nB(ξ)=nB(0)+νBΔξ nB(0)=10mol
按方程式:N2+3H2→2NH3, nN2(3.57)=10-(-1)?3.57=6.43mol
按方程式:N2+H2→NH3, n'N2(7.14)=10-(-1/2)?7.14=6.43mol 两者结果相同。
15. 根据Qp,m=QV,m+∑νB(g)RT,Qp,m 一定大于QV,m 吗?为什么?举例说明。 答:Qp,m 不一定大于QV,m,其大小比较取决于 ∑νB(g) 的符号,若∑νB(g)>0, 则 Qp,m> QV,m,但若 ∑νB(g)<0, Qp,m<QV,m
例如:H2(g)+O2(g)—→H2O(l)
ΔHm=Qp=-285.9 kJ?mol-1 ∑νB(g)=-1.5<0
QV,m=Qp,m-∑νB(g)RT=-285.8?103+1.5?8.314?298=-282 kJ?mol-1 Qp,m<QV,m
又例如:Zn(s)+H2SO4(aq)—→ZnSO4(aq)+H2(g)↑
Qp,m=-177.9 kJ?mol-1 ∑νB(g)=1>0
QV,m=Qp,m-∑νB(g)RT=-177.9?10-3-8.314?298=-180.37 KJ?mol-1 Qp,m>QV,m
16.“稳定单值的焓值等于零”;“化合物摩尔生成热就是 1mol 该物质所具有的焓值” 对吗?为什么?
答:不对。稳定单质的焓值并不等于零。但可以说标准状态下稳定单质的规定焓值等 于零,人为规定标准状态下,稳定单质的生成焓,即规定焓为0。化合物的摩尔生 成热不是 1mol 物质所具有的焓的绝对值,而是相对于生成它的稳定单质的焓的相 对值。即是以标准状态下稳定单质生成热为零作基线,得出的相对值。
17. 证明由键焓计算反应的 ΔHm 的公式是:ΔrHm=(-∑nii)(反应物-产物)
答:化合物的ΔfH=∑ni(ΔH原子)-(∑njj)
而反应热效应 ΔrHm=∑νB(ΔHm,f)B=∑νB[∑ni(ΔH原子)-∑(njj)]B =∑νB(∑niΔH原子)B-∑νB(∑njj)B
因组成产物与反应物的元素相同,且各种原子的数目也相等,
即 ∑νB(∑niΔH原子)B=0
便有ΔHm=-∑νB(∑njj)B
=-∑νB(∑njj)B(反应物)-∑νB(∑njj)(产物)
若将反应物的计量系数νB考虑为正值,则上式(-∑νB(∑njj)B(反应物),便成为 ∑νB(∑njj)B(反应物),再将一个B分子中的j键数nj乘上方程式中反应物的计 量系数ν,便是该反应方程中反应物总j键数nj,改写为ni,键焓 i,那么,
反应物的总键焓值便为(∑nii)(反应物)。同理对产物的计量系数考虑为正值,
则为 (∑nii)(产物)。便得:ΔHm=(∑nii)(反应物)-(∑nii)(产物)。
18. 反应 A(g)+2B(g)—→C(g) 的ΔrHm(298.2K)>0,则此反应进行时必定吸热,
对吗? 为什么?
答:不对。只有在等压下,无非体积功时,Qp=ΔHm,ΔHm>0,故 Qp>0,体系必定 吸热。但在有非体积功,或者非等压条件下,ΔHm≠Qp ,ΔHm>0,Qp可以小于0, 等于0,不一定吸热。例如,绝热容器中H2与O2 燃烧,ΔHm>0,但Q=0, 不吸热。
19. “可逆过程一定是循还过程,循还过程一定是可逆过程”这种说法对吗? 为什么? 答:不对。可逆过程不一定为循环过程。因为只要体系由A态在无摩擦等消耗效应存在
的情况下,经由一系列无限接近平衡状态到达B态,则由A到B的过程是可逆。显然, 如果初态 A 与终态 B 是两个不同的状态,则A到B便不是循环过程;如果B态就是
A 态则该过程便是可逆循环过程。循环过程不一定是可逆的,由始态A开始,状态经 过变化,不论途径可逆与否,只要回到始态A,就是循环过程。只是,由A态开始, 在无摩擦等消耗效应存在的情况下,经过由一系列无限接近平衡状态,又回到A态的 循环过程才是可逆循环过程。总之可逆过程与循环过程是两个完全不同的概念。
20. 气体同一初态(p1,V1)出发分别经等温可逆压缩与绝热可逆压缩,至终态,终态体 积都是V2,哪一个过程所作压缩功大些?为什么?
答:(规定环境做功为正值),绝热可逆压缩功大于等温可逆压缩功。这是因为绝热压缩 时,环境所做功全部都变成气体的内能,因而气体的温度升高,故当气体终态体积为 V2 时,气体的压力比经等温可逆到达V2 时气体的压力要高,即绝热可逆压缩时, 环境施加的压力大些,因而所做压缩功也多些。
21. 从同一初态(p1,V1)分别经可逆的绝热膨胀与不可逆的绝热膨胀至终态体积都是V2 时,气体压力相同吗?为什么?
答:不相同。可逆绝热膨胀由(p1,V1)到V2 体系付出的功大于不可逆绝热膨胀由 (p1,V1)到V2 所付出的功。而两过程的 Q 都等于零,因而前一过程中体系内能
降低得更多,相应终态气体的温度也低些。所以可逆绝热膨胀比不可逆绝热膨胀到 终态V2 时气体的压力低些。
22. 理想气体经一等温循环,能否将环境的热转化为功?如果是等温可逆循环又怎样? 答:不能。理想气体的内能在等温过程中不变。ΔU=0
恒外压不可逆膨胀
假设它由 A(p1,V1,T1)—————————→B(p2,V2,T1)
所作功 W(不)=-Q(不)=-p2(V2-V1),再经过可逆压缩回到始态,
可逆压缩
B(p2,V2,T1)——————→ A(p1,V1,T1)(原初态)
W'=-Q'=-RTln(V1/V2) (因为可逆压缩环境消耗的功最小)
整个循环过程:
W=W(不)+W'=-p2(V2-V1)-RTln(V1/V2)=-Q
∵ -p2(V2-V1)<0,-RTln(V1/V2)>0,并且前者的绝对值小于后者,
∴W=-Q>0,Q<0,环境得热,W>0体系得功,即环境失热。
说明整个循环过程中,环境对体系作功,而得到是等量的热,不是把环境的热变成功。 同样,如果A—→B是等温可逆膨胀,B—→A是等温不可逆压缩,结果也是W>0, Q<0,体系得功,环境得热,即环境付出功得到热。不能把环境热变成功。
如果 A——B是等温可逆膨胀,B——A是等温可逆压缩,即为等温可逆循环过程, W=-RTln(V2/V1)-RTln(V1/V2)=0, 则 Q=-W=0,不论是体系还是环境,
均未得失功,各自状态未变。
由上分析,理想气体经一等温循环,不能将环境温转化为功。
23. 将置于室内的一电冰箱的箱门打开,使其致冷机运转,能否降低全室温度?设该机在 0℃ 与室温(25℃)作理想可逆循环每小时能冻出 1Kg 的冰,如房间的总热容为 150 KJ?K-1,估算电冰箱工作 10 小时后室内温度的变化?
答:不能。因为,冰箱门打开,箱内与室内空气流通,使高低两个热源温度相等。致冷机
工作,致冷机消耗的电功以及冰箱内冷却器 (低温热源)吸的热都以热的形式放到室 内 (高温热源),当冰箱门打开时,室内空气又流入箱内,使室内气温升高。这样, 总的效果是致冷机消耗电能转化为室内空气的内能,反使室内温度升高。因而使室 内温度非但不降低反而升高。
1克水的比热为 4.184 J?K-1,1克水的凝固热为 339 J?g-1
Q'=1000?(4.184?25+339)?10=4436 KJ
β=T1/(T2-T1)= 273/25 = 10.92 β=Q'/W
W=Q'/10.92=4436/10.92=406.23 KJ
Q2=W-Q'=4842 KJ ΔT=4842/150=32 K
T3=298+32= 330 K ,房间温度变为330K。
第二章 热力学第二定律
1. 什么是自发过程?实际过程一定是自发过程?
答:体系不需要外界对其作非体积功就可能发生的过程叫自发性过程,或者体系在理论 上或实际上能向外界做非体积功的过程叫自发过程。实际过程不一定是自发性过程, 如电解水就是不具有自发性的过程。
2. 为什么热力学第二定律也可表达为:“一切实际过程都是热力学不可逆的”?
答:热力学第二定律的经典表述法,实际上涉及的是热与功转化的实际过程的不可逆性。 导使过程的不可逆性都相互关联,如果功与热的转化过程是可逆的,那么所有的实 际过程发生后都不会留下痕迹,那也成为可逆的了,这样便推翻了热力学第二定律, 也否定了热功转化的不可逆性,则“实际过程都是不可逆的”也不成立。因而可用“ 一切实际过程都是不可逆的”来表述热力学第二定律。
3. 可逆过程的热温商与熵变是否相等,为什么? 不可过程的热温商与熵变是否相等? 答:可逆过程的热温商即等于熵变。即ΔS=QR/T (或ΔS=∫δQR/T)。不可逆过程热温 商与熵变不等,其原因在于可逆过程的 QR 大于 QIr,问题实质是不可逆过程熵变 由两部分来源,一个是热温商,另一个是内摩擦等不可逆因素造成的。因此,不可逆 过程熵变大于热温商。由于熵是状态函数,熵变不论过程可逆与否,一旦始终态确定,
则ΔS 值是一定的。
4. 为什么说(2-11)式是过程方向的共同判据? 为什么说它也是过程不可逆程度的判据? 答:(2-11)式为:ΔSA→B-∑AδQ/T≥0,由于实际过程是不可逆的,该式指出了实
际过程只能沿 ΔSA→B-∑AδQ/T 大于零的方向进行;而 ΔSA→B-∑ABδQ/T 小于零 的过程是不可能发生的。因而(2-11)式可作为过程方向的共同判据。但不是自发过程方 向的判据.(ΔS-∑δQ/T) 的差值越大则实际过程的不可逆程度越大,因此又是不可逆 程度的判据。
5. 以下这些说法的错误在哪里? 为什么会产生这样的错误?写出正确的说法。 B
(1)因为ΔS=| δQR/T,所以只有可逆过程才有熵变;而ΔS>∑δQIr/T,所以不可 A
逆过程只有热温商,但是没有熵变。
(2) 因为ΔS>∑δQIr/T,所以体系由初态 A 经不同的不可逆过程到达终态 B,其熵 的变值各不相同。
B
(3) 因为ΔS=|δQR/T,所以只要初、终态一定,过程的热温商的值就是一定的, A
因而 ΔS 是一定的。
答:(1) 熵是状态函数,ΔS=SB-SA 即体系由 A 态到 B 态其变化值 ΔS是一定的,与 过程的可逆与否无关;而热温商是过程量,由A态到B态过程的不可逆程度不同,则 其热温商值也不相同。产生上述错误的原因在于对熵的状态函数性质不理解,把熵变与 B
热温商这两个本质不同的概念混为一谈。ΔS=| δQR/T,只说明两个物理量值上相
A
等,并不是概念上等同。
(2) 因为熵是状态函数不论过程可逆与否,其ΔS=SB-SA,只要始终态一定,其值一定, 其改变值与过程无关。错误原因在于没掌握好状态函数的概念。
(3) 错误在于将过程量热温商与状态函数改变量混为一谈,始终态一定,热温商可以是 许多数值。正确的说法是:只要始、终态一定,其ΔS 改变值就一定,热温商的却随 过程的不可逆程度不同而不同,而其中可逆过程的热温商数量等于熵变ΔS。
6.“对于绝热过程有ΔS≥0,那末由A态出发经过可逆与不可逆过程都到达B态,这样同 一状态B就有两个不同的熵值,熵就不是状态函数了”。显然,这一结论是错误的, 错在何处?请用理想气体绝热膨胀过程阐述之。
答:绝热可逆过程中ΔS值一定等于零,因此该过程中QR=0,体系与环境无热交换; 而绝热不可逆过程中,QIr=0,而ΔS一定大于零.另外,从同一始态出发经绝热 可逆过程与绝热不可逆过程达到的终态是不同。现以理想气体从同一始态出发,分别 经过绝热可逆膨胀和绝热不可逆膨胀达到相同的压力,绝热可逆膨胀过程向外做的功 的绝对值比绝热不可逆过程膨胀向外做的功的绝对值要大些,内能降低得也多些,故 绝热可逆过程终态温度低于绝热不可逆过程终态温度,相同的终态压力时,终态体积 是经绝热可逆过程的小,经绝热不可逆过程的大,两者是不同的终态。
7. 263K 的过冷水结成 263K 的冰,ΔS<0,与熵增加原理相矛盾吗?为什么?
答:并不矛盾,熵增加原理适用条件是孤立体系或绝热体系,而上述过程并不具备这个特 定条件,体系与环境间有热交换,不是孤立体系或绝热体系,ΔS 可以小于零。而总 熵会大于零的。
8.“p、298K过冷的水蒸气变成 298K 的水所放的热Qp,Qp=ΔH,而ΔH只决定于 初、终态而与等压过程的可逆与否无关,因而便可用该相变过程的热 Qp,根据 ΔS= Qp/T (T为298 K)来计算体系的熵变”这种看法是否正确?为什么?
答:不正确,ΔS只能等于可逆过程的热温商之和,就是说可以通过可逆过程的热温商 来计算熵变ΔS,而题述过程为不可逆恒温过程,故ΔS≠Qp/T,不可用热温商来 计算体系的ΔS。
9. 如有一化学反应其等压热效应ΔH<0,则该反应发生时一定放热,且ΔS<0,对吗? 为什么?
答:不对。因为化学反应的热效应ΔH是指在等温等压、无非体积功条件下,这时Qp= ΔH,当ΔH<0,Qp<0,反应发生时放热。如果反应不是在等温等压、无非体积 功的条件下,Q≠ΔH,ΔH<0,也不一定放热。例如:绝热容器中H2与O2燃烧 反应,反应的等压热效应ΔH<0,但该条件下Q=0,不放热,也不吸热。再如等 温等压下在可逆电池发生的反应,虽然ΔH<0,但Q可能大于零。即使是放热反应, ΔS也不一定小于零,例如:浓 H2SO4 溶于水,放热,但 ΔS>0。
10. 根据S=lnΩ,而Ω是微粒在空间与能量分布上混乱程度的量度,试判断下述等 温等压过程的ΔS是大于零? 小于零? 还是等于零?
(1) NH4NO3(s)溶于水; 答:ΔS>0
++ (2) Ag(aq)+2NH3(g)—→Ag(NH3)2; 答:ΔS<0
(3)2KClO3(s)—→KCl(s)+3O2(g); 答:ΔS>0
(4)Zn(s)+H2SO4(aq)—→ZnSO4(aq)+H2(g) 答:ΔS>0
11. 物质的标准熵S(298K)值就是该状态下熵的绝对值吗?
答:不对。物质的标准熵 S,298是以绝对零度 0K 时完美晶体的熵值规定为零作为
基点,计算出在标准压力p的 298K 与 0 K 的熵值之差,因此,S(298K)是指标 准压力 p下、298K 的熵值相对于 0K 时熵值的相对值,不是绝对值。
12. (2-29)式与(2-32)式在意义上有何不同? 为什么用(2-32)式判定过程的自发性时不需 加上无非体积功的条件呢?
答:(2-29)式即 dGT,p,W'=0≤0;(2-32)式即ΔGT,p≤0。(2-29)式是等温等压无非
体积功过程的自发方向判据,它表明了在该条件下实际过程沿体系吉布斯自由能降低 方向进行,当体系的自由能不再改变时便达到平衡态,而吉布斯自由能增大过程是不 可能发生的。(2-32)式的“<”表示自发性,而“=”表示平衡态,在等温等压下不 论体系是否作非体积功,自发过程总是沿吉布斯自由能降低方向进行,直到 G 值不变 达到平衡态。如果 W'≠0,环境做 W' 功,则 ΔGT,p>0,不合条件;体系做 W'
功(W'绝对值小于ΔG绝对值),发生自发过程时,ΔGT,p<0;如果 W'=0, ΔGT,p>0的过程不能发生,体系只能发生自发过程 ΔG ≤ 0,由此可见,不论体 系是否作非体积功,(2-32)式都是等温等压下自发过程方向与限度的判据。
13. “ΔGT,p,W'=0≤0 说明ΔG<0 的过程只能在T,p一定,且W'=0 的条件下才能发生”, 这种说法对吗? 为什么?
答:不对。ΔGT,p,W'=0<0,说明在T,p一定时,无非体积功的条件下ΔG<0的过程 可以自发进行,但该过程并非只有在 W'=0条件下发生,有非体积功 W' 时,只要 所作非体积功的绝对值小于吉布斯自由能的降低值条件下也能发生。
14. 关于公式ΔGT,p=WR'的下列说法是否正确?为什么?
(1) “体系从 A 态到 B 态不论进行什么过程 ΔG 值为定值且一定等于W'”;
(2) “等温等压下只有体系对外做非体积功时 G 才降低”;
(3) “G就是体系中能做非体积功的那一部分能量”。
答:(1)不对,只有在 T,p 一定的可逆过程中,体系的 ΔGT,p才等于 WR';在其它条 件下,不可逆过程中 ΔGT,p 不等于 WR'。
(2) 不对,体系的吉布斯自由能是状态函数,假如GB<GA,则由A至B的等温等压过 程是自发的,但不论在实际过程中体系是否对外作非体积功,体系自由能都是降低的。
(3) 不对,只有在等温等压条件下,吉布斯自由能的降低值才是作非体积功的能值。
15. 为什么等温等压下化学反应的自发性不能用ΔH作判据;但有些情况下用ΔH作判据, 又能得到正确的结论?
答:等温等压下化学反应自发性的判据是用ΔG,而不是用ΔH,但由于有ΔG=ΔH- TΔS的关系,因此对|ΔH|>|TΔS|的反应,用ΔH作判据所得到的结论与用 ΔG 判据是一致的,在这种条件下可以用 ΔH 作为判据;另外,对于ΔH>0,ΔS< 0或ΔH <0,ΔS>0的反应,用ΔH判据与 ΔG 判据也是一致的,因此也可用 ΔH来作为判据。
16. 对于ΔH>0,ΔS>0而在常温下不能自发进行的反应改变温度能否使反应自发进 行?为什么?
答:能够。依据ΔG=ΔH-TΔS公式,TΔS 随温度的升高而增大,提高反应温度使 TΔS>ΔH,从而 ΔG<0,反应就能自发进行了。
17. 一般固体分解产生气体时,常常大量吸热,试比较这类固体在低温与高温下的稳定性。 答:固体分解产生气体的反应吸热,ΔH>0,由于产生气体,ΔS>0,随着温度升高, TΔS 增加,ΔG=ΔH-TΔS,随温度升高,反应的 ΔG 降低,所以高温下固体 的热温定性较差。
18. 为什么ΔU =∫TdS-∫pdV 适用于单组分均相封闭体系的任何过程? 这是否意味着对 这种简单的热力学体系的任何过程∫TdS及∫pdV都分别代表热与功呢?
答:对dU=TdS-pdV公式,对一定量单组分均相物系,只要初、终态相同,不论过程可 逆与否都能适用,这因为单组分均相物系不会发生化学变化和相变化,只是p,V,T 的变化,同时由于上式中,U、S、V是状态函数,其变化值与过程无关,因此该式 适用于任何过程,但是只有在可逆过程中∫TdS 才是体系所吸的热。而-pdV才是物 系所作的体积功。
19. 根据 δQ=dU+pdV 及 dU=(U/V)TdV+(U/T)VdT 用全微分判别式证明Q 不是状态函数。
答:全微分的一个重要性质是二阶微商与其求导的次序无关(即尤拉关系式)。
dU 代入δQ,并把 (U/T)V=T(p/T)V-p 代入,
δQ=(U/T)VdT+[(U/V)T+p]dV 中, 那么:
[(U/T)V/V]T≠[(U/V)T/T]V+(p/T)V
所以 Q 不具有全微分性质。
20. 分别讨论定压下升高温度及定温下增大压力时以下过程的ΔG值如何变化?
(1) 沸点下液体气化为蒸气;
(2) 凝固点下液体凝为固体(如Vm(l)>Vm(s))。
答:依据(ΔG/T)p=-ΔS,由ΔS值即可判定在定压下ΔG 对T的变化率的。 当 ΔS>0 时,则(ΔG/T)p<0,随温度升高,ΔG 值减小。当 ΔS<0时,则
(ΔG/T)p>0,随温度升高,ΔG值增大;依据(ΔG/p)T=ΔV,由ΔV 值
可判定在定温下,ΔG 对压力p的变化率。当ΔV>0 时,则 (Δ/p)T>0, 定温下,随压力增大,ΔG增加。
(1)在沸点下液体气化为蒸气,ΔS>0,恒压下升高温度气化 ΔG减小,蒸发更 易进行;而ΔV>0,定温下增加压力,ΔG增大,蒸发不易进行。
(2)液体凝固成固体,由于 Vm(l) > Vm(s),ΔV < 0,定温下加压凝固过程 ΔG 降低,凝固更易进行。而ΔS<0,定压下升温,ΔG增大,凝固不易进行。
21. 如果在 1000cm3 水中加入1mol H2SO4 所得溶液的体积为V,则该溶液中 H2SO4 的 偏摩尔体积是V-1000cm3,对吗?
答:不对。溶液体积为: V=(1000/18)VH2O+VH2SO4,故 H2SO4 的偏摩尔体积为 VH2SO4=V-(1000/18)VH2O。因溶液中水的偏摩尔体积 VH2O≠18 cm3,水的体 积也不再是 1000 cm3,故VH2SO4≠V-1000。
22. “f=p 的状态就是真实气体的标准态”对吗?为什么?
答:不对。真实气体的标准是指定 f=p=101325pa,并且其性质又符合理想气体行为 的状态,即 f=p,γ=1的假想态,而真实气体f=p(即101325pa)的状态,逸
度系数 γ ≠1,因此不是标准态。
. 如果 1000cm3 水中加入1mol 的 H2SO4,溶液的体积增加ΔV,则 H2SO4的偏摩尔的数 值就是 ΔV吗?为什么?
答:不是,题中的ΔV值是溶液变化的体积,不是 H2SO4 的偏摩尔体积,因为偏摩尔体积 的定义是 V(H2SO4)=(V/n)T,p,n1。可以理解为无限大量的 H2SO4 水溶液中,加入 1mol H2SO4 所引起溶液体积的变化值ΔV,本题条件不是无限大量体系,因此ΔV 不是 H2SO4 的偏摩尔体积。
2. 当溶液浓度趋向饱和时,溶质的微分溶解热与摩尔积分溶解热各趋向何值?当浓度趋 向无限稀释时,又将怎样?
答:当浓度趋向饱和时,溶质的微分溶解热趋向于零,而摩尔积分溶解热趋向于某一定值。 当浓度趋向无限稀释时,微分溶解热等于溶质的积分溶解热曲线在原点时的斜率。而 积分溶解热倾向于零,但是它的摩尔积分溶解热趋向一个定值。
3. (3-6) 式与 (3-7)式各表明怎样的物理意义?
答:(3-6)式为:ΔHsol=Hslu-[nBH*B+(1/MA)?H*A],其意义表明该体系的积分溶 解热等于其混合后(终态)与混合前(初态)的焓差值;
(3-7)式为:(ΔHsol/nB)T,p,n(B)=HB-HB,m 表明溶质B的微分溶解热等于B 在溶液中的偏摩尔焓与其纯态的摩尔焓之差。
4. 拉乌尔定律与亨利定律有何异同?
答:相同点,两者意义均表明溶液中组分的蒸气压正比于其在溶液中的浓度,因此两者的 数学形式相同;不同点,拉乌尔定律适用于理想稀溶液的溶剂,公式中的比例常数为 该溶剂 A 在所述温度时的纯 A 的蒸气压 p*A,亨利定率适用于理想稀溶液中的溶质, 亨利定律的比例常数为实验值的经验常数,见下列:
Kx=lim pB/XB; Km=lim pB/mB; KC=lim pB/CB
→→→ x0 m0 c0
亨利常数只有数学上的极限意义无其它物理意义。使用亨利定律时,其浓度单位可按 需要应用x、m或c,并且亨利定律的形式也按需要可写成pB=RxXB,xB=KxpB 等 形式,使用的溶度单位不同,亨利常数也不同。
5. 亨利常数对每一种物质是否是一个定值,它会随浓度、温度、溶剂性质而变吗?
答:亨利常数对每一种物质不是一个定值,对不同的物质,在不同的温度与溶剂有不同的 亨利常数值,对同一温度与同一溶剂,其亨利常数不随浓度的变化而变化,但随温度 的变化而变化。另外,亨利常数随使用的浓度单位不同而数值不同,但不同浓度单位 的亨利常数之间可相互转化换算。
6. 何谓溶剂,何谓溶质,两者各服从怎样的规律性?
答:溶剂与溶质的划分具有相对的意义。对于液体溶于液体形成的溶液,把数量多的组分 叫溶剂,数量少的组分叫溶质。对于气体、固体溶于液体形成的溶液,气体、固体叫 溶质,液体叫溶剂。在理想稀溶液中溶剂服从拉乌尔定律,溶质服从亨利定律;理想 混合物中,拉乌尔定律与亨利定律是一回事,各组分在任何浓度下都服从拉乌尔定律。
7. Kx、Km与KC 三个实验值是否存联系?有人认为其间存在的关系为:
Kx=Km/MA=KρA/MA,你相信否?
答:由于 xB、mB、cB 三种浓度单位之间存在联系,故Kx、Km与KC 之间必然存在
联系。在稀溶液的条件下,三种浓度单位的亨利常数之间存在题中给出的关系式。
8. 标准态具有怎样的意义,溶剂与溶质的标准态有何异同?如果溶质也选用摩尔分数xB 为浓度单位,那么它的标准态是怎样一个状态?(提示:教材上图3--3中Kx点)
答:物质的标准态一般是计算该物质在混合物中,或在溶液中的化学势相对值时而选取的基准态。
液态理想混合物中任一组分组分 B 的标准态为μB=μB*(l,T,p)。稀溶液中溶剂A的 标准态为μA(T)=μ*A(l,T,p);溶质B的标准态为亨利定律直线的延长线上某一状态, 其浓度为1个浓度单位(xB=1,mB=1或cB=1,视所用的浓度单位而定)并用其活度系数 γB(γx,γm或γC)亦为1的一个假想态。如果以xB表示浓度,标准态是xB=1,并且仍符合 亨利定律的假想态,即图3-3中的 Kx点。
9. μB(l,T,p)、μB*(l,T,p)、μB(l,T)、μB(g,T) 四个符号的意义有何不同? 答:μB(l,T,p) 为在温度T,压力p时液态混合物中组分 B 的化学势。
μ*B(l,T,p) 为在温度T,压力p时液态纯 B 的化学势;
μB(l,T) 为温度T,标准压力p下,液态混合物中,组分B的标准态化学势; μB(g,T) 为温度T,标准压力p下,但为气态混合物中组分 B 的标准化学势。
10. 下列三者何者正确(1)μB,m(l)=μB,C(l); (2)μB,m=μB,C+RTlnKC;
(3)μB,C(l)-μB,m(l)=RTln(KB,C/kB,m)。
答:第三式正确,该式指出了理想稀溶液中组分 B 二种不同浓度单位 m 与 c 的标准
的化学势之差。
11. 根据公式 (3-25)与 (3-26),当活度 aB,m或aB,C,等于1时的状态就是标准态,
这个想法是否对?若将图3-5中通过对角线 m=1 的点作一水平线与实线相交的点, 其化学势为多少?是否是标准态?
答:(3-25)式:μB(l,T)=μB,m(l,T)+RTlnaB,m ;
(3-26)式:μB(l.T)=μB,C(l,T)+RTlnaB,C ;aB,m或aB,C 等于1的点,该状态
不一定是标准态,只有活度系数也是 γ=1才是标准态。
图3-5中,通过对角线 m=1的点作一水平线与实线相交的点其化学势的大小与标 准态化学势相等,但不是标准态。
12. 为什么稀溶液的沸点升高、冰点下降、渗透压以及溶剂蒸气压下降称为依数性。引起 依数性的最基本原因是什么?
答:上述四种性质的数值只与溶于溶剂中溶质的粒子数多少有关,而与溶质本身的性质无 关,故称为依数性。依数性产生的主要原因是由于溶质溶入后引起溶剂化学势降低。
13. 在溶剂中一旦加入溶质就能使溶液的蒸气压降低,沸点升高,冰点降低并且具有渗透 压。这句话是否准确?为什么?
答:不一定准确。如果加入的溶质是挥发性的,并且挥发性比溶剂大,则溶液的蒸气压增 加,沸点下降;如果溶质是非挥发性的,或者溶质的挥发性小于溶剂,则题述结果正 确。
14. 如果在水中加入少量的乙醇,则四个依数性将发生怎样的变化,为什么有这样的变化?
如果加 NaCl、CaCl2 则又怎样?
答:水中加入乙醇后,溶液蒸气压上升,沸点下降。冰点仍是下降,渗透压仍存在。
这是由于乙醇是挥发性的,并且挥发性又很大。但乙醇水溶液凝固时,析出的固态仍 是纯冰。如果溶入 NaCl,由于每个分子完全电离成二个粒子,则蒸气压降低,沸点 升高,所呈依述性数值加倍,如溶入 CaCl2,则近似增加三倍。
15. 某一定浓度的稀溶液,它的四个依数性间存在着怎样的简单定量关系?
答:ΔTb/Kb=ΔTf/Kf=πVA/(RTMA)=(mpA*/pA)/MA。
16. 运用公式(3-40)时,从溶液中析出的固体是否必须是固态纯溶剂,为什么?
答:(3-40)式为:ΔTf=KfmB,条件是必须固态纯溶剂,因推导该式的基础是溶液中
溶剂 A 的化学势与固态纯溶剂的化学势相等。
17. 你怎样从微观上理解只有理想混合物中的每一种组分才能在全组成范围内服从拉
乌尔定律。
答:因为理想混合物中每一种组分粒子与其周围异种组分粒子之间的相互作用,等同于 该组分处于纯态的情况(即等于同种粒子之间的相互作用),因此理想混合物在全组 成范围内服从拉乌尔定律。
18. 溶液中的组分与混合物中的组分有何区别?
答:溶液可以是气体、固体溶于液体形成的,气体、固体称为溶质,液体称为溶剂,而混 合物中必须是两种液体混合而得的。用热力学处理时,混合物中任一组分化学势公式 都服从或近似服从拉乌尔定律,而溶液中的溶剂按拉乌尔定律处理,溶质按亨利定律 处理,因此两者运用不同的处理过程。
19. 理想气体与理想液态(或固态)混合物的微观粒子间的相互作用有何区别?
答:理想气体的分子间不存在相互作用,而理想混合物的粒子间存在相互作用,不过是同 种粒子还是异种粒子之间的作用力一样大。
20.“理想稀溶液与理想混合物属于一个概念”,这句话你以为如何?
答:理想稀溶液中溶质完善地服从亨利定律,溶剂服从拉乌尔定律,两者的标准态具有不 同的含义。而理想混合物中任一组分服从拉乌尔定律,任一组分的标准态具有相同的 含义。因此两者不属于同一概念。
21. 你能说清楚 (3-17)式中每一项的物理意义吗?
答:(3-17)式:μA(l,T,p)=μ*A(l,T,p)+RTlnxA≈μA(l,T)+RTlnxA
μA(l,T,p) 是液态溶液中组分 A 在 T 温度,压力 p 时的化学势,μ*A(l,T,p)是 液态纯 A 在温度T,压力 p 时的化学势,μA(l,T)是A在温度T,标准压力p 时的标准态化学势。由于压力对液态化学势影响很小,μ*(l,T,p)近似等于μ(l,T)。 RTlnXA 是溶液中组分 A 较纯 A 的化学势的下降值。
22. 理想混合物与非理想混合物在微观结构与宏观性质上有何不同?
答:理想混合物的微观结构特征是同种粒子或异种粒子之间作用力相等,而非理想混合物 便不具理想混合物的微观特征是同种粒子或异种粒子之间作用力不相等。理想混合物 的宏观特征为ΔV(混合)=0,ΔU(混合)=0,ΔH(混合)=0,ΔCp(混合)=0,非理 想混合物不具有上述几个特征。
23. 试比较组分 B 的化学势在理想混合物与非理想混合物的公式中有何同异?
答:在理想混合物中为 μB(T)=μB(T)+RTlnXB
在非理想混合物中 μB(T)=μB(T)+RTlnaB
相同点:(1)数学形式相同;(2)标准态相同;不同点:理想混合物中直接引用浓度xB而
非理想混合物须引用活度aB,活度aB=γBXB,γB为活度系数。
24. 下列三个式子在一般压力下是否都正确,为什么?
μB(s,T)≈μB*(s,T,p)
μB(l,T)≈μB*(l,T,p)
μB(g,T)≈μB*(g,T,p)
答:前两者比较正确,因这二者的 μB 与 μB 之差为Δμ=VS(p-p)或 Δμ= VL(p-p),该值与 μB相比较甚小可忽略不计,故这两式成立,第三式Δμ= Vg(p-p),因Vg较VS或Vl相差甚大,Δμ不能忽略不计,故第三式不能成立。
第四章 化 学 平 衡
1. 对于一个封闭体系,其化学反应自由能ΔGm即(G/ξ)T,p 是否随反应的进度而变 化?为什么?
答:对于一个封闭体系,其化学反应自由能 ΔGm 即(G/ξ)T,p随反应的进度而变化。 在等温等压条件下,当反应物自由能的总和不等于产物自由能总和时,反应总是自发地 向自由能减小的方向进行。也就是体系中自由能G随着反应进度ξ的变化而降低,因此, ΔGm 即(G/ξ)T,p随ξ的变化而改变。另一方面,ΔGm=(G/ξ)T,p=∑νBμB, 由于μB与组成xB有关,封闭体系中,反应物与产物混合在一起,随反应进度ξ的改变, 体系中组成发生变化,μB改变,因此ΔGm也发生变化。
2. 如果知道某一反应体系在一定温度与压力下,其ΔGm<0,则体系中的反应物是否能全 部变成产物?
答:当温度、压力一定时,反应体系的 ΔGm<0,则正向反应能自发进行。
(1)若为封闭体系,ΔGm=(G/ξ)T,p=∑νBμB是随ξ变化而变化的,也就是随着反
应的进行,反应物数量减少,产物数量增多,反应物化学势总和不断减小,产物的化 学势总和不断增大,最终达到相等。此时ΔGm=0,反应达到平衡。反应物与产物的 数量不随时间而改变,这时反应物与产物共存,故反应不能进行到底。
(2)若为敞开体系,有些反应ΔGm=∑νBμB不随ξ变化而变化,反应物化学势之和总 是大于产物化学势之和,因此反应能进行到底,例如:标准压力下,900℃时,在空 气中煅烧石灰石反应:CaCO3(s)—→CaO(s)+ CO2↑,就能进行到底。
3. 对于封闭体系中的匀相反应 cC+dD—→ gG+hH
(a)如果 gμG+ hμH<cμC+dμD
(b)如果 gμG+ hμH>cμC+dμD
(c)如果 gμG+hμH=cμC+dμD
(d)如果 gμG+hμH=cμC+dμD
以上四种况,各表明反应体系存在什么情况?
答:(a) 正向反应能自发进行 (b) 逆向反应能自发进行
(c) 参加反应的物质都处于标准态时达到化学平衡,不是处于标准态时,不一处 于平衡态。
(d) 反应处于平衡状态。
4. 对于一个等温等压下的封闭反应体系,因其ΔG=-RTLnK,故反应体系的标准态 即是平衡态,这个概念是否正确?如果体系的情况为ΔG= 0,则体系是否是平衡态? 答:这个概念不正确。ΔG与K各自对应于反应体系二种不同的状态,ΔG是指反应物
与产物都处于标准态的自由能之差,K是反应体系处于平衡态时反应组分的活度积, ΔG=-RTLnK仅反映了ΔG 与K之间数值上的关系,并没有物理意义上联系, 更没 有表明是同一状态。当体系中ΔG=0,体系不一定处于平衡态,因为ΔG=0, 体系的 ΔGm =ΔG+RTnQ=RTLnQa,只要活度商Qa≠1,则ΔGm≠0,体系就不是 化学平衡 态。只有当体系的Qa=1,或反应体系中各反应物质都处于标准态,ΔGm=RTLnQa=0, 或ΔGm=ΔG=0,体系才处于平衡态,这仅是一种特殊的情况。
5. 为什么化学反应一定存在着一个确定的平衡态?反应体系的平衡条件是∑iμiνi=0 还是 Ka?
答:对于封闭体系来说,化学反应一定存在一个确定的平衡态。因为封闭体系在一定条件 下,ΔGm=(G/ξ)T,p=∑νBμB 随着反应进度ξ的变化而改变,正方向进行时, 反应物浓度减小,反应物化学势之和降低,产物浓度增大,产物化学势之和升高,最 后必然导致反应物化学势之和与产物化学势之和相等,处于反应物与产物共存一起, 其浓度不随时间而改变的平衡态。其根本原因是产物于反应物混和在一起,由于混合,
熵增大,自由能降低,使体系自由能随反应进度的变化曲线上有一个极小值,即平衡时, 自由能最低。因此,封闭体系反应一定存在一个确定的平衡态。 而对于敞开体系,可 能不存在平衡态。反应体系平衡的条件是∑iνBμB=0,而不是Ka。
6. “某一反应的平衡常数是一个确定不变的常数。”这句话是否恰当。
答:不恰当。平衡常数会随某些反应的条件(如温度)变化而变化。
7. 下述二个反应的平衡常数有何区别(包括单位),ΔG 又是怎样的?
A B 及 B A nA(A)n 与 nA(A)n
答:AB与BA的平衡常数及其量纲都互为倒数。两者ΔG绝对值相等,符号 相 反; nA(A)n 与nA(A)n 前者的平衡常数和量纲是后者的平方, 前者的ΔG 是后者的二倍。
8. 何为标准生成自由能?为什么对于非挥发性物质ΔG,f≈ΔGm,f,而对于气态物 质两者却相很大?
答:规定标准态下稳定单质生成自由能为零,由标准态下的稳定单质生成标准态下1mol 的化合物所引起自由能的改变值称为该化合物的摩尔标准生成自由能 ΔG,f;根 Δf G p
据(ΔG/p)T=ΔVm, | dΔG=|ΔVdp, ΔfG-ΔfGm=ΔV(p-p), ? ΔfGm p
则ΔfG-ΔfG*m=ΔVm(p-p),对于非挥发性物质ΔVm 很小,因此:
ΔVm(p-p)项与 Δf Gm 相比,可忽略不计,ΔfG≈ΔfG*m而对于气态物质ΔVm 数值较大,ΔVm(p-p)项不能忽略不计,因此 ΔfG与 ΔfG*m 相差较大。
9. 为什么对于计算液相反应的ΔGm,在压力不甚高的条件下,也可以用μ*B来代替μB?
答:μB(L)=μB(T)+RTLnaB
p p
∵μ*B(l,T,p)=μB(l,T,p)+| VBdp,对液体体系,其中 |VBdp=VB(p-p) ? p p
当压力p不甚高条件下,这项值很小,仅几个焦耳,而μB是几十个千焦耳,相比, 因此可忽略不计,μ*B≈μB,可用μ*B代替μB,写成μB(L)=μ*B(T)+RTLnaB。
10. 气相反应的 K、Kp、KC、Kx 及Kf 之间什么区别与联系,各具怎样的量纲?
∑ν∑ν∑ν∑ν答:(1)对于理想气体,K=Kp(p)-,Kp=K(p)=Kx(p)=KC(RT),
K、Kp、KC 仅是温度的函数,Kx 是T、p的函数。K、Kx 无量纲,Kp
∑ν∑ν 量纲为(pa),KC 量纲为 (mol/dm-3),如 ∑ν=0,均无量纲。
∑ν (2)对于实际气体,Kf=KpKr,Kf=K(p),K、Kf 仅是温度的函数,Kp
∑ν 是T、p的函数,K、Kx 无量纲,Kf、Kp 量纲为(pa),∑ν=0,则均无量
纲。
11.“凡是反应体系便一定能建立化学平衡”,这个概念是否一定正确,试举例说明之。 答:不一定正确。如对于敞开体系,许多反应能进行到底,不能建立化学平衡。例如, 1000℃ 时在空气中煅烧石灰:CaCO3(s)—→CaO(s)+CO2(g),这个反应就能进行到 底,不能建立起化学平衡。
12. 怎样从等温方程式得出等压方程式?这两个方程各有几种形式?各说明什么问题? 答:(1)等温方程ΔGm=-RTLnK+RTLnQa,如果体系中每一种组分都处于标准态时, 则上式便变为ΔG=-RTLnK,便可用来计算平衡常数,将上式变形后,对温度 求微商可导出等压方程: ΔG/T=-RLnK
[(ΔG/T)/T]p=[-R(LnK)/T]p=-R[(LnK)/T]p
而吉--赫公式:[(ΔG/T)/T]p=-ΔH/T2
∴ [(LnK)/T]p=ΔH/RT2 即为等压方程式
(2)等温方程形式有:ΔGm=ΔG+RTLnQa
ΔG=-RTLnK+RTLnQa=RTLn(Qa/K) 等。
等压方程除上面的微分式 (Lnk/T)p=ΔH/RT2 外,还有:
LnK=-ΔH/RT+C
Ln[K(T2)/K(T1)=ΔH(T2-T1)/RT1T2 等形式。
(3)等温方程说明反应进行的方向和限度(平衡)。等压方程式说明温度对K的 影响,即温度对化学平衡的影响,以及不同温度时 K(T) 的计算。
13. 为什么反应平衡体系中充入惰性气体与减低体系的压力等效?
答:因为在等压下,体系的总压不变情况下,在平衡体系中一但充入惰性气体,体系 中气体总摩尔数增加,反应组分的摩尔分数减少,则必然降低反应体系各反应组分的 分压力。于是也降低了反应组分的总压,因此在总压不变条件下,充入惰性气体与降 低体系的压力对平衡的影响等效。如果不是总压不变条件下,若是等容条件下,充入 惰性气体与降压不等效。第五章 相 平 衡
1. 图 5-2中,α 曲面与 β 曲面相交的abd线是一条等化学势的曲线。这句话的含义 是什么?
答:abd曲线在Tp平面上的投影为 a'd'b',该线上的任意一点,在其指定的温度和压 力下,两相化学势相等,即α 与 β 二相处于平衡状态。
2. 西藏高原的气压为 65.8Kpa,为什么在西藏高原用一般锅子不能将生米烧成熟饭? 答:查不同温度下水的饱和蒸气压表,可知 89℃ 时水的饱和蒸气压为65.8Kpa,在西藏 高原,加热到 89℃ 水就沸腾,一般锅子中水温不能超过 89℃,温度不够高,所以 生米不能成熟饭。
3. 为了防止苯乙烯的高温聚合,可以采用减压蒸馏,若使苯乙烯在 318.2K 减压蒸馏, 欲计算出设备的真空度为多少?如何算法,尚需哪些数据?
答:根据克--克方程 ln(p2/p1)=(ΔvapHm/R)(1/T1-1/T2),若已知一个压力(p1)下 的沸点(T1)和汽化热(ΔvapHm)数据,就可以求 318.2K(T2) 时苯乙烯的饱和蒸气压 (p2),则就可求得设备的真空度。为此,尚需要知道苯乙烯的正常沸点(或一个温度下 的饱和蒸气压)和汽化热(ΔvapHm)数值。
4. 对于一个含有N种化学物质所组成的体系,若体系中不存在化学反应,则N与C存在什
么关系? 又若其中某一种化学物质在某一项中实际不存在,试推导出该体系的相律形式 仍然是(5-14)式。[提示:请考虑描述体系组成的变量数与各种物质在各相间化学势 相等的等式数应该作怎样的修正?]
答:化学物质数N是一指相平衡体系内能够出现的不同化学性质的物质数;组分数C是指 该平衡体系内所需的最少物质数,即该相平衡体系中物种数减去化学平衡数,再减去浓 度限制条件数,C=N-R-R'。如果体系中不存在化学反应,则C=N-R', 如果体系中不存在化学反应,也不存在浓度限制条件,则C=N。
C种物质在φ 个相中都存在,则描述体系组成的变量数为 φ(C-1),化学势相等的关 系式数为 C(φ-1),描述体系最少变量数,即自由度 f=φ(C-1)-C(φ-1)+2 =C-φ+2;
若某种物质在其中某一相中不存在,则描述体系组成的变量数为 (φ-1)+(C-2) =φ(C-1)-1,化学势相等的关系式数为: C(φ-2)+(C-1)=C(φ-1)-1,自由度 f=[φ(C-1)-1]-[C(φ-1)-1]+2=φ-C+2。因此体系的相律形式是同一形式。
5. 对于纯水,当水气、水与冰三相共存时,其自由度为多少?你是怎样理解的? 答:根据相律,水纯物质,c=1,T=273.16K,p=611pa,温度压力确定,其自由度 f=1-3+2=0,说明该体系的组成、温度与压力均不能任意改变。
6. 在图 5-6 中,若体系从 a 点移动到 c 点,体系的状态将发生怎样的变化;
如果从 d 点移动到 a 点,则又将发生怎样的变化?
答:体系由状态 a 点开始,经恒温压缩到达CT时,开始液化,这时T、p
均保持不 变,直到蒸气全部变成液体后,压力才继续增加到达 c点状
态。体系从 d 点状态,经等压升温,到达CT线时,开始汽化,这时
T、R均不变,直 到液态水全部变成水汽后,才升温到 a 点状态。
7. 在图 5-8(b) 中,若体系从 a 点移动到 d 点: (a) 缓慢改变;
(b) 快速改变,
体系的状态将发生怎样的改变?
答:从 a→d 的缓慢变化过程,液态硫在恒压下降低温度,到达EC线上b'点时,冷凝 成单斜硫,b'→c' 为单斜硫恒压降温过程,到达EB线上c点时,单斜硫转变为斜方 硫,此后 c→d 为斜方硫的恒压降温压过程。
从 a→d 的快速改变过程,液态硫恒压降温到 b'点,来不及转变成单斜硫,温度很 快降到EG线上 b 点时,开始凝结成斜方硫,b→d 为斜方硫恒压降温过程。
8. 由水气变成液态水是否一定要经过两相平衡态,是否还有其它途径。
答:不一定要经过两相平衡。从水的相图上可知,将水汽先升温,使温度超过 647.2K, 后再加压,使压力超过 2.2?107pa,然后再先降温后降压,便可不经过气液两相平衡 态,使水汽转变成液态水。
9. 图 5-9 是 CO2 的相图,试与水的相图比较,两者有何异同,图中有哪处 f=0? 根据相图你如何理解在高压钢瓶内可以储存液态 CO2,而将液态 CO2 从钢瓶口快速喷 至空气中,在喷口上装一呢袋,在袋内得到的是固态 CO2(干冰),而不能得到液态 CO2?
答:与水的相图比较,显著的差别是固液二相平衡线的倾斜方向不同,水的液固二相平衡 线斜率 dp/dT<0,而 CO2 的 dp/dT>0。
在室温和正常大气压,p/p=1时,液态水是稳定的,而对于 CO2 来说,固态与气 态是稳定的,因为水的三相点时压力 p/p<1,而 CO2 三相点时压力 p/p>1,液 态是不能稳定存在的,气、固二相可平衡存在,因此从钢瓶中喷出的 CO2 不可能是液 态,高压下液态 CO2 喷出钢瓶,压力迅速降低,迅速气化膨胀,体系对环境作功,内 能下降,温度降低,使另一部分 CO2 因温度下降而凝结成固态 CO2(即干冰)。因此 呢袋内得到干冰,而不能得到液态 CO2 。

10. 根据硫的相图,请考虑下述诸问题:
(a) 为什么硫存在四个三相点?
(b) 将室温下的斜方硫投入 373.2K 的沸水中,便迅速取出来与在沸水中放置一段较长 的时间再取出来,二者的状态可能有何差别?
(c) 将 388K 的熔融硫倒入 373K 的沸水中放置一段时间,硫将成什么状态?
(d) 将高温硫蒸气分别通入 373K 的沸水中与 298K 的水中,所形成的硫各是什么状 态?
(e) 将单斜硫迅速冷却至室温,其状态是稳定态还是介稳状态?久置后又将怎样? 答:(a) 因为硫具有单斜与斜方两种晶相,一种气相与一种液相共四相,所以具有四 个三相点。
(b) 放入 373.2K 沸水中迅速取出来,不及进行晶形转变,仍为斜方硫,在沸水中久 放后便转变为单斜硫。
(c) 硫成为单斜硫。
(d) 通入沸水中为单斜硫,通入 298K 水中为斜方硫。
(e) 迅速冷却仍为单斜硫,它是介稳状态,久置后转变为斜方硫。
11. 为什么具有 40% Cd 的 Bi-Cd 体系,其步冷曲线的形状与纯 Bi 及纯 Cd 的相同? 答:因将该体系冷却到 413K 时,便有固相出现,但析出的固体成份与液相成份相同, 液相组成不变,f=0,温度不变,步冷曲线出现平台,直至全部凝固后温度才下 降,所以步冷曲线形状与纯 Bi 或纯 Cd 相同。
12. 怎样可从含 Cd 80% 的 Bi-Cd 混合物中分离出 Cd 来,能否全部分离出来? 答:先将体系加热熔化(温度起过 563K ),再使其缓慢冷却,(搅拌使液相组成均匀),当 体系冷却到BC线处,便有纯 Cd 析出,继续冷却,Cd 不断析出,使温度不低于 413 K时,便可分离出纯固态 Cd,但不能把体系中 Cd 全部分离出来,因为温度降到 413K 时,除了 Cd 析出外,Bi 也析出,也可认为 Cd 与 Bi 形成低共熔混合物(含 Cd40%) 析出,用杠杆规则计算可知最多能有 66.7% 的 Cd 可以分离出来。
13. 在图 5-13 与 5-14 中各有几个f=0的点?
答:在图 5—13 中有五个 f=0 的点,分别是甲酸、甲醛的熔点(M点与R点),化合 物熔点(p点)和二个最低共熔点(N点与Q点)。
在图 5—14 中有四个f=0 的点,CaF2、CaCl2 的熔点(A点与D点),低共熔点 (C点)和不稳定化合物的不相称熔点(B点)。
14. 图 5-18 与 5-19 所示的两种部分互溶体系有何基本相同之处,又有何不同之处? 答:基本相同处是两者都能形成二种固溶体α 及 β,两者均具有二块液固平衡区及一条 三相平衡线。不同之处是:前者两种纯组分物质的熔点比较接近,体系能形成一最低 共熔点,而后者的两种纯组分物质的熔点相差很大,体系不能形成最低共熔点,而形 成转熔点。固相(α)与液二相平衡时,前者固相线在液相线的左边( Cd 合量是液相中 大于于固相α 中),后者固相线在液相线的右边( Cd合量是液相中小于固相α 中)。
15. 位于图 5-22 中 A'B' 直线上方的某一个点是表示体系的点,还是体系某一相的点? 位于眼区内的点是体系的点,还是体系中某一相的点? 怎样估计该点的气-液二相的 相对质量?
答:在 A'B' 直线上方,只存在一个相--液相,该区内任一点是表示体系的点,也是表 示液相的点,两者是一致的。 位于眼区内的一个点(如O点),是表示体系的点, 不是相点,经过该点作横坐标的平行线,与液相线和气相线交点(M、N),分别表示 该体系中,平衡的气、液两相的相点。 根据杠杆规则,气、液平衡两相的相对质量 W(g)/W(l)=OM/ON。
16. “根据相律,对图 5-22 进行检查,在 A点的自由度为:f*=2-2+1=1
即说明除T已恒定外,压力和组成还可以自由改变。”这结论是否符合实际情况? 应如何纠正?
答:A点为该双组分体系中特殊点,实际上组成 C=1,已成为单组分体系,故题中自 由度 f*=2-2+1=1不符合实际情况。应是 f*=1-2+1=0,即除T恒定外,压力 和组成均不能改变。
17. 图 5-25 及 5-26 中的曲线极值处的自由度为多少?如何得来?说明什么问题? 什么样的双液系会出现具极值的曲线?
答:图 5—25 及 5—26 中的曲线极值处的自由度为零,f*=0。得来的方法有两种: 一种是:可简单地认为极值处气液相组成相同,可作为单组分体系,f*=1-2+1=0。 另一种是:根据相律推导,在极值处时气液二相组分相同,描述体系组成变量的总数 由φ(C-1) 改变成 (φ-1)(C-1),化学势相等的等式数不变,所以:f=(φ-1)(C-1) -C(φ-1)+2=3-φ ,恒压时 f*=2-φ。因此不论单双组分或是三组分体系, 只要二相平衡时组成相同, 其自由度f*=2-2=0。
说明恒压下,此体系温度和组成不变,是恒沸混合物。 当两种组分的异种分子间 引力与两种组分的同种分子间引力相差较大,溶液中组分的蒸气压对拉乌尔定律计算 值有较大的偏差时,形成的双液体系会出现具有极值的曲线。
18. 如何将含HCl 24% 的盐酸进行蒸馏,馏出物为何物? 如果将含HCl 18% 的盐酸蒸 馏又如何?(参考表 5-3)。
答:HCl—H2O 体系的恒沸混合物组成是含 HCl 22.25%,具有最高恒沸点。含 HCl 24% 的盐酸蒸馏,馏出物中 HCl%>24%,剩余物中的 HCl%小于24%,但大于22.25%; 如果 含 HCl 18% 的盐酸蒸馏,馏出物中 HCl%<18%,剩余物中 HCl% 大于18%, 但小于 22.25%。
19. 有人说三组分体系的实际相图中,其状态点的自由度均是条件自由度,你认为对否? 为什么?
答:对的。因为三组分体系中,C=3,f=5-φ,当fmin=0时,φ=5,即最多可 以存在五相平衡。而当 φmin=1时,f=4,就是说三组分体系中最多可以有4个独 立变量,要用四维坐标才能完整地表示其相图,而四维相图无法画出,实际相图最多是 三维坐标立体相图,或者二维坐标平面相图,因此通常把压力恒定,或温度、压力均恒 定,这时的自由度就是条件自由度。
20. 如图 5-35 所示的体系,当温度下降时,对大多数体系的二块半园形部分互溶区域逐 渐扩大,直至最后能联成带状,请分析这时相图中各块面积的状态。
答:A与B,A与C是部分互溶,B与C是完全互溶,当温度下降后形成abcd带状 (见相图),这时相图上,面积Abd是α 相(单相区),面积BaCc为 β 相(单相 区),面积abcd为α 与 β 二相平衡区,如果体系的组成以O点表示,M点表示
α 相组成,N点表示 β 相组成。
图 5-35 图 5-36
21. 如图 5-36 中三块部分互溶区域,当体系的温度下降时,三块半园形面积会逐渐扩大 直到相互交盖,在图中央会出现一个三角形,试分析体系在这三角形中的状态。 答:图中央出现三角形 A'B'C',在三角形 A'B'C' 中任意一点,
存在三个相平衡,三相的组成:α 相组分以 A' 点表示;
β 相的组分以 B' 点表示;γ 相的组分以 C' 点表示。
22. 在三角形坐标图上,有一由顶点至对边任一点的联线,如图 5-37 中的 Cf 线,试 用几何法证明在该线上任一点,A 与 B 的组成比为一定值。
答:Cf 线上任意一点p,根据三组分体系三角形坐标表示法特点,p点的组成 A/B= Cb/Ac=ap/bp,在AB二组分体系中,f点物系中 A/B=Bf/Af,要证明三组分中任 一点物系中组分A与B的合量之比为一定值,能证明 ap/bp=Bf/Af 即可。
根据,在 ΔCfB 中,ap∠Bf,ap/Bf=Cp/Cf;
ΔCAf 中 b'p∠Af,b'p/Af=Cp/Cf; 则 ap/Bf=b'p/Af
∵ ∟pbb'=∟pb'b'=60°,bp=b'p
∴ ap/Bf =bp/Af 即 ap/bp=Bf/Af

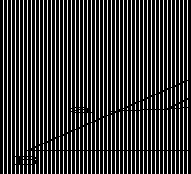
三组分体系中任一点物系止,组分A与B的合量之比为定值。(证毕)
第六章 统计热力学初步
1. 宏观状态确定的粒子体系,下边哪种说法是正确的?
a.微观状态总数 Ω 有确定值;
b.只有一种确定的微观状态;
c.只有一种确定的分布。
答:(a)正确。因 S=lnΩ,当体系的宏观状态一经确定,就具有一定的熵值,从而就 有一定的 Ω 值。
2. 下边关于分布的说法,哪一种是正确的?
a. 一种分布就是一种微观状态,而且只是一种微观状态;
b. 一种分布就是其中具有能量为 1 的有一组粒子n1 具有能量为 2 的有一组粒 子n2?,具有能量为 i 的有一组粒子ni ;
c. 具有各种能量的各组分子,其中一组表示一种分布 ;
d. 各种分布具有相同的出现几率。
答:(b)正确。因为符合分布的定义。
3. 麦克斯维--玻尔兹曼统计只能应用于独立粒子体系,下面的叙述,哪一个不是 这一统计的特点?
a. 宏观状态参量 N、U、V 为定值的封闭体系;
b. 体系由独立可别粒子组成 U=∑inii;
c. 各能级的各量子状态中分配的粒子数,受包里不相容原理的限制;
d. 一可实现的微观状态,以相同的几率出现。
答:(c)不符合麦--玻统计,受保里不相容原理限制,该体系需应用量子统计。
4. 使用麦克斯维-玻尔兹曼分布定律,要求粒子 N 很大。这是因为在推出该定律时, a. 应用拉氏未定乘因子法;
b. 应用了斯特令近似公式;
c. 忽略了粒子之间的相互作用;
d. 假定了粒子是可别的。
答:(b)正确,由于应用了斯特令公式,故其粒子数 N 必须很大。
5. 对于一个独立粒子体系,低能级上分配的粒子数目可以小于高能级上的粒子数吗? 答:可以。依 M--B 分布定律 L,K 两个能级的粒子数之比为:
nL/n=(gL/g)EXp[-(L-)/KT]
上式中 L 为高能级,由于εL>ε,上式中右边指数式小于 1,但 随着T增大时便 逐渐接近于1,当 gL/g >1 时,便可能 出现 nL>n。
6. 写出物质的量为1摩尔时的粒子体系的熵、内能、焓、亥姆霍兹自由能及吉布 斯自由能等热力学函数的统计热力学表达式。
答:Sm(可别)=NKlnq+U/T=Rlnq+RT(lnq/T)V
Sm(不可别)=NKln(qe/N)+U/T=Rln(qe/NA)+RT(lnq/T)V
Um(可别)=Um(不可别)=RT2(lnq/T)V
Hm(可别)=Hm(不可别)=RT[T(lnq/T)V+V(lnq/V)T]
Am(可别)=-RTlnq
Am(不可别)=-RTln(qe/N)
Gm(可别)=-RT[lnq-V(lnq/V)T
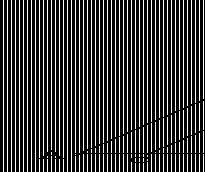
]
Gm(不可别)=-RT[ln(qe/N)-V(lnq/V)T]
7. 若规定最低能级能量为 0,则体系 0K 时的内能为 U0=N0。若规定 0=0,则 U0=N0=0。如何理解体系内能的意义?
答:因 U=NKT2(lnq/T)V 则 U0=NKT2(lnq0/T)V
U0=NKT2(lnq0/T)V
∵ q0=q0EXp(-0/KT) ∴ U0=U0+NE0
所以选取 0 为最低能级的能量值,体系的内能比选取零作最低能级的能量值多 N0。因体系在 0K 时的内能为一定的,基准值既选取 U0,也可选取 U0,两者 相差 Nε0 。
8. 从配分函数的意义,思考平动、转动及振动配分函数分别与温度的关系。
答:因 q(平动)=(2πmKT)3/2V/h3
若为固体或液体则 q(平动)∝ T3/2;若为气体,代入 V=NKT/p,
∴ q(平动)∝ T5/2,
因 q(转动)=3π2IKT/ζh ∴q(转动)∝ T
因 q(振动)=∑iN[1-exp(-hν/kT)] 其中,线型分子 N=3n-5 ;
非线型分子 N=3n-6,可见 q(振动)与 T 无简单关系。
9. 为什么非线型多原子分子,振动模式为 3n-6,而线型分子则为 3n-5(n 是分子中 的原子数)?
答:对于一个由五个原子组成的分子,若要确定全部粒子的瞬时位置,需要3n个坐
标,其中三个坐标为质心坐标,即整个分子的平动自由度;对于线型分子要用两个 坐标为规定了分子相对于某一固定的坐标,即该线型分子的转动自由度,故其余的 3n-5 个坐标确定原子间的相对位置,即有 3n-5 个转动自由度。对于非线型分 子,则要三个坐标确定其空间取向,即3个转动自由度,其振动自由度为 3n-3 -3=3n-6。
10. 解释单原子分子理想气体 CV,m=R;双原子分子理想气体在通常温度下 CV,m=2.5R,温度高时可能等于3.5R。
答:对单原子分子:q=q0(电子)q(平动)=q0(电子)(2πmKT)3/2V/h3
CV,m=(Um/T)V
∵ Um=RT2[[lng0(电子)(2πmKT)3/2V/h3]/T]V=3RT/2
平动自由度有3个自由度,每个自由度对 Um 贡献 RT/2,
而 CV,m=(Um/T)V=3R/2。每个自由度对 CV,m 贡献 R/2。
对于双原子分子:
q=q0 (电子)?{(2πmKT)3/2V/h3}{8π2IKT/(ζh2)}[1-exp(-hν/kT]-1
代入,Um=RT{2.5+(hν/kT)/[exp(hν/kT)-1]}
室温下,exp(hν/kT)-1≈exp(hν/kT),Um=RT[2.5+(hν/kT)/exp(hν/kT)]
Cm,V=(Um/T)V=5R/2+R(hν/kT)2exp(hν/kT) ,∵ hν/k>>T,
CV,m=5R/2, 即三个平动二个转动自由度中的每一运动自由度对 Cm,V 为 R/2, 高温下,∵ hν/kT<<T,Um=7RT/2 便有 CV,m=7R/2
即总共有三个平动,二个转动,一个振动自由度,每个振动自由度贡献为 CV,m=R。
11. 思考一物质自固态到液态到气态其熵值变化的情况。
答:可以由两方面进行考虑
(a) 对同一物质 Ω(固) < Ω(液)< Ω(气),而 S=KlnΩ
所以 S(固) < S(液) < S(气)
(b) 因 S=NKlnq+U/T 对同一物质有 , U(固)< U(液)< U(气)
q(固) < q(液)< q(气),所以 S(固) < S(液) < S(气)
12. 比较同一气体的 Cm、c(平) 及 √c2(平) 的大小。
答:Cm=(2KT/m)1/2 , c(平)=(8KT/mπ)1/2 ,
√c2(平)=(3KT/m)1/2
∴ Cm < c(平)<[c2(平)]1/2
13. 一方形箱体积为 V,其中有 n 个质量为 m 的理想气体分子。它们从各个方向碰 撞器壁而产生压力。在 x 方向上因碰撞而产生的压力应为以下何式?
a. p=2mnv2x/V; b. p=2mnc(平)/V;
c. 2mnvx2(平)/V d. 2mnc2(平)/V
答:(c)是正确的。
14. 常温常压下,气体分子的 ζ≈10-10 m,n≈1024 m-3,c≈102 m?s-1。请估
算 ZA、ZAA 及平均自由程的数量级。
解:ZA=πnζ2c=3.14?1024?(10-10)2?102≈106s-1
ZAA=(√2)πζ2n2c/2=(√2)π?(10-10)2?(1024)2?102/2 ≈1030 m-3?s-1
L=(√2)πnAζA2/2=c/ZA=10-2/106=10-4 m
15. 为什么得到(6-136)式即 ZAA 的计算式时除以2,而得到(6-138)式即 ZAB 的计 算时不除以2?
答:(6-136) 式是同种分子 A 之间的碰撞频率计算公式,因每个 A 分子在撞与被撞二 种情况下重复算一次,故要除以2,而 ZAB 为两种不同分子间的碰撞,计算 A 分子 碰撞 B 分子,或B分子碰撞A分子,未重复计算,故不要除以2。
16. 思考用量热法计算一化学反应平衡常数的程序。
答:因 ΔG=-RTlnK
∴ -lnK=(1/R)?(ΔG/T)=(1/R) Δ[(G-U,0)/T]+(ΔU,0/T) 上式中的 ΔU,0 可以量热法求得,因此计算化学反应平衡常数的程序(步骤)为: (a) 因为可以证得 ΔU,0=ΔH,0
T
(b) ΔH,0(T)=ΔH,0+| ∑νBCp,m(B)dT
0
(c) 由于Cp,m=a+bT+cT2+??
∑νBCp,m(B)=∑νBaB+∑νBbBT+∑νBcBT2+??
(d) ΔH,0=ΔH(T)-∑νBaBT+∑νBbBT2-ⅲ∑νBcBT3-??
(e) 计算吉布斯自由能函数差ΔG,便可按公式得 K。
17. 思考用光谱法计算一化学反应平衡常数的程序。
答:因 ΔG=-RTlnK, ΔU,0=ΔH,0 ,计算程序如下:
(a) -lnK=(1/R)?(ΔG/T)=(1/R)?Δ[(G-U,0)/T]+ΔU,0/T
(b) H,T-U,0=(U,T-U,0)+RT=RT2(lnq0/T)V+RT
(c) 利用光谱数据算出焓函数表 (即为:H,T-U,0 表)
(d) 从而得出 ΔU,0=ΔH,T-Δ(H,T-U,0)
(e) 代入公式可求出 平衡常数 K。
对于∑νB= 0 的反应,可运用公式:
K=[∏qB,0(产物)/∏qB,0(反应物)]?EXp(-ΔU,0/RT)
3/2 ={∏MB(产物)/∏MB(反应物)}?{∏IB(产物)/∏IB(反应物)}
?{∏ζ(产物)/∏ζ(反应物)}?{∏q0(振动,产物)/∏q0(振动,反应物)
?EXp(-ΔU,0/RT)
除了用上述光谱法程序求出 ΔU,0 外,还要用光谱数据求出 IB 及物质的振
动频率νB 。
第七章 化学动力学
1.对恒容反应 aA + bB→ eE + fF,其反应速率可用其中任何一种物质的浓度随时间的 变化率表示,它们之间的关系是( )。
(1) -a(dcA /dt)=-b(dcB /dt)=e(dcE /dt)=f(dcF /dt)
(2) -dcF /fdt=-dcE /edt=dcA /adt=dcB /bdt
(3) -fdcA /adt= -fdcB /bdt= fdcE /edt =dcF /dt
(4) dcA /dt=bdcB /adt=edcE /adt=fdcF /adt
答:(3)
2.在描述一级反应的下述说法中,不正确的是( )。
(1) lnc 对时间 t 作图得一条直线;
(2) 半衰期与反应物起始浓度成反比;
(3) 同一反应消耗反应物的百分数相同时,所需的时间相等;
- (4) 速度常数的单位是(时间)1。
答:(2)
3.二级反应 2A→B 的半衰期是( )。
(1) 与 A 的起始浓度无关; (2) 与 A 的起始浓度成正比;
(3) 与 A 的起始浓度成反比; (4) 与 A 的起始浓度平方成反比。

答:(3)
4.已知某反应为 n 级,其速率方程式为 : r=kcn
试据此导出其有关动力学方程式,并讨论当 n=0,1,2,3 时的情形。
--答:dc/dt=kcn ;dc/cn=kdt ;积分后得:[1/(n-1)][1/(cn1)-1/(c0n1)]=kt
当 n=0 -c+c0=kt c=c0-kt (为零级反应动力学公式)
----- 当 n=1 k1t=(n-1)1[(cn1)1-(c0n1)1] 右边是0/0 型
--- 求极值,令x = n-1 k1t=Lim x→0 x1[(cx)1-(c0x)1]
---- =Lim x→0 (c x-c0 x)/x=Lim x→0 (-c xlnc+c0 xlnc0)/1
-- =Lim x→0 (c0 xlnc0-c xlnc)=ln c0/c
即:k1t=lnc0/c (一级反应动力学方程)
当 n=2 (1/c)-(1/c0)=kt (二级反应动力学公式)
当 n=3 [(1/c2)-(1/c02)]=kt (三级反应动力学公式)
5.在基元反应中,正确的是( )。
(1) 反应级数与反应分子数总是一致; (2) 反应级数总是大于反应分子数;
(3) 反应级数总是小于反应分子数; (4) 反应级数不一定与反应分子数总是一致。 答:(4)
6.给出方程式 A+B →2p,则正确的叙述是( )。
(1) 此反应为二级反应; (2) 此反应为双分子反应;
(3) 此反应为基元反应; (4) 此反应各物质间的计量关系已定。 答:(4)
7.质量作用定律对于总反应式为什么不一定正确?
答:因质量作用定律只能用于基元反应,而总反应不一定是基元反应。因此不一定正确。
8.对于平行反应的描述,不正确的是( )。
(1) k1和k2 的比值不随温度而变;
(2) 反应物的总速率等于两个平行的反应速率之和;
(3) 反应产物 B 和 D 的量之比等于两个平行反应的速率之比;
(4) 反应物消耗的速率主要决定于反应速率较大的一个反应。
答:(1)
9.由纯A开始的对峙反应,在定温下进行,下述说法中不正确的是( )
(1) 开始时,A的消耗速率最大;
(2) 反应进行的净速率是正逆两向反应速率之差;
(3) 正反向的速率常数之比是定值;
(4) 达平衡时,正逆二向速率常数相等。
答:(4)
10.已知复杂反应的历程为:则d[cA]/dt等于( )
(1) k1[cA]-k-1[cB]+k2[cA][cB]
(2) -k1[cA]+k-1[cB]-k2[cA][cB]
(3) -k1[cA]2+k-1[cB]-k2[cA][cB]
(4) k1[cA]2-k-1[cB]+k2[cA][cB]
答:( 都不对,应为 -k1cA2+k-1cB-k2cAcC )。
11.H2 和 O2 反应引起爆炸的原因是( ),
(1) 大量引发剂引发反应; (2) 直链传递的速率增加;
(3) 自由基被消除; (4) 生成双自由基形成支链。
答:(4)
12.H2 和 O2 反应存在爆炸的压力下限,因为( ):
(1) 发生链传递物的气相消毁; (2) 存在杂质的影响;
(3) 链传递物与器壁碰撞而消毁; (4) 反应物太少不发生反应。
答:(3)
13.对于热爆炸反应,下述关系正确的是( ),
(1) 起始反应速率 > 中间反应速率 > 终了反应速率;
(2) 中间反应速率 > 起始反应速率 > 终了反应速率;
(3) 终了反应速率 > 中间反应速率 > 起始反应速率;
(4) 终了反应速率 > 起始反应速率 > 中间反应速率。
答:(3)
14.Arrhenius经验式适用于( ):
(1) 基元反应; (2) 基元反应和大部分非基元反应;
(3) 对峙反应; (4) 所有化学反应。
答:(2)
15.室温时符合 van’t Hoff 规则的化学反应,其活化能范围在( ):
--- (1) 40~400 kJ?mol1; (2) 50~250 kJ?mol1; (3)100 kJ?mol1。
答:(3)
-16.某反应的ΔH=100 kJ?mol1,则其活化能( ),
-- (1) 必小于 100kJ?mol1; (2) 必大于 100kJ?mol1;
-- (3) 可大于或小于 100kJ?mol1; (4) 只能等于 100kJ?mol1。
答:(2)
17.指出下列反应哪个的活化能最小,并请按其活化能大小排一顺序,
(1) Cl+Cl+M→Cl2+M; (2) HI+C2H4→C2H5I;
(3) H+CH4→H2+CH4; (4) N2+M→N+N+M。
答:(1)反应活化能最小,从小到大次序为 (1)(3)(2)(4)。
18.气体反应碰撞理论的要点是( )全体分子可看作是钢球, (1) 一经碰撞便起反应;
(2) 在一定方向上发生了碰撞,才能引起反应; (3)分子迎面碰撞,便能反应;
(4) 一对分子具有足够能量的碰撞,才能引起反应。
答:(4)
19.化学反应的过度状态理论认为( ) (1)反应速率决定于活化络合物的生成速率;
(2) 反应速率决定于活化络合物分解为产物的分解速率;(3) 用热力学方法可以算出速率常数;
(4) 活化络合物和产物间可建立平衡。
答:(2)
20.温度升高,反应速率增大,这一现象的最佳解释是( )
(1) 反应分子的碰撞频率增加; (2) 阈能或能垒降低;
(3) 能量超过活化能的分子的百分含量增加; (4) 反应历程改变。
答:(3)
21.何为分子笼和偶遇? 据此设想的溶液反应模型怎样?
答:和气态相比,液态分子是紧密排列的,反应物分子在液态溶剂里,必然处于周围溶剂分子
的紧密包围中。人们把这种状态形象地比喻为分子笼,即认为反应物分子在溶剂中的运动,
是在紧邻分子所组成的笼中的一种振动。我们把在一个笼中的反复碰撞,称为一次偶遇。溶
液中反应的模型为:A+BA∶B→p,A与B形成偶遇对,该过程快速达平衡,偶遇对 分解成产物,该过程为慢过程。
22.溶剂对反应速率的影响,有些属于物理作用,其具体内容是什么?
答:溶剂介电常数的影响属于物理效应,溶剂化影响属于化学效应,离子强度的影响既有化学效应 也有物理效应。
23.链反应和光反应有何特征? 激光化学反应有何特征?
答:链反应的特性是,反应一旦开始⒙,如不加控制,就会自动地发展下去,其发展方式好象链锁一样。
链的引发可以是光照,也可以是加热或加入引发剂。光化反应是在可见光的作用下激活分子而发生 化学反应。所发生的反应中有些Φ很大,则是链反应,如 H2+Cl2,但多数光化反应的Φ较小,是非
链反应。激光化学反应是由于高强度单色光( 激光 )的照射,激光的频率与化合物中某一健的振动 频率相匹配,从而使该特定的键发生断裂,而化合物中的其它键不断,使得用普通方法不能进行的 反应而得到进行。
24. Franck-Condon原理具体内容是什么? 对研究光化学反应有何意义?
-答:Franck-Condon原理∶相对于双原子分子的振动周期(约1013秒)而言电子跃迁所需时是极短的
-(约1015秒),故在电子跃迁的瞬间,原子的核间距可以认为没有变化。从基态S0的振动能级
v=0到激发态S1的振动能级v=0 的跃迁(即 0→0 )的几率最大,振动谱线强度最大,其余 跃迁,如0→1,0→2 等则较弱。根据这一原理可解释为什么化合物的振动谱线有些强,有些弱, 从而可以推测哪些跃迁能使分子产生强烈振动而发生离解。
25.比较荧光和磷光的异同。
答:萤光和磷光都是冷光,从单重态到基态(S*→S)的跃迁产生的光为萤光,其特征为波长短,
强度强,辐射寿命短,从三重态到基态(T*→S)的跃迁产生的光为磷光,其特征为波长长,
强度弱,发射寿命长。
26.催化作用有哪些特征? 酶催化与一般催化有何异同?
答:催化作用特征:
1. 催化剂参与反应生成中间产物。
2. 对于热力学认为可以自发进行的反应,催化剂只能缩短达到平衡的时间,不能改变平衡位置。
3. 催化剂改变反应途径,降低决定速率步骤的活化能。
4. 催化剂具有选择性。
酶催化与一般催化比较,不同点为:高度专一性;高度催化活性;特殊的温度效应 。
27.催化剂为什么不会改变化学平衡位置?
答:因为根据热力学原理,反应物是反应体系的初态,产物是终态,始终态已经确定,其状态函数改变
值 ΔGm,ΔG为定值,催化剂不能改变始、终态,也就不改变ΔG,不改变平衡位置。反之 如果改变平衡位置,则将可设计出第二类永动机而违反热力学第二定律。
28.吸附和催化有什么关系?
答:多相催化在表面上进行,因此吸附便是表面反应的必要条件。
29.物理吸附和化学吸附有什么区别? 在什么情况下,二者可以相互转换?
答:化学吸附与物理吸附比较:吸热大,有选择性,单分子层,吸附活化能较高,在较高温度下进行。
当随着吸附条件的改变,特别是温度升高,有些物理吸附会转变为化学吸附,但化学吸附总是伴 随物理吸附。
30.郎格缪尔等温式的推导和应用有什么条件?
答:必须是等温条件,除了等温以外,该式适用于θ较小,表面均匀,被吸附分子间没有相互作用 的单分子层吸附。
31.化学动力学和化学热力学所解决的问题有何不同? 举例说明。
答:化学热力学解决某一反应在一定条件能否会自发进行的判据,进行到什么程度为止(化学平衡态),
而动力学却要解决反应进行得快慢与反应机理,计算某一反应在一定温度下经过一段时间转化率为 多少?热力学解决可能性,动力学解决现实性。例如:合成NH3反应,H2与O2点燃反应。
32.合成氨的生产条件为什么要选择高温,高压如压力选为(1~3)?104 kpa,温度选为723~823K。 答:合成氨 N2 +3H2 →2NH3 是分子数减少的反应,增加压力可以提高转化率。合成氨用 Fe 催化剂,
Fe 催化剂要在高温才有活化。在 723-823k时 Fe活性大,并在较高温度下,反应快,单位时间内 产率高。
33.硫酸工业中,二氧化硫的转化塔为什么要采用四段转化?
答:因 SO2+O2 SO3 ΔH<0,放热反应
根据平衡移动原理,降低温度有利于平衡向右移动,提高 SO2的转化率,但温度低又会减慢反应速率, 因而工业生产中采用塔顶第一段催化温度最高,以便快速达到平衡然后进入温度渐次减低的第二段、
第三段、第四段催化段,使平衡位置逐渐向右移动,以便提高 SO2的转化率,这样的装置能达到既快, 转化率又高的目的。
第八章 电解质溶液
1.柯尔拉乌希经验公式适用条件和范围是什么?柯尔拉乌希离子独立运动定律的重要性何在?
答:柯尔拉乌希经验公式:?m????Ac, 适用于强电解质水溶液,浓度低于0.01mol·dm-3的
稀溶液。根据离子独立移动定律,可以从相关的强电解质的Λ∞来计算弱电解质的Λ∞。或由离子 电导数值计算出电解质的无限稀释时摩尔电导。
2.电导率与摩尔电导概念有何不同? 它们各与哪些因素有关?
答:电导率κ是:两极面积各为1m2,并相距1m时,其间溶液所呈的电导;而摩尔电导是在相距
1m的两电极间含有1mol溶质的溶液所呈的电导,摩尔电导用Λm表示Λm=κ/c,电导率κ与电 解质本性有关,与温度有关,与电解质浓度有关;摩尔电导与电解质本性有关,与温度有关, 与电解质浓度有关。
3.为什么用交流电桥测定溶液的电导? 为什么用1000Hz(即c/s,周每秒)频率测定溶液的电导? 为
什么在未知电阻的线路上并联一电容? 测准溶液电导的关键是什么?
答:用交流电流测溶液的电导,可以避免电解作用而改变电极本性,并且可以消除电极的极化作用。
用1000Hz的交流频率可防止电极上的极化作用,并可用耳机检零。并联电容是为了消除电导池 的电容的影响。测准电导的关键是在各接触点均接触的条件下,电桥平衡,正确检零。
4.当一定直流电通过一含有金属离子的溶液时,在阴极上析出金属的量正比于:
(1) 金属的表面积; (2) 电解质溶液的浓度;
(3) 通入的电量; (4) 电解质溶液中离子迁移的速度。
答:(3).
5.在界面移动法测定离子迁移数的实验中,其结果是否正确,最关键是决定于:
(1) 界面移动的清晰程度; (2) 外加电压的大小;
(3) 阴、阳离子迁移速度是否相同; (3) 阴、阳离子的价数是否相同。
答:(1)
-6.电解质在水溶液中时,作为溶剂的水电离为 H+、OH离子,为什么一般不考虑它们的迁移数?
影响离子迁移数的主要因素是什么?
--答:因为水中H+与OH的浓度甚低,Ksp=1014,其迁移数极小,不考虑不会影响测量结果。
离子迁移数与温度及浓度有关,但是更主要的是离子受溶剂化以及形成络离子的影响。
7.电解质的摩尔电导可看作是阴阳离子摩尔电导之和,这一定律适用于下列哪种溶液:
(1) 强电解质溶液; (2) 弱电解质溶液;
-(3) 无限烯溶液; (4) 摩尔浓度为1 mol·dm3的溶液。
答:(3)
8.(A) 弱电解质的极限摩尔电导为什么不能外推法求得,而用计算的方法求得?
强电解质溶液的极限摩尔电导为什么可以用外推法求得?(原题有错,以改)
(B) 下列看法哪个较正确:
(1) 弱电解质溶液仅部分电离,其Λm值随浓度变化比较大;
(2) 弱电解质溶液的Λ∞可以外推法求得,但不准确;
(3) 强电解质溶液全部电离,浓度对Λ∞影响不显箸。
解:(A) 由于弱电解质的摩尔电导与浓度的关系式,不服从柯尔拉乌希经验公式,在稀溶液中不
成线性关系,因此不能用外推法求得极限摩尔电导,但可以根据离子独立移动定律,计算求得。 而强电解质稀溶液服从柯尔拉乌希公式,成线性关系,可以用外推法求出极限摩尔电导。
(B) (3)比较正确。
9.德拜-尤格尔关于强电解质溶液中离子氛模型及其定量处理的基本假设有哪几点?
答:离子氛基本假设:(1) 强电解质在水中完全电离。(2) 由于离子间相互作用而形成离子氛。
(3) 由于离子的热运动,离子氛不是静止的,离子氛是时间统计的平均结果。
定量处理的基本假设:(1) 借助 Boltzman分布定律处理离子氛中离子的分布;
(2) 利用泊松方程推导距离任意选定的某中心离子处的电势 ?;
(3) 电离公式中的x,其倒数 1/x相当于离子氛的平均厚度(离子氛半径)。
10.德拜-尤格尔公式为什么只能适用于稀溶液,提高适用范围怎么办?
答:因浓度较大时,离子之间相互作用强,甚至会出现离子间的结合,按公式计算会产生较大误差。
提高适用范围的办法在极限公式后边加一项CI,可以扩大适用的浓度范围,CI项考虑了离子短程相互作用。
11.研究电解质溶液离子平均活度系数的意义和重要性何在? 非电解质溶液的活度系数能用
该公式计算吗?
答:因在溶液中阴、阳离子是相伴存在,不能单独测出单种离子的化学势、活度和活度系数,
有了平均活度系数的概念,便可计算整个强电解质的化学势与活度。若将γ±ν = γ+ν+ γ-ν- 用于非电解质, 则ν+,ν- 均为零,则γ±=1。故非电解质活度系数不能用该式求出,但可用依数性方法算出。
12.离子强度概念在理论上有什么重要意义?
答:离子强度是离子电荷所形成静电场强度的量度,是离子之间静电作用大小的量度。
13.电解质离子平均活度系数的大小主要决定下列何种因素?
(1) 离子之间的静电引力;(2) 决定于离子强度;(3) 决定电解质的内因,即离子的平均直径; 你认为主要决定于什么因素。
答:(1)
14.德拜-尤格尔理论和翁萨格理论各自解决了什么问题?两个理论中心思想是什么?两者的
关系是什么?
答:德拜—尤格尔理论解决了如何计算强电解质溶液中离子和电解质的活度系与活度,而翁萨
格理论从理论上解决了强电解质的摩尔电导计算问题;两个理论的中心思想都是强电解质是 完全电离的,能形成离子氛。但前者是假定离子氛只存在热运动中,是球形对称的,而后者 认为离子氛在电场中定向移动时,不再是球形对称,从而产生电泳力与松驰力。翁萨格理论 是在德拜-尤格尔理论基础上发展起来的,两者都仅适用于强电解质稀溶液。
15.德拜-尤格尔-翁萨格理论在导出关系式中考虑了许多因素,下面哪一个因素没有考虑?
哪些因素考虑了?
(1) 电解质溶液与理想溶液的偏差主要由静电力所致;
(2) 每个离子都被电荷相反的离子所包围;(3) 每个离子都是溶剂化;
(4) 离子之间存在着缔合现象;
答:没有考虑的因素是(4),考虑的因素是(1)、(2)、 (3)
16.翁萨格方程?????A,它适用于下列中的哪一个?
(1) 弱电解质;(2) 强电解质的稀溶液;(3) 无限稀溶液;(4) 摩尔浓度为1的溶液。 答:(2)
17.有哪些数据可以表征离子的水化?研究离子水化有什么具体意义?
答:由ΔH(溶)=-ΔH(晶)+ΔH(水化)的数据,当ΔH(水化)=ΔH(溶)+ΔH(晶))≠0时;且有
些水化离子有颜色;离子有确定的水化数,这些可以表征离子的水化。用离子水化的概念可 以解释一些实际问题,如:晶体物质的溶解度与温度的关系;同一种电解质在不同的溶剂中 表现的强弱不同。水化电子的发现,将对无机化学的某些机理有新的认识。
第九章 可 逆 电 池
1.在应用电势差计测定电池电动势的实验中,必须使用下列何种电池或溶液:
(1) 标准氢电极组成电池; (2) 甘汞电极组成电池;
(3) 活度为 1 的电解质溶液; (4) 标准电池;
答: (4)
2.在电势差计中AB线段为电阻,为什么能表示电势的数值呢?
答: 根据欧姆定律 E=IRAB=IκAB,上式中I为通过回路的电流,κ为导线单位长度的电阻Ω/m,
当测定ES及Ex时,两值相比,I及κ均约去,便有 ES=AB,Ex=AC,因此在电势差计中可以 用 ES=AB,Ex=AC 来表示,而其它情况下不能用导线长度来表示电势。
3.用电势差测定电池电动势时,若发现检流计始终偏向一方,可能的原因:
(1) 检流计不灵; (2) 被测定的电池电动势太大;
(3) 搅拌不充分,造成浓度不均匀;(4) 被测电池的两个电极接反了。
答: (4)
4.为什么选用韦斯登电池作为标准电池?
答: 因为韦斯登电池能保证在测量过程中处于可逆过程的条件,并且该电池的电动势稳定,
温度系数很小。
5.电池在恒温、恒压和可逆条件下放电,则其与环境间的热交换为下列何者:
(1) 一定为零; (2) 为 ΔH;
(3) 为 TΔS; (4)与 ΔH 和 TΔS 均无关。
答: (3)
6.在温度为 T 时,有下列两反应
+- ?Cu+?Cl2=?Cu2+Cl ?1
+- Cu+Cl2= Cu2+2Cl ?2
?1 和?2 的关系为下列何者:
(1) ?1=?2; (2) 2?1=?;
(3) 4?1=?2; (4) ?1=2?2。
答: (1)
7.E和 E与什么因素有关? 它们是强度因素还是容量因素? E值必须是一个标准压力,
各物质的活度为 1 时的电动势,这句话你认为对吗?
答: E 与 E是强度因素,因 nEF=-ΔG,故 E 与电池反应的物质在反应过程中的ΔG有关,
而ΔG 与温度有关,故 E 与温度有关。E 必须是一个标准压力下,各物质的活度为 1 时 的电动势,这句话原则上对的,但在特殊条件下也不尽然。如果各物质的活度不一定是 1,
而各反应物质的 Qa 刚等于 1,则该电池的电动势也等于该温度下的 E之值。
8.同一反应如 Cu2+Zn=Cu+Zn2, 化学反应的热效应和电化学反应的热效应是否相同? 为什么? 答: 对于同一反应,化学反应的等压热效应与电池反应的电化学热效应不相同,因为化学热效应是
等温等压下,无非体积功时的反应热,Qp=ΔH。而电池反应热效应 QR=TΔS,ΔH=-nFE+QR 两者之间相差电池与环境的电能传递的 nEF。
+---9. 2H+2e= H2 和 Cl2+2e= 2Cl 均属于气-液电极反应,其界面电势差ΔΦ(g,sln)如何表示? 答: 对于气液反应
ΔΦ(g,Sln)=Φ(g)-Φ(Sln)=[μM+(Sln)+nμe(M)-μM(g)]/nF
=[μM+(Sln)+nμn(M)-μM(g)]/nF+RTlnaM/nF
因对于气体电极,是以惰性金属 M(Pt)电极为导体,电子附于金属 M上,故上式
中仍为 nμe(M) 而不是 nμe(g)。
10.金属表面带正电还是带负电荷受什么因素所决定,又与那些因素有关?对于较浓的硫酸铜
溶液放入铜电极时金属表面带什么电?
答: 金属表面带正电,必须是阳离子在溶液中的化学势,比金属表面上电势高,即ΔΦ(M,Sln)为正值,
否则金属带负电。与电极的本性ΔΦ(M,Sln),及参加电极反应的各物质的活度有关。Cu 放入 较浓的硫酸铜溶液中,则金属表面正电。
11.? (s)、? (M) 表时什么电势? Δ? 和 ? 又表示什么电势?Δ? 和 ? 两者有何不同?
如何由 Δ? 过渡到 ??
答: ? (S)即 ? (Sln),? (Sln) 表示物质在溶液中的电势;? (M) 表示在金属表面上的电势,
Δ? 表示物质在两个不同相界面上的电势差,?表示物质在一相上的电势值。但?表示
物质在某相上的电势相对数值;规定标准氢电极数值为零,把某电极与标准氢电极组成电池, 测出其电动势,那么该电动势数值即为该电极的?值,?值。
12.标准电极电势表中给出的数据一般指 298K,对于不同温度下的标准电极电势?能否从电极
电势的能斯特公式计算?
答: 可以,只要知道电极电势的温度系数 (? ?/?T)p,就行:
? (T)=? (298)+(??/?T)ΔT=?(298)+(RT/nF)lnaM++(??/?T)ΔT
13.金属钠和钠汞齐两个反应的电极电势公式如何表示?这两个反应的?和?是否相同?
+ 答: Na 电极的反应为 Na+e → Na(S)
?Na+/Na=?Na+/Na+(RT/F)?ln(aNa+/aNa)
当 aNa+=1, aNa=1, ?=?Na+/Na
对于钠汞齐电极,反应为 Na++e → Na(Hg)
?Na+/Na(Hg)=?Na+/Na(Hg)+(RT/F)?ln(aNa+/aNa(Hg))
aNa(Hg) 是 Na 在汞齐中的活度。
当 aNa+=1,aNa(Hg)=1, ?Na+/Na(Hg)=?Na+/Na(Hg)
因此这两个电极? 不相同,? 也不同。 如果 Na 在 Hg 中溶解达到饱和时,
则?Na+/Na 和?Na+/Na(Hg) 数值相等。
14.为什么难溶盐电极都是对阴离子可逆的电极? ++
答: 因难溶盐为固相,还原后的金属仍为固相,而未还原的阴离子进入溶液,故难溶盐电极都
是对阴离子可逆的电极。
++++15.对氧化还原电极: Pt|Fe2,Fe3; Pt|Sn2,Sn4 若将Pt换为Fe和Sn是否可以?为什么?
++++答: 若将电极 Pt|Fe2,Fe3;Pt|Sn2,Sn4中的Pt分别换成Fe和Sn,则Fe极表面的三个反应 :
+Fe3+3e → Fe ?=0.036 V
+ Fe2+2e → Fe ?=-0.447 V
++ Fe3+e → Fe2 ?=0.770 V
++其中以 Fe2→Fe 的电势最低,故负极最可能的电极反应为 Fe→Fe2+2e
++而不是 Fe2→Fe3+e。
对于 Sn 电极的二个反应为:
+ Sn2+2e → Sn ?=-0.1364 V
+ Sn4++2e → Sn2 ?=0.151 V
因此负极反应最可能是第一个而不是后者。
这样这两支电极都失去其原来氧化--还原电极的作用。因此,不能换。
16.下列电池属于哪一种类型的电池?
(1) Ag, AgCl|HCl(m1)|H2(p),(Pt)——(Pt),H2(p)|HCl(m2)|AgCl,Ag(s)
(2) Hg—Zn(a1)|ZnSO4(a)|Zn(a2)—Hg ; a1>a2
(3) Na(汞齐)(0.206%)|NaI(在 C2H5OH 中)|Na(s)
答: (1) 双联浓差电池,属于电解质浓差电池。
(2) 电极浓差电池。 (3) 电极浓差电池。
17.为什么说玻璃电极也是一种离子选择性电极?使用玻璃电极应注意什么问题?用玻璃电极
作为指示电极,组成电池能否测定 HCl 的活度系数?
答: 因为玻璃电极的特殊构造,并且内部有内参比电极,因此玻璃电极电势大小与待测溶液的
pH关系,298K时为: ? (玻璃)=?(玻璃)-0.05915pH,其中?(玻璃)是常数,数值大小与 电极玻璃膜性质有关, 与 H+ 浓度无关, 可见定温下? (玻璃)大小仅与待测液中 H+ 浓度 有关, 因此它是氢离子选择电极,也是一种离子选择电极。使用玻璃电极, 要注意避免受较 强的机械震动, 不要把玻璃膜与硬物相触;新买的玻璃电极使用前, 要用蒸馏水浸泡 24 小 时以上, 玻璃电极在强碱中使用, 要尽快操作, 毕后立即用蒸馏水清洗。 用玻璃电极作指示 电极, 组成电池, 不能测定HCl溶液的活度系数,因为单离子的活度是不能测定的,对稀溶 液中pH的测定,人们给了一个操作定义,也就是以国际上统一规定五个标准缓冲溶液的pH值 为参考点,确定待测溶液的pH值,即 pH(x)=pH(s)+(Es-Ex)F/2.303RT , 因为标准缓冲溶
+液中, pH(s) 不是正好等于 -LgaS(H+), 同样, pH(x) 也不是正好等于 -Lga(H), 所以用玻
璃电极测出的 HCl的 pH值,即 -Lga(H+)是相对数值,不能以此计算出 HCl 的活度系数 。
18.用作图法当 m→0 时可求 E 值,和前面所讲的各物质的活度为 1 时,则 E=E的概念
是否矛盾? 图 9-10 以 E+0.1183lg m 对√m 作图应为直线? 而实际并非为直线 ,为什么? 在此情况下如何准确地测得 E?
答: 两者概念不相矛盾,作图法是求得 E 值的实验方法;选 a=1 时的 E=E,是对 E 物理
意义的解释,因用实验手段不可能配制 a= 1 的溶液。 以 E+0.1183lgm 对 √m 作图,在 m 较 大时不是直线,因在推导公式时运用德拜--尤格尔的极限定律,该定律只适用于稀溶液。如果得 不到直线,则根据Y=E+0.1183lg(m/m)=f(m),则可以 Y 对 m 的高次方根作图,使横坐标距离 拉开。但在稀溶液处可得到直线,从而得到原始纵坐标之值。
19.根据 Fe—H2O 电势—pH 图回答下列问题:
(1) 铁在什么条件下最稳定?
(2) 铁在什么介质中腐蚀最严重?
+ (3) 铁在什么电势、pH 条件下被腐蚀为 Fe2?
答: (1) Fe 在?<-0.5, pH值 比较低时最稳定。
(2) Fe 在 pH < 6,和? >-0.4 时以及?≈0--0.8, 和 pH≈8—14 间腐蚀最严重。
+ (3) 在 pH<6, -0.4<?< 0.8 区成为 Fe2。
20.已知下列标准电极电势数据
0.54 1.20 1.70
--- I ——→I3——→IO3——→H5IO6
1.23 1.69
+- Mn2——→MnO2——→MnO4
利用标准电极电势的数据,回答下列问题
(1) 将高锰酸逐滴加入氢碘酸溶液中,可得到什么产物?
(2) 将碘化物溶液逐滴加入高锰酸盐溶液中得到什么产物?
--+解: (1) MnO4 滴加入 HI 溶液中,得到产物 I3 与 Mn2。
--- 道理是: 高锰酸盐逐滴时, MnO4是少量, I大量存在, 如生成 IO3,
------ ? (IO3/I3)=1.20, ? (I3/I)=0.54 ;则要发生反应: I+IO3 → 2I3
-- 如果生成 H5IO6,这个电位更正,更容易与 I 发生反应。因此在 I 大量存
--++ 在下,产物只能是 I3。另一方面 MnO4 还原产物为 Mn2。如果不是 Mn2
-+ 是 MnO2,则 MnO2 与大量 I 还要发生反应。? (MnO2/Mn2)=1.23 V
--+? (I3/I)=0.54 因此最终产物只能是 Mn2。
--+-+ 所以,反应式为: 15I+2MnO4+16H → 5I3+2Mn2+8H2O
---(2) HI 滴加入 MnO4 中,产物为 IO3 与 MnO2。
-++- 道理是:这里 MnO4 是过量的, 如果产物是 Mn2,则 Mn2 与 MnO4 还要发生
---- 反应,结果产物为 MnO2。 I 被氧化,如果产物是 I3,那? (IO3/I3)=1.20
-- 比? (MnO4/MnO2)=1.69V 要小,还要被氧化,最后产物是 IO3。
--- 由? (H5IO6/IO3)=1.70 V,比? (MnO4/MnO2) 要大,因此 I 也不会被氧化成
H5IO6。 因此反应为:
--+-I+2MnO4+2H→ IO3+2MnO2+H2O
第十章 不可逆电极过程
1. 你认为影响分散层厚度的因素有哪些?
答:分散层厚度,主要受电极表面电荷密度和电解质溶液浓度的影响。金属表面电荷 密度越大,溶液中离子浓度越大,分散层厚度越小,甚至可以忽略,只剩下紧密 层。相反,当金属表面的电荷密度和溶液中离子浓度越小,分散层厚度越大。
2. 如果金属表面带负电荷,则在金属—溶液界面上的电势将如何分布?当出现“特性 吸附”时,界面上的电势又将如何分布?
答:出现与图10—6中曲线上下反转的现象。 (1)带负电荷 (2)特性吸附
3.试以铅—酸蓄电池为例,说明当其作为电源放电和电池充电时,哪个电极是阳极、 阴极、正极和负极?
答:铅—酸蓄电池为 :pb,pbSO4|H2SO4|pbO2,pb ;当作为原电池放电时:
- 负极 pb+SO42→pbSO4+2e 发生氧化为阳极
+- 正极 pbO2+4H+SO42+2e→2pbSO4 发生还原为阴极
当充电时,作为电解池,上述负极反应逆转为还原过程,故成为阴极,而正极反 应逆转为氧化过程,故成为阳极。
4. 从上例的讨论中,你能否归纳出一些共性的规律?
答:不论是原电池还是电解池,凡是发生氧化过程的电极称为阳极,而发生还原过程 的电极称为阴极。
5. 在测定极化曲线时,为什么要使用另一参考电极?对参考电极应该有什么要求? 答:因为使用另一参考电极,应用对消法,可测出待测电极在无电流通过时的电势值。 测定方法:先测出待测电极无电流通过时的平衡电势,再测出待测电极有电流通过
(与辅助电极组成回路) 的非平衡电势值,由这两者之差,便得到某电流密度 i时 超电势。 参考电极要求电位稳定,数值巳知,可逆性大,即i0较大,例如饱和甘汞电极。
6. 如何理解交换电流i0的物理意义并说明其数值的大小和极化的关系。
答:交换电流i0是由于电极表面与溶液中的某金属离子在平衡条件下时,即氧化与还原
+ 反应:Mn+neM 速率相等条件下,单位时间,单位表面上所交换的电量。
如果i0大,表明通过很大外电流,电极电势改变小,该电极反应可逆性大,不容易 发生极化。反之,i0小,电极反应可逆性小,该电极很容易发生极化。

7. 当通过阴极的电流密度很小时,试用(10—20)、(10—21)和(10—22)式导出(10—25), 并说明影响U数值的因素。
答:(10-20)式为 =i0exp(?FΔ?/RT)
(10-21)式为 =i0exp(-βFΔ?/RT)
当i很小时,其过电位Δ?也很小。把(10-20)式与(10-21)式按级数展开:
+ i=i0exp(?FΔ?/RT)=i0[1+?FΔ?/RT+(?FΔ?/RT)2??)≈i0(1+?FΔ?/RT)
+ 运用(10—21)式 =i0exp(-βFΔ?/RT)=i0(1-βFΔ?/RT+(βFΔ?/RT)2??)
≈i0(1-β FΔ?/RT) 上两式可忽去二次方以上的相,则代入(10—22)式,有 i= - =i0(1+?FΔ?/RT)-i0(1-βFΔ?/RT)
=i0(?FΔ?/RT+βFΔ?/RT)=i0F(?+β)Δ?/RT=i0FΔ?/RT 其中?+β=1 便有 Δ?=(RT/i0F)i,令RT/i0F=ω 即(10—25)式η=ωi
比较(10—21)式与(10—20)式可知,与活化能U值有影响的因素主要是?或β 和 Δ?(即超电位)。
++++8. 如果在铅酸蓄电池的电解液中含有下例微量杂质:Mn2、Au3、Cd2、Fe2,试
指出何种杂质是有害杂质,为什么?
+答:其中 Au3 是有毒杂质。
电极电势?(pbSO4/pb)=-0.3588,?(pbO2/pbSO4)=1.6913;
+++ ?(Fe2/Fe)=-0.447,?(Cd2/Cd)=-0.407,?(Mn2/Mn)=-1.1029,
++ ?(Au3/Au)=1.507。 因而充电时,阴极反应:Au3+3e→Au; ( ∵Au 电位大
于-0.5588,而 Fe、Cd、Mn 电位小于 -0.5585V )
+-+ 阳极反应: pbSO4+2H2O-2e→pbO2+4H+SO42 ; ∴ Au3是有害的。
9. 试说明对流与扩散传质的差异。
答:对流传质是指反应物或产物粒子随着液体的流动而移动的过程,不考虑液体与粒 子间相对运动。扩散是粒子从高浓度向低浓度方向转移的现象。二者区别,扩散 是指粒子相对于溶剂的运动,对流指整个液体(包括溶剂与粒子)间的运动。
10. 试讨论电解过程中,对流过程的存在对电极反应速率可能的影响。
答:由于对流的存在,可以减低扩散层的厚度δ,从而也就增大了电极表面的浓度 梯度,也就增大了在电极表面附近的扩散速度,这样就增大了电流密度,增快 了电极反应的速率。
11. 试比较电化学极化和浓差极化的基本特征。
答:电化学极化是由于电极表面进行化学反应或电化学反应不可逆过程而引起的,电化
学极化的大小决定于电极表面反应的活化能,而这活化能大小又随电极上的 外加 电压而改变。浓差极化是由于参加电极反应的物质在界面和溶液本体存在着浓度差 引起不可逆扩散过程而引起的极化,加强搅拌,可减小δ,增 i,减低浓差极化。
12. 试讨论旋转圆盘电极的特点和优点。
答:旋转园盘电极是将搅拌与电极结合在一起,使电极环绕中心轴高速旋转,从而 园盘上各点的扩散层厚度均匀,园盘电极上各点的液相传质速度相等,电流密 度分布均匀,充分利用电极表面的反应潜力,也就提高了电流密度,降低了浓 差超电势。
13. 试说明化学腐蚀和电化学腐蚀的不同特征。
答:化学腐蚀就是在金属表面直接发生化学反应使金属氧化、溶解,即氧化成离子或高 价化合物;电化学腐蚀的特征是:主要发生在非均匀的金属表面上,在金属表面构 成微电池(局部电池),产生的局部电流,发生电化学反应,使金属氧化、溶解,能 量以热的形式传给环境。
14. 试比较阴极保护和阳极保护法的特点和优缺点。
答:阳极保护是被腐蚀的金属作电池的阳极,使之发生氧化反应。但在该金属表面设法 先经过适当的氧化剂处理,形成一层致密的膜,这样就加大了金属持续氧化的超电 势,从而缓解了金属的腐蚀,阳极氧化一般称为钝化。而阴极保护是在被腐蚀的金 属上联接一块电势更负的金属,这样该金属先于被保护金属发生腐蚀,也就是被保 护的金属成为原电池的阴极,这样就不会发生腐蚀,阴极保护的另一方法是在用一 外电源的负极联接到被保护的金属,调节到外加电势与局部原电池中的阳极电势相 等,这样局部电池上的开端电势为零,也就防止了金属的腐蚀。
15. 讨论在腐蚀性介质中,加入不同添加剂后,金属的腐蚀电势和腐蚀电流间的关系。 答:加入阳极型缓蚀剂,能加速升高阳极电势?a,从而减低腐蚀电流I;加入阴极
型缓冲剂,能加速降低阴极电势?C,从而减低腐蚀电流I;加入混合型缓冲剂
既加速升高阳极电势,又减低阴极电势,从而减低腐蚀电流i。
16. 试分析电化学反应与一般均相氧化还源反应的区别。
答:电化学反应是氧化与还原反应的产物,分别集中于两个不同的极区,因此若将极 区设法隔离就可得到电化学反应氧化产物与还原产物,而均相氧化还原反应的结 果两种产物混在同一相内,必须设法加以分离才能得到两种反应的产物。
17. 试比较恒电势法与恒电流法各自的特征。
答:恒电势法,是控制电势,测出相应的电流。电解时相当于用一种还原剂,能得到 一种产物。恒电流法,就是控制电流测出相应的电势。电解时相当于多种还原剂, 得到是多种产物混合在一起。对阳极的钝化曲线测定,只能用恒电势法测出。
18. 用铂做电极,电解 ZnCl2 水溶液,在阴极上可能发生哪些电极反应?在用锌代替 铂电极,在阴极上又进行什么反应?
++++答:在铂极可能发生 Zn2 的还原与 H的还原,因? (H/H2,平衡)>? (Zn2/Zn,平衡),
而且在铂板上的η(H2)很小:0.05~0.045V,因此? (H2,析出)>? (Zn,析出),先析 出 H2;但是在锌板上H2的η(H2)为0.520~1.235V;而且Zn 的η≈0,因此在 pb 板上,Zn 的析出电势为? (Zn)=-0.7628-0=-0.763,而氢的析出电势为
? (H2)=0-1.235=-1.235V,低于 Zn 的析出电势,因此 Zn 先于 H2 析出。
如用 CuCl2 代替 ZnCl2,Cu 的? (平衡)=0.3402,则 Cu与 H2 的析出电势分别为 ? (Cu)=0.3402-0=0.3402V ? (H2)=0-1.235=-1.235V ,前者仍然大于后者,
+因此在 pb 极上首先是铜析出:Cu2+2e→Cu。
19. 当某一氧化还原反应在化学电池中进行时,有人说化学能的转换效率可不受热力 学第二定律的限制;有人说可不受卡诺循环所规定的最高转换效率所限制。你如 何评价这两种说法?
答:化学电池中能量转换也受到热二定律限制。化学电池中,化学能的转换效率,可 逆电池的最大有用功为 ΔGm=-nEF,不能再大于此值,否则可设计出第二类永 动机,因此仍然受热力学第二定律的限制,但由于这种能量转换不经过热能转变 为功的阶段,是由化学能直接转变为电能,所以是不受卡诺热机效率的限制,特 别是燃料电池的设计成功,便大大提高燃料的使用价值。
20. 试就影响热机效率和燃料电池的理论效率的因素进行比较。
答:热机效率为η=(T1-T2)/T2,即热源与冷源的温差越大,冷源温度越低,热机
效率就越高。而燃料电池的效率为=ΔGm/ΔHm=1-TΔSm/ΔHm,如果ΔSm/ΔHm 为正值,且电池的操作温度越低,则效率越大;如果ΔSm/ΔHm为负值,则η可能 大于1,其物理意义是电池在工作时,能从环境中吸热而转变为电能。
第十一章 表 面 现 象
1. 表面能、表面自由能、比表面自由能、表面张力是否是一个概念?相同否?
答:总的说来四者都是描述表面的过剩能量,但概念上有区别,表面能为物质表面较其 内部多余的能量;若在 T,p 恒定时,这部分能量称为表面自由能(表面吉布斯自由
- 能);若在T,p恒定时,单位表面的自由能,便称为比表面自由能,其单位为 J?m2,
--因 J=N?m,故 J?m2 也可化为 N?m1,这样表面自由能又转变为另一
概念,成为垂直作用于单位长度相表面上沿着相表面的切面方向的力,称为表面张 力。虽然比表面自由能和表面张力的数值相同,也可混用,但概念有差别,前者是标 量,后者是矢量。
2.若在容器内只是油与水在一起,虽然用力振荡,但静止后仍自动分层,这是为什么? 答:油与水是互不相溶的,当二者剧烈振荡时,可以相互分散成小液滴,这样一来,表 面能增大,这时又没有能降低表面能的第三种物质存在,因此这时为不稳定体系, 体系有自动降低能量的倾向,分层后,体系能量降低,因此会自动分层。
3.铅酸蓄电池的两个电极,一个是活性铅电极,另一个是活性氧化铅电极,你是怎样理 解这理解这“活性”两字?
答:这里活性是指铅或氧化铅处于多孔性,即具有大的比表面积,具有较高比表面自由
能,处于化学活性状态。这是在制备电极时经过特殊活化工序而形成的高分散状态, 根据热力学理论及表面性质,若铅蓄电池长期使用或者长期放置而未能及时充电, 电极的高分散状态会逐渐减低,这种活性也就消失。
4 在化工生产中,固体原料的焙烧,目前很多采用沸腾焙烧,依表面现象来分析有哪些优点? 答:沸腾焙烧是将固体原料碎成小颗粒,通入预热的空气或其它气体,使炉内固体颗粒在 气体中悬浮,状如沸腾,这样就增大了固气间的接触界面,增强了传质与传热,使体 系处于较高的化学活性状态。
5. 在滴管内的液体为什么必须给橡胶乳头加压时液体才能滴出,并呈球形?
答:因在滴管下端的液面呈凹形,即液面的附加力是向上的,液体不易从滴管滴出,因此 若要使液滴从管端滴下,必须在橡胶乳头加以压力,使这压力大于附加压力,此压力 通过液柱而传至管下端液面而超过凹形表面的附加压力,使凹形表面变成凸形表面, 最终使液滴滴下,刚滴下的一瞬间,液滴不成球形,上端呈尖形,这时液面各部位的 曲率半径都不一样,不同部位的曲面上所产生附加压力也不同,这种不平衡的压力便 迫使液滴自动调整成球形,降低能量使液滴具有最小的表面积。
6. 在进行蒸馏实验时要在蒸馏烧瓶中加些碎磁片或沸石以防止暴沸其道理何在?
答:若无碎磁片或沸石,由于液体内部不易形成新相( 气相 ),因若形成新相的刹那间, 该新气泡相的凹形表面的曲率很大,则根据开尔文公式,这样微小的气泡便自发消失, 因此体系便不能在正常情况下沸腾,便会升高温度形成局部过热的介稳定状态,导至 暴沸。如果在液体内加上沸石,则在沸石表面的尖端有较大的凸端,此处 pr( 气泡 内压强)>>p*(液体饱和蒸气压),因而容易沸腾,并且沸石内部吸附的空气,也因受热 而脱附,成为形成气泡气核,又因沸石与瓶底紧密相接,而成为局部过热处,两者相 接处的液膜在瞬间过热,pr>p*,便成为微泡,使沸石跳动,结果便成为一新气泡上升。
7.如果在一杯含有极微小蔗糖晶粒的蔗糖饱和溶液中,投入一块较大的蔗糖晶体,在恒 温密闭的条件下,放置一段时间,这时这杯溶液有什么变化?
答:任何物质的饱和溶液,当其中存在着大小不同的被溶解物质晶态物质时,实际上这 些大小不同的同种晶态物质的溶解度是不同的,由公式:RTn(Cr/C*)=2Mrζ(S)/rρ(S)
可知,r越小,即晶粒越小越微,其溶解度Cr越大,其溶解度大于大块晶体的溶解度C*, 因此,将这饱和溶液长期放置后,微晶、小晶 体便逐渐消失,而大块晶体却逐渐增大。
8.表面吸附量、表面浓度、表面过剩量是否是一个概念?
答:表面吸附量、表面浓度、表面过剩量是三个不同的概念。表面浓度是表面上每单位 体积中所含溶质的摩尔数。表面吸附量与表面过剩量是同一个概念,表面吸附量是 指溶液单位表面上与溶液内部相应部分的所含溶质的过剩量,即表面浓度与本体浓 度之差。对于由表面活性剂形成的溶液,由于体相浓度与表面浓度相比,其值甚小, 因此,表面浓度之值与表面吸附量之值相近或一致。
9.表面活性剂在溶液中是采取定向排列吸附在溶液表面上,还是以胶束的形式存在于溶 液中?为什么?
答:表面活性剂在溶液表面形成定向排列,以降低水的表面张力,使体系趋向稳定,但 在溶液内部,表面活性剂也能把增水基团靠在一起,形成胶束,一般来说,浓度较稀 时以定向排列吸附在表面为主,但溶液内部也可能有简单的胶束形成;随着表面活性 剂的浓度增加,表面定向排列增加的同时,内部胶束数量也增多,一旦表面形成单分 子膜,这时便达到临界胶束浓度,以后再增加表面活性剂浓度,只增加胶束数量,表 面张力不再改变。
10.两性离子型与非离子型表面活性剂有何不同?
答:两性离子型表面活性剂在某一定的 pH 值时,在溶液中呈等电点,当溶液低于这个 pH 值时,即在酸性溶液中,它呈阳离子表面活性剂,而在大于该 pH 值的溶液中,它 呈阴离子表面活性剂。 非离子型表面活性剂在溶夜中不能电离,不能成为离子型 表面活性剂,非离子型表面活性剂多含有在水中不解离的羟基(-OH)和(-O-)结合 的含氧基团,并以这类基团为亲水基团。
11.水在玻璃管中呈凹形夜面,但水银则呈凸形。为什么?
答:因水与玻璃的接触小于90°,水的表面的附加压力为负值,这样就使水在玻璃管
中呈凹面。而水银与玻璃的接触为大于90℃,水银表面的附加力为正值,因而水银在玻 璃管内呈凸形液面。
12.在装有部分液体的毛细管中,当一端加热时,如图 11-8 所示;(a) 润湿性液体向 毛细管哪一端移动? (b) 不润湿液体向哪一端移动? 为什么?
(a) (b)
答:(a)的情况,水液柱向着远离加热点(即向左)移动;(b)的情况,水银柱面向着加热 点(即向右)移动。因此表面张力随温度的升高而降低。加热处表面张力减少,未加热 处不变。在表面张力作用下,(a)润湿性液柱向左移动,(b)不润湿性液柱向右移动。
13.在亲水固体表面,经适当表面活性剂(如防水剂)处理后,为什么可以改变其表面性 质,使其具有憎水性?
答:由于表面活性剂在亲水表面上的定向排列,亲水基团与固体表面接触,憎水基团向 外这样就使固体表面形成一层憎水层,从而改变了固体表面结构与性质,使其具有 憎水性。
14.基于表面活性剂的基本性质,为何在纤维表面吸附适当表面活性剂(如纺纱油剂) 后,可以使纤维柔软平滑?
答:由于纤维表面具有亲水性,表面活性剂的亲水基团吸附在纤维表面而定向排列,外面 是表面活性剂的憎水基团定向排列,使纤维的表面形成一个新的憎水表面,而憎水基 团一般是近乎直链的脂肪基团,这样便在纤维表面形成一层薄薄的油层,就显出柔软 而平滑的手感。
第十二章 胶体及大分子溶液
1.纯液体有无散射光? 为什么? 一般溶液如何? 溶胶具有乳光现象,但体系透明,为何? 答:(1) 对于纯液体或纯气体,其n1=n2,便应无散射现象,但实际上它们也都有微弱的乳 光,这是由于密度的涨落致使其折射率变化而引起的。
(2) 对一般真溶液的散射光是很微弱的,一般低分子溶液,其分子体积很小,乳光很微弱, 远不如溶胶明显,因此丁铎尔效应是判别溶胶与真溶液的简单方法。
(3) 溶胶胶粒较大,散射光较强,具有乳光,但溶胶是均匀分散体系,所以是透明。
2.超显微镜为何要用强的光源?
答:因为根据 Raylligh 公式,对一个体系,其散射光的强度与入射光的强度成正比。超 显微镜是观察胶粒的散射光,因此使用超显微镜,强光源于能有效地提高超显微镜的 观测能力。
3.为何说我们观察到的布朗运动,不是胶粒真实的运动情况?
答:布朗运动是由于分散介质的分子热运动不断地由各个方向同时冲击胶粒,其合力未被 抵消,短时间向某一方向有一显著作用,而导致胶粒运动,因此布朗运动不是胶粒的
- 真实运动。又因胶粒受不平衡的冲击引起振动,周期约为108秒,而人们的肉眼能分
辨的周期最低为 0.1秒,因此我们所观察到的胶粒平均位移是胶粒在每秒钟内受各个 方向冲击百万次运动变化的宏观结果。
4.布朗运动扩散方程式,可以解决哪些问题?
答:根据 Δ=2Dt=RTt/3πrηL,解决列问题 :
(1) 证实原子、 分子存在的真实性。
(2) 分子运动学说的可靠性。
(3) 测算阿佛加德罗常数的实验手段。
(4) 运用该体系可研究分散体系的动力性质,胶粒扩散系数以及粒子大小等。
5.为什么胶体粒子量(胶团量)M=(4/3)?πr3ρL ?
答:因 (4/3)πr3ρ 为一个胶团粒的质量,L 为阿佛加德罗常数,根据SI制,摩尔
的概念是指体系中所包含物质的基本单元的数目与 0.012kg 12C 的原子数目(L)相 等,所谓基本单元可以是原子、 分子、 离子、 电子及其它粒子或这些粒子的特定组 合,因此对于胶体体系来说,具有6.022?1023(即L)数目的胶粒,便可谓是 1 mol 的胶粒,这样(4/3)πr3ρL 便是胶体粒子量(胶团量)。
6.试比较胶粒表面电势,Stern层(紧密层)电势及δ电势?
答:胶粒表面电势是指固相表面由于电离或吸附离子等原因使溶胶粒子带电,固体表面与 溶液深处的电势差,是热力学的平衡电势差。Stern 层电势是指溶胶粒子表面由于静电

或分子间的相互作用而紧密吸附一层的总电势,显然这层电势小于胶粒表面电势。
δ电势(滑动面电势)是指当溶胶粒子在液相中运动时,在上述紧密层之外有一层滑动面,
以滑动面的电势与液相内部电势为零处的电势差,称为滑动面电势或称δ(zeta)电势。
7.亚铁氰化铜溶胶的稳定剂是亚铁氰化钾,试写出其胶团表示式,胶粒电荷符号如何?
-答:以K4Fe(CN)6为亚铁氰化铜的稳定剂,则必然是Fe(CN)64进入溶胶粒子的紧密层内,
-+-+ 胶团为{[Cu2Fe(CN)6]m?nFe(CN)64?(4n-q)K}q?qK ,胶粒带负电荷。
8.如何理解溶胶是动力学上稳定而热力学上不稳定的体系,且有聚沉不稳定的特性? 答:由于溶胶的布朗运动以及扩散运动,又由于胶粒表面的双电层结构及离子溶剂化膜, 造成溶胶的动力学稳定性,但溶胶是高度分散的非均相体系,具有很大的表面自由 能,有自发聚沉以降低体系能量的趋势,因此是热力学的不稳定体系,有聚沉不稳定 的特性。
9.在三个烧杯中各装有20cm3同种溶胶,加入电解质溶液使其开始显著聚沉时,在第一个
-- 烧杯需加 1mol?dm3KCl溶液 2.1cm3。第二个需加12.5cm3的0.005mol?dm3 Na2SO4
-- 溶液,第三个烧杯需加7.5cm3的3.3?104mol?dm3Na3pO4溶液。试确定其聚沉值及该
溶胶电荷符号。
答:在溶胶中加入电解质溶液,当溶胶开始明显聚沉时,每升溶胶中加入电解质的最小体 积浓度称为这种电解质的聚沉值(CFC)。
-- 1mol?dm3KCl溶液聚沉值:1?2.1?1000/(20+2.1)=95.02m?mol?dm3
-- 0.005mol?dm3Na2SO4聚沉值 0.005?12.5?1000/(20+12.5)=1.923m?mol?dm3
-- 3.3?104mol?dm3Na3pO4溶液聚沉值:
- 0.00033?7.5?1000/(20+7.5)=0.091m?mol?dm3 该溶胶是带正电荷的。
10.考虑唐南平衡建立后,大分子溶液渗透压关系如何?
答:当唐南平衡建立后,由于电解质对高分子溶液渗透压的影响,溶液两侧的浓度差低 于纯高分子溶液的浓度,因此有电解质时大分子溶液的渗透压一般低于无电解质的情况。
11.当膜内、 外没有共同离子,及膜外只是溶剂水时的唐南平衡的关系如何?
答:(1) 当膜内外无共同离子,
例如:
膜 内 外
+-+- 起始 Na R K Cl
C1 C1 C C2
+---+ 达平衡 Na R K Cl K Cl Na
c1-z c1 x y c2x c2-y z
因满足电中性,有 x+(c1-z)=c1+y ∴ y=x-z
满足唐南平衡 (c1-z)y=z(c2-y)
(c1-z)(x-z)=z[c2-(x-z)] (1)
以及 xy=(c2-x)(c2-y) x(x-z)=(c2-x)[c2-(x-z)] (2)
解(1)(2)两个方程 x=c2(c1-c2)/(c1+2c2)
y=c22/(c1+2c2)
z=c1c2/(c1+2c2)
(2) 当膜外只是溶剂水如:
膜 内 外
+- 起初 Na R 2O
+- c1 c1 cHcOH=Kw
+-++- 膜平衡 Na R H OH
c1-x c1 x x x
唐南平衡条件: (c1-x)(Kw/x)=x2 =[Kw(c1-x)]1/3
若x<<c1 则 x=(Kwc1)1/3
- 故膜内酸性,膜外碱性,若大分子电解质为R+Cl型,则结果相反,这类膜平衡称为
膜水解,因此可以部分解释生理上细胞内外呈不同的pH及胃酸的形成。
