第二章 热力学第一定律
一、基本概念
系统与环境,状态与状态函数,广度性质与强度性质,过程与途径,热与功,内能与焓。
二、基本定律
热力学第一定律:ΔU=Q+W。
焦耳实验:ΔU=f(T) ; ΔH=f(T)
三、基本关系式
1、体积功的计算 δW= -pedV
恒外压过程:W= -peΔV
可逆过程: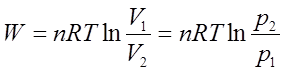
2、热效应、焓
等容热:QV =ΔU(封闭系统不作其他功)
等压热:Qp =ΔH(封闭系统不作其他功)
焓的定义:H=U+pV ; dH=dU+d(pV)
焓与温度的关系:ΔH=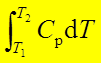
3、等压热容与等容热容
热容定义: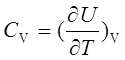 ;
;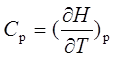
定压热容与定容热容的关系:
热容与温度的关系:Cp=a+bT+c’T2
四、第一定律的应用
1、理想气体状态变化
等温过程:ΔU=0 ; ΔH=0 ; W=-Q= pedV
pedV
等容过程:W=0 ; Q=ΔU=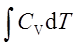 ; ΔH=
; ΔH=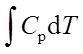
等压过程:W=-peΔV ; Q=ΔH=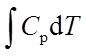 ; ΔU=
; ΔU=
可逆绝热过程:Q=0 ; 利用p1V1γ=p2V2γ求出T2,
W=ΔU=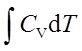 ;ΔH=
;ΔH=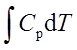
不可逆绝热过程:
Q=0 ; 利用CV(T2-T1)=-pe(V2-V1)求出T2,
W=ΔU=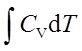 ;ΔH=
;ΔH=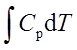
2、相变化
可逆相变化:ΔH=Q=nΔ_H;
W=-p(V2-V1)=-pVg=-nRT ;
ΔU=Q+W
3、热化学
物质的标准态;热化学方程式;盖斯定律;标准摩尔生成焓。
摩尔反应热的求算:
反应热与温度的关系—基尔霍夫定律:
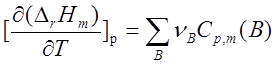 。
。
关于节流膨胀 :恒焓过程
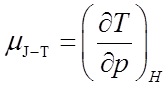
μJ-T称为焦耳—汤姆逊系数
第三章 热力学第二定律
一、基本概念
自发过程与非自发过程
二、热力学第二定律
1、热力学第二定律的经典表述
克劳修斯,开尔文,奥斯瓦尔德。实质:热功转换的不可逆性。
2、热力学第二定律的数学表达式(克劳修斯不等式)
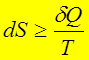 “=”可逆;“>”不可逆
“=”可逆;“>”不可逆
三、熵
1、熵的导出:卡若循环与卡诺定理
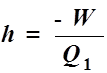
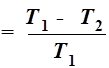
2、熵的定义: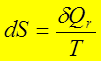
3、熵的物理意义:系统混乱度的量度。
4、绝对熵:热力学第三定律
5、熵变的计算
(1)理想气体等温过程:
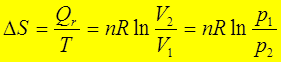
(2)理想气体等压过程: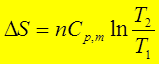
(3)理想气体等容过程: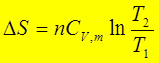
(4)理想气体pTV都改变的过程:
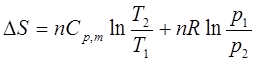
(5)可逆相变化过程: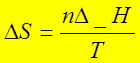
(6)化学反应过程:
四、赫姆霍兹函数和吉布斯函数
1、定义:A=U-TS;G=H-TS
等温变化:ΔA=ΔU-TΔS;ΔG=ΔH-TΔS
2、应用:不做其他功时,ΔAT,V≤0 ;自发、平衡
ΔGT,P≤0 ;自发、平衡
3、热力学基本关系式
dA=-SdT-PdV;dG=-SdT+VdP
4、ΔA和ΔG的求算
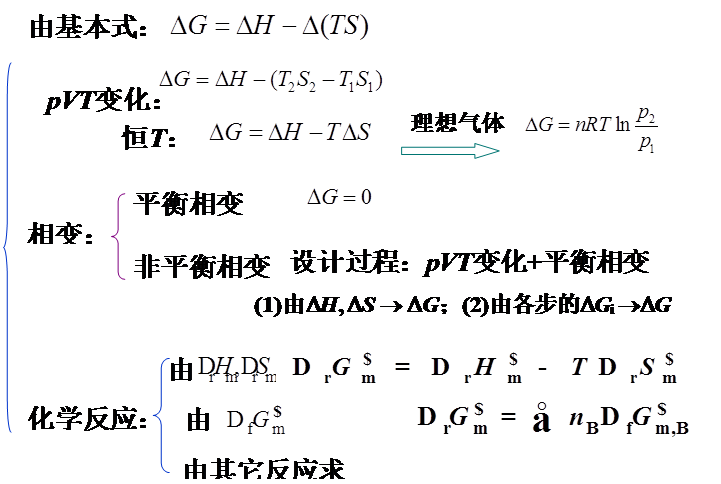

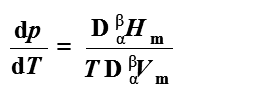
五、1、克拉配龙方程
克-克方程
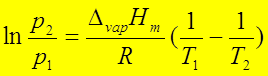
第四章 多组分系统热力学
一、化学势的概念
1、化学式的定义和物理意义
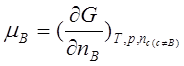 ;在T、p及其他物质的量保持不变的情况下,增加1molB物质引起系统吉布斯函数的增量。
;在T、p及其他物质的量保持不变的情况下,增加1molB物质引起系统吉布斯函数的增量。
2、化学势的应用
在等温等压不作其他功时, <0自发;=0平衡;>逆向自发
<0自发;=0平衡;>逆向自发
3、化学时表示式
理想气体:
纯固体和纯液体: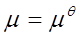
二、拉乌尔定律和亨利定律
1、拉乌尔定律
pA=p*xA ;pA=p*ax,A
适用于液态混合物和溶液中的溶剂。
2、亨利定律
pB=kx,BxB=kb,BbB=k%,B[%B] ;
pB=kx,Bax,B=kb,Bab,B=k%,Ba%,B
适用于溶液中的溶质。
二、液态混合物和溶液中各组分的化学势
1、理想液态混合物
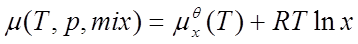
标准态为:同温下的液态纯物质。
理想液态混合物的混合性质

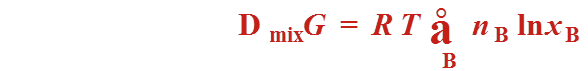

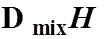
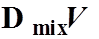 都为0
都为0
2、真实液态混合物
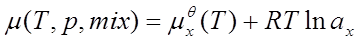
标准态为:同温下的液态纯溶剂。
3、理想稀溶液
溶剂:
标准态为:同温下的液态纯溶剂。
溶质:
标准态为:同温下xB=1且符合亨利定律的溶质(假想状态)。
4、真实溶液
溶剂: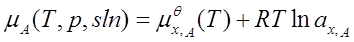 ;ax,A=fx,A x;
;ax,A=fx,A x;
标准态为:同温下的液态纯溶剂。
溶质: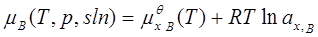 ; ax,B=γx,B xB;
; ax,B=γx,B xB;
标准态为:同温下xB=1且符合亨利定律的溶质(假想状态)。
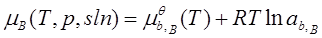 ; ab,B=γb,B bB;
; ab,B=γb,B bB;
标准态为:同温下bB=1且符合亨利定律的溶质(假想状态)。
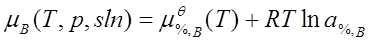 ; a%,B=γ%,B[%B];
; a%,B=γ%,B[%B];
标准态为:同温下[B%]=1且符合亨利定律的溶质(一般为假想状态)。
三、各种平衡规律
1、液态混合物的气液平衡
pA=p ax,A ; pB=p
ax,A ; pB=p ax,B ; p=pA+pB
ax,B ; p=pA+pB
2、溶液的气液平衡
pA=p ax,A;pB=kx,Bax,B=kb,Bab,B=k%,Ba%,B;p=pA+pB
ax,A;pB=kx,Bax,B=kb,Bab,B=k%,Ba%,B;p=pA+pB
3、理想稀溶液的凝固点降低,
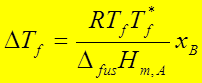
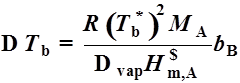 4、沸点升高
4、沸点升高
5、范特霍夫渗透压公式
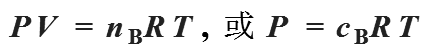
第五章 化学平衡
一、化学平衡的条件
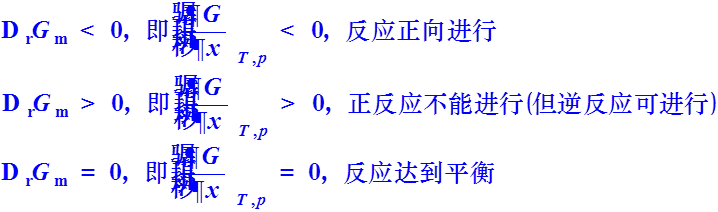
二、化学平衡常数与平衡常数表达式
如:Zn+2HCl(aq)=H2+ZnCl2(aq)
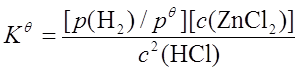
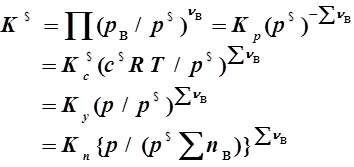
三、 标准平衡常数的求算
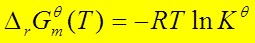
四、 范特荷夫等温方程

五、平衡常数与温度的关系范特荷夫等压方程
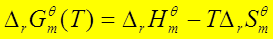 ;
;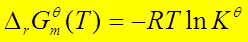
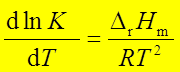
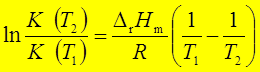
五、各种因素对平衡的影响
分压、总压、惰性气体、温度。
第六章相平衡
一、相律
1、物种数、独立组分数、相数、自由度数
2、相律公式 f=C-φ+2
二、单组分系统
1、克-克方程
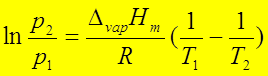
2、水的相图
三面、三线、一点。
三、双组分系统
1、相律分析
根据f=C-φ+1(一般固定压力),φ=2,f=1;φ=3,f=0
2、杠杆规则
3、步冷曲线
四、典型相图
1、6.3.4理想液态混合物甲苯-苯相图
2、6.6.2部分互溶系统水-正丁醇相图
3、6.8.1生成稳定化合物苯酚-苯胺相图
第七章电化学
电解质溶液
一、电解质溶液的电导
1、电导
G=1/R ; 单位:S(西门子)
2、电导率
G=κA/l 或κ=G l/A ; 单位:S/m
3、摩尔电导率
Λm=κ/c
4、无限稀释摩尔电导率
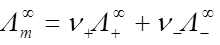
5、离子的电迁移
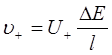 ;
;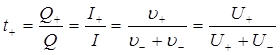 ;
;
二、电解质溶液的活度
1、电解质的化学势(电解质溶液的浓度用mB或bB表示)
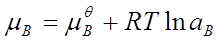
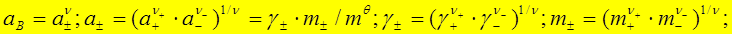 2、离子强度
2、离子强度
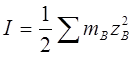
3、德拜—休克尔极限公式
可逆电池热力学
一、可逆电池的构成
电池反应互为逆反应;充放电时电流无穷小。
二、可逆电池热力学
1、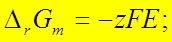

2、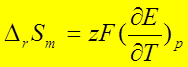
3、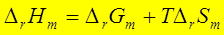
4、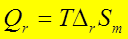 ;电池反应做了其他功。
;电池反应做了其他功。
三、能斯特方程
1、电池反应的能斯特方程
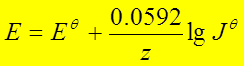 ;常用
;常用
2、电极反应的能斯特方程
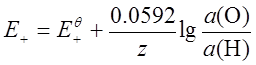 ;不常用
;不常用
四、可逆电极的种类
1、第一类电极
金属电极;气体电极
2、第二类电极
难溶盐电极;难溶氧化物电极
3、氧化还原电极
五、电极电势的应用
1、测定电池反应的热力学函数
2、测定电解质的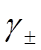
3、测定溶液的pH值
六、极化现象和超电势
1、浓差极化
电极反应速度比离子迁移速度快造成的。
2、电化学极化
电极反应速度比电子移动速度慢造成的。
3、极化结果
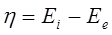 ;对阳极η总为正;对阴极η总为负。
;对阳极η总为正;对阴极η总为负。
第十章 界面现象
一、表面吉布斯函数
1、产生
表面分子与内部分子的差别。
2、定义及单位
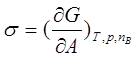 ;J/m2或N/m;因此又称表面张力。
;J/m2或N/m;因此又称表面张力。
3、影响因素
物质本性、温度、相邻相、溶质的种类。
4、表面热力学
在温度、压力、组成不变的情况下,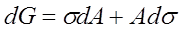
缩小表面积和降低表面张力为自发方向。
二、弯曲液面的表面现象
1、附加压力

2、饱和蒸气压

3、毛细管现象
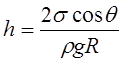
三、新相生成与介安状态
1、过饱和蒸汽与人工降雨
2、过冷现象与晶种
3、过饱和溶液与种盐
4、过热现象与沸石
四、固体表面的吸附作用
1、物理吸附与化学吸附
范德华力与化学键力;又无选择性;单分子层与多分子层。
2、吸附曲线
等温线(判断单多层);等压线(判断吸附类型)、等量线(求吸附热)
3、吸附等温式
弗伦德里希: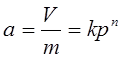
朗格谬尔: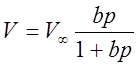
五、溶液表面的吸附
1、溶液的表面张力
各类溶质对表面张力的影响。
2、吉布斯吸附公式

六、润湿现象
1、接触角θ
θ=0°,完全润湿;θ<90°,润湿;θ>90°,不润湿;
θ=180°,完全不润湿。
2、杨氏方程
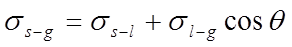
七、表面活性剂
1、定义
溶于水后能显著降低水的表面张力的物质。
2、分类
离子型、非离子型。
3、结构特点
一端亲水基一端亲油基。
4、应用
乳化、去污(增溶)、浮选、改变润湿角。
第十一章 化学动力学基础
一、关于反应速率的基本概念
1、反应速率的表示
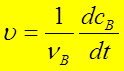
2、反应速率的测定
测定不同时刻的浓度(化学法、物理法),作c~t曲线,t时刻切线的斜率即为t时的反应速率。
3、基元反应和非基元反应
一步完成的反应为基元反应,基元反应遵守质量作用定律。是否基元反应只能通过实验确定。
4、速率方程与速率常数
质量作用定律是速率方程的特殊形式,对于非基元反应也有类似的式子。
速率常数仅与温度和催化剂有关,而与浓度无关。
5、反应级数
速率方程中浓度幂之和称之。基元反应一定为正整数,非基元反应可为0或小数。
二、浓度对反应速率的影响
1、一级反应
微分式: ——与浓度的一次方成正比;
——与浓度的一次方成正比;
k的单位为时间-1;
积分式: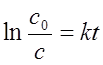 ——以lnc~t作图得一直线;
——以lnc~t作图得一直线;
半衰期: ——与起始浓度无关。
——与起始浓度无关。
2、二级反应与准一级反应
微分式: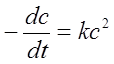 ——与浓度的二次方成正比;
——与浓度的二次方成正比;
k的单位为浓度-1时间-1;
积分式: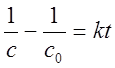 ——以1/c~t作图得一直线;
——以1/c~t作图得一直线;
半衰期: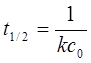 ——与起始浓度的一次方成反比。
——与起始浓度的一次方成反比。
准一级反应:对于A+B==Y+Z,当A大大过量或B大大过量时,可按一级反应处理。
3、反应级数的测定
尝试法:将一组c~t数据代入不同积分公式求k,若k为常数则所代公式正确;
作图法:将一组c~t数据按lnc~t、1/c~t等作图,若得直线可判定反应级数;
半衰期法:根据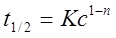 得
得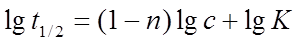 ,以
,以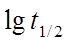 ~
~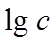 作图可得直线,从斜率可求n。
作图可得直线,从斜率可求n。
微分法:根据 得
得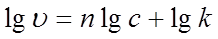 ,以
,以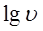 ~
~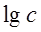 作图可得直线,斜率即为n。
作图可得直线,斜率即为n。
四、温度对反应速率的影响
1、阿仑尼乌斯公式
微分式: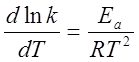
积分式:
2、活化能
活化分子的平均能量与反应物分子的平均能量之差。
复合反应
一、复合反应基本类型
1、平行反应
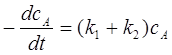 ;
;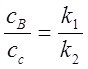
2、对行反应
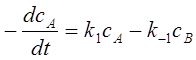 ;
;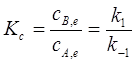
3、连串反应
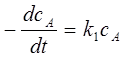 ;
;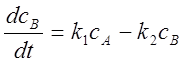 ;
;
二、复合反应机理近似处理方法
1、平衡态法
反应物与中间物达成平衡。
2、稳态法
中间物的浓度维持微小量不变。
三、链反应与爆炸半岛
1、链反应
分为直链反应和支链反应;链引发、链传递、链终止。
2、爆炸半岛
常见可燃气体在空气中的爆炸限。
四、催化作用的特征
1、催化剂不能改变反应的方向和限度
2、催化剂参与反应,改变了反应途径,降低了反应的活化能
3. 催化剂具有特殊的选择性
4、反应前后催化剂的数量及化学性质不变
第十二章 分散系统
胶体分散系统 1 < d <1000nm
溶胶的光学性质: 丁铎尔效应 本质:光散射
动力学性质: 布朗运动 沉降与沉降平衡
电动现象:电泳、电渗、流动电势、沉降电势。
溶胶粒子带电原因:离子吸附,电离
z = 0 时,为等电点,胶粒间无静电斥力,溶胶极易聚沉
所以溶胶稳定的原因:
1)胶粒带电 ¾ 增加胶粒间的排斥作用;
2)溶剂化作用 ¾形成弹性水化外壳,增加溶胶聚合的阻力
3)Brown运动 ¾使胶粒克服受重力影响而不下沉
第二篇:初中物理化学知识点总结
化学知识点的归纳总结。
一、初中化学常见物质的颜色
(一)、固体的颜色
1、红色固体:铜,氧化铁
2、绿色固体:碱式碳酸铜
3、蓝色固体:氢氧化铜,硫酸铜晶体
4、紫黑色固体:高锰酸钾
5、淡黄色固体:硫磺
6、无色固体:冰,干冰,金刚石
7、银白色固体:银,铁,镁,铝,汞等金属
8、黑色固体:铁粉,木炭,氧化铜,二氧化锰,四氧化三铁,(碳黑,活性炭)
9、红褐色固体:氢氧化铁
10、白色固体:氯化钠,碳酸钠,氢氧化钠,氢氧化钙,碳酸钙,氧化钙,硫酸铜,五氧化二磷,氧化镁
(二)、液体的颜色
11、无色液体:水,双氧水
12、蓝色溶液:硫酸铜溶液,氯化铜溶液,硝酸铜溶液
13、浅绿色溶液:硫酸亚铁溶液,氯化亚铁溶液,硝酸亚铁溶液
14、黄色溶液:硫酸铁溶液,氯化铁溶液,硝酸铁溶液
15、紫红色溶液:高锰酸钾溶液
16、紫色溶液:石蕊溶液
(三)、气体的颜色
17、红棕色气体:二氧化氮
18、黄绿色气体:氯气
19、无色气体:氧气,氮气,氢气,二氧化碳,一氧化碳,二氧化硫,氯化氢气体等大多数气体。
二、初中化学之三
1、我国古代三大化学工艺:造纸,制火药,烧瓷器。
2、氧化反应的三种类型:爆炸,燃烧,缓慢氧化。
3、构成物质的三种微粒:分子,原子,离子。
4、不带电的三种微粒:分子,原子,中子。
5、物质组成与构成的三种说法:
(1)、二氧化碳是由碳元素和氧元素组成的;
(2)、二氧化碳是由二氧化碳分子构成的;
(3)、一个二氧化碳分子是由 一个碳原子和一个氧原子构成的。
6、构成原子的三种微粒:质子,中子,电子。
7、造成水污染的三种原因:
(1)工业“三废”任意排放,
(2)生活污水任意排放
(3)农药化肥任意施放
8、收集方法的三种方法:排水法(不容于水的气体),向上排空气法(密度比空气大的气体),向下排空气法(密度比空气小的气体)。
9、质量守恒定律的三个不改变:原子种类不变,原子数目不变,原子质量不变。
10、不饱和溶液变成饱和溶液的三种方法:增加溶质,减少溶剂,改变温度(升高或降低)。
11、复分解反应能否发生的三个条件:生成水、气体或者沉淀
12、三大化学肥料:N、P、K
13、排放到空气中的三种气体污染物:一氧化碳、氮的氧化物,硫的氧化物。
14、燃烧发白光的物质:镁条,木炭,蜡烛。
15、具有可燃性,还原性的物质:氢气,一氧化碳,单质碳。
16、具有可燃性的三种气体是:氢气(理想),一氧化碳(有毒),甲烷(常用)。
17、CO的三种化学性质:可燃性,还原性,毒性。
18、三大矿物燃料:煤,石油,天然气。(全为混合物)
19、三种黑色金属:铁,锰,铬。
20、铁的三种氧化物:氧化亚铁,三氧化二铁,四氧化三铁。
21、炼铁的三种氧化物:铁矿石,焦炭,石灰石。
22、常见的三种强酸:盐酸,硫酸,硝酸。
23、浓硫酸的三个特性:吸水性,脱水性,强氧化性。
24、氢氧化钠的三个俗称:火碱,烧碱,苛性钠。
25、碱式碳酸铜受热分解生成的三种氧化物:氧化铜,水(氧化氢),二氧化碳。
26、实验室制取CO2不能用的三种物质:硝酸,浓硫酸,碳酸钠。
27、酒精灯的三个火焰:内焰,外焰,焰心。
28、使用酒精灯有三禁:禁止向燃着的灯里添加酒精,禁止用酒精灯去引燃另一只酒精灯,禁止用嘴吹灭酒精灯。
29、玻璃棒在粗盐提纯中的三个作用:搅拌、引流、转移
30、液体过滤操作中的三靠:(1)倾倒滤液时烧杯口紧靠玻璃棒,(2)玻璃棒轻靠在三层滤纸的一端,(3)漏斗下端管口紧靠烧杯内壁。
31、固体配溶液的三个步骤:计算,称量,溶解。
32、浓配稀的三个步骤:计算,量取,溶解。
33、浓配稀的三个仪器:烧杯,量筒,玻璃棒。
34、三种遇水放热的物质:浓硫酸,氢氧化钠,生石灰。
35、过滤两次滤液仍浑浊的原因:滤纸破损,仪器不干净,液面高于滤纸边缘。
36、药品取用的三不原则:不能用手接触药品,不要把鼻孔凑到容器口闻药品的气味,不得尝任何药品的味道。
37、金属活动顺序的三含义:(1)金属的位置越靠前,它在水溶液中越容易失去电子变成离子,它的活动性就越强;(2)排在氢前面的金属能置换出酸里的氢,排在氢后面的金属不能置换出酸里的氢;(3)排在前面的金属能把排在后面的金属从它们的盐溶液中置换出来。
38、温度对固体溶解度的影响:(1)大多数固体物质的溶解度随着温度的升高而增大,(2)少数固体物质的溶解度受温度影响变化不大(3)极少数固体物质的溶解度随着温度的升高而减小。
39、影响溶解速度的因素:(1)温度,(2)是否搅拌(3)固体颗粒的大小
40、使铁生锈的三种物质:铁,水,氧气。
41、溶质的三种状态:固态,液态,气态。
42、影响溶解度的三个因素:溶质的性质,溶剂的性质,温度。
三、初中化学常见混合物的重要成分
1、空气:氮气(N2)和氧气(O2)
2、水煤气:一氧化碳(CO)和氢气(H2)
3、煤气:一氧化碳(CO)
4、天然气:甲烷(CH4)
5、石灰石/大理石:(CaCO3)
6、生铁/钢:(Fe)
7、木炭/焦炭/炭黑/活性炭:(C)
8、铁锈:(Fe2O3)
四、初中化学常见物质俗称
1、氯化钠 (NaCl) : 食盐
2、碳酸钠(Na2CO3) : 纯碱,苏打,口碱
3、氢氧化钠(NaOH):火碱,烧碱,苛性钠
4、氧化钙(CaO):生石灰
5、氢氧化钙(Ca(OH)2):熟石灰,消石灰
6、二氧化碳固体(CO2):干冰
7、氢氯酸(HCl):盐酸
8、碱式碳酸铜(Cu2(OH)2CO3):铜绿
9、硫酸铜晶体(CuSO4 .5H2O):蓝矾,胆矾
10、甲烷 (CH4):沼气
11、乙醇(C2H5OH):酒精
12、乙酸(CH3COOH):醋酸
13、过氧化氢(H2O2):双氧水
14、汞(Hg):水银
15、碳酸氢钠(NaHCO3):小苏打
四、初中化学溶液的酸碱性
1、显酸性的溶液:酸溶液和某些盐溶液(硫酸氢钠、硫酸氢钾等)
2、显碱性的溶液:碱溶液和某些盐溶液(碳酸钠、碳酸氢钠等)
3、显中性的溶液:水和大多数的盐溶液
五、初中化学敞口置于空气中质量改变的
(一)质量增加的
1、由于吸水而增加的:氢氧化钠固体,氯化钙,氯化镁,浓硫酸;
2、由于跟水反应而增加的:氧化钙、氧化钡、氧化钾、氧化钠,硫酸铜
3、由于跟二氧化碳反应而增加的:氢氧化钠,氢氧化钾,氢氧化钡,氢氧化钙;
(二)质量减少的
1、由于挥发而减少的:浓盐酸,浓硝酸,酒精,汽油,浓氨水;
2、由于风化而减少的:碳酸钠晶体。
六、初中化学物质的检验
(一) 、气体的检验
1、氧气:带火星的木条放入瓶中,若木条复燃,则是氧气.
2、氢气:在玻璃尖嘴点燃气体,罩一干冷小烧杯,观察杯壁是否有水滴,往烧杯中倒入澄清的石灰水,若不变浑浊,则是氢气.
3、二氧化碳:通入澄清的石灰水,若变浑浊则是二氧化碳.
4、氨气:湿润的紫红色石蕊试纸,若试纸变蓝,则是氨气.
5、水蒸气:通过无水硫酸铜,若白色固体变蓝,则含水蒸气.
(二)、离子的检验.
6、氢离子:滴加紫色石蕊试液/加入锌粒
7、氢氧根离子:酚酞试液/硫酸铜溶液
8、碳酸根离子:稀盐酸和澄清的石灰水
9、氯离子:硝酸银溶液和稀硝酸,若产生白色沉淀,则是氯离子
10、硫酸根离子:硝酸钡溶液和稀硝酸/先滴加稀盐酸再滴入氯化钡
11、铵根离子:氢氧化钠溶液并加热,把湿润的红色石蕊试纸放在试管口
12、铜离子:滴加氢氧化钠溶液,若产生蓝色沉淀则是铜离子
13、铁离子:滴加氢氧化钠溶液,若产生红褐色沉淀则是铁离子
(三)、相关例题
14、如何检验NaOH是否变质:滴加稀盐酸,若产生气泡则变质
15、检验生石灰中是否含有石灰石:滴加稀盐酸,若产生气泡则含有石灰石
16、检验NaOH中是否含有NaCl:先滴加足量稀硝酸,再滴加AgNO3溶液,若产生白色沉淀,则含有NaCl。
17、检验三瓶试液分别是稀HNO3,稀HCl,稀H2SO4?
向三只试管中分别滴加Ba(NO3)2溶液,若产生白色沉淀,则是稀H2SO4;再分别滴加AgNO3溶液,若产生白色沉淀则是稀HCl,剩下的是稀HNO3
18、淀粉:加入碘溶液,若变蓝则含淀粉。
19、葡萄糖:加入新制的氢氧化铜,若生成砖红色的氧化亚铜沉淀,就含葡萄糖。
七、物质的除杂
1、CO2(CO):把气体通过灼热的氧化铜
2、CO(CO2):通过足量的氢氧化钠溶液
3、H2(水蒸气):通过浓硫酸/通过氢氧化钠固体
4、CuO(Cu):在空气中(在氧气流中)灼烧混合物
5、Cu(Fe) :加入足量的稀硫酸
6、Cu(CuO):加入足量的稀硫酸
7、FeSO4(CuSO4): 加 入足量的铁粉
8、NaCl(Na2CO3):加 入足量的盐酸
9、NaCl(Na2SO4):加入足量的氯化钡溶液
10、NaCl(NaOH):加入足量的盐酸
11、NaOH(Na2CO3):加入足量的氢氧化钙溶液
12、NaCl(CuSO4):加入足量的氢氧化钡溶液
13、NaNO3(NaCl):加入足量的硝酸银溶液
14、NaCl(KNO3):蒸发溶剂
15、KNO3(NaCl):冷却热饱和溶液。
16、CO2(水蒸气):通过浓硫酸。
八、化学之最
1、未来最理想的燃料是H2 。
2、最简单的有机物是CH4 。
3、密度最小的气体是H2 。
4、相对分子质量最小的物质是H2 。
5、相对分子质量最小的氧化物是H2O 。
6、化学变化中最小的粒子是 原子 。
7、PH=0时,酸性最强,碱性最弱 。
PH=14时,碱性最强 ,酸性最弱 。
8、土壤里最缺乏的是N,K,P三种元素,肥效最高的氮肥是 尿素 。
9、天然存在最硬的物质是 金刚石 。
10、最早利用天然气的国家是 中国 。
11、地壳中含量最多的元素是 氧 。
12、地壳中含量最多的金属元素是 铝 。
13、空气里含量最多的气体是 氮气 。
14、空气里含量最多的元素是 氮 。
15、当今世界上最重要的三大化石燃料是 煤,石油,天然气。
16、形成化合物种类最多的元素:碳
九、有关不同
1、金刚石和石墨的物理性质不同:是因为 碳原子排列不同。
2、生铁和钢的性能不同:是因为 含碳量不同。
3、一氧化碳和二氧化碳的化学性质不同:是因为 分子构成不同。
(氧气和臭氧的化学性质不同是因为分子构成不同;水和双氧水的化学性质不同是因为分子构成不同。)
4、元素种类不同:是因为质子数不同。
5、元素化合价不同:是因为最外层电子数不同。
6、钠原子和钠离子的化学性质不同:是因为最外层电子数不同
十、有毒的物质
1、 有毒的固体:亚硝酸钠(NaNO2),乙酸铅等;
2、 有毒的液体:汞,硫酸铜溶液,甲醇,含Ba2+的溶液(除BaSO4);
3、 有毒的气体:CO,氮的氧化物,硫的氧化物
初中物理基本概念概要
一、测量
⒈长度L:主单位:米;测量工具:刻度尺;测量时要估读到最小刻度的下一位;光年的单位是长度单位。
⒉时间t:主单位:秒;测量工具:钟表;实验室中用停表。1时=3600秒,1秒=1000毫秒。
⒊质量m:物体中所含物质的多少叫质量。主单位:千克; 测量工具:秤;实验室用托盘天平。
二、机械运动
⒈机械运动:物体位置发生变化的运动。
参照物:判断一个物体运动必须选取另一个物体作标准,这个被选作标准的物体叫参照物。
⒉匀速直线运动:
①比较运动快慢的两种方法:a 比较在相等时间里通过的路程。b 比较通过相等路程所需的时间。
②公式: 1米/秒=3.6千米/时。
三、力
⒈力F:力是物体对物体的作用。物体间力的作用总是相互的。
力的单位:牛顿(N)。测量力的仪器:测力器;实验室使用弹簧秤。 力的作用效果:使物体发生形变或使物体的运动状态发生改变。
物体运动状态改变是指物体的速度大小或运动方向改变。 ⒉力的三要素:力的大小、方向、作用点叫做力的三要素。
力的图示,要作标度;力的示意图,不作标度。
⒊重力G:由于地球吸引而使物体受到的力。方向:竖直向下。
重力和质量关系:G=mg m=G/g
g=9.8牛/千克。读法:9.8牛每千克,表示质量为1千克物体所受重力为9.8牛。
重心:重力的作用点叫做物体的重心。规则物体的重心在物体的几何中心。 ⒋二力平衡条件:作用在同一物体;两力大小相等,方向相反;作用在一直线上。 物体在二力平衡下,可以静止,也可以作匀速直线运动。
物体的平衡状态是指物体处于静止或匀速直线运动状态。处于平衡状态的物体所受外力的合力为零。
⒌同一直线二力合成:方向相同:合力F=F1+F2 ;合力方向与F1、F2方向相同; 方向相反:合力F=F1-F2,合力方向与大的力方向相同。 ⒍相同条件下,滚动摩擦力比滑动摩擦力小得多。
滑动摩擦力与正压力,接触面材料性质和粗糙程度有关。【滑动摩擦、滚动摩擦、静摩擦】
7.牛顿第一定律也称为惯性定律其内容是:一切物体在不受外力作用时,总保持静止或匀速直线运动状态。 惯性:物体具有保持原来的静止或匀速直线运动状态的性质叫做惯性。
四、密度
⒈密度ρ:某种物质单位体积的质量,密度是物质的一种特性。
公式: m=ρV 国际单位:千克/米3 ,常用单位:克/厘米3, 关系:1克/厘米3=1×103千克/米3;ρ水=1×103千克/米3; 读法:103千克每立方米,表示1立方米水的质量为103千克。
⒉密度测定:用托盘天平测质量,量筒测固体或液体的体积。
面积单位换算:
1厘米2=1×10-4米2,
1毫米2=1×10-6米2。
五、压强
⒈压强P:物体单位面积上受到的压力叫做压强。
压力F:垂直作用在物体表面上的力,单位:牛(N)。
压力产生的效果用压强大小表示,跟压力大小、受力面积大小有关。 压强单位:牛/米2;专门名称:帕斯卡(Pa)
公式: F=PS 【S:受力面积,两物体接触的公共部分;单位:米2。】 改变压强大小方法:①减小压力或增大受力面积,可以减小压强;②增大压力或减小受力面积,可以增大压强。
⒉液体内部压强:【测量液体内部压强:使用液体压强计(U型管压强计)。】 产生原因:由于液体有重力,对容器底产生压强;由于液体流动性,对器壁产生压强。
规律:①同一深度处,各个方向上压强大小相等②深度越大,压强也越大③不同液体同一深度处,液体密度大的,压强也大。 [深度h,液面到液体某点的竖直高度。]
公式:P=ρgh h:单位:米; ρ:千克/米3; g=9.8牛/千克。 ⒊大气压强:大气受到重力作用产生压强,证明大气压存在且很大的是马德堡半球实验,测定大气压强数值的是托里拆利(意大利科学家)。托里拆利管倾斜后,水银柱高度不变,长度变长。
1个标准大气压=76厘米水银柱高=1.01×105帕=10.336米水柱高 测定大气压的仪器:气压计(水银气压计、盒式气压计)。
大气压强随高度变化规律:海拔越高,气压越小,即随高度增加而减小,沸点也降低。
六、浮力
1.浮力及产生原因:浸在液体(或气体)中的物体受到液体(或气体)对它向上托的力叫浮力。方向:竖直向上;原因:液体对物体的上、下压力差。
2.阿基米德原理:浸在液体里的物体受到向上的浮力,浮力大小等于物体排开液体所受重力。
即F浮=G液排=ρ液gV排。 (V排表示物体排开液体的体积)
3.浮力计算公式:F浮=G-T=ρ液gV排=F上、下压力差
4.当物体漂浮时:F浮=G物 且 ρ物<ρ液 当物体悬浮时:F浮=G物 且 ρ物=ρ液
当物体上浮时:F浮>G物 且 ρ物<ρ液 当物体下沉时:F浮<G物 且 ρ物>ρ液
七、简单机械
⒈杠杆平衡条件:F1l1=F2l2。力臂:从支点到力的作用线的垂直距离
通过调节杠杆两端螺母使杠杆处于水位置的目的:便于直接测定动力臂和阻力臂的长度。
定滑轮:相当于等臂杠杆,不能省力,但能改变用力的方向。
动滑轮:相当于动力臂是阻力臂2倍的杠杆,能省一半力,但不能改变用力方向。
⒉功:两个必要因素:①作用在物体上的力;②物体在力方向上通过距离。W=FS 功的单位:焦耳
3.功率:物体在单位时间里所做的功。表示物体做功的快慢的物理量,即功率大的物体做功快。
W=Pt P的单位:瓦特; W的单位:焦耳; t的单位:秒。
八、光
⒈光的直线传播:光在同一种均匀介质中是沿直线传播的。小孔成像、影子、光斑是光的直线传播现象。
光在真空中的速度最大为3×108米/秒=3×105千米/秒
⒉光的反射定律:一面二侧三等大。【入射光线和法线间的夹角是入射角。反射光线和法线间夹角是反射角。】
平面镜成像特点:虚像,等大,等距离,与镜面对称。物体在水中倒影是虚像属光的反射现象。
⒊光的折射现象和规律: 看到水中筷子、鱼的虚像是光的折射现象。
凸透镜对光有会聚光线作用,凹透镜对光有发散光线作用。 光的折射定律:一面二侧三随大四空大。
⒋凸透镜成像规律:[U=f时不成像 U=2f时 V=2f成倒立等大的实像] 物距u 像距v 像的性质 光路图 应用
u>2f f<v<2f 倒缩小实 照相机
f<u<2f v>2f 倒放大实 幻灯机
u<f 放大正虚 放大镜
⒌凸透镜成像实验:将蜡烛、凸透镜、光屏依次放在光具座上,使烛焰中心、凸透镜中心、光屏中心在同一个高度上。
九、热学:
⒈温度t:表示物体的冷热程度。【是一个状态量。】
常用温度计原理:根据液体热胀冷缩性质。
温度计与体温计的不同点:①量程,②最小刻度,③玻璃泡、弯曲细管,④使用方法。
⒉热传递条件:有温度差。热量:在热传递过程中,物体吸收或放出热的多少。
【是过程量】
热传递的方式:传导(热沿着物体传递)、对流(靠液体或气体的流动实现热传递)和辐射(高温物体直接向外发射出热)三种。
⒊汽化:物质从液态变成气态的现象。方式:蒸发和沸腾,汽化要吸热。
影响蒸发快慢因素:①液体温度,②液体表面积,③液体表面空气流动。蒸发有致冷作用。
⒋比热容C:单位质量的某种物质,温度升高1℃时吸收的热量,叫做这种物质的比热容。
比热容是物质的特性之一,单位:焦/(千克℃) 常见物质中水的比热容最大。
C水=4.2×103焦/(千克℃) 读法:4.2×103焦耳每千克摄氏度。 物理含义:表示质量为1千克水温度升高1℃吸收热量为4.2×103焦。 ⒌热量计算:Q放=cm⊿t降 Q吸=cm⊿t升
Q与c、m、⊿t成正比,c、m、⊿t之间成反比。⊿t=Q/cm
6.内能:物体内所有分子的动能和分子势能的总和。一切物体都有内能。内能单位:焦耳
物体的内能与物体的温度有关。物体温度升高,内能增大;温度降低内能减小。
改变物体内能的方法:做功和热传递(对改变物体内能是等效的)
7.能的转化和守恒定律:能量即不会凭空产生,也不会凭空消失,它只会从一种形式转化为其它形式,或者从一个物体转移到另一个物体,而能的总量保持不变。
十、电路
⒈电路由电源、电键、用电器、导线等元件组成。要使电路中有持续电流,电路中必须有电源,且电路应闭合的。 电路有通路、断路(开路)、电源和用电器短路等现象。
⒉容易导电的物质叫导体。如金属、酸、碱、盐的水溶液。不容易导电的物质叫绝缘体。如木头、玻璃等。
绝缘体在一定条件下可以转化为导体。
⒊串、并联电路的识别:串联:电流不分叉,并联:电流有分叉。
【把非标准电路图转化为标准的电路图的方法:采用电流流径法。】 十一、电流定律
⒈电量Q:电荷的多少叫电量,单位:库仑。
电流I:1秒钟内通过导体横截面的电量叫做电流强度。 Q=It
电流单位:安培(A) 1安培=1000毫安 正电荷定向移动的方向规定为电流方向。
测量电流用电流表,串联在电路中,并考虑量程适合。不允许把电流表直接接在电源两端。
⒉电压U:使电路中的自由电荷作定向移动形成电流的原因。电压单位:伏特(V)。 测量电压用电压表(伏特表),并联在电路(用电器、电源)两端,并考虑量程适合。
⒊电阻R:导电物体对电流的阻碍作用。符号:R,单位:欧姆、千欧、兆欧。 电阻大小跟导线长度成正比,横截面积成反比,还与材料有关。【 】
导体电阻不同,串联在电路中时,电流相同(1∶1)。 导体电阻不同,并联在电路中时,电压相同(1:1)
⒋欧姆定律:公式:I=U/R U=IR R=U/I
导体中的电流强度跟导体两端电压成正比,跟导体的电阻成反比。
导体电阻R=U/I。对一确定的导体若电压变化、电流也发生变化,但电阻值不变。
⒌串联电路特点:
① I=I1=I2 ② U=U1+U2 ③ R=R1+R2 ④ U1/R1=U2/R2
电阻不同的两导体串联后,电阻较大的两端电压较大,两端电压较小的导体电阻较小。
例题:一只标有“6V、3W”电灯,接到标有8伏电路中,如何联接一个多大电阻,才能使小灯泡正常发光?
解:由于P=3瓦,U=6伏
∴I=P/U=3瓦/6伏=0.5安
由于总电压8伏大于电灯额定电压6伏,应串联一只电阻R2 如右图, 因此U2=U-U1=8伏-6伏=2伏
∴R2=U2/I=2伏/0.5安=4欧。答:(略)
⒍并联电路特点:
①U=U1=U2 ②I=I1+I2 ③1/R=1/R1+1/R2 或 ④I1R1=I2R2 电阻不同的两导体并联:电阻较大的通过的电流较小,通过电流较大的导体电阻小。
例:如图R2=6欧,K断开时安培表的示数为0.4安,K闭合时,A表示数为1.2安。求:①R1阻值 ②电源电压 ③总电阻
已知:I=1.2安 I1=0.4安 R2=6欧
求:R1;U;R
解:∵R1、R2并联
∴I2=I-I1=1.2安-0.4安=0.8安
根据欧姆定律U2=I2R2=0.8安×6欧=4.8伏
又∵R1、R2并联 ∴U=U1=U2=4.8伏
∴R1=U1/I1=4.8伏/0.4安=12欧
∴R=U/I=4.8伏/1.2安=4欧 (或利用公式 计算总电阻) 答:(略) 十二、电能
⒈电功W:电流所做的功叫电功。电流作功过程就是电能转化为其它形式的能。 公式:W=UQ W=UIt=U2t/R=I2Rt W=Pt 单位:W焦 U伏特 I安培 t秒 Q库 P瓦特
⒉电功率P:电流在单位时间内所作的电功,表示电流作功的快慢。【电功率大的用电器电流作功快。】
公式:P=W/t P=UI (P=U2/R P=I2R) 单位:W焦 U伏特 I安培 t秒 Q库 P瓦特
⒊电能表(瓦时计):测量用电器消耗电能的仪表。1度电=1千瓦时=1000瓦×3600秒=3.6×106焦耳
例:1度电可使二只“220V、40W”电灯工作几小时?
解 t=W/P=1千瓦时/(2×40瓦)=1000瓦时/80瓦=12.5小时 十三、磁
1.磁体、磁极【同名磁极互相排斥,异名磁极互相吸引】
物体能够吸引铁、钴、镍等物质的性质叫磁性。具有磁性的物质叫磁体。磁体的磁极总是成对出现的。
2.磁场:磁体周围空间存在着一个对其它磁体发生作用的区域。
磁场的基本性质是对放入其中的磁体产生磁力的作用。
磁场方向:小磁针静止时N极所指的方向就是该点的磁场方向。磁体周围磁场用磁感线来表示。
地磁北极在地理南极附近,地磁南极在地理北极附近。
3.电流的磁场:奥斯特实验表明电流周围存在磁场。
通电螺线管对外相当于一个条形磁铁。
通电螺线管中电流的方向与螺线管两端极性的关系可以用右手螺旋定则来判定。
