高考离子共存问题总结
不能共存的原因: 1、有气体产生;
H+与CO32-、HCO3-、SO32-、HSO3ˉ、S2ˉ、HSˉ等不能共存
如CO32-、S2-、HS-、HSO3-等易挥发的弱酸的酸根与H+不能大量共存,
主要是由于CO32-+2H+=CO2↑+H2O、HS-+H+=H2S↑。 2、有沉淀生成或生成微溶物质。
①SO4与Ba、Ca、Ag等不能共存;
2ˉ
2+
2+
+
②CO32ˉ与Ba2+、Ca2+、Mg2+、Ag+、Cu2+、Zn2+等不能共存; ③S2ˉ与Cu2+、Pb2+、Fe2+、Hg2+、Ag+等不能共存;
④OHˉ与Mg2+、Al3+、Fe2+、Fe3+、Cu2+、Ag+、Zn2+等不能共存;
⑤AlO2ˉ与HCO3ˉ不能大量共存:AlO2ˉ+HCO3ˉ+H2O=Al(OH)3↓+CO32ˉ(发生双水解)
如:
Cu2+、Fe3+等不能与OH-大量共存
也是因为Cu2++2OH-=Cu(OH)2↓,Fe3++3OH-=Fe(OH)3↓等。 3、有弱电解质生成。 如OH、CH3COO、CO3
--2-
、HCO32- 、SO32-、 HSO3- 与H+不能大量共存,
NH4+与OH-不能大量共存
主要是由于OH-+H+=H2O、CH3COO-+H+=CH3COOH; 一些酸式弱酸根不能与OH-大量共存 是因为HCO3-+OH - =CO32-+H2O、 HPO42-+OH-=PO43-+H2O、 NH4++OH-=NH3·H2O等。
4、一些容易发生水解的离子,在溶液中的存在是有条件的。
如AlO2-、S2-、CO32-、C6H5O-等必须在碱性条件下才能在溶液中存在; 如Fe3+、Al3+等必须在酸性条件下才能在溶液中存在。
这两类离子不能同时存在在同一溶液中,即离子间能发生“双水解”反应。 如3AlO2-+3Al3++6H2O=4Al(OH)3↓等。
①H+与OHˉ、AlO2ˉ、SiO32ˉ、ClOˉ、Fˉ、PO43ˉ、HPO42ˉ、H2PO4ˉ、CH3COOˉ、C6H5Oˉ等不能大量共存;
++2
②OHˉ与H、NH4、HCO3ˉ、HSO3ˉ、HSˉ、H2PO4ˉ、HPO4ˉ等不能大量共存; 若是酸性溶液,所有弱酸根离子和OH-不能大量共存。 5. 由于发生氧化还原反应,离子不能大量共存
1、具有较强还原性的离子不能与具有较强氧化性的离子大量共存。 如I-和Fe3+不能大量共存 是由于2I-+2Fe3+=I2+2Fe2+。
2、在酸性或碱性的介质中由于发生氧化还原反应而不能大量共存
①NO3ˉ与Iˉ、Brˉ、Fe、Sˉ、HSˉ、SO3ˉ、HSO3ˉ等不能共存;
2+
2
2
②Sˉ与SO3ˉ等不能共存(碱性条件下可以共存);
③MnO4ˉ与Iˉ、Brˉ、Clˉ、S2ˉ、HSˉ、SO32ˉ、HSO3ˉ、Fe2+等不能共存;
2+22
④ClOˉ与Fe、Iˉ、Sˉ、HSˉ、SO3ˉ、HSO3ˉ等不能共存;
3+22
(2)Fe与Sˉ、HSˉ、SO3ˉ、HSO3ˉ、Iˉ等不能共存; 注意:
MnO4-、NO3-在中性或碱性溶液中氧化应较弱,但在有大量H+存在情况下具有强 氧化应性能共
SO32-和S2-在碱性条件下也可以共存,但在酸性条件下则由于发生2S2-+SO32-+ 6H+=3S↓+3H2O反应不能存在。 6.由于形成络合离子,离子不能大量共存 (1)Fe3+和SCN-、C6H5O-不能共存;
(2)Ag与NH4在碱性条件下不能共存。
如Fe3+与SCN-不共存;Ag+与NH3·H2O分子不共存;Ag+与CN-不共存。 由于Fe3++SCN-= [Fe(SCN)]2+等络合反应而不能大量共存。
7.能水解的阳离子跟能水解的阴离子在水溶液中不能大量共存。 (1)Al3+与AlO2-、HCO3-、CO32ˉ、HSˉ、S2ˉ、SO32ˉ、HSO3ˉ、SiO32ˉ、ClOˉ、C6H5Oˉ
+
+
22
发生双水解等不能共存;
(2)Fe3+与AlO2ˉ、HCO3ˉ、CO32ˉ、SiO32ˉ、ClOˉ等不能共存;
(3)NH4+与AlO2ˉ、SiO32ˉ等不能共存;
由于水解和电离的相互影响而不能大量共存。AlO2-与HCO3-虽然均属于弱酸根离子,水溶液因水解呈碱性,但H3AlO3的酸性太弱,AlO2-的水解能力太强,含有AlO2-的水溶液中[OH-]较大,能直接与HCO3-作用生成Al(OH)3沉淀和CO32-。故AlO2-与HCO3-不能共存于同一溶液中。
与其类似的还有AlO2-与HSO3-、HS-、H2PO4-、HPO42-等。
具有氧化性的某些含氧酸根离子(如NO3-)若不是在酸性溶液中,则能与某些还原性较强的离子(如S2-、I-、Fe2+等)共存。因为这些含氧酸根离子只有在酸性条件下才能表现出强氧化性。又如:MnO4-在碱性条件下能氧化SO32-、S2O32-、S2-、I-,但不能氧化Cl-、Br-;在酸性条件下,MnO4-的氧化性很强,常温下就能氧化Cl-、Br-。
(3)水解能力弱的弱碱阳离子与弱酸根离子(如Mg2+与HCO3-、Mg2+与HSO3-等),可以不考虑它们之间的双水解,能共存于同一溶液中。
限制酸性溶液的条件(隐含有H+)
1. 常温下PH=a (a<7)的溶液; 2.使紫色石蕊溶液呈红色; 3.使甲基橙呈红色;
4.加镁粉放氢气;
5.常温下c(OH-)为10-n(n>7); 限制碱性的条件(隐含有OH-)
1.常温下PH=a(a>7)的溶液; 2.使pH变蓝; 3.使红色石蕊变蓝; 4.酚酞呈红色; 5.甲基橙呈黄色;
6.c(H+)为10-n(n>7) 可酸可碱的条件;
1.水电离c(OH-)或者c(H+)浓度为10-n mol/L; 2.加入铝粉有氢气产生;
3.HCO3-离子不能稳定存在的溶液; 无色溶液条件:
MnO4(紫色),Fe3(橙黄色),Fe2+(浅绿色),Cu2(蓝色); 审题时应注意题中给出的附加条件
+-
①酸性溶液(H)、碱性溶液(OH)
-
+
+
“与Al反应能放出H2的某溶液”,
可能是强酸性溶液(其中不可能含NO3ˉ),也可能是强碱溶液。、 由水电离出的H+或OH-=1×10-10mol/L的溶液等。
-+++
②有色离子:MnO4,Fe3,Fe2+,Cu2,Fe(SCN)2。
Fe(浅绿色)、Fe(黄色)、Cu(蓝色)、MnO4ˉ(紫红色)、Fe(SCN)(血红色)、Fe(C6H5O)6ˉ(紫色)等。
--
③ MnO4,NO3等在酸性条件下具有强氧化性。
-
④S2O32在酸性条件下发生氧化还原反应:
-+
S2O32+2H=S↓+SO2↑+H2O
⑤ 注意题目要求“大量共存”还是“不能大量共存”。 审题时还应特别注意以下几点: 与酸碱指示剂颜色变化有关的信息。
(1)注意溶液的酸性对离子间发生氧化还原反应的影响。
+-
如:Fe2与NO3能共存,
+-+
但在强酸性条件下(即Fe2、NO3、H相遇)不能共存;
--
MnO4 与Cl在强酸性条件也不能共存; --
S2与SO32在钠、钾盐时可共存,但在酸性条件下则不能共存。
-+
(2)酸式盐的含氢弱酸根离子不能与强碱(OH)、强酸(H)共存。如:
----
HCO3+OH=CO32+H2O (HCO3遇碱时进一步电离)
-+
HCO3+H=CO2↑+H2O
32+
3+
2+
2+
第二篇:离子共存问题总结
1. 复习重点
(1)增加限制条件,如强酸性、无色透明、碱性、pH=1、甲基橙呈红色、发生氧化还原反应等。
(2)定性中有定量,如“由水电离出的H+或OH-浓度为1×10-10mol/L的溶液中,……”。
2.难点聚焦
(一)、由于发生复分解反应,离子不能大量共存。
1、有气体产生。如CO32-、HCO3-、S2-、HS-、SO32-、HSO3-等易挥发的弱酸的酸根与H+不能大量共存,主要是由于发生CO32-+2H+=CO2↑+H2O、HS-+H+=H2S↑等。
2、有沉淀生成。如Ba2+、Ca2+、Mg2+等不能与SO42-、CO32-等大量共存,
主要是由于Ba2++CO32-=BaCO3↓、Ca2++SO42-=CaSO4↓(微溶);
Mg2+、Al3+、Cu2+、Fe2+、Fe3+等不能与OH-大量共存是因为
Cu2++2OH-=Cu(OH)2↓,Fe3++3OH-=Fe(OH)3↓等;
SiO32-、AlO2- 、S2O32-等不能与H+大量共存是因为
SiO32-+2H+=H2 SiO3↓、AlO2-+H++H2O=Al(OH)3↓、S2O32-+2H+=S↓+SO2↑+H2O
3、有弱电解质生成。
如OH-、ClO-、F-、CH3COO-、HCOO-、PO43-、HPO42-、H2PO4-等与H+不能大量共存,
主要是由于OH-+H+=H2O、CH3COO-+H+=CH3COOH等;
一些酸式弱酸根及NH4+不能与OH-大量共存是因为
HCO3-+OH-=CO32-+H2O、HPO42-+OH-=PO43-+H2O、NH4++OH-=NH3·H2O等。
4、一些容易发生水解的离子,在溶液中的存在是有条件的。
如:AlO2-、S2-、HS-、CO32-、HCO3-、SO32-、HSO3- 、ClO-、F-、CH3COO-、HCOO-、PO43- 、SiO32-、C6H5O-等必须在碱性条件下才能在溶液中大量存在;Mg2+、Al3+、Cu2+、Fe2+、Fe3+、NH4+等必须在酸性条件下才能在溶液中大量存在。
(二)、由于发生氧化还原反应,离子不能大量共存
1、一般情况下,具有较强还原性的离子不能与具有较强氧化性的离子大量共存。如I-、、S2-、HS-和Fe3+不能大量共存是由于2I-+2Fe3+=I2+2Fe2+、2Fe3++ S2-=S↓+2Fe2+、2Fe3++3S2-=S↓+2Fe S↓。
2、在酸性或碱性的介质中由于发生氧化还原反应而不能大量共存。如NO3-和I-在中性或碱性溶液中可以共存,但在有大量H+存在情况下不能共存;SO32- 、S2O32-和S2-在碱性条件下可以共存,但在酸性条件下由于发生2S2-+SO32-+6H+=3S↓+3H2O、2S2-+S2O32-+6H+=4S↓+3H2O不能共存。ClO-与S2-不论是在酸性条件下还是在碱性条件下都不能大量共存。
(三)、由于形成络合离子,离子不能大量共存
中学化学中还应注意有少数离子可形成络合离子而不能大量共存的情况。如Fe3+和SCN-、C6H5O-,由于Fe3++SCN- [Fe(SCN)]2+等络合反应的发生而不能大量共存。
[Fe(SCN)]2+等络合反应的发生而不能大量共存。
(四)、能水解的阳离子与能水解的阴离子一般不能同时存在在同一溶液中,即离子间能发生“双水解”反应。例如:Al3+和HCO3-,Al3+和CO32-,Al3+和S2-,Al3+和HS-,Al3+和AlO2-,Al3+和C6H5O-,Fe3+和AlO2-,Fe3+和HCO3-,Fe3+和CO32-,NH4+和AlO2-等。如3AlO2-+Al3++6H2O=4Al(OH)3↓等。特别注意:NH4+和CO32-、NH4+和HCO3-、NH4+和CH3COO-在同一溶液中能大量共存。
注意事项:1.首先必须从化学基本概念和基本理论出发,搞清楚离子反应的规律和“离子共存”的条件。在中学化学中要求掌握的离子反应规律主要是离子间发生复分解反应和离子间发生氧化还原反应,以及在一定条件下一些微粒(离子、分子)可形成络合离子等。“离子共存”的条件是根据上述三个方面统筹考虑、比较、归纳整理而得出的。因此解决“离子共存”问题可从离子间的反应规律入手,逐条梳理。
2.审题时应注意题中给出的附加条件,如:
①酸性溶液(H+)、碱性溶液(OH-)、能在加入铝粉后放出可燃性气体的溶液、由水电离出的H+或OH-浓度为1×10-10mol/L的溶液等。
②有色离子:MnO4-,Fe3+,Fe2+,Cu2+,Fe(SCN)2+使溶液呈现一定的颜色。
③MnO4-、NO3-、Cr2O72-等在酸性条件下具有强氧化性。
④注意题目要求“一定大量共存”、“可能大量共存”还是“不能大量共存” 等要求。
3.审题时还应特别注意以下几点:
(1)注意溶液的酸碱性对离子间发生氧化还原反应的影响。如:Fe2+与NO3-能共存,但在强酸性条件下发生3Fe2++NO3-+4H+=3Fe3+ + NO↑+2H2O而不能大量共存;I-与NO3-能共存,但在强酸性条件下不能大量共存;MnO4- 与Cl-在强酸性条件下也不能大量共存;S2-与SO32-在碱性条件下可共存,但在酸性条件下不能大量共存。
(2) 弱酸的酸式根离子(如HCO3-、HSO3-、HS-、HPO42-、H2PO4-)既不能与H+大量共存也不能与OH-大量共存。如:HCO3-+OH-=CO32-+H2O (HCO3-遇碱时进一步电离)
HCO3-+H+=CO2↑+H2O。
(3) 注意挖掘题目中隐含的信息,排除干扰信息,克服非智力因素失分。
离子方程式的书写正误是历年高考必出的试题,考查离子方程式的目的主要是了解考生使用化学用语的准确程度和熟练程度,具有一定的综合性。从命题的内容看,存在着三种特点:
⑴所考查的化学反应均为中学化学教材中的基本反应,错因大都属于化学式能否拆分、处理不当、电荷未配平、产物不合理和漏掉部分反应等。
(2)所涉及的化学反应类型以复分解反应、溶液中的氧化还原反应为主。
⑶一些重要的离子反应方程式,在历年考卷中多次重复。
4.离子方程式正误判断规律(八“看”)
⑴看离子反应是否符合客观事实,不可主观臆造产物及反应。
⑵看“=”“≒”“↑”“↓”等是否正确。
⑶看表示各物质的化学式是否正确。如HCO3-不能写成CO32-+H+
⑷看是否漏掉离子反应。
⑸看电荷是否守衡。
⑹看反应物或产物的配比是否正确。
⑺看是否符合题设条件及要求。
⑻看物料是否守衡。
3. 例题精讲
[例1]下列各组中的离子,能在溶液中大量共存的是:
A.K+、Ag+、NO3-、Cl- B.Ba2+、Na+、CO32-、OH-
C.Mg2+、Ba2+、OH-、NO3- D.H+、K+、CO32-、SO42-
E.Al3+、Fe3+、SO42-、Cl- F.K+、H+、NH4+、OH-
解析:A组中:Ag++Cl-=AgCl↓ B组中,Ba2++CO32-=BaCO3↓
C组中,Mg2++2OH-=Mg(OH)2↓ D组中,2H++CO32-=CO2↑+H2O
E组中,各种离子能在溶液中大量共存。
F组中,NH4+与OH-能生成难电离的弱电解质NH3·H2O,甚至有气体逸出。
NH4++OH-=NH3·H2O或NH4++OH-=NH3↑+H2O
答案:E
[例2]在pH=1的无色透明溶液中,不能大量共存的离子组是:
A.Al3+、Ag+、NO3-、I- B.Mg2+、NH4+、NO3-、Cl-
C.NH4+、K+、S2-、Br- D.Zn2+、Na+、NO3-、SO42-
解析:题目给出两个重要条件:pH=1(即酸性)和无色透明,并要求找出不能大量共存的离子组。选项A中Ag+与I-不能共存,生成黄色的AgI不溶于HNO3(H+和NO3-),Al3+、NO3-、H+都为无色,符合题意。选项B、D中的各离子虽都是无色的,但能共存于酸性溶液中,不符合题意。选项C中各离子能够共存,且为无色,但S2-与H+不能大量共存,所以C也符合题意。 答案:A、C
[例3]下列各组离子,在强碱性溶液中可以大量共存的是:
A.K+、Na+、HSO3-、Cl- B.Na+、Ba2+、AlO2-、NO3-
C.NH4+、K+、Cl-、NO3- D.K+、Na+、ClO-、S2-
解析:A中HSO3-+OH-=SO32-+H2O C中NH4++OH-=NH3·H2O
D中ClO-具有强氧化性,S2-具有还原性,发生氧化还原反应 答案:B
[例4]下列各组离子在水溶液中能大量共存的是:
(1)I-、ClO-、NO3-、H+ (2)K+、NH4+、HCO3-、OH-
(3)SO32-、SO42- 、Cl-、OH- (4)Fe3+、Cu2+、SO42- 、Cl-
(5)H+、K+、AlO2-、HSO3- (6)Ca2+、Na+、SO42- 、CO32-
A.(1)和(6) B.(3)和(4) C.(2)和(5) D.(1)和(4)
解析:通常组合选择题需对题干及各项逐一分析,选出符合题意的组合,然后与各选项比较得出结论。但本题可用排除法,先判断出组合(1)由于次氯酸是弱酸,故ClO-与H+不能大量共存,发生反应:H++ClO-=HClO,次氯酸有较强的氧化性以及硝酸(NO3-、H+)都能与I-(具有还原性)发生氧化还原反应,因此该组不合题意,凡是含(1)的选项即A和D都不正确,可以排除。(2)中因发生:NH4++OH-=NH3·H2O,HCO3-+OH-=CO32-+H2O而不能大量共存,由此排除C,正确答案为B。其中(3)和(4)这两组离子在水溶液中能大量共存。本题涉及的组合(5)也不能大量共存,因为发生:H++AlO2-+H2O=Al(OH)3↓,H++HSO3-=SO2↑+H2O而不能大量共存。组合(6)中因Ca2++CO32-=CaCO3↓析出沉淀而不能大量共存。 答案:B
[例5]下列各组离子,能够在溶液中大量共存的是:
A.Na+、Al3+、NO3-、AlO2- B.Na+、Ca2+、HCO3-、HSO4-
C.Cu2+、K+、NO3-、OH- D.S2O32-、Na+、H+、SO42-
E.Fe3+、Cl-、SCN-、K+ F.Fe3+、NH4+、Cl-、NO3-
G.Fe2+、Cl-、NO3-、H+ H.Na+、Al3+、SO42-、HCO3-
解析:解本题的关键在于熟悉离子反应、盐类水解、氧化还原反应的规律以及某些特殊离子的存在条件是否由于其它离子的存在而遭破坏。下列各组离子,因为发生下列反应不能大量共存。
A组:Al3++3AlO2-+6H2O=4Al(OH)3↓ B组:HCO3-+HSO4-=H2O+CO2↑+SO42-
C组:Cu2++2OH-=Cu(OH)2↓ D组:S2O32-+2H+=SO2↑+S↓+H2O
E组:Fe3++3SCN-=Fe(SCN)3 G组:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
H组:Al3++3HCO3-=Al(OH)3↓+3CO2↑ F组:能大量共存 答案:F
[例6]下列离子方程式正确的是
A.AlCl3溶液中加入过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+;
B.C6H5ONa溶液中通入少量CO2:2C6H5O-+CO2+H2O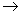 2C6H5OH+ CO32-;
2C6H5OH+ CO32-;
C.FeBr2溶液中通入少量Cl2:2Br-+Cl2=Br2+2Cl-;
D.Mg(HCO3)2溶液中加入足量NaOH溶液: Mg2++2HCO3-+4OH-=Mg(OH)2↓+2CO32-+2H2O.
解析:B中不论CO2多少,均得HCO3-;C中应先氧化Fe2+。 答案:A、D
[例7]下列离子方程式正确的是
A.向NaHSO4溶液中逐滴加入Ba(OH)2溶液,至沉淀完全:
2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
B.碳酸钠与醋酸溶液反应:CO32-+2CH3COOH=CO2↑+2CH3COO- +H2O
C.将1~2mL氯化铁饱和溶液加入到20 mL沸水中:
Fe3++3H2O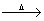 Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+
D.氢氧化铁与氢碘酸中和:Fe(OH)3+3H+=Fe3++3H2O
解析:A应为H++SO42-+Ba2++OH-=BaSO4↓+H2O; D中氢碘酸有还原性,要还原
+3价的铁:2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O
答案:B、C
[例8]下列离子方程式正确的是
A.等物质的量浓度的Ba(OH)2溶液与明矾溶液以体积比3比2混合
3Ba2++6OH-+2Al3++3SO42-=3BaSO4↓+2Al(OH)3↓
B.Fe(OH)2溶于稀硝酸中 Fe(OH)2+3H+=Fe2++3H2O
C.H218O中投入Na2O2固体 2H218O+2O22-=4OH-+18O2↑
D.CuCl2溶液中加入Na2S溶液 Cu2++S2-+2H2O=Cu(OH)2↓+H2S↑
解析:B中硝酸有氧化性,要氧化+2价的铁:3Fe(OH)2+10H++NO3-=3Fe3++NO↑+8H2O;
C应为2H218O+2 Na2O2=2 Na OH+2 Na 18OH+O2↑;D应为Cu2++S2-=Cu S↓ 答案:A
[例9]下列离子方程式的书写正确的是
A.FeS固体与稀HNO3溶液混合 FeS+2H+=2Fe2++H2S↑
B.NH4HSO4溶液中加入足量Ba(OH)2溶液 H++SO42-+Ba2++OH-=BaSO4↓+H2O
C.Ca(ClO)2溶液中通入足量的CO2气体 Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO
D.等浓度等体积的Ca(H2PO4)2溶液与NaOH溶液混合 Ca2++H2PO4-+OH-=CaHPO4↓+H2O
解析:A中硝酸有氧化性,要氧化+2价的铁和-2价的硫;
B应为NH4++H++SO42-+Ba2++2OH-=BaSO4↓+NH3·H2O+H2O; C中CO2足量应生成HCO3-。
答案:D
[例10]下列离子方程式书写正确的是
A.将少量SO2气体通入NaClO溶液中 SO2+2ClO-+H2O=SO32-+2HClO
B.向KHSO4溶液中加入Ba(OH)2溶液至所得溶液的pH=7 Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
C.向Ca(HCO3)2溶液中滴入过量的NaOH溶液 Ca2++2 HCO3-+2OH-=CaCO3↓+CO32-+2H2O
D.112mL(S.T.P)Cl2通入10mL1mol/L的FeBr2溶液中 2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2
解析:A中SO32-要被HClO 氧化;D中Cl2少仅氧化Fe2+ 答案:B、C
