离子共存问题 1.由于发生复分解反应,离子不能大量共存。
(1)有气体产生。如CO3、SO3、S、HCO3、HSO3、HS等易挥发的弱酸的酸根与H+不能大量共存。
(2)有沉淀生成。如Ba、Ca、Mg、Ag等不能与SO4、CO3等大量共存;Mg、Fe、Ag、Al、Zn、Cu、Fe等不能与OH大量共存;Pb与Cl,Fe与S、Ca与PO4、Ag与I不能大量共存。
(3)有弱电解质生成。如OH、CH3COO、PO4、HPO4、H2PO4、F、ClO、AlO2、SiO3、CN、C17H35COO、 等与H不能大量共存;一些酸式弱酸根如HCO3、HPO4、HS、H2PO4、HSO3不能与OH大量共存;NH4与OH不能大量共存。
(4)一些容易发生水解的离子,在溶液中的存在是有条件的。如AlO2、S、CO3、C6H5O
3+3+-2-2---+---+-2------3-2-----2--+3+2+2+3+-2+-2+2-2+3-+2+2+2++2-2-2+2+2-2-2----等必须在碱性条件下才能在溶液中存在;如Fe、Al等必须在酸性条件下才能在溶液中存
在。这两类离子不能同时存在在同一溶液中,即离子间能发生“双水解”反应。如3AlO2+3Al+6H2O=4Al(OH)3↓等。
2.由于发生氧化还原反应,离子不能大量共存。
(1)具有较强还原性的离子不能与具有较强氧化性的离子大量共存。如S、HS、SO3、I和Fe不能大量共存。
(2)在酸性或碱性的介质中由于发生氧化还原反应而不能大量共存。 如MnO4、Cr2O7、NO3、ClO与S、HS、SO3、HSO3、I、Fe等不能大量共存;SO3和S在碱性条件下可以共存,但在酸性条件下则由于发生2S+SO3+6H=3S↓+3H2O反应不能共在。H与S2O3不能大量共存。
3.能水解的阳离子跟能水解的阴离子在水溶液中不能大量共存(双水解)。 例:Al和HCO3、CO3、HS、S、AlO2、ClO等;Fe与CO3、HCO3、AlO2、ClO等不能大量共存。
4.溶液中能发生络合反应的离子不能大量共存。
如Fe、Fe与SCN不能大量共存;Fe与 不能大量共存。
5、审题时应注意题中给出的附加条件。
①酸性溶液(H)、碱性溶液(OH)、能在加入铝粉后放出可燃气体的溶液、由水电离出的H或OH=1×10-10mol/L的溶液等。
②有色离子MnO4,Fe,Fe,Cu,Fe(SCN)2 ③MnO4,NO3等在酸性条件下具有强氧化性。 -3+2+2++.--+-+-2+3+-3+3+-2--2---3+2----+2-2-2-2-+----2--2---2+2--3+2--2--3+
④S2O3在酸性条件下发生氧化还原反应:S2O3+2H=S↓+SO2↑+H2O
⑤注意题目要求“大量共存”还是“不能大量共存”。
6、审题时还应特别注意以下几点:
(1)注意溶液的酸性对离子间发生氧化还原反应的影响。如:Fe与NO3能共存,但在强酸性条件下(即Fe、NO3、H相遇)不能共存;MnO4与Cl在强酸性条件下也不能共存;S与SO3在钠、钾盐时可共存,但在酸性条件下则不能共存。
(2)酸式盐的含氢弱酸根离子不能与强碱(OH)、强酸(H)共存。
如HCO3+OH=CO3+H2O(HCO3遇碱时进一步电离);HCO3+H=CO2↑+H2O
若题目限定溶液“无色”,则不含有色离子,即Fe2+(浅绿色)、Fe3+(黄色)、Cu2+(蓝色)、MnO4-(紫色)等离子。若“透明”,则溶液不形成混浊或沉淀(与溶液有无颜色无关)。如Ag+与Cl-、Br-、
I-、SO42-;Ca2+与CO32-、SO42-;Ba2+与CO32-、SO32-、SO42-等在水溶液中会发生反应,有混浊或明显的沉淀生成,它们不能大量共存。
例1.某无色透明的溶液中,下列各组离子能大量共存的是
A.H+、Cl-、Ba2+、CO32-
B.Ag+、I-、K+、NO3-
C.K+、OH-、Cl-、Na+
D.Fe3+、Cl-、NO3-、Na+
解析:正确选项应满足无色透明和能大量共存两个条件。答案为C项。
常见的叙述有强酸性溶液、PH=1的溶液、能使PH试纸变红的溶液、紫色石蕊试液呈红色的溶液、甲基橙呈红色的溶液、加入镁粉能放出氢气的溶液等。
若题目中限定溶液呈酸性,则溶液中有H+存在,其中不能大量含有OH-、弱酸根离子(如CO32-、SO32-、
S2-、F-、ClO-、CH3COO-、PO43-、AlO2-、SiO32-等)以及弱酸的酸式根离子(如HCO3-、HSO3-、HS-、HPO42-、H2PO4-等)。
例2.在pH=1的溶液中,可以大量共存的离子是
A.K+、Na+、SO42-、SO32- --2---+-+2-2-2+-+--2+-2-2-+
B.NH4+、Mg2+、SO42-、Cl-
C.Na+、K+、HCO3-、Cl-
D.K+、Na+、AlO2-、NO3-
解析:正确选项应满足pH=1(有大量H+存在)和可以大量共存两个条件。答案为B项。 常见的叙述有强碱性溶液、PH=14的溶液、能使PH试纸变蓝的溶液、红色石蕊试纸变蓝的溶液、酚酞呈红色的溶液、甲基橙呈黄色的溶液、加入铝粉反应后生成AlO2-的溶液、既能溶解Al(OH)3又能溶解H2SiO3的溶液等。
若题目中限定溶液呈碱性,则溶液中有OH-存在,其中不能大量含有H+、弱碱的阳离子(如NH4+、Mg2+、Ag+、Al3+、Cu2+、Fe2+、Fe3+等)以及弱酸的酸式根离子(如HCO3-、HSO3-、HS-、HPO42-、H2PO4-等)。
例3.某溶液既能溶解Al(OH)3又能溶解H2SiO3的溶液,在该溶液中可以大量共存的离子组是
A.K+、Na+、HCO3-、NO3-
B.Na+、SO42-、Cl-、ClO-
C.H+、Mg2+、SO42-、NO3-
D.Ag+、K+、NO3-、Na+
解析:正确选项应满足溶液既能溶解Al(OH)3又能溶解H2SiO3的溶液(有OH-存在)、可以大量共存两个条件,只有B项符合题意。
常见的叙述有能使Al反应放出H2的溶液等。
若题目中出现这样的条件,则溶液中可能有H+存在,也可能有OH-存在,分析时要注意题目要求回答的是一定能大量共存(满足无论是与H+还是与OH-都不会反应)还是可能大量共存(只要满足与H+、OH-中的一种不会反应就可以)。
例4.若溶液能与Al反应放出H2,满足此条件的溶液中一定可以大量共存的离子组是
A.Al3+、Na+、NO3-、Cl-
B.K+、Na+、Cl-、SO42-
C.K+、Na+、Cl-、AlO2-
D.K+、NH4+、SO42-、NO3-
解析:题目所给的溶液为酸性(含有H+)或碱性(含有OH-)溶液。正确选项应满足在酸性或碱性都能大量共存的条件,只有B项符合题意。
若题目中出现因发生氧化还原反应而不能大量共存这样的条件时,要考虑各离子组中是
否存在强氧化性和强还原性的离子。如Fe3+与S2-、SO32-、HSO3-、I-;H+与S2O32-和S2-;MnO4-(H+)与Cl-;MnO4-(H+)、NO3-(H+)与Fe2+、S2-、HS-、SO32-、HSO3-、Br-、I-等不能大量共存。
例5.下列离子在溶液中因发生氧化还原反应而不能大量共存的是()。
A.H+、NO3-、Fe2+、Na+
B.Ag+、NO3-、Cl-、K+
C.K+、Ba2+、OH-、SO42-
D.Cu2+、NH4+、Br-、OH-
解析:正确选项应满足发生氧化还原反应、不能大量共存两个条件。A项中H+、NO3-、Fe2+能发生氧化还原反应,故答案为A项。
第二篇:高考化学离子共存专题
离子共存问题
一、基本原理
1.一色
“无色透明”条件型
若题目限定溶液“无色”,则不含有色离子,即Fe2+(浅绿色)、Fe3+(棕黄色)、Cu2+(蓝色)、MnO4-(紫色)等离子,也不含Fe(SCN)2+、Fe(C6H5O) 等有色离子。
若“透明”,则溶液不形成混浊或沉淀(与溶液有无颜色无关)。如Ag+与Cl-、Br-、I-、SO42-;Ca2+与CO32-、SO32-;Ba2+与CO32-、SO32-、SO42-等在水溶液中会发生反应,有混浊或明显的沉淀生成,它们不能大量共存。
2.二性
指碱性、酸性。
若是酸性溶液,所有弱酸根离子和OH-不能大量共存。
常见的叙述有酸性溶液、PH=1的溶液、能使PH试纸变红的溶液、紫色石蕊试液呈红色的溶液、甲基橙呈红色的溶液、加入镁粉能放出氢气的溶液、c(OH-)=1×10-14mol·L-1的溶液等。
若题目中限定溶液呈酸性,则溶液中有H+存在,其中不能大量含有OH-、弱酸根离子(如CO32-、SO32-、S2-、F-、ClO-、CH3COO-、C6H5O-、PO43-、AlO2-、SiO32-等)以及弱酸的酸式根离子(如HCO3-、HSO3-、HS-、HPO42-、H2PO4-等)。在中学化学中不能在酸性溶液中共存的离子有:OH-、AlO2-、CO32-、HCO3-、SiO32-、SO32-、HSO3-、S2O32-、S2-、HS-、ClO-、F-、PO43-、H2PO4-、
C6H5O-、CH3COO-、-OOC-COO-、C6H5COO-、CH3CH2O-、SCN-、H2N-CH2-COO-等;若是碱性溶液,则所有弱碱阳离子及H+均不能大量共存。
在中学化学中不能在碱性溶液中大量共存的是:H+、Fe2+、Fe3+、Cu2+、Ag+、Zn2+、Mg2+、Al3+、NH4+、HCO3-、HPO42-、H2PO4-、HSO3-、HS-、HOOC- COO-等。
“酸性或碱性”条件型
常见的叙述有能使Al反应放出H2的溶液、水电离出的c(H+)或c(OH-)<1×10-7 mol·L-1的溶液等。
若题目中出现这样的条件,则溶液中可能有H+存在,也可能有OH-存在,分析时要注意题目要求回答的是一定能大量共存(满足无论是与H+还是与OH-都不会反应)还是可能大量共存(只要满足与H+、OH-中的一种不会反应)。
3.四反应
若离子间能发生下列四种反应中的任一种,则均不能共存。
(1)发生复分解反应
离子相互直接结合生成难溶物(如AgCl、AgBr、BaSO4等)、气体(如NH3、CO2等)或弱电解质(如H2O、HF、H2S等)均不能大量共存于同一溶液中。
①有气体产生。如HCO3-、CO32-、S2-、HS-、SO32-、HSO3-等易挥发性弱酸的酸根离子与H+不能大量共存,因为能发生如下反应:CO32-+2H+=CO2↑+H2O、HCO3-+H+=CO2↑+H2O
②有沉淀生成。如Ba2+、Ca2+、Mg2+等不能与SO42-、CO32-、SO32-、SiO32-、PO43-、HPO42-等大量共存,因为Ba2++CO32-==CaCO3↓、Ca2++SO42-=CaSO4(微溶);Cu2+、Fe3+、Mg2+、Zn2+、Fe2+、Pb2+、Ag+不能与OH-大量共存,是因为Cu2++2OH-=Cu(OH)2↓,Fe3++3OH-==Fe(OH)3↓等。
③有弱电解质生成。如OH-、CH3COO-、PO43-、HPO42-、H2PO4-等与H+不能大量共存,因为OH-+H+ H2O、CH3COO-+H+ CH3COOH,会生成弱电解质;一些酸式弱酸根不能与OH-大量共存,是因为发生了下列反应:HCO3-+OH- CO32-+H2O、HPO42-+OH- PO43-+H2O、NH4++OH- NH3·H2O等。
(2)发生氧化还原反应
若题目中出现因发生氧化还原反应而不能大量共存这样的条件时,要考虑各离子组中是否存在强氧化性和强还原性的离子。如Fe3+与S2-、SO32-、HSO3-、I-;H+与S2O32-; SO32-(H+)与S2-;MnO4-(H+)与Cl-;MnO4-(H+)、NO3-(H+)与Fe2+、S2-、HS-、SO32-、HSO3-、Br-、I-等不能大量共存。两离子相遇若发生氧化还原反应,则不能共存。如Fe3+与S2-、Fe3+与I-、Fe2+与NO3- (H+)等;MnO4-、NO3- (H+)、ClO-(H+)、Cr2O72-与S2-、I-、SO32-、Fe2+不共存;酸性条件下SO32-与S2-不共存。
①具有较强还原性的离子不能与具有较强氧化性的离子大量共存。Fe3+与S2-、SO32-、I-;常见的强氧化剂MnO4-、ClO-、Cr2O72-、NO3-(H+) 分别与常见的还原剂S2-、I-、SO32-、Fe2+等因为发生氧化还原反应而不能大量共存,但Fe3+与Fe2+能大量共存。如I-和Fe3+不能大量共存是由于2I-+2Fe3+=I2+2Fe2+。
②在酸性或碱性的介质中由于发生氧化还原反应而不能大量共存。如NO3-和I-在中性或碱性溶液中可以共存,但在有大量H+存在情况下则不能共存;SO32-和S2-在碱性条件下也可以共存,但在酸性条件下则由于发生2S2-+SO32-+6H+=3S↓+3H2O反应不能共存。
(3)发生双水解反应
弱碱阳离子与弱酸阴离子间因发生双水解反应,故它们不能共存,如Al3+与CO32-、SO32-、HCO3-、HSO3-、HS-、AlO2-不共存;AlO2-与Fe3+、Fe2+、Zn2+、Cu2+、Ag+、NH4+不共存;SiO32-与NH4+不共存。Al3+和HCO3-、CO32-、HSO3-、SO32-、S2-、HS-、AlO2-;Fe3+和HCO3-、CO32-、AlO2- 、HSO3-、SO32-;AlO2-与Fe3+、Cu2+、Zn2+、Ag+、NH4+、Al3+等,因为双水解反应而不能大量共存。
(4)发生络合反应
若离子间发生络合反应生成络离子,则这些离子不能共存。如Fe3+与SCN-不共存;Ag+与NH3·H2O分子不共存;Ag+与CN-不共存。中学化学中还应注意少数离子可形成络离子而不能大量共存的情况。如Fe3+和SCN-、C6H5O-,除此之外,Fe3+、Fe2+、Cu2+、Ag+可与SCN-、CN-、NH3之间形成络离子。由于发生Fe3++SCN- [Fe(SCN)]2+等络合反应而不能大量共存。
4.三特
离子间在同一溶液中能否大量共存,除上述普遍规律外,还有以下三种特殊情况:
(1)由于水解和电离的相互影响而不能大量共存。AlO2-与HCO3-虽然均属于弱酸根离子,水溶液因水解呈碱性,但H3AlO3的酸性太弱,AlO2-的水解能力太强,含有AlO2-的水溶液中[OH-]较大,能直接与HCO3-作用生成Al(OH)3沉淀和CO32-。故AlO2-与HCO3-不能共存于同一溶液中。
与其类似的还有AlO2-与HSO3-、HS-、H2PO4-、HPO42-等。
(2)具有氧化性的某些含氧酸根离子(如NO3-)若不是在酸性溶液中,则能与某些还原性较强的离子(如S2-、I-、Fe2+等)共存。因为这些含氧酸根离子只有在酸性条件下才能表现出强氧化性。又如:MnO4-在碱性条件下能氧化SO32-、S2O32-、S2-、I-,但不能氧化Cl-、Br-;在酸性条件下,MnO4-的氧化性很强,常温下就能氧化Cl-、Br-。
(3)水解能力弱的弱碱阳离子与弱酸根离子(如Mg2+与HCO3-、Mg2+与HSO3-等),可以不考虑它们之间的双水解,能共存于同一溶液中。
二、常见题型
例1. 某无色透明的溶液中,下列各组离子能大量共存的是( )
A.H+、Cl-、Ba2+、CO32-
B.Ag+、I-、K+、NO3-
C.K+、OH-、Cl-、Na+
D.Fe3+、Cl-、NO3-、Na+
解析: 正确选项应满足无色透明、能大量共存两个条件。答案为C项。
例2.(20##年全国高考理综试题?河南等省卷)在pH=1的溶液中,可以大量共存的离子是( )
A.K+、Na+、SO42-、S2O32-
B.NH4+、Mg2+、SO42-、Cl-
C.Na+、K+、HCO3-、Cl-
D.K+、Na+、AlO2-、NO3-
解析: 正确选项应满足pH=1(有H+存在)、可以大量共存两个条件。答案为B项。
例3.(20##年江苏高考化学试题)某溶液既能溶解AI(OH)3,又能溶解H2SiO3,在该溶液中可以大量共存的离子组是( )
A.K+、Na+、HCO3-、NO3-
B.Na+、SO42-、Cl-、ClO-
C.H+、Mg2+、SO42-、NO3-
D.Ag+、K+、NO3- 、Na+
解析: 正确选项应满足溶液既能溶解AI(OH)3又能溶解H2SiO3 (有OH-存在)、可以大量共存两个条件,只有B项符合题意。
例4.(20##年广东高考化学试题)若溶液中由水电离产生的c(OH-)=1×10-14 mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是( )
A.Al3+、Na+、NO3-、Cl-
B.K+、Na+、Cl-、NO3-
C.K+、Na+、Cl-、AlO2-
D.K+、NH4+、SO42-、NO3-
解析: 由水电离产生的c(OH-)=1×10-14 mol·L-1,可知水的电离受到抑制。 酸、碱均会抑制水的电离,使水的电离程度减小,则题目所给的溶液为酸性(含有H+)或碱性(含有OH-)溶液。正确选项应满足在酸性或碱性都能大量共存的条件,只有B项符合题意。
例5.(20##年上海高考化学试题)下列离子在溶液中因发生氧化还原反应而不能大量共存的是( )
A.H3O+、NO3-、Fe2+、Na+
B.Ag+、NO3-、Cl-、K+
C.K+、Ba2+、OH-、SO42-
D.Cu2+、NH4+、Br-、OH-
例6、下列各组离子在水溶液中能大量共存的是(AC)
(A)K+ HCO3— CO32— Br— (B)CO32— HCO3— OH— K+
(C)Fe3+ Cu2+ NO3- SO42- (D)H+ Cl- Na+ SO32-
解析:分析所给选项B中:HCO3—+ OH—= CO32—+H2O;而D中:2H+ + SO32-= H2SO3
[题型2]在无色透明的溶液中离子间能够大量共存。
例7、下列各组离子中,在碱性溶液里能大量共存,并且溶液为无色透明的是(BD)
(A)K+ MnO4- Cl- SO42- (B)Na+ AlO2- NO3- CO32-
(C)Na+ H+ NO3- SO42- (D)Na+ SO42- S2- Cl-
解析:分析所给四个选项A中MnO4- 有颜色不合题意,C中H+ 也不合题材意。
[题型3]在强酸或强碱性溶液中均不能大量共存。
例8、(20##年江苏高考题)若溶液中由水电离产生的C(OH-)=1×10-14 mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是(B)
(A) Al3+ Na+ NO3- Cl- (B) K+ Na+ Cl- NO3-
(C) K+ Na+ Cl- AlO2- (D) K+ NH4+ SO42- NO3-
解析:由题意水的电离被抑制,说明水溶液可能呈强酸性或强碱性。A项中Al3+D项中NH4+在碱性溶液中不能存在;C项中AlO2-在酸性溶液中不能存在。
例9、某无色透明溶液,跟金属铝反应放出H2 ,试判断下列离子:Mg2+、Cu2+、 Ba2+ 、H+、Ag+、 SO42- 、 SO32-、HCO3- 、OH-、NO3- ,何者能存在于此溶液中?
当生成Al3+时,可能存在__________;
当生成AlO2-时,可能存在__________。
解析: (1)说明溶液呈酸性:一则有H+ ,二必有SO42- ,三可能有Mg2+ (注意无NO3- );(2)说明溶液呈碱性:一则有OH- ,二必有Ba2+ ,三可能有NO3- 。
解题回顾:一是审题中注意溶液是无色的,二是注意H+、NO3-与Al作用不产生H2。
[题型4]:离子间因发生氧化还原反应而不能大量共存。
例10(20##年上海市高考题)下列离子在溶液中因发生氧化还原反应而不能大量共存的是(A)
(A)H3O+、 NO3- 、 Fe2+ 、 Na+ (B)Ag+、 NO3- 、Cl-、 K+
(C)K+ 、Ba2+、OH-、 SO42- (D)Cu2+、NH4+、Br-、OH-
解析:所给四个选项中各组离子均不能大量共存,只有A中的 H3O+ 、NO3- 、Fe2+三种离子因发生氧化还原反应符合题意。
点拨:抓住不能共存的条件——发生氧化还原反应。
强强反应规律及中学常见强氧化剂、强还原剂的识记,是解决氧化还原应用问题(特别是隐含氧化还原反应问题)的关键,例如检验SO42-时不能用硝酸酸化,就是因为HNO3会使SO32-氧化为SO42- ,而干扰检验。
[题型5]在特殊条件下能够大量共存。
例11、下列各组离子中,在碱性溶液中共存,且加入盐酸过程中会产生气体和沉淀的是(C)
(A)Na+ NO3- AlO2- SO42- (B)Na+ NO3- SiO32- K+
(C)K+ Cl- AlO2- CO32- (D)Na+ Cl- HCO3- Ca2+
解析:分析所给四个选项:D中HCO3-不能在碱性溶液中大量存在,A和B中加入盐酸后无气体产生也不合题意。
例12、在含有I-且能使酚酞变红的无色溶液中,可大量存在的离子组是( D )
A.Na+、Cu2+、Br-、Cl- B.AlO2-、K+、NH4+、Na+
C.K+、Na+、NO3-、H+ D.K+、S2-、SO42-、OH-
解析:首先理解附加条件:I-不能在强氧化性溶液中存在,使酚酞变红的溶液为碱性,溶液为无色,有色离子不存在。逐一省视各选项:选项A 中Cu2+为蓝色且在碱性溶液中不共存。选项B中NH4+在碱性溶液中不共存。选项C中溶液具有强氧化性,I-不能共存。
解析: 正确选项应满足发生氧化还原反应、不能大量共存两个条件。A项中H3O+(H+)、NO3-、Fe2+能发生氧化还原反应,故答案为A项。 。
三、跟踪训练
1.(20##年天津高考理综试题)下列各组离子在溶液中能大量共存的是( )
A.酸性溶液 Na+、K+、MnO4-、Br-
B.酸性溶液 Fe3+、NH4+、SCN-、NO3-
C.碱性溶液 Na+、K+、AlO2-、SO42-
D.碱性溶液 Ba2+、Na+、CO32-、Cl-
2.(20##年广东高考化学试题)下列各组离子一定能大量共存的是( )
A.在含大量Fe3+的溶液中
NH4+、Na+、Cl-、SCN-
B.在强碱性溶液中
Na+、K+、AlO2-、CO32-
C.在c(H+)=10-13 mol·L-1的溶液中
NH4+、Al3+、SO42- 、NO3-
D.在PH=1的溶液中
K+、Fe2+、Cl-、NO3-
3.(20##年全国高考理综试题?甘肃等省区卷)在某溶液中酚酞呈粉红色。下列离子在该溶液中不能大量存在的是( )
A.K+ B.Na+ C.Ba2+ D.Al3+
4.(20##年江苏高考化学试题)巳知某溶液中存在较多的H+、SO42-、NO3-,则该溶液中还可能大量存在的离子组是( )
A.Al3+、CH3C00-、Cl-
B.Mg2+、Ba2+、Br-
C.Mg2+、Cl-、I-
D.Na+、NH4+、Cl-
5.(20##年全国高考理综试题?河南等省区卷)在pH=l含Ba2+离子的溶液中,还能大量存在的离子是( )
A.AIO2- B.CIO- C.CI- D.SO42-
6.(20##年上海高考化学试题)在pH=1的无色溶液中能大量共存的离子组是( )
A.NH4+、Mg2+、SO42-、Cl-
B.Ba2+、K+、OH-、NO3-
C.Al3+、Cu2+、SO42-、Cl-
D.Na+、Ca2+、Cl-、AlO2-
7.(20##年全国高考化学试题)下列各组离子,在强碱性溶液中可以大量共存的是( )
A.I-、AlO2-、Cl-、S2-
B.Na+、K+、NH4+、Ba2+
C.Br-、S2-、Cl-、CO32-
D.SO32-、NO3-、SO42-、HCO3-
8.(1999年全国高考化学试题)下列各组离于在溶液中既可以大量共存,且加入氨水后也不产生沉淀的是( )
A.Na+ 、Ba2+ 、Cl- 、SO42-
B.K+ 、AlO2- 、NO3- 、OH-
C.H+ 、NH4+ 、Al3+ 、SO42-
D.H+ 、Cl- 、CH3COO- 、NO3-
9.某无色透明的溶液中含有Mg2+、Al3+、Ba2+、H+、Ag+、SO42-、HCO3-、OH-、NO3-中的三种离子,若向其中加入铝粉,反应后生成AlO2-,则原溶液中可能存在的离子是( )
A.Ba2+、OH-、NO3-
B.Ag+、HCO3-、NO3-
C.Mg2+、Al3+、SO42-
D.Mg2+、SO42-、OH-
10.下列各组离子在指定的环境下一定能大量共存的是( )
A.PH=7的溶液
Al3+、K+、SO42-、HCO3-
B.由水电离出的c(H+)=1×10-12 mol·L-1的溶液
Fe2+、ClO-、Na+、SO42-
C.加入镁粉释放出氢气的溶液
SO32-、AlO2-、I-、NO3-
D.使红色石蕊试纸变蓝的溶液
SO32-、CO32-、Na+、K+
11.某溶液中含有大量Fe2+、Fe3+、Mg2+和NH4+,其c(H+)=1×10-2 mol·L-1,在该溶液中可以大量存在的阴离子是 ( )
A.SO42- B.NO3- C.SCN- D.CO32-
12.若某溶液跟甲基橙作用呈红色,则下列离子在该溶液中浓度不可能很大的是( )
A.SO42- B.S2- C.NO3- D.Cl-
13.若在加入铝粉能放出氢气的溶液中,分别加入下列各组离子,一定能大量共存的是( )
A.NH4+、NO3-、CO32-、Na+
B.Ba2+、Mg2+、HCO3-、AlO2-
C.NO3-、Ca2+、K+、Cl-
D.NO3-、K+、AlO2-、OH-
14.下列各组离子中,在碱性溶液中共存,且在加入盐酸过程中会产生气体和沉淀的是( )
A.Na+、NO3-、AlO2-、SO42-
B. Na+、NO3-、SiO32-、K+
C.K+ 、Cl-、AlO2-、 CO32-
D. Na+、Cl-、 、Ca2+
、Ca2+
1.C2.B 3.D 4.D 5.C 6.A 7.A C 8.B 9.A 10.D 11.A 12.B 13.C 14.C
1.(2003·江苏)若溶液中由水电离产生的 =1×10—14mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是( B )
=1×10—14mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是( B )
A. Al3+ 、Na+ 、NO3-、Cl- B. K+ 、Na+、Cl-、NO3-
C. K+ 、Na+ 、Cl-、AlO2- D. K+ 、NH4+、SO32-、NO3-
2.(20##年江苏高考化学试题)某溶液既能溶解AI(OH)3,又能溶解H2SiO3,在该溶液中可以大量共存的离子组是( B )
A.K+、Na+、HCO3-、NO3- B.Na+、SO42-、Cl-、ClO-
C.H+、Mg2+、SO42-、NO3- D.Ag+、K+、NO3- 、Na+
3、下列各组离子在溶液中不能大量共存,且加入过量NaOH溶液或过量稀盐酸均能得到澄清溶液的是 (BD)
A. Fe3+、CI-、Na+、SO42- B. AI3+、Na+、CO32-、NO3-
C. Ag+、Na+、SO42-、NO3- D. AIO2-、CO32-、K+、Na+
4.某能使石蕊试液变红的溶液中,能大量存在的离子是( A )
A.Al3+ NH4+ SO42- CI- B.Na+ Mg2+ HCO3- NO3-
C.K+ Na+ AlO2- Cl- D.Fe2+ K+ NO3- Cl-
5.在pH=0的无色透明溶液中,因发生氧化还原反应而不能大量共存的离子组是( BD )
A.Na+、K+、MnO4—、Cl— B.Cl—、S2O32—、K+、Na+
C.Na+、Cl—、CH3COO—、K+ D.K+、I—、Na+、ClO—
6.常温下测得某无色溶液中由水电离出的H+浓度为1×10—13mol/L,又知该溶液中还有NO-3,Na+,Cl-,那么该溶液中还一定存在的离子是 ( D )
A.AlO2—、ClO— B.Mg2+、、SO42— C.Fe2+ 、Cu2+ D.Ba2+、K+
7、下列各组离子中,在碱性溶液中共存,且加入盐酸过程中会产生气体和沉淀的是(C)
(A)Na+ NO3- AlO2- SO42- (B)Na+ NO3- SiO32- K+
(C)K+ Cl- AlO2- CO32- (D)Na+ Cl- HCO3- Ca2+
8.某溶液滴入甲基橙显红色,在这种溶液中能大量共存的离子是( A )
A.Mg2+、K+、Br-、SO42— B.S2O32—、Na+、H+、Cl-
C.Ca2+、K+、ClO-、I- D.Al3+、K+、AlO3—、Cl-
9.在加入少量Al(OH)3能溶解的溶液中,加入下列各组离子,有可能在溶液中大量共存的是( BD )
A.NH4—、Na+、HCO3—、ClO- B.K+、ClO4—、NO3—、SO42—
C.Ca2+、Fe2+、Cl-、NO3— D.Na+、AlO2-、SO32—、S2-
10.在pH=0的溶液中,下列各组中的离子因发生氧化还原反应而不能大量共存的是(CD)
A.Ag+、Ca2+、NO3—、HCO3— B.SO32—、SO42—、Na+、Mg2+
C.Fe2+、K+、NO3—、Cl- D.K+、S2O32—、SO42—、Na+
11.某无色透明溶液中,由水电离出来的c(H+)=1×10-13 mol·L-1,在该溶液中一定能够大量共存的离子组是(B)
A.K+、Na+、MnO4—、NO3— B.K+、Na+、Cl-、NO3—
C.NH4+、AlO2-、Na+、CH3COO- D.Fe3+、S2-、Al3+、HCO3—
12.下列各离子组的叙述正确的是(BC)
A.在强酸性条件下Na+、I+、K+、可以大量共存
B.在强碱性条件下K+、AlO2-、Na+、S2-、NO3—可以大量共存
C.在水溶液中H+、NH4+、SiO32—、Cl-不能大量共存
D.在强酸性条件下NH4+、K+、SO32—、S2-可以大量共存
13.对下列各组离子的叙述不正确的是(BC)
A.H+、AlO2—、Ba2+、HCO3—不能在水中大量共存
B.Mg2+、NH4+、Fe2+、NO3—能在酸性溶液中大量共存
C.Fe3+、K+、SCN-、Cl-能大量共存且使溶液显红色
D.Na+、NO3—、CO32—、AlO2—能在碱性溶液中大量共存
14.下列各组离子的无色溶液可能跟镁粉反应,又能大量共存的是(AD)
A.K+、Cl-、SO42—、NH4+ B.Ca2+、Cl-、MnO4—、Na+
C.AlO2—、Na+、Al3+、I- D.H+、Cl-、Ba2+、NO3—
15.下列各组离子能大量共存于同一溶液中,且加入过量NaOH溶液或少量稀硫酸时,都能产生白色沉淀的是(C)
A.Ba2+、Mg2+、NO3—、CO32— B.Na+、Al3+、Cl-、AlO2—
C.K+、Ba2+、Cl-、HCO3— D.NH4+、Ba2+、Fe3+、Cl-
16.对于某酸性溶液(可能含有Br –、SO42 –、H2SO3、NH4+),分别进行如下实验: ①加热时放出的气体可使品红溶液褪色;②加入碱溶液使溶液呈碱性,再加热时放出的气体可使湿润的红色石蕊试纸变蓝;③加入氯水时,溶液略呈橙红色,再加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀。对于下列物质不能确定其在原溶液中是否存在的是( B)
A.Br – B.SO42– C.H2SO3 D.NH4+
17.某溶液中可能存在Br-、CO 、SO
、SO 、Al3+、I-、Mg2+、Na+等7种离子中的几种。现取该溶液进行实验,得到如下实验现象:①向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。据此推断,该溶液中肯定不存在的离子是( A )
、Al3+、I-、Mg2+、Na+等7种离子中的几种。现取该溶液进行实验,得到如下实验现象:①向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。据此推断,该溶液中肯定不存在的离子是( A )
A.Al3+、Mg2+、I-、SO B.Mg2+、Na+、CO
B.Mg2+、Na+、CO 、I-
、I-
C.Al3+、Na+、SO 、I- D.Al3+、CO
、I- D.Al3+、CO 、Br-、SO
、Br-、SO
18、在能使PH试纸变红的溶液中,下列离子因发生了氧化还原反应而不能大量共存的是(A)
① Ag+ Na+ Al3+ Cl— ② Na+ Fe2+ Cl— NO3—
③K+ Mg2+ S2— SO42— ④K+ H+ SO42— SO32—
⑤Na+ NO3— SO42— I—
(A)②⑤ (B)①②④ (C)②③⑤ (D)全部
19.三国时代,诸葛亮领兵南征孟获,遇到了“哑泉”,士兵饮后致哑,腹痛,甚至死亡。又有一“安乐泉”,饮后可解“哑泉”之毒。1995年10月国内某报刊报道,经科研人员研究,“哑泉”水中溶有CuSO4,“安乐泉”水质偏碱性。下列有关说法符合题意的是(A)
①“哑泉”之毒是由于水中的Cu2+使人体中的蛋白质变性
②“哑泉”之毒是由于水中的SO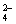 使人体中的蛋白质变性
使人体中的蛋白质变性
③“哑泉”之毒是由于水中的Cu2+水解显酸性使人体中的蛋白质变性
④“安乐泉”能解“哑泉”之毒的离子方程式为Cu2++ 2OH-=Cu(OH)2↓
A.①④ B.②④ C.③ D.均不正确
20、有一无色透明溶液,欲确定是否含有下列离子:K+、Mg2+、Al3+、Fe2+、Ba2+、NO3-、SO42-、Cl-、I-、HCO3-,取该溶液的实验如下,由此判断:

(1)溶液中一定存在的离子是NO3-、SO42- Mg2+、Al3+;溶液中肯定不存在的离子是:Fe2+、HCO3-、I-、Ba2+;
(2)为进一步确定其它离子,应该补充的实验及对应欲检验离子的名称(如为溶液反应,说明使用试剂的名称。不必写详细步骤)K+的检验可以用焰色反应;Cl-的检验:往溶液中加足量的硝酸钡溶液,过滤后,相滤液中加硝酸银溶液,再加稀硝酸,白色沉淀不溶解。
1.某溶液中含有大量Fe2+、Fe3+、Mg2+和 ,其c(H+)=10-2mol·L-1,在该溶液中可以大量存在的阴离子是 ( A )
,其c(H+)=10-2mol·L-1,在该溶液中可以大量存在的阴离子是 ( A )
A .  B.
B.  C. SCN- D.
C. SCN- D. 
2.若某溶液跟甲基橙作用呈红色,则下列离子在该溶液中浓度不可能很大的是( BC )
A. B. S2- C.
B. S2- C.  D. Cl-
D. Cl-
3.在pH=1的含有Mg2+、Fe2+、Al3+三种阳离子的溶液中,可能存在的阴离子是( D )
① Cl- ②  ③
③  ④ S2-
④ S2-
A. ①② B. ②③ C. ③④ D. ①③
4.在强酸性溶液里能大量共存,且溶液为无色透明的离子组是 ( A )
A.  、Al3+、
、Al3+、 、
、 B. K+、Na+、
B. K+、Na+、 、
、
C. K+、 、
、 、
、 D. Na+、K+、
D. Na+、K+、 、
、
5.下列各组离子中,在碱性溶液里能大量共存,且溶液为无色透明的是 ( BC )
A. K+、 、Cl-、
、Cl-、 B. Na+、
B. Na+、 、
、 、
、
C. Na+、H+、 、
、 D. Na+、
D. Na+、 、S2-、Cl-
、S2-、Cl-
6.在某无色透明的酸性溶液中,能共存的离子组是 ( B )
A.  、
、 、Al3+、Cl- B. Na+、
、Al3+、Cl- B. Na+、 、K+、
、K+、
C.  、K+、
、K+、 、Na+ D. K+、
、Na+ D. K+、 、
、 、Na+
、Na+
7.若在加入铝粉能放出氢气的溶液中,分别加入下列各组离子,可能共存的是
( CD )
A.  、
、 、
、 、Na+ B. Ba2+、Mg2+、
、Na+ B. Ba2+、Mg2+、 、
、
C.  、Ca2+、K+、Cl- D.
、Ca2+、K+、Cl- D.  、K+、
、K+、 、OH-
、OH-
8.下列各组离子:(1) I-、ClO-、 、H+ (2) K+、
、H+ (2) K+、 、
、 、OH- (3)
、OH- (3)  、
、 、Cl-、OH- (4) Fe3+、Cu2+、
、Cl-、OH- (4) Fe3+、Cu2+、 、Cl- (5) H+、K+、
、Cl- (5) H+、K+、 、
、 (6) Ca2+、Na+、
(6) Ca2+、Na+、 、
、 在水溶液中能大量共存的是 ( B )
在水溶液中能大量共存的是 ( B )
A. (1)和(6) B. (3)和(4) C. (2)和(5) D. (1)和(4)
9.将20mL 0.4mol/L硝酸铵溶液跟50 mL 0.1mol / L氢氧化钡溶液混合,则混合溶液中各离子浓度的大小顺序是 ( B )
A. c( )>c(OH-)>c(
)>c(OH-)>c( )>c(Ba2+) B. c(
)>c(Ba2+) B. c( )>c(Ba2+)>c(OH-)>c(
)>c(Ba2+)>c(OH-)>c( )
)
C. c(Ba2+)>c( )>c(OH-)>c(
)>c(OH-)>c( ) D. c(
) D. c( )>c(Ba2+)>c(
)>c(Ba2+)>c( )>c(OH-)
)>c(OH-)
10.在pH=1的溶液中,可以大量共存的离子组是 ( B )
A. Na+、K+、S2-、Cl- B. Al3+、Mg2+、 、Cl-
、Cl-
C. K+、Na+、 、
、 D. K+、Na+、
D. K+、Na+、 、
、
11.在pH = 1的无色透明溶液中不能大量共存的离子组是 ( AC )
A. Al3+、Ag+、 、Cl- B. Mg2+、
、Cl- B. Mg2+、 、
、 、Cl-
、Cl-
C. Ba2+、K+、S2-、Cl- D. Zn2+、Na+、 、
、
12.下列各组离子中,在碱性溶液中共存,且在加入盐酸过程中会产生气体和沉淀的是
( C )
A. Na+、 、
、 、
、 B. Na+、
B. Na+、 、
、 、K+
、K+
C. K+、Cl-、 、
、 D. Na+、Cl-、
D. Na+、Cl-、 、Ca2+
、Ca2+
13.下列各组离子,在强碱性溶液中可以大量共存的是 ( B )
A. K+、Na+、 、Cl- B. Na+、Ba2+、
、Cl- B. Na+、Ba2+、 、
、
C.  、K+、Cl-、
、K+、Cl-、 D. K+、Na+、ClO-、S2-
D. K+、Na+、ClO-、S2-
14.下列各组离子,在强碱性溶液中可以大量共存的是 ( AC )
A. I-、 、Cl-、S2- B. Na+、K+、
、Cl-、S2- B. Na+、K+、 、Ba2+
、Ba2+
C. Br-、S2-、Cl-、 D.
D.  、
、 、
、 、
、
15.下列各组离子在水溶液中能大量共存的是 ( C )
A. Na+ 、HS-、Cu2+ 、Cl- B. HS- 、Na+ 、OH- 、K+
C. K+ 、 、Br- 、
、Br- 、 D. H+ 、Cl- 、Na+ 、
D. H+ 、Cl- 、Na+ 、
16.下列各组离子在溶液中既可以大量共存,且加入氨水后也不产生沉淀的是 ( B )
A. Na+、Ba2+、Cl-、 B. K+、
B. K+、 、
、 、OH-
、OH-
C. H+、 、Al3+、
、Al3+、 D. H+、Cl-、CH3COO-、
D. H+、Cl-、CH3COO-、
17.下列各组离子在溶液中能大量共存的是 ( A )
A. Ca2+、 、C1-、K+ B. AI3+、
、C1-、K+ B. AI3+、 、
、 、Na+
、Na+
C. Fe2+、 、
、 、S2- D. Fe3+、SCN-、Na+、
、S2- D. Fe3+、SCN-、Na+、
18.下列离子在溶液中因发生氧化还原反应而不能大量共存的是 ( A )
A. H3O+、 、Fe2+、Na+ B. Ag+、
、Fe2+、Na+ B. Ag+、 、Cl-、K+
、Cl-、K+
C. K+、Ba2+、OH-、 D. Cu2+、
D. Cu2+、 、Br-、OH-
、Br-、OH-
19.下列各组离子在溶液中既可以大量共存,且加入氨水后也不产生沉淀的是 ( C )
A.Na+、Ba2+、Cl-、 B.H+、
B.H+、 、Al3+、
、Al3+、
C.K+、 、
、 、OH- D.H+、Cl-、CH3COO-、
、OH- D.H+、Cl-、CH3COO-、
20.下列各组离子,在强碱性溶液中可以大量共存的是 ( AC )
A. I-、 、Cl-、 S2- B. Na+、K+、NH4+、Ba2+
、Cl-、 S2- B. Na+、K+、NH4+、Ba2+
C. Br-、S2-、Cl-、 D.
D.  、
、 、
、 -、
-、 -
-
21.在pH=1的无色溶液中能大量共存的离子组是 ( A )
A.  、Mg2+、
、Mg2+、 、Cl- B. Ba2+、K+、OH-、
、Cl- B. Ba2+、K+、OH-、
C. Al3+、Cu2+、 、Cl- D. Na+、Ca2+、Cl-、
、Cl- D. Na+、Ca2+、Cl-、
22.在强酸溶液中,下列各组离子能够大量共存的是 ( C )
A. Mg2+、Ca2+、 、Cl- B. Na、
、Cl- B. Na、 、Cl-、
、Cl-、
C. K+、Fe3+、 、Br- D. Fe2+、Ca2+、Cl-、
、Br- D. Fe2+、Ca2+、Cl-、
24.若溶液中由水电离产生的c(OH-)=1×10-14mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是 ( B )
A. Al3+、Na+、 、Cl- B. K+、Na+、Cl-、
、Cl- B. K+、Na+、Cl-、
C. K+、Na+、Cl-、 D. K+、
D. K+、 、
、 、
、
25、在强酸溶液中,下列各组离子能够大量共存的是 ( C )
A. Mg2+、Ca2+、 、CI- B. Na+、
、CI- B. Na+、 、CI-、
、CI-、
C. K+、Fe2+、 、Br- D. Fe2+、Ca2+、CI-、
、Br- D. Fe2+、Ca2+、CI-、
26.重金属离子有毒性。实验室有甲、乙两种废液,均有一定毒性。甲废液经化验呈碱性,主要有毒离子为Ba2+,如将甲、乙两废液按一定比例混合,毒性明显降低。乙废液中可能含有的离子是 ( A )
A. Cu2+和 B. Cu2+和Cl- C. K+和
B. Cu2+和Cl- C. K+和 D. Ag+和
D. Ag+和
27.对某酸性溶液(可能含有Br-, ,H2SO3,
,H2SO3, )分别进行如下实验:
)分别进行如下实验:
① 加热时放出的气体可以使品红溶液褪色;② 加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;
③ 加入氯水时,溶液略显黄色,再加入BaCl2溶液时,产生的白色沉淀不溶于稀硝酸。
对于下列物质不能确认其在溶液中是否存在的是 ( B )
A. Br- B.  C. H2SO3 D.
C. H2SO3 D. 
