金太阳新课标资源网
2009—20xx年高考化学试题分类解析—离子共存 离子反应 20xx年高考
1.(2011江苏高考4)常温下,下列各组离子在指定溶液中一定能大量共存的是
A.1.0 mol·L-1的KNO3溶液:H+、Fe2+、Cl-、SO42-
B.甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl-
C.pH=12的溶液:K+、Na+、CH3COO-、Br-
D.与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3-
解析:本题以溶液中离子共存的方式考查学生对硝酸的氧化性、亚铁离子还原性、甲基橙呈红色水溶液的呈酸性、酸性溶液AlO2-不能在其中共存、与铝反应产生大量氢气有强酸碱性两种可能等相关知识的理解程度,考查学生综合运用所学化学知识解决相关化学问题的能力。
答案:C
2.(2011安徽高考8)室温下,下列各组离子在指定溶液中能大量共存的是
A.饱和氯水中 Cl-、NO3-、Na+、SO32-
B.c(H+)=1.0×10-13mol/L溶液中 C6H5O-、K+、SO42-、Br-
C.Na2S溶液中 SO42-、 K+、Cl-、Cu2+
D.pH=12的溶液中 NO3-、I-、Na+、Al3+
解析:饱和氯水具有强氧化性,能将SO32-氧化成SO42-,A中不能大量共存;c(H+)=1.0×10-13mol/L溶液,说明该溶液显碱性,因此可以大量共存;S2-和Cu2+可以结合生成难溶性CuS沉淀,所以不能大量共存;pH=12的溶液,说明该溶液显碱性,而Al3+与碱不能大量共存。所以正确的答案是B。
答案:B
3. (2011广东高考8)能在水溶液中大量共存的一组离子是
A. H+、I―、NO3―、SiO32- B. Ag+、Fe3+、Cl―、SO42―
C.K+、SO42-、Cu2+、NO3― D.NH4+、OH-、Cl-、HCO3-
解析:本题考察离子共存问题。SiO32-属于弱酸硅酸的酸根与酸不能大量共存,同时在酸性溶液中,NO3―具有氧化性能氧化I―生成单质碘,A不正确;Ag+与Cl―和SO42―均可生成难溶性物质AgCl和Ag2SO4,B不正确;在碱性溶液中NH4+和HCO3-均与OH-结合分别形成氨水和CO32-,因此D也不正确,所以答案是C。
答案:C
4.(2011全国II卷11)将足量CO2通入下列各溶液中,所含离子还能大量共存的是
A.K+、SiO32-、Cl-、NO3- B.H+、NH4+、Al3+、SO42-
C.Na+、S2-、OH-、SO42- D.Na+、C6H5O-、CH3COO-、HCO3- 解析:SiO32-与CO2反应;OH-与CO2反应;C6H5O-与CO2反应。
答案:B
5.(2011四川)甲、乙、丙、丁四种易溶于水的物质,分别由NH4+、Ba2+、Mg2+、H+、OH-、Cl-、HCO3-、SO42-中的不同阳离子和阴离子各一种组成。已知:①将甲溶液分别与其它三种物质的溶液混合,均有白色沉淀生成;② 0.1mol/L乙溶液中c(H+)>0.1mol/L;③ 向丙溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成。下列结论不正确的是
A. 甲溶液含有Ba2+ B. 乙溶液含有SO42-
C丙溶液含有Cl- D.丁溶液哈有Mg2+
第 1 页 共 19 页 金太阳新课标资源网
金太阳新课标资源网
解析:可以形成白色沉淀的只有BaSO4、BaCO3、Mg(OH)2,因此甲只能是Ba(OH)2;0.1mol/L乙溶液中c(H+)>0.1mol/L,什么乙是硫酸;向丙溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成,说明丙是MgCl2,所以丁是NH4HCO3。
答案:D
6.(2011上海)某溶液中可能含有Na+、NH4+、Ba2+、SO42-、I-、S2-。分别取样:①用pH计测试,溶液显弱酸性;②加氯水和淀粉无明显现象。为确定该溶液的组成,还需检验的离子是
A. Na+ B.SO42- C. Ba2+ D.NH4+
解析:溶液显弱酸性,说明有NH4+(水解显酸性);加氯水和淀粉无明显现象排除I-、S2-。所以必需含有SO42-,故不能有Ba2+。Na+无法排除。
答案:A
7.(2011江苏高考6)下列表示对应化学反应的离子方程式正确的是
A.FeCl3溶液与Cu的反应:Cu+Fe3+=Cu2++Fe2+
B.NO2与水的反应:3NO2+H2O=2NO3-+NO+2H+
C.醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+=Ca2++H2O+CO2↑
D.向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
解析:本题是基本概念中离子方程式判断正误的考查,选题以元素化合物基础和生活内容为背景。
A.电荷不守恒,离子方程式要注意三守恒(元素、电子、电荷)等。正确的方程式是:Cu+2Fe3+=Cu2++2Fe2+;
B.NO2与水的反应生成硝酸和NO,仅硝酸可折成离子。
C.用食醋除去水瓶中的水垢涉及到弱电解质及难溶物质的书写,碳酸钙、醋酸均不能拆成离子,内容来源于必修二的课本内容。正确的方程式是:CaCO3+2CH3COOH=2CH3COO-+Ca2++H2O+CO2↑;
D.向NaAlO2溶液中通入过量CO2的产物是Al(OH)3↓+HCO3-,本选项对部分学生有难度,但在单项选择题可以用排除法解决。正确的方程式是:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-。
答案:B
8.(2011北京高考9)下列与处理方法对应的反应方程式不正确的是
A.用Na2S去除废水中的Hg2+:Hg2++S2-=HgS↓
催化剂
B.用催化法处理汽车尾气中的CO和NO:CO+NOC+NO2
C.向污水中投放明矾,生成能凝聚悬浮物的胶体:Al3++3H2OAl(OH)3(胶体)+3H+
D.用高温催化氧化法去除烃类废气(CxHy

):
解析:S2-和Hg2+易结合形成难溶性物质,A正确;NO的氧化性强于CO,反应的方程式为
催化剂
2CO+2NON2+2CO2,因此B不正确;明矾在溶液中电离出的Al3+水解生成
的氢氧化铝胶体能吸附水中的悬浮物,C正确;碳、氢化合物在高温下可被氧气氧化生成二第 2 页 共 19 页 金太阳新课标资源网
金太阳新课标资源网
氧化碳和水,D正确。
答案:B
9.(2011新课标全国)能正确表示下列反应的离子方程式为
A. 硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S?
B. NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O
C. 少量SO2通入苯酚钠溶液中:C6H5O-+SO2+H2O=C6H5OH+HSO3-
D. 大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2?+H2O
解析:硝酸具有氧化性,能氧化FeS,因此产物应该是硝酸铁、硫酸和一氧化氮,A不正确;NH4HCO3溶于过量的NaOH溶液中除了生成碳酸钠外还有氨气生成,方程式为:
NH4++HCO3-+2OH-=CO32-+2H2O+NH3↑,B不正确;SO2不足产物应该是SO32-,C不正确。所以答案是D。
答案:D
10. (2011海南)下列固体混合物与过量的稀H2SO4反应,能产生气泡并有沉淀生产的是
A. NaHCO3和Al(OH)3 B. BaCl2和NaCl
C. KClO3和K2SO4 D. Na2SO3和BaCO3
[答案]D
命题立意:基本化学性质化学反应的考查
解析:根据题中的要求,要产生气泡同时有沉淀生成。A选项无沉淀生成,B选项无气体生成,C选项物质不熟悉可用排除法,D可得到气体和沉淀,符合题目要求。
【技巧点拨】关于物质性质考查的题,通常出现在单选题中。如果选项中有不熟悉的物质,一般用排除法处理,以防解题出错。
11.(2011上海21)在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是
A. Fe2++SO42-+Ba2++2OH-=BaSO4↓+Fe(OH)2↓
B.NH4++Fe3++ 2SO42-+ 2Ba2++ 4OH-=2BaSO4↓+ Fe(OH)3↓+ NH3·H2O
C.2Fe3++ 3SO42-+ 3Ba2++6OH-=3BaSO4↓+ 2Fe(OH)3↓
D.3NH4++ Fe3++3SO42-+ 3Ba2++ 6OH-=3BaSO4↓+Fe(OH)3↓+3NH3·H2O
解析;复盐NH4Fe(SO4)2中Fe的化合价是+3价,因此选项A不正确;又因为NH4Fe(SO4)2还可以形成(NH4)2SO4·Fe2(SO4)3的形式,因此当Ba(OH)2不足时选项C也有可能发生。 答案:BC
20xx年高考
1.(2010全国卷1)能正确表示下列反应的离子方程式是
A.将铜屑加入Fe溶液中:2Fe+Cu=2Fe+Cu
B.将磁性氧化铁溶于盐酸:3+3+2+2+Fe3O4+8H+=3Fe3++4H2O
C.将氯化亚铁溶液和稀硝酸混合:
D.将铁粉加入稀硫酸中:?Fe2++4H++NO3=Fe3?+2H2O+NO?2Fe+6H+=2Fe3??3H2?
【解析】A正确,符合3个守恒;B错误,电荷不守恒,Fe3O4中Fe有两种价态,正确应该为:Fe3O4+8H+=2Fe3++Fe2++4H2O;C错误,得失电子不守恒,电荷不守恒;正第 3 页 共 19 页 金太阳新课标资源网
金太阳新课标资源网
确的应为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;D错误,不符合客观实际,反应后铁只能产生Fe2+和H2;
【答案】A
【命题意图】考查离子方程式的正误判断方法!
【点评】离子方程式正误判断是个老生常谈的问题了,本题出得太没有创意了,如D这是个重现率很高的的经典错误,考生绝对做过原题!B项也见得多,一般考查不是用盐酸而是用氢碘酸,有些专家多次指出,磁性氧化铁不溶于任何酸,这样的典型错误在高考题中再次出现,这道题就没什么意思了!A直接取材于课本第二册,C选项,考生也绝对做过,都是太常见不过了!
(2010全国2)8.能正确表示下列反应的离子方程式是
A.将铜屑加入Fe溶液中:2Fe+Cu=2Fe+Cu
B.将磁性氧化铁溶于盐酸:3+3+2+2+Fe3O4+8H+=3Fe3++4H2O
C.将氯化亚铁溶液和稀硝酸混合:
D.将铁粉加入稀硫酸中:?Fe2++4H++NO3=Fe3?+2H2O+NO?2Fe+6H+=2Fe3??3H2?
【解析】A正确,符合3个守恒;B错误,电荷不守恒,Fe3O4中Fe有两种价态,正确应该为:Fe3O4+8H+=2Fe3++Fe2++4H2O;C错误,得失电子不守恒,电荷不守恒;正确的应为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;D错误,不符合客观实际,反应后铁只能产生Fe2+和H2;
【答案】A
【命题意图】考查离子方程式的正误判断方法!
【点评】离子方程式正误判断是个老生常谈的问题了,本题出得太没有创意了,如D这是个重现率很高的的经典错误,考生绝对做过原题!B项也见得多,一般考查不是用盐酸而是用氢碘酸,有些专家多次指出,磁性氧化铁不溶于任何酸,这样的典型错误在高考题中再次出现,这道题就没什么意思了!A直接取材于课本第二册,C选项,考生也绝对做过,都是太常见不过了!
(2010天津卷)5.下列实验设计及其对应的离子方程式均正确的是
A.用FeCl3溶液腐蚀铜线路板:Cu + 2Fe3+ = Cu2+ + 2Fe2+
B.Na2O2与H2O反应制备O2 :Na2O2 + H2O = 2Na+ + 2OH- + O2↑
C.将氯气溶于水制备次氯酸:Cl2 + H2O = 2H+ + Cl- + ClO-
D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:
2MnO + 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
解析:B中元素不守恒,正确的离子方程式为:2Na2O2+2H2O==4Na++4OH-+O2;C中的HClO是弱酸,不能拆成离子形式;D的离子方程式本身没有问题,但KMnO4的强氧化性能将浓盐酸氧化,不能实现证明H2O2具有还原性的目的(还原性:HCl>H2O2,HCl先反应),D错。
答案:A
命题立意:考查离子方程式的正误判断。
(2010安徽卷)9.在pH=1的溶液中能大量共存的一组离子或分子是
A.Na+、Mg2+、ClO—、NO3— B. Al3+、 NH4+、 Br- 、Cl-
第 4 页 共 19 页 金太阳新课标资源网 ?4
金太阳新课标资源网
C. K+ 、Cr2O72- 、CH3CHO、 SO42- D. Na+、K+ 、SiO32-、Cl-
答案:B
解析:酸性环境下A中生成次氯酸,C中Cr2O72-氧化CH3CHO,D中生成硅酸沉淀。 (2010广东理综卷)7.能在溶液中大量共存的一组离子是
A.NH4+ 、Ag+、PO43-、Cl- B.Fe3+、H+、I-、HCO3-
C.K+、Na+、NO3- 、MnO4- D.Al3+、Mg2+ 、SO42- 、CO32-
解析:A中Ag+和PO43-、Cl-因生成沉淀不共存;B中H+和HCO3-离子生成气体不共存,Fe3+和I-因发生氧化还原反应不共存;D中Al3+和CO32-因互促水解不共存。 答案:C
(2010上海卷)9.下列离子组一定能大量共存的是
A.甲基橙呈黄色的溶液中:I-、Cl-、NO3-、Na+
B.石蕊呈蓝色的溶液中:Na+、AlO2-、NO3-、HCO3-
C.含大量Al3+的溶液中:K+、Na+、NO3-、ClO-
D.含大量OH一的溶液中:CO32-、Cl-、F-、K+
答案:D
解析:此题考查了化学实验中的离子共存知识。使甲基橙呈黄色的溶液pH大于4.4,当其处于4.4-7之间时,NO3-表现强氧化性,将I-氧化为I2,排除A;石蕊呈蓝色的溶液pH大于8,溶液呈碱性,OH-能和HCO3-反应,排除B;含大量Al3+的溶液中,溶液呈酸性,其中的H+能和ClO-结合成HClO,排除C。
知识归纳:在给定条件下,考查离子组能否共存时,要注意其与元素化合物知识、电离平衡知识的联系。特别要注意题干中条件的应用,比如本题中的“甲基橙呈黄色”、“石蕊呈蓝色”、“含大量的Al3+的溶液”等,倘若只分析选项中给出的离子之间能否共存,就会造成错误解答。
(2010上海卷)19.下列反应的离子方程式正确的是
A.苯酚与碳酸钠溶液的反应
B.等体积、等浓度的Ca(HCO3)2溶液和NaOH溶液混合
Ca2??2HCO3??2OH????CaCO3??CO32??2H2O
C.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液
Fe2??2H??H2O2???Fe2??2H2O
D.淀粉碘化钾溶液在空气中变蓝 4I??O2?2H2O???2I2?4OH?
答案:AD
解析:此题考查了离子方程式的正误判断。苯酚是一种具有弱酸性的有机物,故其在离子方程式中应保留化学式,生成的苯酚钠是强电解质,离子方程式正确,A对;等体积等浓度的碳酸氢钙和氢氧化钠溶液混合时,氢氧化钠不足量,离子方程式为:OH-+HCO3-+Ca2+=H2O+CaCO3↓,B错;反应前后的电荷不守恒,C错;空气中的氧气可以氧化I-为I2,其遇淀粉变蓝,D对。
知识归纳:判断离子方程式的正误判时,关键抓住离子方程式是否符合客观事实、化学式的拆分是否准确、是否遵循电荷守恒和质量守恒、氧化还原反应中的得失电子是否守恒等;就能很好的解决问题。
(2010江苏卷)3.下列离子方程式表达正确的是
第 5 页 共 19 页 金太阳新课标资源网
金太阳新课标资源网
?
2Cl+2HO?Cl?+H?+2OH222A.用惰性电极电解熔融氯化钠:
?
通电
B.用氢氧化钠溶液除去铝表面的氧化膜:C.用稀氢氧化钠溶液吸收二氧化氮:D.用食醋除去水瓶中的水垢:
?
Al2O3?2OH??2AlO2?H2O
?
2OH??2NO2?NO3+NO?+H2O
2?
CO3+2CH3COOH?2CH3COO??CO2??H2O
【答案】B
【解析】本题主要考查的是离子方程式的正误判断。A项,电解的是熔融状态的NaCl,不是NaCl溶液,2NaCl2Na + Cl2↑;B项,Al2O3能溶于NaOH溶液,生成偏铝酸盐;C项,NO2与NaOH反应,生成硝酸盐和亚硝酸盐,2OH- + 2NO2 = NO3- + NO2- + H2O;D项,水垢中的主要成分为CaCO3,是难溶物。综上分析可知,本题选B项。 (2010江苏卷)6.常温下,下列各组离子在指定溶液中能大量共存的是 A.pH=1的溶液中
2+?NO3SO4
:Fe、、、Na
?
2?
B.由水电离的C.D.
c?H???1?10?14mol?L?1
的溶液中:
2+??HCO3
的溶液中:Ca、K、Cl、
?
c?H??/c?OH???1012
NH?4
?
3?NO3Cl、Al、、
?
?
c?Fe3???0.1mol?L?1
的溶液中:K、ClO、
?
?
SO24
、SCN
?
【答案】C
【解析】本题主要考查的是离子共存问题。A项,由于H+、NO3-与Fe2+发生氧化还原反应而不能大量共存;B项,抑制了水的电离,溶液中存在大量的H+或OH-,但都不能与HCO3-共存;C项,溶液中的c(H+)=0.1mol/L,能与本组离子共存;D项,Fe3+能与SCN-发生络合反应。综上分析可知,本题选C项。
(2010浙江卷)12. 下列热化学方程式或离子方程式中,正确的是: A.甲烷的标准燃烧热为-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
B. 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:
催化剂
??????2MH3(g)N2(g)?3H2(g)??????
500℃、30MPa
△H=-38.6kJ·mol-1
C. 氯化镁溶液与氨水反应:D. 氧化铝溶于NaOH溶液:
Mg2??2OH??Mg(OH)2?
Al2O3?2OH??3H2O?2Al(OH)
试题解析:
本题考查热化学方程式与离子方程式的书写。A、标准燃烧热的定义,1mol可燃物完全燃烧生成稳定氧化物时方出的热量(标准指298K,1atm)。水液态稳定,方程式系数就是物质的量,
第 6 页 共 19 页 金太阳新课标资源网
金太阳新课标资源网
故A错。B、根据热化学方程式的含义,与
催化剂
??????2MH3(g)N2(g)?3H2(g)??????
500℃、30MPa
对应
的热量是1mol氮气完全反应时的热量,但次反应为可逆反应故,投入0.5mol的氮气,最终
参加反应的氮气一定小于0.5mol。所以△H的值大于38.6。B错。D、氢氧化铝沉淀没有沉淀符号。 本题答案:C 教与学提示:
化学用语的教学是化学学科技术规范,强调准确性,强调正确理解与应用。特别重视热化学方程式的系数与反应热的对应关系。重视离子方程式的拆与不拆的问题。热化学方程式的书写问题由:聚集状态、系数、系数与反应热数值对应、反应热单位、可逆反应的反应热等内容构成。离子方程式的书写问题由:强弱电解质、最简整数比、定组成规律、离子方程式正误判断、守恒、定量离子方程式等内容组成。
(2010四川理综卷)9.下列离子方程式书写正确的是 A.向明矾溶液中加入过量的氢氧化钡溶液:
Al3??2SO42??2Ba2??4OH??2BaSO4??AlO2??2H2O
B.向氢氧化亚铁中加入足量的稀硝酸:
Fe?OH?2?2H??Fe2??2H2O
C.向磷酸二氢铵溶液中加入足量的氢氧化钠溶液:D.向
?NH4?OH??NH3?H2O
CH2BrCOOH
中加入足量的氢氧化钠溶液并加热:
?
CH2BrCOOH?OH????CH2BrCOO??H2O
答案: A
解析:本题考查离子方程式正误判断;氢氧化钡溶液过量,Al3+转化为AlO2-,SO42-完全转化为沉淀,A项正确;硝酸有强氧化性,可将Fe2+氧化为Fe3+,硝酸被还原为NO,B不符合客观事实,错误;在磷酸二氢铵中加入足量的氢氧化钠,磷酸二氢根离子中的氢将被中和,C项错误;
CH2BrCOOH
中存在两种官能团,分别是-Br 和-COOH,加入足量的氢氧
化钠后加热,与-COOH发生中和反应,与-Br发生水解反应,故应该生成CH2OHCOO-,D项错误。
(2010浙江卷)13. 某钠盐溶液中可能含有
?2?NO2、SO4、SO32?、CO32?、Cl?、I?
等阴离
子。某同学取5份此溶液样品,分别进行了如下实验:
①用pH计测得溶液pH大于7 ②加入盐酸,产生有色刺激性气体
③加入硝酸酸化的AgNO3溶液产生白色沉淀,且放出有色刺激性气体
④加足量BaCl2溶液,产生白色沉淀,该沉淀溶于稀硝酸且放出气体,将气体通入品红溶液,溶液不褪色。
⑤加足量BaCl2溶液,产生白色沉淀,在滤液中加入酸化的(NH4)2Fe(SO4)溶液,再滴加KSCN溶液,显红色
该同学最终确定在上述六种离子中公含
?NO2、CO32?、Cl?
三种阴离子。
第 7 页 共 19 页 金太阳新课标资源网
金太阳新课标资源网
请分析,该同学只需要完成上述哪几个实验,即可得出此结论。
A. ①②④⑤ B. ③④ C. ③④⑤ D. ②③⑤
试题解析:
本题是离子组合推断、离子鉴别实验综合题。题型难点是:熟悉各种离子的标准检验方法,明确各种离子检验时的干扰因素。本题的难点还有:采用的出题方式和平时不同。
根据最终的离子分析:NO2-,存在时一定没有SO32-,I-。因NO2-,的氧化性可以使他们氧化。Cl-存在下的NO2-的检验:加入硝酸酸化的AgNO3溶液产生白色沉淀,且放出有色刺激性气体。即证明了NO2-的存在又检验出Cl-的存在。但,仅加入盐酸产生刺激性气体也可能有SO32-的存在。故须先确认SO32-不存在。SO32-,CO32-,SO42-的组合检验可以用:加足量BaCl2溶液,产生白色沉淀,该沉淀溶于稀硝酸且放出气体,将气体通入品红溶液,溶液不褪色。来确认SO32-, SO42-不存在,CO32-一定存在。故选择③④就可以,顺序是先④后③。
本题答案:B
教与学提示:
本题学生存在的困难是NO2-的检验,因为此内容在选修的《实验化学》中,可能会有所忽视。第二个难点是离子要分成两组分别进行检验。教学中碰到有一些学生:只要碰到离子组合检验与推断的题目就死机的现象。分析原因:各种典型离子的检验方式不是很熟练,没有对各种离子单独检验时的干扰因素,干扰离子进行排除。不重视各种相近实验现象进行区别对待,深入研究相近条件下的不同。教学中从单一离子检验开始,增加干扰,增加组合,增加性质区别等逐步复杂化。要多想为什么,多想如何干扰和排除干扰。
(2010全国卷1)28.(15分)有A、B、C、D、E和F六瓶无色溶液,他们都是中学化学中常用的无机试剂。纯E为无色油状液体;B、C、D和F是盐溶液,且他们的阴离子均不同。现进行如下实验:
①A有刺激性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾;
②将A分别加入其它五中溶液中,只有D、F中有沉淀产生;继续加入过量A时,D中沉淀无变化,F中沉淀完全溶解;
③将B分别加入C、D、E、F中,C、D、F中产生沉淀,E中有无色、无味气体逸出; ④将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3,沉淀均不溶。 根据上述实验信息,请回答下列问题:
能确定溶液是(写出溶液标号与相应溶质的化学式):
不能确定的溶液,写出其标号、溶质可能的化学式及进一步鉴别的方法:
【解析】(I)由题干表述可知A和E不是盐,又由纯E为无色油状液体,推知E为硫酸(③步操作进一步确定);(II)由题干和①步操作可知A为氨水; (III)再由②步操作可知F中阳离子为Ag+发生的反应为:Ag++NH3·H2O=AgOH↓+NH4+;AgOH+2NH3·H2O=[Ag(NH3)2]++OH-+2H2O;而常见的盐中只有AgNO3可溶于水,故F为AgNO3;(IV)由③步操作可知B中阴离子应为CO32-,由于此无色无味的气体只能是CO2, B、
C、D中能生成沉淀说明不能是HCO3-,而阳离子可是常见的K+、Na+、NH4+等待定(V)同样由②步操作D中能与氨水生成沉淀的无色溶液中常见的为阳离子为Mg2+或Al3+,而阴离子需待下步反应再确定;(VI)由④步操作生成的沉淀为可能为AgCl、AgBr、AgI、BaSO4、H2SiO3(不合理)等,但限于题干所述中学常用试剂,则沉淀应为AgCl和BaSO4,才不溶于HNO3,一个是与AgNO3结合生成的沉淀,一个是与硫酸结合形成的沉淀,故C应该同时含有Ba2+和Cl-即,C为BaCl2,进而推出D中阴离子应该为SO42-,因为题干所述盐溶液中阴离子均不同,故D为Al2(SO4)3或MgSO4其他解析见答案
【答案】(1)A NH3·H2O或NH3 ;E H2SO4 F AgNO3 C BaCl2
第 8 页 共 19 页 金太阳新课标资源网
金太阳新课标资源网
若C作为不能确定的溶液,进一步鉴别的方法合理,同样给分
(2)B Na2CO3或K2CO3 用洁净的铂丝蘸取少量B,在酒精灯火焰中灼烧,若焰色呈黄色则B为Na2CO3溶液;若透过蓝色钴玻璃观察焰色呈紫色,则B为K2CO3溶液
D Al2(SO4)3或MgSO4 取少量D,向其中滴加NaOH溶液有沉淀生成,继续滴加过量的NaOH溶液,若沉淀溶解,则D为Al2(SO4)3溶液,若沉淀不溶解,则D为MgSO4溶液
【命题意图】考查学生的分析与综合能力,涉及到无机元素及其化合物的性质,离子反应,未知物的推断,物质的检验,常见物质量多与量少的反应不同,现象不同等,此题综合性强,难度大,区分度很好,是一道不可多得的经典好题!
【点评】此题一改过去每年元素推断的通病,思维容量显著增大能力要求高,与20xx年全国卷I理综28题有得一拼,比20xx年的第29题出得高超一些,相比以前的无机推断显然有质的飞跃,看到命题人在进步!但是此题是不是一点瑕疵没有呢?x显然不是,例如本题条件很宽广,没太明显的限制条件,因而答案是丰富多彩的,这不会给阅卷者带来喜出望外,只会增加难度,不好统一评分标准,也就缺乏公平性!特别是B和C上就有争议,如B还可能是(NH4)2CO3,C还可能是BaBr2、BaI2等,当然限制一下沉淀颜色就排除了C的歧义!
(2010天津卷)3.下列鉴别方法可行的是
A.用氨水鉴别Al3+、Mg2+和Ag+
B.用Ba(NO3)2溶液鉴别Cl-、SO4和CO3
C.用核磁共振氢谱鉴别1-溴丙烷和2-溴丙烷
D.用KMnO4酸性溶液鉴别CH3CH=CHCH2OH和CH3CH2CH2CHO
解析:Al3+和Mg2+与氨水反应都只生成沉淀,不溶解,无法鉴别,故A错;SO42-和CO32-与Ba(NO3)2反应都生成白色沉淀,无法鉴别,故B错;1—溴丙烷有三种等效氢,其核磁共振谱有三个峰,而2—溴丙烷有两种等效氢原子,其核磁共振谱有两个峰,故可鉴别,C正确;碳碳双键、醛基都能被酸性KMnO4氧化,KMnO4溶液都退色,故无法鉴别。 答案:C
命题立意:考查阴阳离子和有机物的鉴别,通过鉴别,考查离子或有机物的化学性质。 (2010广东理综卷)32(16分)
碳酸锂广泛应用于陶瓷和医药等领域。以?-锂辉石(主要成分为Li2O?Al2O3?4SiO2)为原材料制备Li2CO3的工艺流程如下:
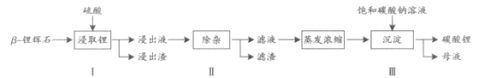
2?2?
已知:Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的PH分别为3.2、5.2、
9.7和12.4;Li2SO4、LiOH和Li2CO3在303K下的溶解度分别为34.2g、12.7g和1.3g.
(1)步骤Ⅰ前,?-锂辉石要粉碎成细颗粒的目的是_____________.
(2)步骤Ⅰ中,酸浸后得到的酸性溶液中含有Li+、SO42-,另含有Al3+、Fe3+、Fe2+、Mg2+、Ca2+、Na+等杂质,需在搅拌下加入_____________(填“石灰石”、“氯化钙”或“稀硫酸”)以调节溶液的PH到6.0~6.5,沉淀部分杂质离子,然后分离得到浸出液。
第 9 页 共 19 页 金太阳新课标资源网
金太阳新课标资源网
(3)步骤Ⅱ中,将适量的H2O2溶液、石灰乳和Na2CO3溶液依次加入浸出液中,可除去的杂质金属离子有______________.
(4)步骤Ⅲ中,生成沉淀的离子方程式为________________.
(5)从母液中可回收的主要物质是_____________.
解析:(1)粉碎可以增大接触面积,加快反应速率
要增强溶液的碱性,只能加入石灰石
H2O23+2+2?2+3+Na2CO3Fe、Mg、CaFeFe可以氧化为,石灰乳和使得沉淀 步骤Ⅲ生成的沉淀是Li2CO3,离子方程式为:2Li++CO32-=Li2CO3?
母液中的溶质是NaOH、
答案:(1)加快反应速率
(2)石灰石 Na2SO4,可以回收NaOH。
3+2+2?Fe、Mg、Ca(3)
(4)2Li++CO32-=Li2CO3?
(5)NaOH。
20xx年高考化学试题
1.(09安徽卷10)在溶液中能大量共存的一组离子或分子是
A.NH4?? 、H、NO3、HCO3 ??
B.K+ 、Al3+、SO42?
2? 、NH3·H2O C.Na+、K+、SO3、Cl2
CO32?D.Na+ 、CH3COO-、、OH-
答案:D
解析:
A项中H+与HCO3-能够反应生成CO2气体,不能大量共存,错误;
Al3+与氨水可以发生反应:Al3++3NH3·H2O=Al(OH)3↓+3NH4+,B选项错误; Cl2具有氧化性,可以将SO32-氧化为SO42-,方程式为:Cl2+H2O+SO32-=SO42-+Cl-+2H+,C选项错误。
2.(09全国卷Ⅰ6)下列各组离子,在溶液中能大量共存、加入NaOH溶液后加热既有气体放出又有沉淀生成的一组是
A.Ba2+ 、
?NO3?、?NH4、Cl B. Ca、??2?HCO3??、?NH42?、?AlO2 2???HSONH4SO4Mg3ClC.K、Ba2+、、 D. 、、、K
答案:D
第 10 页 共 19 页 金太阳新课标资源网
金太阳新课标资源网
解析:
A项,加入NaOH会与NH4+ 产生NH3,但没有沉淀;
B项HCO3- 与AlO2- 不能共存,会生成Al(OH)3 沉淀。
C项,OH-与HSO3- 生成SO32 -,与Ba2+可生成BaSO3沉淀,但无气体。 D项,OH-与NH4+ 产生NH3,与Mg2+会产生Mg(OH)2沉淀,正确。
3.(09天津卷4)下列叙述正确的是
A.0.1 mol/LC6H5ONa溶液中:c(Na+)>c(C6H5O-)>c(H+)>c(OH-)
B.Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小
C.pH=5的CH3COOH溶液和PH=5的NH4Cl溶液中,c(H+)不相等
D.在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降
答案:D
解析:
A项,苯酚钠为碱性溶液,故错;
B项,温度不变,则Kw是不变的,错;
C项,pH=5即代表溶液中C(H+)均为10-5mol/L,错。
D项,Ag2S比AgCl更难溶,故加入S2-会与溶液中的Ag+结合的,正确。
4.(09江苏卷7)在下列各溶液中,离子一定能大量共存的是
+3+SO4A.强碱性溶液中:K、Al、Cl、 -
3++-NO3B. 含有0.1 mol·L-1 Fe的溶液中:K、Mg、I、
2+++CO3Cl-C. 含有0.1 mol·L-1Ca溶液在中:Na、K、、
+3+NO3SO4D. 室温下,pH=1的溶液中:Na、Fe、、 -2-2-2-2+-
答案:D
解析:
A项,强碱性溶液意味着存在大量的OH,所以Al不能共存
(?3?Al3??3OH??Al(OH)3?
3?); B项,Fe和I因发生氧化还原反应而不能共存(
2?CO3C项,Ca和因发生复分解反应而不能共存 2??2Fe3??2I??2Fe2??I2);
5.(09江苏卷11) 下列离子方程式与所述事实相符且正确的是
A.漂白粉溶液在空气中失效:
B.用浓盐酸与
C.向
-ClO-+CO2+H2O=HClO+HCO3 MnO2反应制取少量氯气:MnO2+2H++2Cl- Δ Mn2++Cl2?+2H2O: NaAlO2溶液中通入过量CO2制Al?OH?3 -AlO-
2+CO2+2H2O=Al?OH?3?+HCO3
第 11 页 共 19 页 金太阳新课标资源网
金太阳新课标资源网
D.在强碱溶液中次氯酸钠与
Fe?OH?3反应生成Na2FeO4+: --3ClO-+2Fe?OH?3=2FeO42+3Cl+H2O+4H
答案:C
解析:
漂白粉失效的化学方程式为
子方程式是Ca(ClO)2?H2O?CO2?CaCO3?2HClO,A项错; ,那么该反应的离Ca2??2ClO??H2O?CO2?CaCO3?2HClO
实验室制取Cl2的原理是浓盐酸和二氧化锰反应,离子方程式为MnO2?
4H??2Cl?Mn2??2H2O?Cl2?
?,所以B项错; D项,在强碱溶液中,不可能生成H,所以D错。
6.(09广东理科基础32)下列离子方程式正确的是
A.铁与稀HNO3反应:Fe+2H+=Fe2++H2↑
B.小苏打与氢氧化钠溶液混合:HCO3- + OH- = CO2↑+ H2O
2+2-C.氯化钙与碳酸氢钾溶液混合:Ca + CO3 = CaCO3↓
D.CuSO4溶液与Ba(OH)2溶液混合:
2+2--2+ Cu + SO4 + 2OH + Ba = BaSO4↓ + Cu(OH)2↓
答案:D
解析:
铁与稀HNO3反应不产生H2,而是NO气体,A项错;
HCO3- 与OH-生成CO32 -,而不是CO2,B项错;
碳酸氢钾只能写成HCO3- ,而不可写成CO32 -,C项错; D项,生成两种沉淀,正确。
7.(09广东理科基础33)下列说法正确的是
A.向0.1 mol/L Na2CO3溶液中滴加酚酞,溶液变红
B.Al3+、NO3- 、Cl-、CO32 -、Na+可大量共存于pH=2的溶液中
C.乙醇和乙酸都能溶于水,都是电解质
D.分别与等物质的量的HCl和H2SO4反应时,消耗NaOH的物质的量相同 答案:A
解析:
Na2CO3溶液水解显碱性,故加入酚酞是变红的,A项正确;
pH=2为酸性溶液,所以CO32 -与H+是反应的,故不能共存,B项错; 乙醇属于非电解质,C项错;
第 12 页 共 19 页 金太阳新课标资源网
金太阳新课标资源网
硫酸为二元酸,故NaOH的物质的量是HCl的两倍,D项错。 8.(09广东化学12) 下列离子方程式正确的是 A. 向盐酸中滴加氨水:H+ + OH- = H2O
B. Fe(OH)3溶于氢碘酸:Fe(OH)3 + 3H+ = Fe3+ + 3H2O
C. 铜溶于稀硝酸:3Cu + 8H+ + 2NO3- = 3Cu2+ + 2 NO ↑+ 4H2O
D. 向Na2S2O3溶液中通入足量氯气:S2O32-+2Cl2+3H2O=2SO32-+4Cl-+6H+ 答案:C 解析:
A项中的氨水应写成分子式, B项发生的是氧化还原反应; C项正确;
氯气具有强氧化性将S2O32-氧化成SO42-,正确的离子方程式应为S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+,故D错。
9. (09四川卷8)在下列给定条件的溶液中,一定能大量共存的离子组是
2??HSO3
A.无色溶液:Ca、、H+、Cl、
?
?NO3B.能使pH试纸呈红色的溶液:Na+、NH+4、I、
2?
SO4
?
C.FeCl2溶液:K+、、Na+、、、、
AOl
?
2
Kw?
SiO32?NO3?c(H)D.=0.1 mol/L的溶液:Na+、K+、、
答案:D
10.(09上海卷18)下列离子方程式正确的是 A.B.C.
H2SO4CuSO4AlCl3
与
Ba(OH)2
溶液反应: 气体:
2+2- Ba+O?H++H+?O4S
B?SO2 4a
+HO
溶液吸收
H2S
Cu2++H2S?CuS?+2H+
3+
Al+4N3H?
2
+
A-21O+44NH2+2HO
溶液中加入过量的浓氨水:
H?O
D.等体积、等浓度的
Ba(OH)2
稀溶液与
NH4HCO3
稀溶液混合:
-Ba2++2OH-?NH+4+HCO3?BaCO3 ?+NH3?H2O+H2O
答案:BD
11.(09重庆卷8)下列各组离子,能在溶液中大量共存的是 A.C.
Na+、Mg2+、AlO-2、Br-2-K+、NH+4、CO3、OH-
B
2-H+、Fe2+、SO4、NO-3
D
Ca2+、Al3+、NO-3、Cl-
答案:D 解析:
第 13 页 共 19 页 金太阳新课标资源网
金太阳新课标资源网
A项Mg2+水解呈酸性,AlO2—水解呈碱性,Mg2+与AlO2—发生双水解,Mg2++2AlO2—+4H2O====2Al(OH)3↓+Mg(OH)2↓不能大量共存;A项错误;B项在酸性条件下NO3—具有强氧化性,Fe2+与NO3—不能大量共存B项错误;C项NH4+与OH—结合成弱电解质NH3·H2O不能大量共存,C项错误;答案选D。
12.(09海南卷9)在室温时,下列各组中的物质分别与过量NaOH溶液反应,能生成5种盐的是:
A.A12O3、SO2、CO2、SO3 B.C12、A12O3、N2O5、SO3
C.CO2、C12、CaO、SO3 D.SiO2、N2O5、CO、C12
答案:B
13.(09宁夏卷12)能正确表示下列反应的离子方程式是
A. 向次氯酸钙溶液通入过量CO2:Ca2++2ClO-+CO2+H2O =CaCO3↓+2HClO
B. 向次氯酸钙溶液通入SO2:Ca2++2ClO-+SO2+H2O= CaSO3↓+2HClO
C. 氢氧化钙溶液与碳酸氢镁溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
D. 在氯化亚铁溶液中加入稀硝酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
答案:D
解析:
A选项CO2过量的话,应该生成HCO3- 方程式应为:ClO-+CO2+H2O=HClO+HCO3-; B选项HClO可将CaSO3氧化为CaSO4 ,正确的方程式为:Ca2++ClO-+SO2+H2O=CaSO4↓+Cl-+2H+ ;
C选项要考虑到Mg(OH)2 为沉淀即可, Mg2++2HCO3-+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O。
14.(09全国卷Ⅱ29) (15分)
??2?2?2?3?K,Ag,Ca,Ba,Fe,Al现有A、B、C、D、E、F六种化合物,已知它们的阳离子有,
阴离C1?,OH?,CH3COO?,NO3?,SO42?,CO32?,现将它们分别配成0.1mol?L的溶?1液,进行如下实验:
测得溶液A、C、E呈碱性,且碱性为A>E>C;
向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失;
向D溶液中滴加Ba(NO3)2溶液,无明显现象;
向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色。 根据上述实验现象,回答下列问题:
实验②中反应的化学方程式是 ;
(2)E溶液是 ,判断依据是 ;
(3)写出下列四种化合物的化学式:A 、C 、
D 、F .
答案:
(1)
AgNO3?NH3?H2O?AgOH?NH4NO3 AgOH?2NH3?H2O?Ag(NH)?2HO23OH2
第 14 页 共 19 页 金太阳新课标资源网
金太阳新课标资源网
(2)碳酸钾 由①中碱性减弱的顺序可知,E是碳酸盐。六种阳离子中可以与碳酸根形成可溶性盐的只有钾离子,所以E是碳酸钾
(3)Ba(OH)Ca(CH3COO)22 AIC3IFeSO4
解析:
本题考查离子共存、盐类水解综合运用。根据溶液的性质,确定CO32—只能与K+形成显碱性的溶液,另外可能形成的碱性溶液为碱Ba(OH)2 。由于醋酸的酸性大于碳酸,所以醋酸盐水解的碱性小于碳酸盐,因此A为Ba(OH)2,E为K2CO3,C为醋酸盐,由②可得B中阳离子为Ag+,则肯定为AgNO3,由③可得D中无SO42—,则F中的阴离子为SO42—,D中的阴离子为Cl—。由④可得F中的阳离子为Fe2+,即F为FeSO4,而CH3COO—若与Al3+形成溶液时,Al3+也发生水解,所以C为醋酸钙,而D为AlCl3。
15.(09安徽卷27)(12分)
某厂废水中含5.00×10-3mol·L-1的
将废水处理得到磁性材料2?Cr2O7,其毒性较大。某研究性学习小组为了变废为宝,Cr0.5Fe1.5FeO4(Fe的化合价依次为+3、+2),设计了如下实验流程:

(2)第②步中用PH试纸测定溶液PH的操作是:
(3)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有
(4)欲使1L该废水中的2?Cr2O7完全转化为Cr0.5Fe1.5FeO4。理论上需要加入 GFeSO4·7H2O。
答案: (1)Cr2O72- + 6Fe2+ + 14H+ 2Cr3+ + 6Fe3+ + 7H2O
(2)将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上,再与标准比色卡对照。
(3)Fe(OH)3、Fe(OH)2
(4)13.9
解析
(1)第①步是Cr2O72-与Fe2+发生氧化还原反应,方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
(2)测定溶液的pH的方法是:用玻璃棒蘸取待测溶液滴在pH试纸的中心位置,然后对照标准比色卡,读出对应颜色的数据;
(3)从最终所得磁性材料的化学式可知,滤渣中主要有Cr(OH)3、Fe(OH)2、Fe(OH)3;
(4)1L废水中的n(Cr2O72-)=5.00×10-3mol,根据关系式:Cr2O72-~4Cr0.5Fe1.5FeO4~第 15 页 共 19 页 金太阳新课标资源网
金太阳新课标资源网
10FeSO4·7H2O,所以理论上n(FeSO4·7H2O)=0.05mol,m(FeSO4·7H2O)= 0.05mol×278g·mol-1=13.9g。
16.(09福建卷24)(13分)
从铝土矿(主要成分是
如下:
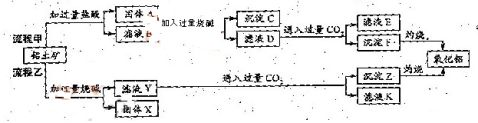
Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取两种工艺品的流程
请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的方程式为_________.
(2)流程乙加入烧碱后生成Si
3?2?o3的离子方程式为________. (3)验证滤液B含Fe,可取少量滤液并加入________(填试剂名称)。
(4)滤液E、K中溶质的主要成份是________(填化学式),写出该溶液的一种用途________
(5)已知298K时,Mg(OH)2的容度积常数KSP=5.6×10?12,取适量的滤液B,加入一定量
2?c(Mg)=_______. 的烧碱达到沉淀溶液平衡,测得PH=13.00,则此温度下残留在溶液中的
答案: (1)Al2O3 + 6H+ 2Al3+ +3H2O (2)SiO2 + 2OH- SiO32 - + H2O
(3)硫氰化钾(或硫氰酸钾、苯酚溶液等合理答案:)
(4)NaHCO3;制纯碱或做发酵粉等合理答案:
(5)5.6×10-10mol/L
解析:
本题考查铝土矿中氧化铝提取的工艺流程。(1)与HCl反应生成Al3+,应为铝土矿中Al2O3。
(2)SiO2可以溶于NaOH中生成Na2SiO3。(3)检验Fe3+的特征反应很多,如与KSCN显血红色,与苯酚显紫色,与OH-显红褐色沉淀等。(4)生成E、K时,CO2均是过量的,故应生成NaHCO3。(5)Ksp?c(Mg2?)c2(OH?),c(Mg2?)=5.6×10-12/(0.1)2=5.6×10-10。
17.(09广东化学22)(12分)
某工厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、 CaMg(CO3)2、Al2O3和Fe2O3等,回收其中镁的工艺流程如下:
第 16 页 共 19 页 金太阳新课标资源网
金太阳新课标资源网
沉淀物
PH Fe(OH)3 3.2 Al(OH)3 5.2 Mg(OH)2 12.4
部分阳离子以氢氧化物形式完全深沉时溶液的pH由见上表,请回答下列问题:
(1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有 (要求写出两条)。
(2)滤渣I的主要成分有 。
(3)从滤渣Ⅱ中可回收利用的主要物质有 。
(4)Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备: MgCl2+2NaClO3===Mg(ClO3)2+2NaCl
已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示:
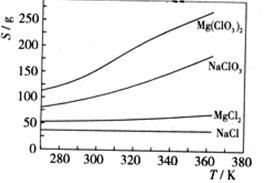
①将反应物按化学反应方程式计量数比混合制备Mg(ClO3)2。简述可制备Mg(ClO3)2的原因: 。
②按①中条件进行制备实验。在冷却降温析出Mg(ClO3)2过程中,常伴有NaCl析出,原因是: 。除去产品中该杂质的方法是: 。
答案:
(1)升高温度、搅拌、过滤后再向滤渣中加入硫酸(多次浸取)
(2)Fe(OH)3 Al(OH)3
(3)Na2SO4
(4)①在某一时NaCl最先达到饱和析出;Mg(ClO3)2的溶解度随温度变化最大;NaCl 的溶解度与其他物质的溶解度有一定的差别。
②降温前溶液中NaCl以达饱和;降低过程中NaCl溶解度会降低 ,会少量析出。重结晶。 解析:
浸出步骤硫酸同固体废料中主要成份反应,从化学反应速率和化学平衡的影响因素来看,可通过升高温度提高硫酸镁的溶解度,或通过搅拌使反应物充分接触反应,或通过过滤后滤渣多次浸取以提高转化率。硫酸浸出液经过滤,滤液中主要溶质是MgSO4、Al2(SO4)3和Fe2(SO4)3,根据阳离子以氢氧化物形式完全沉淀时溶液的pH,在调节pH至5.5时,Fe3+和Al3+已经完全沉淀,滤渣I的主要成分是Fe(OH)3 Al(OH)3,此时滤液中阴离子主第 17 页 共 19 页 金太阳新课标资源网
金太阳新课标资源网
要是SO42-,加入NaOH后Mg2+完全沉淀,溶质主要成分是Na2SO4;反应MgCl2+2NaClO3===Mg(ClO3)2+2NaCl类似于侯德榜制碱法生成NaHCO3的原理,因为NaCl溶解度小而从溶液中析出,使反应向生成Mg(ClO3)2的方向进行;同样是依据①的原理,在降温的过程中,Mg(ClO3)2的溶解度不断减小,从溶液中析出,在生成Mg(ClO3)2的过程中NaCl也不断生成,但因溶解度没有增加,所以也伴随Mg(ClO3)2析出;相同温度时氯化钠的溶解度最小,因此在冷却降温析出Mg(ClO3)2过程中一定会析出氯化钠。由于氯酸镁和氯化钠均溶于水,溶于水的可溶性物质一般用结晶和重结晶的方法分离。
18.(09广东化学24)(11分)
超细氧化铝是一种重要的功能陶瓷原料。
(1)实验室常以NH4Al(SO4)2和NH4HCO3为原料,在一定条件下先反应生成沉淀NH4AlO(OH)HCO3该沉淀高温分解即得超细Al2O3。NH4AlO(OH)HCO3热分解的化学反应方程式 。
(2)NH4Al(SO4)2·12H2O的相对分子质量为453。欲配制100mLPH为2、浓度约为0.1mol-1的NH4Al(SO4)2溶液,配制过程为
①用托盘天平称量NH4Al(SO4)2·12H2O固体 g;
②将上述固体置于烧杯中 。
(3)在0.1mol·L-1NH4Al(SO4)2溶液中,铝各形态的浓度(以Al3+计)的对数(lgc)随溶液PH变化的关系见下图
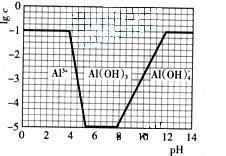
①用NaOH溶液调节(2)中溶液PH至7,该过程中发生反应的离子方程式有 。 ②请在答题卡的框图中,画出0.01mol·L-1NH4Al(SO4)2溶液中铝各形态的浓度的对数lgc随溶液PH变化的关系图,并进行必要的标注。
答案: (1)2NH4AlO(OH)HCO3高温 Al2O3+3H2O+2CO2↑+2NH3↑
(2)①4.5g;②再向烧杯中加入100mL蒸馏水,充分搅拌至固体溶解
(3)① H++OH-=H2O NH4++ OH—= NH3·H2O Al3++3OH—=Al(OH)3↓;
第 18 页 共 19 页 金太阳新课标资源网
金太阳新课标资源网
②
解析:
(1)根据 NH4AlO(OH)HCO3
高温
组成联系到碳酸氢铵盐的分解可知:2NH4AlO(OH)HCO3Al2O3+3H2O+2CO2↑+2NH3↑;
(2)由物质的量浓度的定义公式可计算:
m(NH4Al(SO4)2·12H2O)=n·M(NH4Al(SO4)2·12H2O)=c·V·M(NH4Al(SO4)2·12H2O) =0.1mol/L×100mL×10-3×453g/mol=4.53g,由于托盘天平的精确度为0.1g,故为4.5g;
(3)①由图像可知,开始阶段c(Al3+)没变化;而后c(Al3+)降低,生成Al(OH)3沉淀;当pH>8,Al(OH)3沉淀开始溶解。调节pH至7,OH—先跟NH4+反应,然后与Al3+反应生成Al(OH)3沉淀。
第 19 页 共 19 页 金太阳新课标资源网
