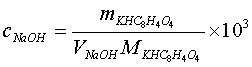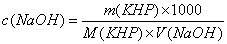实验 氢氧化钠标准溶液的配制与标定
一、实验目的
1、掌握氢氧化钠滴定液的配制和标定方法。
2、巩固用递减法称量固体物质。
3、熟悉滴定操作并掌握滴定终点的判断。
4、本实验需4学时。
二、仪器与试剂
仪器:分析天平、台秤、滴定管(50mL)、玻棒、量筒、试剂瓶(1000mL)、电炉、表面皿、称量瓶、锥形瓶
试剂:固体NaOH、基准邻苯二甲酸氢钾、纯化水、酚酞指示剂
三、原理与方法
NaOH易吸收空气中CO2而生成Na2CO3,反应式为:
2NaOH + CO2 = Na2CO3 + H2O
由于Na2CO3在饱和NaOH溶液中不溶解,因此将NaOH制成饱和溶液,其含量约52%(w/w),相对密度为1.56。待Na2CO3沉待淀后,量取一定量的上清液,稀释至一定体积,即可。用来配制NaOH的纯化水,应加热煮沸放冷,除去水中CO2。
标定NaOH的基准物质有草酸(H2C2O4·2H2O)、苯甲酸(C7H6O2)、邻苯二甲酸氢钾(KH C8H4O4)等。通常用邻苯二甲酸氢钾标定NaOH滴定液,标定反应如下:

计量点时,生成的弱酸强碱盐水解,溶液为碱性,采用酚酞作指示剂。按下式计算NaOH滴定液的浓度:
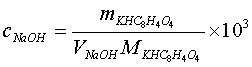
四、实验内容
1、NaOH溶液的配制
(1)NaOH饱和溶液的配制:用台称称取120g NaOH固体,倒入装有100mL纯水的烧杯中,搅拌使之溶解成饱和溶液。贮于塑料瓶中,静置数日,澄清后备用。
(2)NaOH滴定溶液的配制(0.1mol/L):取澄清的饱和NaOH溶液2.8mL,置于1000 mL试剂瓶中,加新煮沸的冷纯化水500 mL,摇匀密塞,贴上标签,备用。
2、NaOH溶液的标定
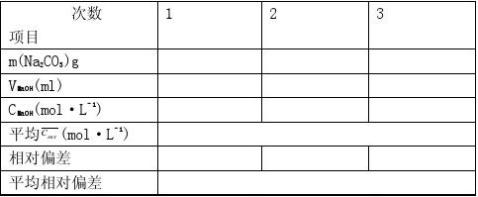
用递减法精密称取在105~110℃干燥至恒重的基准物邻苯二甲酸氢钾3份,每份约0.5g,分别置于250 mL锥形瓶中,各加纯化水50 mL,使之完全溶解。加酚酞指示剂2滴,用待标定的NaOH溶液滴定至溶液呈淡红色,且30秒不褪色,即可。平行测定三次,根据消耗NaOH溶液的体积,计算滴定液NaOH的浓度和相对平均偏差。
…… …… 余下全文