酸碱中和滴定
教学目标
1、知识与技能:
(1)熟练中和滴定实验有关仪器(滴定管和锥形瓶等)的基本操作规范。
(2)理解中和滴定实验过程要记录的实验数据。
2.过程与方法:
(1)通过酸碱中和滴定实验,理解化学实验中测定酸或碱的准确浓度的基本方法。
(2)通过酸碱中和滴定实验,掌握中和滴定实验操作方法。
3.情感和价值观目标
(1)通过中和滴定终点时指示剂的颜色突变等感受量变引起质变的规律,感受化学实验中的色彩美。
(2)通过中和滴定实验过程“先快后慢”、边滴边振荡等的把握,养成耐心、细致的实验习惯。
(3)通过中和滴定实验数据的处理和计算,培养实事求是的实验态度。
实验教学重点和难点
重点:中和滴定实验操作过程。
难点:实验数据的处理
教学过程
一、 酸碱中和滴定原理
以酸碱中和反应为基础,H+ + OH- = H2O
在滴定达到终点(即酸碱恰好反应)时n (H+) =n (OH-)
若是一元酸和一元碱反应则有 :
n(酸)=n(碱) c酸. V酸 = c碱. V碱
现在我们用0.1000mol/L的盐酸标准溶液测定未知浓度的NaOH溶液
C(NaOH)=C(HCl)·V(HCl)/V(NaOH)
二、 酸碱中和滴定
( 一)认识仪器:
1、滴定管构造
①类型 : 酸式滴定管 碱式滴定管
②刻度 : A、 “0”点在上端,从上向下增大。
B、每小格为0.1mL,但应估读至0.01
③标记: 容积、温度、刻度
2、滴定管的使用方法
①查:活塞、是否漏水
②洗:(三洗)自来水洗、蒸馏水洗、酸碱溶液润洗。
润洗(2~3次)示范一次操作,后叫一名同学上来润洗碱式滴定管
③调:
把溶液注入滴定管中,使液面位于“0”以上2cm~3cm处,再把滴定管固定在滴定管夹上,在滴定管下放一个烧杯,调节活塞使滴定管的尖嘴部分充满溶液(不留气泡),并使液面处在“0”或“0”以下某一刻度处,记下准确读数。
④读数:
a、滴定管要垂直,
b、装液或放液后静置一会儿,待液面稳定再读数
c、视线与凹液面最低处保持水平,
d、估读到0.01mL。
( 二)中和滴定
1、仪器: 酸式滴定管、碱式滴定管、滴定管夹、铁架台、锥形瓶、烧杯。
2、试剂:标准液0.1000mol/L的盐酸溶液、待测液0.1mol/L左右的氢氧化钠溶液、酚酞
3、中和滴定操作
(1)滴定前准备:查漏—洗涤—润洗—注液—调液—读数
①查漏:检查滴定管是否漏液.
②洗涤:用水和蒸馏水分别洗涤滴定管、锥形瓶.(2~3次)
③润洗:用盛装液分别润洗滴定管,锥形瓶不能用盛装液润洗.(2~3次)
④注液:向滴定管中注入溶液,排出尖嘴部位的气泡.
⑤调液:调节液面至零或零刻度以下.
⑥在锥形瓶待测液中滴加2-3滴酚酞。
(2)滴定
①左手握滴定管活塞,右手拿锥形瓶并不断振荡。
②眼睛注视锥形瓶内溶液颜色的变化。
③终点判断:当滴入最后一滴,溶液颜色变化且在半
分钟内不褪色。
④读取滴定管刻度并记录。
注意:读数时视线与凹液面水平相切
为保证测定的准确性,上述滴定重复2-3次。
三. 数据记录与处理
已知c(HCl)=0.1000mol/L,V(NaOH)=10.00mL

数据处理:
V(HCl)平均 =
c(NaOH)=
第二篇:酸碱中和滴定实验
酸碱中和滴定实验
1、定义:利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的浓度的实验方法叫做酸碱中和滴定。
2、原理:在中和反应中虽然表面上没有明显现象,但溶液PH发生很大的变化,在滴定过程中会发生PH突变而使指示剂发生颜色变化。通过溶液的颜色变化判断反应终点,测出酸(或碱)溶液的体积,根据化学方程式中酸碱物质的量之比求出未知溶液的浓度。计算公式为: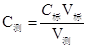
3、仪器和试剂
 酸式滴定管(不能盛放碱性溶液和水解呈碱性的盐溶液)
酸式滴定管(不能盛放碱性溶液和水解呈碱性的盐溶液)
⑴仪器 碱式滴定管(不能盛放酸性溶液和强氧化性溶液)
锥形瓶、铁架台、滴定管夹、烧杯等
★ 注意:①酸式滴定管、碱式滴定管是进行中和滴定、滴定曲线绘制实验中准确量取一定 体积的溶液的仪器,其精确度为0.01mL。
②指示剂的选择:强酸强碱之间的滴定用甲基橙或酚酞均可。若用强酸滴定弱碱,用甲基橙为好,终点的现象由黄变橙;若用强碱滴定弱酸,用酚酞为佳,终点的现象为由无色变浅红。石蕊一般不用作指示剂。
③误差分析:以标准盐酸溶液滴定待测NaOH溶液的实验误差分析归纳入下表:

⑵试剂:标准溶液、待测溶液、酸碱指示剂
4、实验操作(以标准盐酸滴定NaOH溶液为例)
⑴洗涤:锥形瓶内只用蒸馏水洗涤,不能用待测溶液润洗。酸式、碱式滴定管先用蒸馏水洗涤,再用所盛溶液润洗2~3次。洗涤的原则是少量多次,洗涤方法是将滴定管横放慢慢转动,洗净的标准时管内壁不挂水珠。
⑵取液:向酸式滴定管中注入标准盐酸至0刻度以上,调节液面至0或0以下,使尖嘴部分充满溶液且不留有气泡,记下刻度。
用碱式滴定管取待测NaOH溶液,调节液面使尖嘴部分充满溶液而不留有气泡,准确放出一定体积的溶液至锥形瓶中,加入2~3滴酚酞指示剂。
⑶滴定:在锥形瓶下垫一张白纸,滴定过程中用左手旋转活塞,右手不断振荡锥形瓶,眼睛注视锥形瓶中溶液的颜色变化,直至加入一滴盐酸使溶液由红色褪为无色时,停止滴定。
⑷读数:平时滴定管中凹液面最低处,读取溶液体积。
⑸计算:重复滴定2~3次,要求每次滴定所消耗溶液的体积误差不超过0.2mL。取几次结果的平均值,
依c(NaOH)=  进行计算。
进行计算。
