实验4 无机混凝剂的制备
姓名: 学号:
1. 前言
1.1 目的与意义
聚合硫酸铁(PFS)是 2O世纪 80年代发展起来的一种新型无机高分子絮凝剂。相比传统的铝系絮凝剂,具有水解速度快、絮凝体密度大、适用pH值范围宽(4~i0)等特点,且成本低、使用方便、无残留,因而广泛用于工业用水、工业废水及城市污水的净化处理【1】。
通过制备聚硫酸铁的综合实验,不但使学生了解混凝剂在水处理中的原理及重要作用,掌握合成无机混凝剂的操作技术,并且学会通过金属含量、碱化度、Zata电位的测定,评价混凝剂的水处理产品稳定性和混凝性能。
1.2 文献综述与总结
絮凝净化法具有适应范围广、工艺简单、处理成本低等特点,目前广泛应用于饮用水、生活污水和工业废水的处理中。
聚合硫酸铁PFS是20世纪80年代出现的一种新型无机高分子絮凝剂具有水解速度快、絮凝体密度大、适用pH范围宽等特点 具有很强的中和悬浮颗粒上电荷的能力,有很大的比表面积和很强的吸附能力,能很好地去除水中悬浮物、有机物、硫化物、重金属离子等杂质。 具有脱色、除臭、破乳化及污泥脱水等功能,因而被广泛应用于矿山 印染、造纸等工业废水处理。相比传统的铝系絮凝剂而言PFS在反应过程中无离子水相转移和残留积累使用更方便、价格更便宜、用量更省【2】。
直接氧化法虽然工艺简单、操作简便,但存在氧化剂用量大、成本高、氧化剂引入的离子需分离除去、反应中产生的有害气体需专门设备吸收处理等问题。因而难于在工业化生产中普及和应用,但试验研究中需要少量聚合硫酸铁时,采用此类方法制备简便易行【1】。
2. 实验部分
2.1 实验原理
二价铁离子在酸性条件下,经催化氧化、水解、聚合三步反应,可制得聚合硫酸铁:
(1) 氧化反应
2FeSO4 +1/2 O2 + H2SO4 =Fe2(SO4)3 + H2O
氧化反应控制着整个反应过程,其目的是将Fe2+氧化为Fe3+。氧化反应中要控制H2SO4/Fe的比例为0.3~0.45。
(2) 水解反应
Fe2(SO4)3 + nH2O=Fe2(OH)n(SO4)3-n/2 + n/2H2SO4
当整个反应体系中硫酸根数量不足时,氧化后的;三价铁离子会发生水解,生成高价羟基铁络离子,同时羟基相互交联,形成聚合硫酸铁。
(3) 聚合反应
mFe2(OH)n(SO4)3-n/2 =[Fe2(OH)n(SO4)3-n/2]m
水解和聚合反应的顺利进行,消耗了氧化反应的产物Fe2(SO4)3,使氧化反应的平衡向右移动,FeSO4不断被氧化为Fe2(SO4)3,直至反应完全。由于三价铁离子水解产生了羟基铁络离子,因此聚合硫酸铁作为中性分子所需的硫酸根量要少一些。
(4)碱化度:以氟化钾作掩蔽剂,采用酸碱中和滴定来测定。计算公式为:[3]
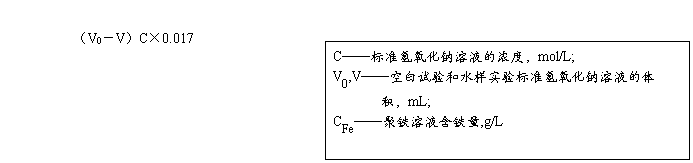
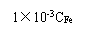
 X= ×100%
X= ×100%

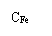
 = ×100%
= ×100%
2.2 仪器与试剂
2.2.1主要仪器
可调速搅拌器、三口烧瓶250ml、可调速搅拌器、三口烧瓶、锥形瓶、烧杯、恒温槽、酸式滴定管、碱式滴定管、胶头滴管、量筒、移液管
2.2.2主要试剂
七水硫酸亚铁FeSO4?7H2O、硫酸、过氧化氢H2O2(30%)、氯酸钠NaClO3、
酚酞指示剂,重铬酸钾标准溶液0.025mol/L、盐酸溶液:0.1011mol/L、NaOH溶液0.0978mol/L,硫磷混酸15%、二苯胺磺酸钠2g/L、氟化钾
2.3 实验步骤
2.3.1 产品制备
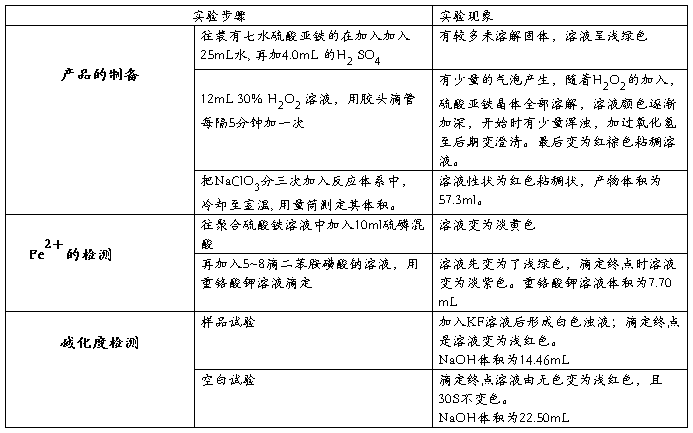
称取50g 置于烧瓶中,加入25mL去离子水,按照硫酸与亚铁盐摩尔比例为0.4,实取硫酸4.0ml,然后加入烧瓶中。控制水浴反应温度为50—80°C,取理论反应量的过氧化氢12.0ml和理论量20%的氯酸钠0.64g,快速搅拌混合溶液(800rpm),同时,每隔5min加一次过氧化氢,在1—1.5h内加完。最后将氯酸钠分三次加完,再搅拌15min。
氧化反应完后,溶液完全变为红棕色。用滴管取少量溶液观察,其中应无明显的二价铁离子的颜色,否则,继续加入过氧化氢或氯酸钠。样品分析时,二价铁的转化率应达95%以上。
2.3.2 产物中Fe2+的检测
取5mL聚铁溶液,放入250mL锥形瓶中,稀释至100mL,加入10mL硫磷混酸,冷却后加入7滴二苯胺磺酸钠溶液,用重络酸钾标准溶液滴定至呈稳定的紫色。
2.3.3碱化度检测
用移液管量取1mL聚铁溶液,置于250mL锥形瓶中,用移液管准确移入25.00mL盐酸溶液,再加入20mL去离子水,摇匀,盖上表面皿,在室温下放置10分钟。加入10mL氟化钾溶液,摇匀。再加入5滴酚酞,立即用氢氧化钠溶液滴定至淡红色为终点。
用去离子水做空白实验,重复以上步骤。
2.2 实验现象与结果
Fe2+转化率的计算
M(FeSO4·7H2O)= 278g/mol
Fe+的物质的量:n=m/M=50g÷(278g/mol)=0.1798mol
产品体积:57.3mL
总铁浓度:0.1798mol*56g/L÷57.3mL=175.20g/L
亚铁浓度:
6Fe2+ + Cr2O72- + 14H+ =6Fe3+ + 2Cr3+ + 7H2O
n(Fe2+)=6n(Cr2O72-)=7.70mL* 0.025mol/L*6=1.16*10-3mol
[Fe2+]=56g/L*1.16*10-3mol ÷5mL=0.0063mol/L=12.94g/L
产率:(175.20g/L-12.94g/L) ÷175.20g/L×100%=92.61%
碱化度的检测
空白样品滴加氢氧化钠标准液体积:22.50mL
样品溶液滴加氢氧化钠溶液体积:14.46mL
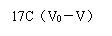
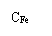
 X = ×100%
X = ×100%
=17*(22.50-14.46) ÷175.20g/L ×100%=7.63 %
 表1 聚合硫酸铁产量与质量指标
表1 聚合硫酸铁产量与质量指标

3. 结果与讨论
1.由表1知合成聚合硫酸铁产品的转化率高,其外观、总铁均符合标准要求
2.产品二价铁含量(12.94g/L)超出了标准(<1g/L),超标量非常大。由于反应开始时的搅拌速度控制不好,太慢,导致溶液中发生水解产生沉淀,溶液为浑浊状态。产品合成还受硫酸影响,亚铁盐在足量的硫酸中被氧化时会生成铁盐;当亚铁盐的硫酸溶液中硫酸量不足,氧化最终将会发生水解,比例过小,产生的氢氧根易生成氢氧化铁沉淀。
4. 由表1可知碱化度偏低,可知聚合硫酸铁的聚合度偏低,凝聚效果不够好。
用碱滴定测碱化度过程难以做到无CO2反应环境,滴定时间快慢也会影响误差的大小,实验可能存在较大误差,由于环境中存在大量CO2滴定终点的浅红色在30s内不变色即可,否则时间长或剧烈震荡都会由于CO2与NaOH反应而浅红色变浅甚至变为无色。
5.PFS的制备受反应温度、氧化剂种类,氧化剂的加入速度和酸度等多种因素的影响,如果条件控制不好,将直接影响产品的性能和质量,其中氧化剂的选择、加入速度以及酸度的控制对其性能的影响尤为显著【4】。
①氧化剂的影响
氧化剂的加入速度直接影响反应速度,加入速度较慢有利于物料的充分接触,但反应时间过长,加上又太慢、太迟又易产生沉淀。
②反应时间的影响
反应时间不同会影响产品性能。水浴加热使水分蒸发溶液浓缩同时增强聚合效
果。反应时间越长,产品性能越好,但是4小时后产品性能改变减小,继续延长反应时间,只能增加能耗降低生产效率;如果反应时间太短,不能够完全生成聚合硫酸铁,从而影响聚合效果,导致产品碱化度过低。因此本次实验设定的反应时间为1.5小时。
③反应温度的影响
将NaClO3分份加入,由于反应放出大量的热,温度对Fe2+的转化率影响不明显。
但在温度较低时,七水合硫酸亚铁很难溶解,延长了反应时间,同时Fe2+转化率稍有降低;在温度较高时,使溶液中含有较少的Fe2+,所以把温度控制在50~55℃即可。
4. 结论
在该实验中,所得产品为红褐色黏稠透明液体,产率可达92% 以上。因此说用H2O2氧化FeSO4 ·7H2O 生产聚合硫酸铁是较经济的, 设备简单。如能找到适当的废酸, 成本将会更低, 而且用过氧化氢生产聚铁具有设备简单、生产周期短、原料廉价易得,能以废治废、产品稳定性高等优点.综上所述, 聚铁制备具有广泛的社会、经济、环境效益。
【参考文献】
[1] 潘碌亭,吴锦峰.聚合硫酸铁制备技术的研究与进展[J].工业水处理,2009,29(9):1-5
[2] 黄珊,李正山,潘科.KClO3氧化法制备PPS的氧化过程研究[J].四川环境,2007,26(3):5-7
[3] 邵维仁,朱传俊.聚合硫酸铁产品的质量检验[J]. 工业水处理,1994,14(1):30-32
[4] 冯西平,李光荣 聚合硫酸铁碱化度的测试与分析 科技创新导报[J].化学工业,2009(30)
第二篇:无机混凝剂的制备
华南师范大学实验报告
学生姓名 吴健华 学 号 20102401046
专 业 化学(师范) 班 级 10化学五班
课程名称 化学综合实验 实验项目 无机混凝剂的制备
实验指导老师 廖高祖老师 实验时间 2014 年 3 月 7 日
预习验证码: 57207 实验评分
一、前言
1.实验目的
①了解混凝剂在水中处理中重要作用,混凝剂的种类与制备方法。
②掌握合成无机混凝剂的操作技术。
③学会通过金属含量、碱化度、Zeta电位的测定,评价混凝剂的水处理产品稳定性和混凝性能。
2.背景知识
混凝法是废水处理中非常重要、应用广泛的方法,即在废水中预先投加化学药剂来破坏胶体的稳定性,使废水中的胶体和细小悬浮物聚集成具有可分离性的絮凝体,再加以分离除去的过程,其混凝机理包括压缩双电层、吸附电中和、吸附架桥、沉淀网捕等。
混凝剂按组成、性质分类可大致分为无机混凝剂、有机混凝剂、微生物混凝剂3类。这里着重介绍无机混凝剂。无机混凝剂主要有铁盐系和铝盐系两大类,按阴离子成分又可分为盐酸系和硫酸系,按相对分子质量大小又可分为低分子体系和高分子体系两类,主要混凝剂有FeCl3、AlCl3、Fe2(SO4)3、Al2(SO4)3及其多聚物等。无机混凝剂应用较早,广泛用于水的净化处理和污水的脱泥处理等。
目前,最具市场潜力和应用前景的混凝剂是聚合硫酸铁(PFS),这是一种无机高分子混凝剂,其分子式可表示为[Fe2(OH)n(SO4)3-n/2]m,其相对分子质量可高达10000-100000。根据红外光谱和透射电镜分析,聚铁溶液中包含多种铁的配合离子,如[Fe(H2O)6]3+、[Fe(H2O)3]3+、[Fe(OH)2]+、[Fe(OH)6]3-、[Fe(OH)4]-、[Fe(OH)5]2-等,这些带电粒子具有很强的架桥、卷扫、絮凝和电中和等作用,受到pH值和带点颗粒的影响很容易脱稳形成更大颗粒的絮状沉淀,沉降速率更快,比传统的简单无机盐即铁盐和铝盐混凝性能要好得多,去除COD、S、浊度、臭味、重金属的能力和脱色、脱水等性能更好,絮体沉降速度更快,因此在各种废水治理、工业水处理及污泥脱水中得到了广泛的应用。又因价格较低,逐步成为主流絮凝药剂。
目前,市场上有两种类型的聚铁产品,即液体聚铁(或聚铁溶液)和固体聚铁。液体聚铁的生产方法根据原料的不同主要有以下两种:①以铁盐为原料,将其直接水解;②以硫酸和硫酸亚铁为原料。这又分为直接氧化法和催化剂氧化法。直接氧化法是在快速搅拌下,用强氧化剂,如H2O2、Cl2、KClO3、MnO2等,直接氧化硫酸亚铁的硫酸水溶液(硫酸与硫酸亚铁的摩尔比在0.20-0.45范围内)而制得产品。催化氧化法是在快速搅拌下,以亚硝酸钠作为催化剂,用氧气或空气氧化硫酸亚铁的硫酸水溶液(硫酸雨硫酸亚铁的摩尔比在0.2-0.45范围内)而制得产品。
工业上一般采用催化氧化法,尤其可采用工业副产品废硫酸亚铁和废酸(酸洗废酸、TiO2生产废酸)等为原料,生产工艺简单、原料价廉易得,能以废治废,因而具有广泛的社会效益、环境效益和经济效益。
液体聚铁和固体聚铁各有其优点缺点。液体聚铁制备方法简单、使用方便,但运输困难,储存过程中容易水解出现浑浊(尤其当聚铁的碱化度比较大时)。为了延长稳定时间,往往要在溶液中加入NaCl、KCl、Na3PO4、K3PO4等盐类。固体聚铁可克服以上缺点,但制备时耗能大。
聚铁最先是由日本于20世纪70年代开发成功的液体产品,并于80年代初实现工业化生产。我国于80年代开始对聚铁进行开发研究。到目前为止,已开发成功采用不同原料和不同生产方法的制备工艺,力图克服文献方法中的缺点。如①将催化空气氧化法改为密闭容器中的加压氧气氧化法,既提高了反应速率,又避免了NOx的泄漏;②采用废铁屑、废硫铁矿渣、废铁矿石渣、其他铁矿渣等为原料,以废治废。
自聚铁出现以来对其研究和开发一直未间断过,目前已发展到聚铁分子中可包含几种甚至多种其他的阳离子和阴离子,如Al3+、Cl-、PO43-、SiOx等,这可大幅度提高其混凝性能和絮体沉降速度。单纯的聚铝类和聚铁类高分子混凝剂现在已研究较少,复合型和硅酸盐金属类高分子混凝剂现在已成为研究热点;并且,无机与有机高分子复合共聚的混凝剂已成为新的方向。
二、实验部分
1.实验原理
(1)制备原理
本实验采用工业副产品废硫酸亚铁和废酸(酸洗废酸、TiO2生产废酸)等为原料制备混凝剂聚合硫酸铁溶液(PFS)。
采用直接氧化法,即用强氧化剂,如H2O2、Cl2、KClO3、MnO2等,直接氧化硫酸亚铁的硫酸水溶液(硫酸与硫酸亚铁的摩尔比在0.20-0.45范围内)而制得产品。反应过程中,一方面,铁盐(三价)在水溶液中会发生水解生成碱式铁盐;另一方面,亚铁盐在足量的硫酸溶液中被氧化时,会生成铁盐。这样,当亚铁盐的硫酸溶液中硫酸的量不足时,氧化的最终将会发生水解,在硫酸亚铁和硫酸的比例合适的情况下,同时还发生聚合,形成高分子的碱式铁盐,即聚合硫酸铁(简称聚铁)。为了防止形成碱式铁盐沉淀,总硫酸根于总铁盐的摩尔的比以1.25-1.45为佳。
硫酸铁聚合过程及其复杂,一般认为分三个大步骤。
①氧化过程 二价铁在氧化剂作用下被氧化为三价铁,这是比较复杂的一步,目前采取的氧化剂种类很多,显然采取不同的氧化剂对氧化过程的影响是不一样的,即使是同样的氧化剂,对过程的机理,不同的研究者也存在不同的看法。以氧化剂H2O2为例,其反应过程如下所示:
2FeSO4+H2O2+2H2SO4==2Fe2(SO4)3+3H2O (4-1)
②水解过程 水解是Fe3+和OH-相互结合的过程,这是极其重要的一步,其重要概念是盐基度,盐基度B=[OH-]/(3[Fe3+]),OH-结合越多,则聚合度就越高,絮凝效果也就越好,产品质量越高,水解反应过程如下所示:
Fe3++OH-==Fe(OH)2+ (4-2)
Fe(OH)2++OH-==Fe(OH)2+ (4-3)
Fe(OH)2++OH-==Fe(OH)3 (4-4)
(4-2)、(4-3)两式对盐基度B有贡献,但式(4-4)须加以抑制,由于Fe(OH)3溶度积非常小,[Fe3+]×[OH-]3==4×10-38(20℃),在溶液中很容易沉淀,在水解过程中应当限制该反应的发生。
③聚合过程 聚合过程的化学方程式如下:
mFe2(OH)n(SO4)3-n/2→[Fe2(OH)n(SO4)3-n/2]m (4-5)
式中,m表示聚合度的大小,聚合度m在反应过程中是逐渐增加的,该值是个表观值。
综合起来,可以认为整个制备过程的化学反应方程式如下:
4FeSO4 +(2-n)H2SO4+(2n-2)H2O+O2(或氧化剂)→2Fe2(OH)n(SO4)3-n/2 (4-6)
mFe2(OH)n(SO4)3-n/2→[Fe2(OH)n(SO4)3-n/2]m (4-7)
(2)碱化度
碱化度又称盐基度,表示羟基在物质分子中所占的比例,它是关系到产品稳定性和混凝性能的重要技术指标。碱化度测定一般采用酸碱中和滴定,这样核心问题便是如何掩蔽Fe3+。氟化物可与Fe3+生成稳定性很好的六氟合铁络合物沉淀,氟化钾是最合适的掩蔽剂。
碱化度的计算:
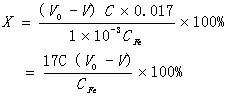
式中 C——标准NaOH溶液浓度,mol/L
V0,V——空白试验和水样试验标准NaOH溶液的体积,mL
CFe——聚铁溶液含铁量,g/L
2.仪器与药品
(1)主要仪器
可调速搅拌器、三口烧瓶250mL、电炉、带柄铁锅、铁架台
(2)主要试剂
硫酸亚铁(C.P.)、浓硫酸(C.P.)、30%H2O2(C.P.)、KClO3(C.P.)、盐酸标准溶液(0.1017mol/L)、NaOH标准溶液(0.09778mol/L)、酚酞指示剂(10g/L)、K2Cr2O7标准溶液(0.025 mol/L)、氟化钾溶液(500g/L)
3.实验步骤
(1)聚合硫酸铁的制备
①称取50g FeSO4·7H2O置于烧瓶中,加入25mL水。
②按照H2SO4/Fe=0.3~0.45的比例量取H2SO4,即2.93~4.40mL,现取4.3mL,加入烧瓶中。
③控制水浴反应温度为50~60℃。
④取理论反应量的H2O2,现取9.2mL,和理论量20%的NaClO3,现取0.73g。
⑤快速搅拌混合溶液(800~1600r/min),同时,每隔5min加一次H2O2,在1h内加完。最后将KClO3间隔5-10min分三次加完。加完后,再搅拌15min。
⑥氧化反应完后,溶液完全变为红棕色。用滴管取少量溶液观察,其中应无明显的二价铁离子的颜色,否则,继续加入H2O2/KClO3。
⑦计量好所制得产品的体积,以便确定总铁含量。另外,注意保存好余下样品,留待测定其混凝性能。
(2)产物聚合硫酸铁中Fe2+检测
取1mL聚铁溶液,放入250mL锥形瓶中,稀释至30mL,加入2mL硫磷混酸,冷却后加入5滴二苯胺磺酸钠溶液,用K2Cr2O7标准溶液滴定至呈稳定的紫色。
(3)碱化度检测
①用移液管量取1mL聚铁溶液,置于250mL锥形瓶中。
②用移液管准确移入25.00mL盐酸溶液,再加入20mL无CO2蒸馏水,摇匀,盖上表面皿,在室温下放置10min。
③加入10mL氟化钾溶液,摇匀。再加入5滴酚酞,即用NaOH标准溶液滴定至淡红色为终点。
④用无CO2蒸馏水做空白试验,重复以上步骤。
4.实验现象与结果
在实验中,称取50g FeSO4·7H2O置于烧瓶中,加入25mL水后,部分固体溶解,溶液呈绿色。加入3.1mL硫酸,控制水浴温度于55℃左右,快速搅拌,固体完全溶解。逐次加入30% H2O2,溶液中冒出气泡,并显黄色。随着H2O2不断加入及反应的进行,溶液颜色逐渐变深,最后加入KClO3,得到反应产品体积为60.0mL棕褐色溶液。
(1)总铁含量计算:
总铁含量为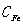 =
=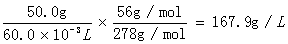
(2)产物聚合硫酸铁中Fe2+含量检测:
取1mL制备的聚铁溶液,置于250m L锥形瓶中,稀释至30mL,加入硫磷混酸,冷却后加入二苯胺磺酸钠溶液,并用K2Cr2O7标准溶液滴定。滴定时溶液由无色逐渐变成浅绿色,后绿色加深,最后呈紫色,到达滴定终点,滴定时共用去0.025mol/L的K2Cr2O7标准溶液4.30mL,根据反应过程方程式:
6Fe2+ + Cr2O72- + 14H+ = 6Fe3+ + 2Cr3+ + 7H2O
可计算出n(Fe2+) = 6×0.0025mol/L×4.30×10-3L = 6.45×10-5mol
因此原聚铁溶液中的Fe2+浓度为:C=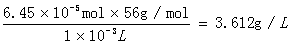
产率(转化率)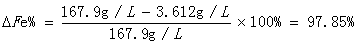
(3)产物碱化度检测:
取1mL制备的聚铁溶液,置于250m L锥形瓶中,准确加入25.00mL盐酸溶液,再加入20mL无CO2蒸馏水,摇匀,盖上表面皿,在室温下放置10min后,加入10mL KF溶液,5滴酚酞,用0.09588mol/L NaOH标准溶液滴定。滴定时溶液由白色逐渐变成粉红色,到达滴定终点,共用去NaOH标准溶液V=22.15mL;同样条件下,滴定空白试验样时,所用NaOH溶液体积为V0=27.22mL。
则碱化度计算如下:
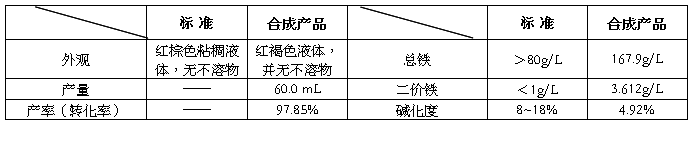
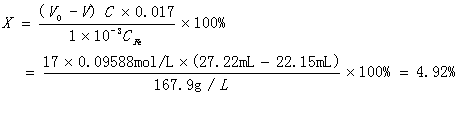
聚合硫酸铁产量与质量指标
三、实验分析与讨论
实验制备得到的聚合硫酸铁为红褐色液体。经过计算,其总铁含量为167.9g/L,大于标准的80g/L,产率(转化率)为97.85%,说明本次实验比较理想,具有较高的总铁浓度。但制得的产品二价铁含量3.612g/L高于标准值,说明Fe2+被氧化程度相对较低,且产品碱化度也较低,说明混凝剂的聚合度不高。分析实验过程中导致出现该结果的各种可能性:
1、将FeSO4·7H2O加入烧瓶中溶解时不能完全溶解,需通过搅拌、加热溶解所有固体溶解,所需的时间长。因此会在一定程度上减缓Fe2+被氧化的速率,从而降低了发生聚合的Fe3+的浓度,则最后所得的混凝剂的转化率下降,Fe2+含量增加;
2、在实验过程中控制水浴温度为50℃—60℃,加入H2O2时,一部分的H2O2因温度以及浓硫酸的强酸性、强氧化性作用之下迅速分解逃逸,这也导致实际参与反应的过氧化氢不足,Fe2+被氧化为Fe3+难度也就相应增大;
聚铁制备实验中,一般硫酸与硫酸亚铁的摩尔比控制在0.25-0.45的范围内,此比值或大或小时,可能会出现什么结果?
在反应中,当硫酸与硫酸亚铁的摩尔比小于0.25-0.45范围时,Fe3+在溶液中很容易直接水解成Fe(OH)3,甚至可能生成沉淀,因此难以形成聚合物;而当硫酸与硫酸亚铁的摩尔比大于0.25-0.45范围时,盐基度较低,产品难以聚合形成,絮凝效果差。
聚铁制备时要采用很快的搅拌速度,而混凝性能实验时则搅拌速度比较慢,为什么?
在聚铁制备过程中采用快速搅拌,为了促使反应物能充分接触,并且使聚合过程能够充分地进行,促进反应速率,提高产率;而在混凝剂的性能测验时降低搅拌速度,防止因强烈的搅拌扰动沉聚下来的沉淀,且破坏混凝剂的结构,影响其净水的作用。
四、结论
本实验采用直接氧化法,氧化硫酸亚铁,并使三价铁离子发生水解、聚合,形成新型的无机混凝剂聚合硫酸铁。本法操作简易,材料易于获得且无公害,方法经过改进后能在工业生产上有显著的优势。在制备混凝剂过程中,需注意硫酸与铁的配比,并且控制氧化剂用量、温度的控制、加入时间、反应时间的因素,提高产物产率及纯度。
五、参考文献:
[1]吕向红,叶炳林.聚铁——一种新型无机高分子混凝剂,广州化工,1990,(3):33
[2]陈平.混凝剂的开发进展.污染防治技术,2006,9(1):20
[3]郑怀礼, 刘克万. 无机高分子复合絮凝剂的研究进展及发展趋势[J]. 水处理技术, 2004,30(6): 315-319
[4]高礼让等.新型聚合硫酸铁的研制及其结构和净水效果的探讨.化学世界,1996,(10):519
