希托夫法测定离子迁移数
一、目的要求
1.掌握希托夫法测定离子迁移数的原理和LQY离子迁移数测定装置的使用方法,特别是铜库仑电量计的使用方法;
2.明确迁移数的概念;
3.了解电量计的使用原理和方法。
二、实验原理
电解质溶液的导电,是由于离子在电场作用下运动的结果,在电解质中,当有电流通过时,正、负离子均参与导电,阳离子向阴极迁移,阴离子向阳极迁移,由于阴、阳离子在溶液中的迁移速度不同,所以搬运电荷的量也不相同,但通过电解质溶液的总电量为两者迁移电量之和,现设定阴、阳离子搬运电量分别为Q-和Q+则总电量为:
Q总= Q- + Q+
在物理化学中,对于电解质溶液的导电机理的研究,用离子迁移数更为直观,通常将一种离子迁移的电量与通过电解质溶液的总电量之比称为该种离子的迁移数,并以符号t表示
阳离子迁移数:t+ = Q+/ Q总,Q+=z+n+迁移F
阴离子迁移数:t- = Q-/ Q总,Q-= z-n-迁移F
并且 t+ + t- = 1 (其中,z+,z-为正负离子所带电荷数,F为法拉第常数)
测定迁移数的方法有两种,一种是界面移动法,一种为电解法(即希托夫法)。本实验采用希托夫法测定CuSO4溶液中Cu2+的迁移数。希托夫法测定离子迁移数的示意图如图1所示。
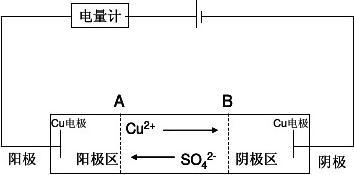
图1 希托夫法测定离子迁移数的示意图
将已知浓度的CuSO4溶液装入迁移管中(注:迁移管中所用电极为铜电极),若有Q库仑电量通过体系,在阴极和阳极上分别发生如下反应:
阳极: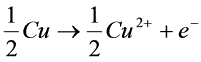 (1)
(1)
阴极: (2)
(2)
此时,溶液中Cu2+向阴极方向迁移,阴极上析出Cu,这时电解后阴极区Cu2+的物质的量n电解后Cu2+计算如下:
n电解后Cu2+=n原始Cu2+ + n迁移Cu2+ -n析出Cu
则,n迁移Cu2+= n电解后Cu2+- n原始Cu2++ n析出Cu
另外,SO42-离子向阳极方向迁移,阳极附近产生Cu2+,这时电解后阴极处SO42-的物质的量n 电解后SO42-计算如下:
n电解后SO42-= n原始SO42- + n迁移SO42- (3)
则,n迁移SO42-= n电解后SO42-- n原始SO42- (4)
电极反应与离子迁移引起的总结果是阴极区CuSO4浓度减小,阳极区的CuSO4浓度增大,且增加与减小的摩尔数相等。由于流过小室中每一截面的电量相同,因此离开与进入假想中间区Cu+数相同,SO42-数也相同,所以中间区的浓度在通电过程中保持不变。以阳极区CuSO4浓度变化为对象,结合上述可得计算离子迁移数的公式如下:
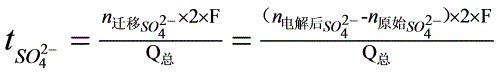 (5)
(5)
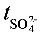 =1-
=1-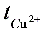 (6)
(6)
式中,F为法拉第常数;Q总为总电量,“2”表示SO42-所带电荷为2。Q总由铜库仑电量计测定。铜库仑电量计中也是一个CuSO4的电解槽(是一种特殊的电解槽,其电流效率为100%),它和迁移管中CuSO4的电解池串联,其电路连接如图2所示。
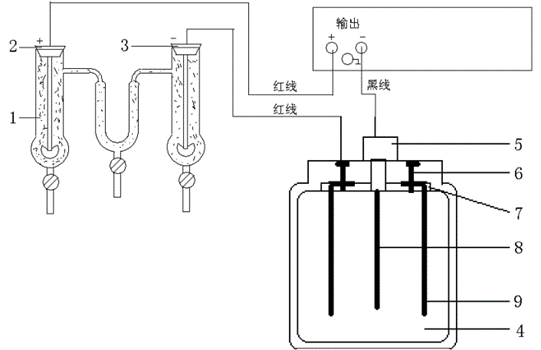
图2 LQY离子迁移数测定装置的电路连接图
其中,1---Hb迁移管,迁移管中电极为铜片;2---阳极;3---阴极;4---库仑计;5---阴极插座;6---阳极插座;7---电极固定板;8---阴极铜片;9---阳极铜片。在串联电路中通过迁移管中CuSO4溶液的Q总和通过铜库仑电量计中CuSO4溶液的Q总是相同的。铜库仑电量计中阴、阳极所发生的反应同式(1)和式(2),阴极铜片中析出铜,其质量增大,则通过铜库仑电量计中CuSO4溶液的Q总计算如下:
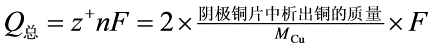 (7)
(7)
注意:(7)式中分母为1/2MCu (MCu为Cu的摩尔质量),是因为阴极反应式中带有1/2,具体原因可见课本P5。“阴极铜片上析出铜的质量”是指铜库仑电量计中阴极铜片。
将式(7)代入式(5)得:
 (8)
(8)
电解前后CuSO4浓度变化(注意是阳极区的CuSO4浓度)由滴定法测定。首先在铜离子溶液中加入过量的碘化钾,铜离子把电离子氧化成碘,生成的碘用硫代硫酸钠标准溶液滴定,从而间接求出铜离子的量。反应方程式如下:
 (9)
(9)
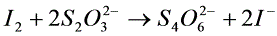 (10)
(10)
三、仪器药品
LQY离子迁移数测定装置,锥形瓶,0.05mol/LCuSO4溶液,10%KI溶液,1mol/L乙酸溶液,0.05mol/L NaS2O3溶液,0.5%淀粉溶液,6mol/L HNO3。
四、实验步骤
1. LQY离子迁移数测定装置简介
LQY离子迁移数测定装置的前面板示意图见图3。
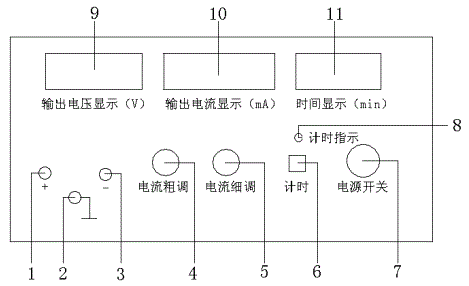
图3 LQY离子迁移数测定装置的前面板示意图
其中,1---正极接线柱:负载的正极接入处;2---接地接线柱;3---负极接线柱:负载的负极接入处;4---电流粗调:粗略调节电流所需电流值;5---电流细调:精确调节电流所需电流值;6---计时按钮:按下此按钮,停止或开始计时;7---电源开关;8---计时指示:计时开始计时指示灯亮;9---输出电压显示窗口:显示输出的实际电压值;10---输出电流显示窗口:显示输出的实际电流值;11---时间显示窗口:显示计时时间。注:
2. 具体实验操作步骤
(1)洗净所有的容器,用少量0.05mol/LCuSO4溶液洗涤希托夫迁移管3次,然后在迁移管中装满该溶液,迁移管中不应有气泡。
(2)将库仑计的阴极片放在6mol/L HNO3溶液中稍微洗涤一下,以除去表面的氧化层,用蒸馏水冲洗后,再用无水乙醇淋洗一下,用热空气将其吹干。在天平上称重得m1,然后放入库仑计。
特别注意库仑计的使用方法。(1)库仑计中共有三片铜片,两边铜片为阳极,中间铜片为阴极。(2)阳极铜片固定在电极固定板上,不可拆下,阴极铜片由阴极插座固定。拆下或固定阴极铜片时只需逆时针旋松或顺时针旋紧阴极插座即可。(3)电极固定板上有两个阳极插座,实验中可任意插入其中一个插座。
(3)将粗、细电流调节旋钮逆时针旋到底。
(4)按图3连接好测量线路。连接后面板电源插座。
(5)将电源开关置于“ON”位置,显示板即有显示。顺时针调节粗调旋钮,待接近所需电流15mA时,再顺时针调节细调旋钮,直到达到要求,按下计时按钮,开如计时(计时指示灯亮)。注意:在调节粗调旋钮时,一定要等电压、电流稳定后,再调下一档,切莫连续快速调节,另外,高压危险(实验过程电压大致在200v左右)。
(6)通电60分钟后,先将粗调旋钮逆时针旋到底,再将细调旋钮逆时针旋到底。注意:粗调旋钮的调节速度不应过快。
(7)切断电源,取出库仑计中的铜阴极,用蒸馏水冲洗后,用无水乙醇淋洗,再用热空气将其吹干,然后称重得m2。
(8)将阳极区溶液全部放入已知质量的锥形瓶后称重。
(9)测定阳极区溶液体积及滴定溶液中Cu2+浓度:①利用比重瓶测定阳极区的密度后再计算出阳极区溶液的总体积。②取10mL阳极区溶液加入10%KI溶液10mL和1mol/L 乙酸溶液10mL,先用0.05mol/L标准硫代硫酸钠溶液滴定至淡黄色,再加入1mL 0.5%淀粉滴至蓝紫色消失,溶液呈象牙粉色。
另外,还需要注意的事项有:(1)通电过程中,迁移管应避免振动。(2)电解结束时,尽快分流出阳极区溶液,瑾防各区域溶液混合。
五、数据处理
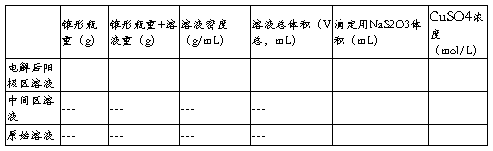
1. 数据记录
表1 基本数据

表2 各溶液相关质量与浓度
2. 此时,n(电解后SO42-)- n(原始SO42-)
=(电解后阳极区溶液中CuSO4浓度-原始溶液中CuSO4浓度)×V总= mol
将此结果代入式(8)中计算得到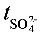 ,
,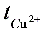 =1-
=1-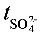 。
。
六、思考题
1. 实验中Q总为什么不用Q=It计算?对比使用Q=It计算所得Q总与使用库仑电量计计算Q总。
2.请简写利用阴极区电解前后CuSO4浓度变化求解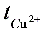 的过程。
的过程。
第二篇:希托夫法测定离子迁移数
希托夫法测定离子迁移数
平均室温: ℃ 平均气压: Kpa 同组人: 日期:2013/3/15
一、实验目的
1.掌握希托夫法测定电解质溶液中离子迁移数的基本原理和操作方法。
2. 测定CuSO4溶液中Cu2+和SO42-的迁移数。
二、实验原理
当电解质溶液通过电流时,在两电极上发生氧化和还原反应。反应物质的量与通过电量的关系服从法拉第定律。同时,在溶液中的正、负离子分别向阴、阳两极迁移,由于各种离子的迁移速度不同,各自所带过去的电量也必然不同。每种离子所带过去的电量与通过溶液的总电量之比,称为该离子在此溶液中的迁移数。当通过电量为Q法拉第时,有:
Q=Q++Q—
其中Q+是正离子所迁移的电量,Q—是负离子所迁移的电量。
Q值可由电量计阴极上沉积出物质的量求出。根据迁移数的定义某离子的迁移数就是该离子搬运的电量与通过的总电量之比,可得:
正离子迁移数t+=Q+ /Q =阳极区减少的量/(2×铜电量计阴极上沉积铜的量)
负离子迁移数t-=Q— /Q =阴极区减少的量/(2×铜电量计阴极上沉积铜的量)
在溶液中间区浓度不变的条件下,分析通电前原溶液及通电后阳极区(或阴极区)溶液的浓度,比较等重量溶剂所含电解质的量,可计算出通电前后迁移出阳极区(或阴极区)的电解质的量。
在迁移管中,两电极均为Cu电极。其中放CuSO4 溶液。通电时,溶液中的Cu2+ 在阴极上发生还原,而在阳极上金属银溶解生成Cu2+ 。因此,通电时一方面阳极区有Cu2+ 迁移出,另一方面电极上Cu溶解生成Cu2+ ,因而有:
n迁=n原+n电—n后
tCu2+ =(n迁/n电)tSO4 2 -=1-tCu2+
式中n迁表示迁移出阳极区的Cu2+的量,n原表示通电前阳极区所含Cu2+的量,n后表示通电后阳极区所含Cu2+的量,n电表示通电时阳极上Cu溶解(转变为Cu2+)的量,也等于铜电量计阴极上Cu2+析出Cu的量。
三、仪器与试剂
1、迁移数管 1支; 铜电量计 1套;
移液管 2支; 酸式滴定管 1支;
锥形瓶 6个;
2、硫酸铜溶液(0.05 mol.L-1 ); HNO3 (6 mol.L-1);
乙酸溶液 (1mol.L-1); KI溶液(10%);
淀指示剂(0.5%); 硫代硫酸钠溶液(0.0500mol.L-1);
四、主要实验步骤
1. 清洗迁移数管,注意活塞是否漏水。用少量硫酸铜溶液(0.05mol.L-1)淌洗两次,将该溶液充满迁移数管。(注意管中不能有气泡)
2. 用铜电量计测定通过溶液的电量。阴极和阳极皆为铜片,实验开始前用砂纸
将阴极铜片磨光,再用硝酸浸洗,然后用蒸馏水洗净,晾干。称其重量(W1)。
3.接通电源,使阴极铜片上的电流密度为10—15mA/cm2,通电60分钟后切断电源。取出阴极铜片用蒸馏水洗净,晾干。称其重量(W2)。
4、将迁移管中的溶液分别放入已称量的锥形瓶中,再称各瓶的重量,然后计算各溶液的净重。
5、取各瓶放出的溶液10mL,加入10%KI溶液中10mL,1mol.L-1乙酸溶液10mL,用标准硫代硫酸钠溶液滴定,滴至淡黄色,加入1mL0.5%淀粉,溶液变成蓝紫色,再滴至蓝紫色消失。
五、数据记录与处理
1、数据记录:
硫代硫酸钠溶液的浓度C=0.04912mol/L
阴极铜片的质量:反应前W1=34.4132g 反应后W2=34.4274g
电解得到的铜的质量为: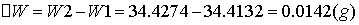
表1: 三极区溶液的质量

表2:硫代硫酸钠溶液对反应后阳极、阴极、中间区域的滴定
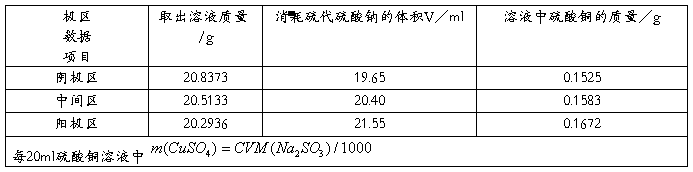
根据表2得出表3:

2.计算:
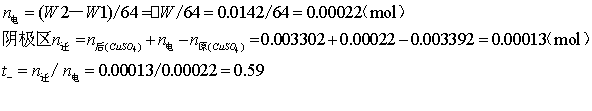 t+=1- t-=1-0.59=0.41
t+=1- t-=1-0.59=0.41
六、实验注意事项及体会:
1.实验中的铜电极必须是纯度为99。999%的电解铜。
2.实验过程中凡是能引起溶液扩散,搅动等因素必须避免。电极阴、阳极的位置能对调,迁移数管及电极不能有气泡,两极上的电流密度不能太大。
3.本实验中各部分的划分应正确,不能将阳极区与阴极区的溶液错划入中部,这样会引起实验误差 。
4.本实验由铜库仑计的增重计算电量,因此称量及前处理都很重要,需仔细进行。
5.昨晚实验后掌握了希托夫法测定电解质溶液中离子迁移数的基本原理和操作方法;能够测定并计算CuSO4溶液中Cu2+和SO42-的迁移数。
