实验十五 离子迁移数的测定
当电流通过电解质溶液时,溶液中的正负离子各自向阴、阳两极迁移,由于各种离子的迁移速度不同,各自所带过去的电量也必然不同。每种离子所带过去的电量与通过溶液的总电量之比,称为该离子在此溶液中的迁移数。若正负离子传递电量分别为q+和q-,通过溶液的总电量为Q, 则正负离子的迁移数分别为:
t+=q+/Q t-=q-/Q
离子迁移数与浓度、温度、溶剂的性质有关,增加某种离子的浓度则该离子传递电量的百分数增加,离子迁移数也相应增加;温度改变,离子迁移数也会发生变化,但温度升高正负离子的迁移数差别较小;同一种离子在不同电解质中迁移数是不同的。
离子迁移数可以直接测定,方法有希托夫法、界面移动法和电动势法等。
(一) 希托夫法测定离子迁移数
【目的要求】
1. 掌握希托夫法测定离子迁移数的原理及方法。
2. 明确迁移数的概念。
3. 了解电量计的使用原理及方法。
【实验原理】
希托夫法测定离子迁移数的示意图如图2-15-1所示 :
将已知浓度的硫酸放入迁移管中,若有Q库仑电量通过体系,在阴极和阳极上分别发生如下反应:
阳极: 2OH-→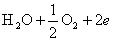
阴极: 2H+ +2e→ H2
此时溶液中H+离子向阴极方向迁移,SO2-4离子向阳极方向迁移。电极反应与离子迁移引起的总后果是阴极区的H2SO4浓度减少,阳极区的H2SO4浓度增加,且增加与减小的浓度数值相等,因为流过小室中每一截面的电量都相同,因此离开与进入假想中间区的H+离子数相同,SO2-4离子数也相同,所以中间区的浓度在通电过程中保持不变。由此可得计算离子迁移数的公式如下:

式中,F=96500C·mol-1为法拉第(Farady)常数;Q为总电量。
图2-15-1所示的三个区域是假想分割的,实际装置必须以某种方式给予满足。图2-15-2的实验装置提供了这一可能,它使电极远离中间区,中间区的连接处又很细,能有效地阻止扩散,保证了中间区浓度不变的可信度。
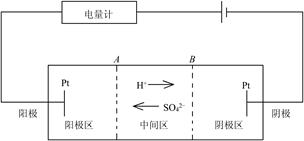
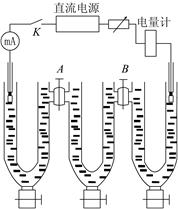
图2-15-1希托夫法测定离子迁移数 图2-15-2 希托夫法测定离子迁移数装置图

【仪器试剂】
迁移管1套; 铂电极2只; 精密稳流电源1台; 气体电量计1套; 分析天平1台; 碱式滴定管(250mL)1只; 三角瓶(100mL)3只; 移液管(10mL)3只; 烧杯(50ml)3只; 容量瓶(250mL)1只。
浓H2SO4; 标准NaOH溶液(0.1mol·dm-3) 。
【实验步骤】
1. 溶液的配制及装样: 配制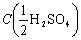 为0.1mol·dm-3的H2SO4的溶液250mL,并用标准NaOH溶液标定其浓度。 然后用该H2SO4溶液冲洗迁移管后,装满迁移管。
为0.1mol·dm-3的H2SO4的溶液250mL,并用标准NaOH溶液标定其浓度。 然后用该H2SO4溶液冲洗迁移管后,装满迁移管。
2. 打开气体电量计活塞,移动水准管,使量气管内液面升到起始刻度,关闭活塞,比平后记下液面起始刻度。
3. 按图接好线路,将稳流电源的“调压旋钮”旋至最小处。 经教师检查后,接通开关K,打开电源开关,旋转“调压旋钮”使电流强度为10mA~15mA,通电约1.5h后,立即夹紧两个连接处的夹子,并关闭电源。
4. 将阴极液(或阳极液)放入一个已称重的洁净干燥的烧杯中,并用少量原始H2SO4液冲洗阴极管(或阳极管)一并放入烧杯中,然后称重。中间液放入另一洁净干燥的烧杯中。
5. 取10mL阴极液(或阳极液)放入三角瓶内,用标准NaOH溶液标定。再取10mL中间液标定之,检查中间液浓度是否变化。
6. 轻弹气量管,待气体电量计气泡全部逸出后,比平后记录液面刻度。
【注意事项】
? 电量计使用前应检查是否漏气。
? 通电过程中,迁移管应避免振动。
? 中间管与阴极管、阳极管连接处不留气泡
? 阴极管、阳极管上端的塞子不能塞紧
【数据处理】
1.将所测数据列表
室温 ; 大气压 ; 饱和水蒸气压 ; 气体电量计产生气体体积V ;标准NaOH溶液浓度 。
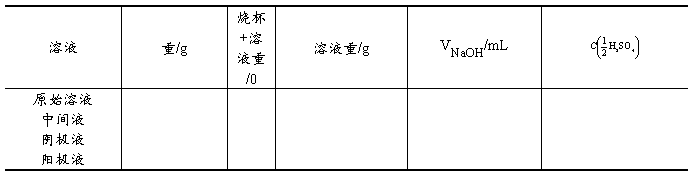
2. 计算通过溶液的总电量Q
3. 计算阴极液通电前后H2SO4减少的量n
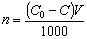
式中,C0为H2SO4原始浓度;C为通电后H2SO4浓度;V为阴极液体积(cm3),由V=W/ρ 求算(W为阴极液的重量,ρ为阴极液的密度,20℃时0.1mol·dm-3 H2SO4 的ρ=1.002g·cm-3)。
4. 计算离子的迁移数 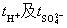 。
。
思 考 题
1. 如何保证电量计中测得的气体体积是在实验大气压下的体积?
2. 中间区浓度改变说明什么?如何防止?
3. 为什么不用蒸馏水而用原始溶液冲洗电极?
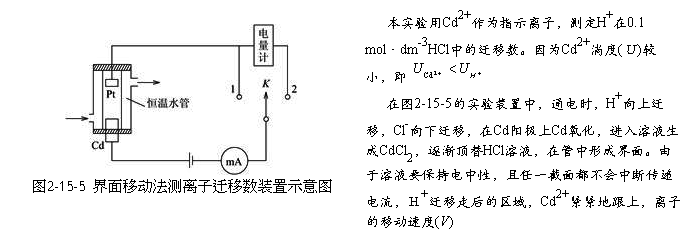
(二) 界面移动法测定离子迁移数
【实验原理】

Q为通过溶液的总电量;V为界面移动的体积,可用称量充满aa′和bb′间的水的重量校正之。
是相等的, 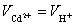 由此可得:
由此可得:
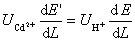
结合上式得:
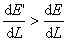
即在CdCl2溶液中电位梯度是较大的,如图2-15-3所示。因此若H+因扩散作用落入CdCl2溶液层。它就不仅比Cd2+迁移得快,而且比界面上的H+也要快,能赶回到HCl层。同样若任何Cd2+进入低电位梯度的HCl溶液,它就要减速,一直到它们重又落后于H+为止,这样界面在通电过程中保持清晰。
【仪器试剂】
精密稳流电源;电量计1套;烧杯(25ml)一只。
HC1 0.1 mol·dm-3;甲基橙(或甲基紫)指示剂。
【实验步骤】
1. 在小烧杯中倒入约10mL 0.1 mol·dm-3HCl,加入少许甲基紫,使溶液呈深蓝色。 并用少许该溶液洗涤迁移管后,将溶液装满迁移管,并插入Pt电极。
2. 打开气体电量计活塞,移动水准管使气量管液面升至上部起始刻度,关闭活塞,比平后读取气量管液面起始刻度。
3. 按图2-15-5连接线路,将稳压电源的“电压调节旋钮”旋至最小处,开关K打向“1”。 经教师检查线路后,方可接通电源,并旋转“调压旋钮”,使电流强度为5mA~7mA,注意实验过程中如变化较大要及时调节。
4. 当迁移管内蓝紫色界面达到起始刻度时,立即将开关K打向“2”,当蓝紫色界面迁移1mL后,立即关闭电源开关,用手弹气量管,待全部气体自液体中逸出,比平后读取气量管液面刻度。
【注意事项】
? 通过后由于CdCl2层的形成电阻加大,电流会渐渐变小,因此应不断调节电流使其保持不变。
? 通电过程中,迁移管应避免振动
【数据处理】
计算 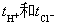 。讨论与解释观察到的实验现象,将结果与文献值加以比较。
。讨论与解释观察到的实验现象,将结果与文献值加以比较。
思 考 题
1. 本实验关键何在?应注意什么?
2. 测量某一电解质离子迁移数时,指示离子应如何选择?指示剂应如何选择?
【讨论】
在离子迁移数的实验中测总电量的方法除了气体电量计法外还有电流—时间法和库仑计法。
电流—时间法实验装置如图2-15-6所示。其操作方法如下:
接通开关K与电源D相通,调节电位器R保持电流在5mA~7mA之间。随电解进行在迁移管下部形成一个清晰的界面,当界面移动到 第一个刻度时,立即开动秒表,此时要随时调节电位器R,使电流I保持定值。当界面移到第二个刻度时,立即记下时间(但不停秒表),继续通电记时,记录界面达到第三个刻度和第四个刻度的时间。
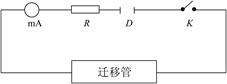
图2-15-6 电流—时间测总电量示意图
第二篇:希托夫法测定离子迁移数
希托夫法测定离子迁移数
一、目的要求
1.掌握希托夫法测定离子迁移数的原理和LQY离子迁移数测定装置的使用方法,特别是铜库仑电量计的使用方法;
2.明确迁移数的概念;
3.了解电量计的使用原理和方法。
二、实验原理
电解质溶液的导电,是由于离子在电场作用下运动的结果,在电解质中,当有电流通过时,正、负离子均参与导电,阳离子向阴极迁移,阴离子向阳极迁移,由于阴、阳离子在溶液中的迁移速度不同,所以搬运电荷的量也不相同,但通过电解质溶液的总电量为两者迁移电量之和,现设定阴、阳离子搬运电量分别为Q-和Q+则总电量为:
Q总= Q- + Q+
在物理化学中,对于电解质溶液的导电机理的研究,用离子迁移数更为直观,通常将一种离子迁移的电量与通过电解质溶液的总电量之比称为该种离子的迁移数,并以符号t表示
阳离子迁移数:t+ = Q+/ Q总,Q+=z+n+迁移F
阴离子迁移数:t- = Q-/ Q总,Q-= z-n-迁移F
并且 t+ + t- = 1 (其中,z+,z-为正负离子所带电荷数,F为法拉第常数)
测定迁移数的方法有两种,一种是界面移动法,一种为电解法(即希托夫法)。本实验采用希托夫法测定CuSO4溶液中Cu2+的迁移数。希托夫法测定离子迁移数的示意图如图1所示。
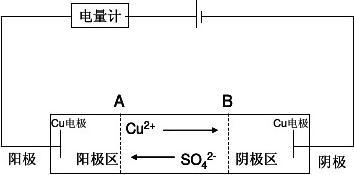
图1 希托夫法测定离子迁移数的示意图
将已知浓度的CuSO4溶液装入迁移管中(注:迁移管中所用电极为铜电极),若有Q库仑电量通过体系,在阴极和阳极上分别发生如下反应:
阳极: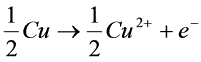 (1)
(1)
阴极: (2)
(2)
此时,溶液中Cu2+向阴极方向迁移,阴极上析出Cu,这时电解后阴极区Cu2+的物质的量n电解后Cu2+计算如下:
n电解后Cu2+=n原始Cu2+ + n迁移Cu2+ -n析出Cu
则,n迁移Cu2+= n电解后Cu2+- n原始Cu2++ n析出Cu
另外,SO42-离子向阳极方向迁移,阳极附近产生Cu2+,这时电解后阴极处SO42-的物质的量n 电解后SO42-计算如下:
n电解后SO42-= n原始SO42- + n迁移SO42- (3)
则,n迁移SO42-= n电解后SO42-- n原始SO42- (4)
电极反应与离子迁移引起的总结果是阴极区CuSO4浓度减小,阳极区的CuSO4浓度增大,且增加与减小的摩尔数相等。由于流过小室中每一截面的电量相同,因此离开与进入假想中间区Cu+数相同,SO42-数也相同,所以中间区的浓度在通电过程中保持不变。以阳极区CuSO4浓度变化为对象,结合上述可得计算离子迁移数的公式如下:
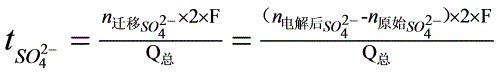 (5)
(5)
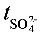 =1-
=1-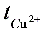 (6)
(6)
式中,F为法拉第常数;Q总为总电量,“2”表示SO42-所带电荷为2。Q总由铜库仑电量计测定。铜库仑电量计中也是一个CuSO4的电解槽(是一种特殊的电解槽,其电流效率为100%),它和迁移管中CuSO4的电解池串联,其电路连接如图2所示。
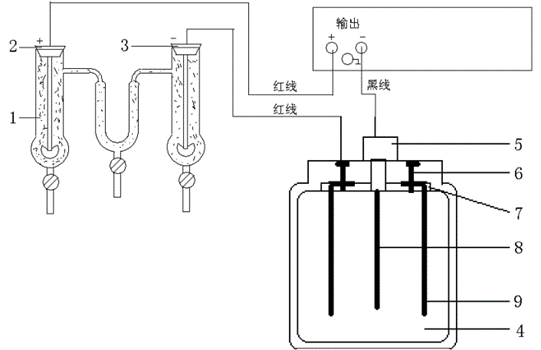
图2 LQY离子迁移数测定装置的电路连接图
其中,1---Hb迁移管,迁移管中电极为铜片;2---阳极;3---阴极;4---库仑计;5---阴极插座;6---阳极插座;7---电极固定板;8---阴极铜片;9---阳极铜片。在串联电路中通过迁移管中CuSO4溶液的Q总和通过铜库仑电量计中CuSO4溶液的Q总是相同的。铜库仑电量计中阴、阳极所发生的反应同式(1)和式(2),阴极铜片中析出铜,其质量增大,则通过铜库仑电量计中CuSO4溶液的Q总计算如下:
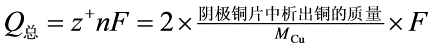 (7)
(7)
注意:(7)式中分母为1/2MCu (MCu为Cu的摩尔质量),是因为阴极反应式中带有1/2,具体原因可见课本P5。“阴极铜片上析出铜的质量”是指铜库仑电量计中阴极铜片。
将式(7)代入式(5)得:
 (8)
(8)
电解前后CuSO4浓度变化(注意是阳极区的CuSO4浓度)由滴定法测定。首先在铜离子溶液中加入过量的碘化钾,铜离子把电离子氧化成碘,生成的碘用硫代硫酸钠标准溶液滴定,从而间接求出铜离子的量。反应方程式如下:
 (9)
(9)
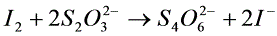 (10)
(10)
三、仪器药品
LQY离子迁移数测定装置,锥形瓶,0.05mol/LCuSO4溶液,10%KI溶液,1mol/L乙酸溶液,0.05mol/L NaS2O3溶液,0.5%淀粉溶液,6mol/L HNO3。
四、实验步骤
1. LQY离子迁移数测定装置简介
LQY离子迁移数测定装置的前面板示意图见图3。
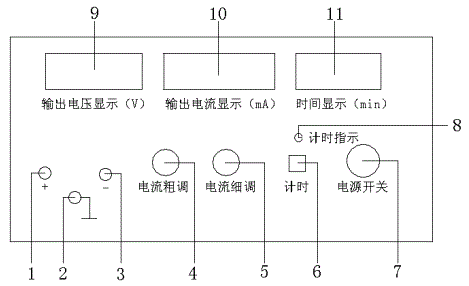
图3 LQY离子迁移数测定装置的前面板示意图
其中,1---正极接线柱:负载的正极接入处;2---接地接线柱;3---负极接线柱:负载的负极接入处;4---电流粗调:粗略调节电流所需电流值;5---电流细调:精确调节电流所需电流值;6---计时按钮:按下此按钮,停止或开始计时;7---电源开关;8---计时指示:计时开始计时指示灯亮;9---输出电压显示窗口:显示输出的实际电压值;10---输出电流显示窗口:显示输出的实际电流值;11---时间显示窗口:显示计时时间。注:
2. 具体实验操作步骤
(1)洗净所有的容器,用少量0.05mol/LCuSO4溶液洗涤希托夫迁移管3次,然后在迁移管中装满该溶液,迁移管中不应有气泡。
(2)将库仑计的阴极片放在6mol/L HNO3溶液中稍微洗涤一下,以除去表面的氧化层,用蒸馏水冲洗后,再用无水乙醇淋洗一下,用热空气将其吹干。在天平上称重得m1,然后放入库仑计。
特别注意库仑计的使用方法。(1)库仑计中共有三片铜片,两边铜片为阳极,中间铜片为阴极。(2)阳极铜片固定在电极固定板上,不可拆下,阴极铜片由阴极插座固定。拆下或固定阴极铜片时只需逆时针旋松或顺时针旋紧阴极插座即可。(3)电极固定板上有两个阳极插座,实验中可任意插入其中一个插座。
(3)将粗、细电流调节旋钮逆时针旋到底。
(4)按图3连接好测量线路。连接后面板电源插座。
(5)将电源开关置于“ON”位置,显示板即有显示。顺时针调节粗调旋钮,待接近所需电流15mA时,再顺时针调节细调旋钮,直到达到要求,按下计时按钮,开如计时(计时指示灯亮)。注意:在调节粗调旋钮时,一定要等电压、电流稳定后,再调下一档,切莫连续快速调节,另外,高压危险(实验过程电压大致在200v左右)。
(6)通电60分钟后,先将粗调旋钮逆时针旋到底,再将细调旋钮逆时针旋到底。注意:粗调旋钮的调节速度不应过快。
(7)切断电源,取出库仑计中的铜阴极,用蒸馏水冲洗后,用无水乙醇淋洗,再用热空气将其吹干,然后称重得m2。
(8)将阳极区溶液全部放入已知质量的锥形瓶后称重。
(9)测定阳极区溶液体积及滴定溶液中Cu2+浓度:①利用比重瓶测定阳极区的密度后再计算出阳极区溶液的总体积。②取10mL阳极区溶液加入10%KI溶液10mL和1mol/L 乙酸溶液10mL,先用0.05mol/L标准硫代硫酸钠溶液滴定至淡黄色,再加入1mL 0.5%淀粉滴至蓝紫色消失,溶液呈象牙粉色。
另外,还需要注意的事项有:(1)通电过程中,迁移管应避免振动。(2)电解结束时,尽快分流出阳极区溶液,瑾防各区域溶液混合。
五、数据处理
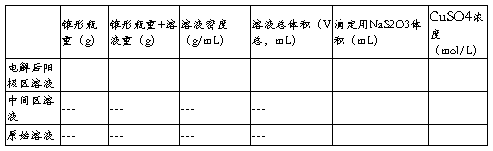
1. 数据记录
表1 基本数据

表2 各溶液相关质量与浓度
2. 此时,n(电解后SO42-)- n(原始SO42-)
=(电解后阳极区溶液中CuSO4浓度-原始溶液中CuSO4浓度)×V总= mol
将此结果代入式(8)中计算得到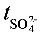 ,
,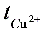 =1-
=1-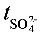 。
。
六、思考题
1. 实验中Q总为什么不用Q=It计算?对比使用Q=It计算所得Q总与使用库仑电量计计算Q总。
2.请简写利用阴极区电解前后CuSO4浓度变化求解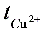 的过程。
的过程。
