离子迁移数的测定——界面法
姓名:张冶 学号: 班级:化21
同组实验者:努尔艾力·麦麦提
实验日期:20##年12月4日 提交报告日期:20##年12月7日
实验助教:王溢磊
1 引言
1.1 实验目的
1.采用界面法测定H+离子的迁移数。
2.掌握测定离子迁移数的基本原理与方法。
1.2 实验原理[1]
当电流通过电解池溶液时,电极上发生化学变化,溶液中阳离子与阴离子分别向阴极和阳极迁移。若两种离子传递的电荷量分别为q+和q-,通过的总电荷量为
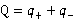
每种离子传递的电荷量与总电荷量之比称为离子迁移数,则阴、阳离子的迁移数分别为
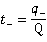
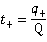
且 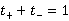
在包含数种电解质的溶液中,t-和t+分别为所有阴、阳离子迁移数总和,一般增加某种离子浓度,其离子迁移数增加;对只含一种电解质的溶液,浓度的改变使离子间引力场改变,自然离子迁移数也改变;若温度改变,迁移数亦变化,一般温度升高时,t-和t+差别减小。
实验中采用界面法,以镉离子作为指示离子,测量一定浓度的盐酸溶液中H+离子迁移数。在一截面均匀的垂直放置的迁移管中充满盐酸溶液,通以电流,当有Q电量的电流通过每个静止的截面时,t+Q当量的H+上行,t-Q当量的Cl-通过界面下移。假定在管的下部某处存在一个界面,界面以下没有H+而被Cd2+取代,此界面将随H+的上移而移动,界面位置可利用界面上下溶液pH值的不同,使用指示剂显色。正常条件下界面保持清晰,界面以上的一段溶液保持均匀,H+向上迁移的平均速率等于界面上移速率。在某通电时间t内,界面扫过体积V,H+输送电荷数为该体积中H+带电总数,即

 式中:C为H+的浓度,F为法拉第常数,电荷量以库[仑](C)计。
式中:C为H+的浓度,F为法拉第常数,电荷量以库[仑](C)计。
要想使界面保持清晰,须使界面上、下的电解质不相混合,这可通过选择合适的指示离子在通电情况下达到,Cd2+就符合这个要求。Cd2+的淌度(U)较小,有
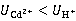
通电时,H+上行Cl-下移,Cd在Cd电极上氧化并经入溶液中生成CdCl2,逐渐顶替HCl,在管内形成界面。由于溶液呈电中性,任意截面都不会中断传递电流,H+迁移走后Cd2+紧随其后且两者迁移速率相等,则
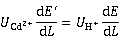
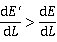
说明CdCl2溶液中电位梯度较大(如图1),导致H+难以扩散至下层,而Cd2+也难以扩散到界面以上,可保持界面清晰。
2 实验操作
2.1 实验药品、仪器型号及测试装置示意图
一次性移液管,DC-0510节能型智能恒温槽,DHD 300 V/500 mA直流稳压稳流电源,Cd电极,针状Ag电极,UT56数字万用电表,HCl-甲基橙溶液(HCl浓度为0.100 mol/L),秒表。
2.2 实验条件
实验室中为102.10 kPa,11.2 ℃。
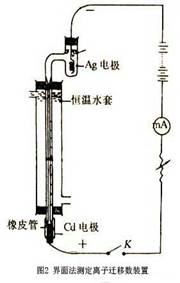 2.3 实验操作步骤及方法要点
2.3 实验操作步骤及方法要点
1) 用带有甲基橙的盐酸润洗两次迁移管,然后加满盐酸溶液。将镉电极打磨后在套管中加满盐酸溶液,安装在迁移管下部,并注意排出气泡。将银电极置于顶部,迁移管垂直固定避免震荡,连接好线路。
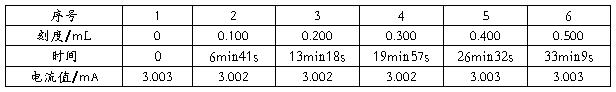
2) 调稳压稳流电源至稳压,电流6~7mA。当界面移动到第一个刻度时,立刻打开秒表。此后每隔一分钟记录时间及对应的电流值。每当界面移动至第二、第三等整数刻度时,记下相应的时间及对应的电流值,直到界面移动至第五个刻度(每两个刻度的间隔为0.1mL)。
3) 关闭开关,过几分钟后观察界面,再打开电源,数分钟再观察。试解释该现象。
4) 用恒电流方法重复实验(I=3mA),只需记录电流值及界面迁移到整数刻度(0.1 mL,0.2 mL…0.5mL)的时间。
5) 实验完成,清洗迁移管,整理实验台。
3 结果与讨论
3.1 原始实验数据
溶液酸度为0.100mol/L。
水浴温度:25.0℃ 室温:11.2℃ 室内压力:102.10kPa
1)恒压条件洗下测定数据:
表1 恒压条件下测的数据
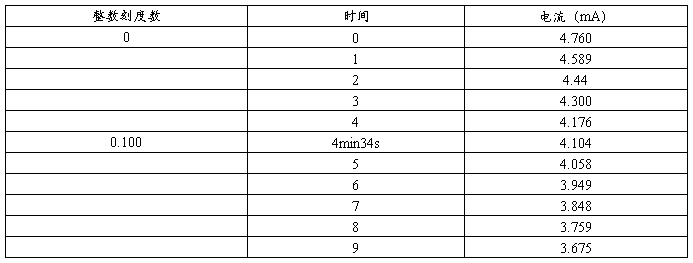
续表1 恒压条件下测的数据
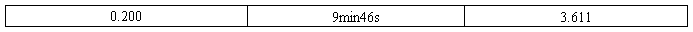
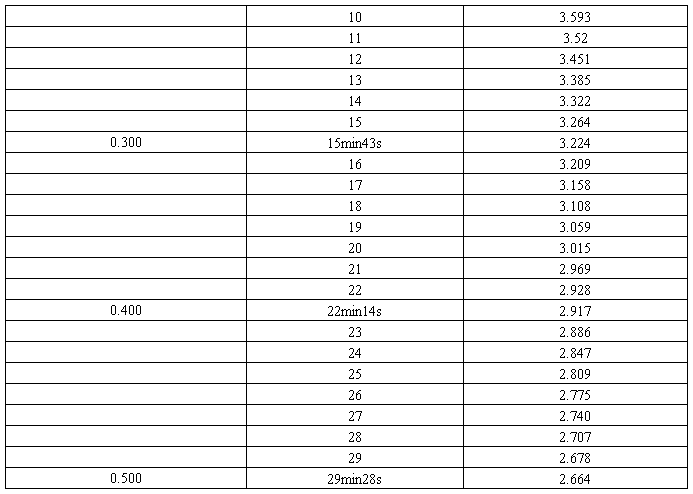
2)恒流测量数据:
恒流条件下电流值
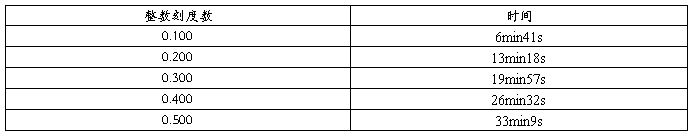
表2 恒流条件下数据的测量
3.2计算的数据、结果
a. 恒压数据处理思路:
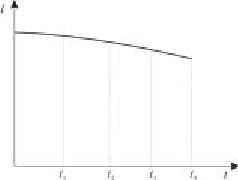
1) 选定几组刻度范围,做出电流—时间图,利用曲线所包围的面积求出几组刻度范围内的电荷量Q。
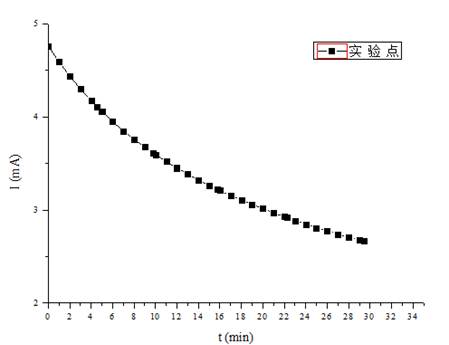
图1 恒压下I-t曲线
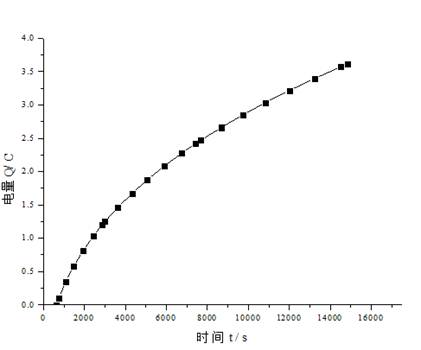
图2 恒压下电量-t积分曲线
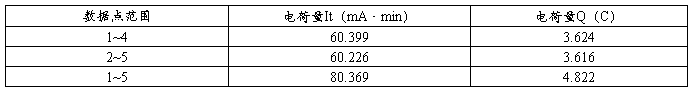
定三组刻度范围刻度1~4,2~5,1~5。利用origin计算积分,求出三组刻度范围所对应时间内的电荷量如下:
表3 恒压下定区域电荷量
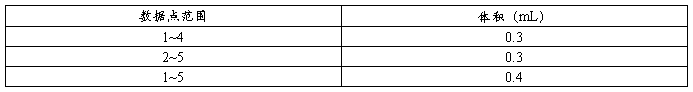
2) 求出几组刻度范围间的体积V。
因为相邻两个整数刻度间的体积为0.1mL,所以上述数据点范围间的相应体积为:
表4 恒压下体积比变化
3) 利用 和
和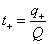 ,求出迁移数,取几组数据的平均值。
,求出迁移数,取几组数据的平均值。
表5 恒压下数据处理结果
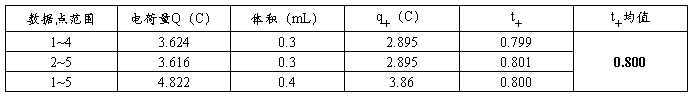
文献值0.831。[2](注:此文献值为盐酸浓度为0.100mol/L下氢离子的迁移数,此处取为近似参考值)
相对误差
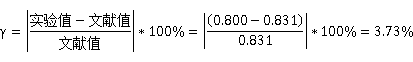
b. 恒流数据处理思路:
表6 电流恒定时的数据
(2)电流恒定:分别为电流恒定条件下的电流-时间曲线和积分曲线。
图3 恒流时电流波动
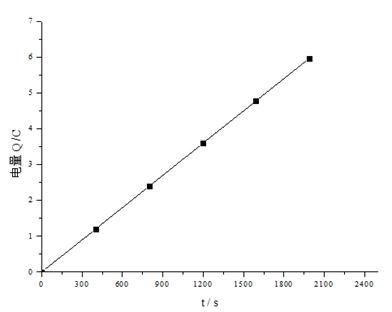
图4 恒流下电量-t积分曲线
从积分曲线图中可以读出第1、2、4、5整刻度点处(取0.1 mL刻度为第一刻度)的电量值,分别为1563.61 mC、3091.23 mC、6158.27 mC、7701.50 mV,列出表4
表7恒流下定区域电荷量
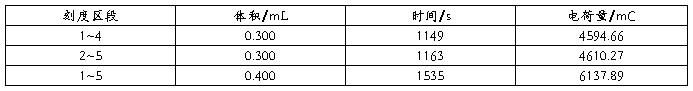
表8 恒压下数据处理结果
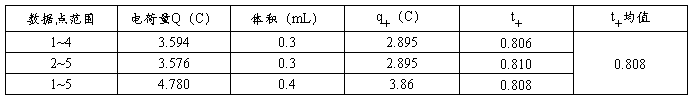
相对误差
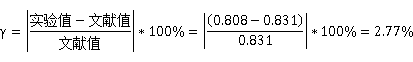
3.3 讨论分析
查阅文献得,25℃时,H+浓度为0.1 mol/L时,氢离子的迁移数为0.831,实验数据的处理结果分别为0.800和0.808,偏差分别为3.73%与2.77%,两次结果均偏小,但误差不是很大。
实验中观察到管内出现界面,界面上部分溶液为红色,下部呈无色。并且界面随着反应的不断进行而逐渐上移随着电解反应的进行,界面不断上移,且在Ag电极表面,不断有气泡产生,进入到大气中。
关闭电源后,发现原有的清晰界面逐渐表模糊,但是再次打开电源后,几分钟内,界面重新出现且变清晰,并继续上移。
这是因为关闭电源后,外电场不再给体系施加作用,导致H+逐渐扩散至界面以下,使界面模糊。当又打开电源后,外加电场重新作用,使H+向上移动,从而重新产生清晰界面。
实验中,将Ag电极置于上端而Cd电极置于下端,这是因为在反应的过程中会在Ag电极上不断产生氢气,若将Ag电极置于下端,产生的气泡将从整个装置中流过,将引起氢离子的浓度波动,破坏实验整体的稳定性。
3.4 误差分析
两种方法的测量均存在的一个问题就是对是否到达整数刻度的判断。由于刻度线存在一定的宽度,读数时需保证每次液面均提升到同一位置后再记录,否则可能由于确定是否达到整数刻度的标准不同,造成记录上的误差。
还有就是仪器内部的润洗、电极的打磨等,都会对实验结果造成一定的误差。
对于恒压测量,主要误差可能出现在电流示数的读取。在开始计时初期,由于电流下降较快,万用表的示数变化比较快,可能在记录时,在较短的时间内先后观测到两个值,从而在取舍时发生一定的错误。
对于恒流测量,虽然电流出现过一定的波动,但其波动仅为0.001mA,影响不大,不过由于数据点的数量很少,所以可能由于数据过少而使最后的结果并不可靠。
4 结论
25 ℃条件下,在氢离子为1mol/L的情况下,恒压条件下测得的氢离子迁移数为0.800,恒流条件下测得的氢离子的迁移数为0.808。
5参考文献
[1] 贺德华,麻英,张连庆.基础物理化学实验.北京:高等教育出版社,2008:76-80.
[2] 朱文涛, 基础物理化学下册,北京,清华大学出版社,2011.11
6 附录
思考题
1. 为什么在迁移过程中会得到一个稳定界面?为什么界面移动速率就是H+离子移动
速率?
答:Cd2+的淌度(U)较小,而H+和Cd2+迁移速率相等,所以CdCl2溶液中电位梯度是很大的。因此,若H+扩散至CdCl2溶液中,则它就不仅比Cd2+迁移的快,而且比界面上的H+迁移的也要快,能返回HCl层,同样若Cd2+向上扩散至HCl溶液中也会很快返回至界面以下,这样界面将保持清晰。总的过程类似于负反馈。
2. 实验过程中电流值为什么会逐渐减小?
答:因为实验中采取的是稳压的方式,随着电解的进行,溶液中H+浓度越来越小,而Cd2+的浓度则越来越大,Cd2+的淌度小,即相当于电阻不断增大,在等电压的情况下,由I=U/R可得,电流值不断减小。
3. 如何求得Cl-离子的迁移数?
答:溶液中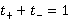 ,所以要得到Cl-的迁移数,只要用1减去H+迁移数即可。
,所以要得到Cl-的迁移数,只要用1减去H+迁移数即可。
7 总结
这是本学期最后一次物化实验课,实验并不是很复杂,做得也比较快,但是收获却很多。
老师上课并没有只是单纯的教给我们实验操作和方法,更多的是让我们去思考为什么这么做,仔细思考实验中的每一步的操作原因,加深了我们对本实验、本实验装置的理解。这种启发式指导能让我们学到更多地知识,掌握与实验相关的比较重要的但却容易忽视的问题,而不仅仅是单纯的去做实验。希望以后的物化实验能做出类似的改进。
第二篇:离子迁移数测定
离子迁移数测定
一 实验目的
掌握界面移动法测定H+ 离子移数的基本原来和方法,通过求算H+离子的电迁移率,加深对电解质溶液有关概念的理解。
二 实验原理
电解质溶液的导电是靠溶液内的离子定向迁移和电极反应来实现的。而通过溶液的总电量Q就是向两极迁移的阴、阳离子所输送电量的总和。现设两种离子输送的电量分别为Q+、Q-,则总电量 Q = Q+ + Q -= I t (2-124)
为了表示每一种离子对总电量的贡献,令离子迁移数为t+与t-, 则:
QQt+=+,t?=? QQ
(2-125)
离子的迁移数与离子的迁移速度有关,而
后者与溶液中的电位梯度有关。为了比较离子
的迁移速度,引入离子电迁移率概念。它的物
理意义为:当溶液中电位梯度为1Vxm时的
?1?1式中I为电流强度,t为通电时间。 离子迁移速度,用u+、u- 表示,单位为mxs
xV 。
本实验采用界面移动法测定HCl溶液中
H离子的迁移数,其原理如图2-58所示。在
一根垂直安置的有体积刻度的玻璃管中,装入
含甲基橙指示剂的HCl溶液,顶部插入Pt丝
作阴极,底部插入Cd极作阳极。通电后,H
? + + ?12 图2-58 迁移管中离子迁移示意图
2+ 离子向Pt极迁移,放出氢气,Cl离子向Cd极迁移,且在底部与由Cd电极氧化而生成的Cd
逐步替代HCl溶液。由于Cd2+ +

离子形成CdCl2溶液,离子的电迁移率小于H离子,所以底部
的Cd2+ 离子总是跟在H离子后面向上迁移。因为CdCl2与HCl对指示
++ 剂呈现不同的颜色,因此在迁移管内形成了一个鲜明的界面。下层Cd
子迁移的平均速度。
+ 若溶液中H离子浓度为c2+ 离子层为黄色,上层H 离子层为红色。这个界面移动的速度即为H+ 离H+,实验测得t时间内界面从1-1到2-2
+ 移动过的相应体积为V,则根据式(2-124)与式(2-125),H离子的迁移
数为 tH+=cH+VF
It
?1 (2-126) 式中F为法拉第常数,96 485Cxmol。
应该指出,由于迁移管内任一位置都是电中性的,所以当下层的H离子迁移后即由Cd
Cd
2+ + 2+ 离子来补充。这样,稳定界面的存在意味着+ 离子的迁移速度与H离子的迁移速度相等。即 ?dE??dE???? (2-127) =u2+?uCd?dl?2+H+?dl?+??Cd层??H层
?dE?式中??dl??为迁移管内的电位梯度,即单位长度上的电位降。
??
?dE??dE???所以?因为离子电迁移率不同,u2+<u+,>?dl?2+?dl??+。CdH??Cd层??H层
此式表明Cd
的Cd2+ 2+ 离子层电位梯度比H离子层大,也即Cd+ + + 2+ 离子层单位长度的电阻较大。因此,若在下层有H离子,其迁移速度不仅比同层离子快,而且要比处在上层的H离子也快,它总能赶到上层去。
2+ 反之,超前的Cd离子也必会减慢迁移速度而到下层来。这样,形成
+ 2+ 并保持了稳定的界面。同时,随着界面上移,H离子浓度减小,Cd离
子浓度增加,迁移管内溶液电阻不断增大,整个回路的电流会逐渐下降。
通过离子迁移数的测定,用下式可求得离子的电迁移率: tΛmtΛm ,u?=? (2-128) u+=+
FF
式中Λm为一定温度下溶液的摩尔电导率,单位为S?m2?mol?1。
三 试剂与仪器
试剂:0.1molxL?1 HCl标准
溶液,0.1%的甲基橙指示剂,
Cd棒(φ 3×30 mm),Pt丝。
仪器:带恒温水夹套迁移
管,300V直流电源,100?标准
电阻,毫安表,数字电压表,秒
表。
仪器装置见图2-59。
四 实验步骤
1. 用去离子水与待测液先
后淋洗迁移管的内壁,注入含甲
基橙指示剂的浓度为0.1molxL?1
图2-59 界面移动法实验装置 的HCl标准溶液(其体积比为:
指示剂:酸= 5:100)。通恒温水使系统恒温于25.0 ± 0.1℃。
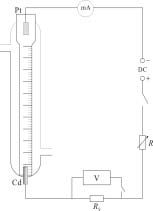
2. 按图2-59接好线路。图中V表为数字电压表,Rs为标准电阻,R为可变电阻,DC为直流电源。控制直流电源输出电压为300V,调节电阻R,使电流控制在3 mA左右。(注意:高压直流电危险!)
3. 待迁移管内界面移动到0.2 mL时开始计时,界面每移过0.02 mL记录相应的时间和数字电压表读数。直至界面移动到0.5 mL为止。 五 数据处理
1. 由测得电压U及标准电阻R s,求得电流I=U,以此电流Ι对Rs
相应的时间t作图,如图2-60所示,求出其包围的面积即总电量I t。如为直线,可按梯形法求出面积。
2. 用与总电量I t对应的界面移过的体积V,代入式(2-126)求得tH+。
3. 已知25.0℃时0.1molxL
2?1?1 HCl溶液的摩尔电导率为0.03
913Sxmxmol,根据式(2-128)计算
H+ 离子的迁移率。
4. 考虑到迁移管的体积未经校
正以及电源电压的波动,可以取不
同间隔的体积V及对应的电It,分
别求得t+,再取平均值。 H
图2-60 I-t积分图 六 思考题
+ 1. 为什么在迁移过程中会得到一个稳定界面?为什么界面移动速度就是H离子移动速度?
2. 如何能得到一个清晰的移动界面?
3. 实验过程中电流值为什么会逐渐减小?
4. 如何求得Cl离子的迁移数? ?
实验指导参考
一、教学要点
1、迁移数概念。
2、迁移管中为什么会形成一个鲜明的界面?而且会是一个稳定的界面?
3、分析界面移动速度即H+离子迁移的平均速度。
4、随着界面向上移动,整个回路电流逐渐下降的原因。 5、I~t积分图的测求。
二、指导实验的要点
1、迁移管内不可有气泡。
2、为获得稳定的界面,防止管内两层液体间对流、扩散,电流不宜过高,应控制在3mA左右。
3、正确使用标准电阻。
三、数据处理示例
25℃ cHCl=0.1015 molxL?1, 迁移体积 V = 0.32cm3 I~t 积分图上得 I × t=3.81 Axs
+ tH= cH+VF/(I×t) = 0.1015×0.32×10?3×96485/3.81=0.82
uH+= tH+Λm /F = 0.82×0.03913/96485 = 3.33×10?7 m2S?1V?1
四、思考题解答要点
1、参见实验原理部分。
。 2、参见“进一步讨论”
3、由于H + 离子浓度减小,Cd 2+ 离子增大,迁移管内溶液的电阻不断增大,使回路的电流值逐渐减小。
4、Cl ? 离子的迁移数与H + 离子的迁移数之和为1。
五、进一步讨论
1. 界面移动法的关键是要形成一个鲜明的移动界面,为达此目的,必须:
2+ ① 选择适当的指示离子。如本实验选用Cd离子因为uCd2+<uH+,
使上下两层分开而不相混。
② 防止迁移管内两层间的对流和扩散。所以迁移管内温度应该均匀,且温度不宜过高;通过的电流不宜过大;迁移管截面积要小;实验时间不宜过长。
③ 选择最合适的指示剂,使两层的颜色反差明显。
2. 影响离子迁移数的因素主要是电解质溶液的浓度与温度。温度升高,正、负离子迁移数的差值减小。浓度的影响,考虑到离子间的相互作用力,故难有普遍规律。
3. 测定离子迁移数除界面移动法外,还有希脱夫(Hittorf)法。它是根据电解前后在两电极区由于离子迁移与电极反应导致极区溶液浓度的变化。此法适用面较广,但要配置库仑计及繁多的溶液浓度分析工作。
