资源信息表

10.1 测定1mol气体的体积(共3+1课时)
第4课时 测定1mol气体体积实验误差的原因分析
[设计思想]
任何定量测定的方法,得到的数据都有一定的精确范围,或者说存在一定的误差。定量实验必须尽可能减小实验误差,提高实验精确度。本节课的教学围绕实验中如何实现这一要求?展开教学讨论,让学生认识实验误差的来源:一是仪器装置精密度和药品试剂的品质;二是操作的失误。围绕着误差的来源,结合自己的实验,分析产生各种误差的原因,获得减小实验误差的方法。在讨论减小实验误差,提高实验精确度的方法、措施时,从以下几个方面展开:(1)根据实验要求和条件精选精度比较高的计量仪器(如量体积时,尽可能用滴定管或移液管);(2)进行重复测量。计算时取两次(或多次)可测量值之间的平均值;(3)准确规范操作。如读数液体体积时,视线应该与管中的凹液面最低处相切等。最后让学生归纳出:定量实验存在误差是一定的、允许的,重要的是误差要控制在合理的范围内,本实验误差值在-2—+2%。
一.教学目标
1.知识与技能
(1)实验误差分析(B)。
(2)实验报告的书写(B)。
2.过程与方法
(1)通过实验反思,认识重复测量、数据处理等科学方法。
(2)明白实验操作不当引起实验误差的方法。
3.情感态度与价值观
(1)通过实验报告的交流,同学间的倾听,体验相互学习、尊重他人的价值。
(2)通过对实验的反思,体验实事求是、严肃认真科学精神的意义。
二.教学重点与难点
1.教学重点
实验报告的书写。
2.教学难点
分析操作不当引起实验误差。
三.教学用品
媒体:电脑、投影仪等
四.教学流程
 1.流程图
1.流程图
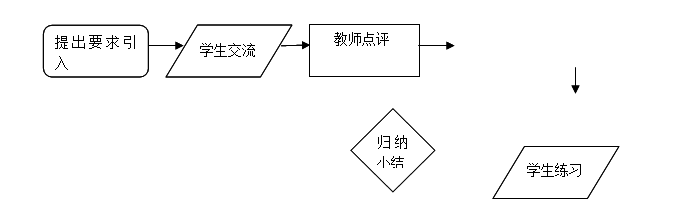



2.流程说明
引入:我们做了测定1摩尔氢气的体积的实验,下面请交流你们的实验报告。
学生交流: 交流实验报告。
教师点评:根据报告与实验中观察获得的信息,对学生的实验作点评与评价。
师生交流:因操作不当而造成的误差。如:(1)没有进行装置的气密性检查,(2)镁带表面氧化镁没有擦除或没有除尽等等
学生练习:工业上测量SO2、N2、O2混合气体中SO2含量。
归纳小结:测定气体的质量或者体积一般有那些方法
作业:教材上10.1
五.教学案例
1.教学过程

2.主要板书
三、实验误差的原因分析
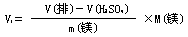

1.没有进行装置的气密性检查——V(排)偏低——气体摩尔体积偏低;
2.镁带表面氧化镁没有擦除或没有除尽——V(排)偏低——气体摩尔体积偏低;
3.硫酸的量不足,镁带没有完全反应V(排)偏低——气体摩尔体积偏低;
4.称量好镁带后用砂纸擦表面的氧化膜V(排)偏低——气体摩尔体积偏低;
5..没有冷却到室温读数V(排)偏高——气体摩尔体积偏高。
3.相关连接
1 中学化学教师手册 上海教育出版社
2 http://xiaohe.heyma.net
六.教学反思
通过实验误差的原因分析,从实验中获取大量的感性知识,经过理性思考、分析训练科学思维方法,提高学生分析问题和解决问题的能力。了解实验操作正确与否对测定结果有很大影响;认识了许多未知需要实验去探索,作为研究化学必备的实验技能需要通过做实验去提高;体验严谨、细致、认真负责的态度对做好实验的重要性。
教学中如果条件允许的情况下,可把学生试验过程中的操作问题录象下来,本节课可以根据录象资料中的问题展开教学,效果更好,更能引起学生讨论、交流的学习热情。
第二篇:实验4 液体饱和蒸气压的测定
物理化学实验备课材料
实验4 液体饱和蒸气压的测定
一、基本介绍
压力是体系的一个重要参数,许多物质的物理化学性质,如熔点、沸点,以及吸附、溶解、扩散、化学平衡移动等物理化学过程都与压力有着密切的关系。压力测量是物理化学实验的主要操作技术之一,因此,体系压力的测量具有实用价值。
在一定温度下,与液体处于平衡状态时的蒸气压力,称为该温度下的饱和蒸气压。这里的平衡状态是指动态平衡。在某一温度下,被测液体处于密闭真空容器中,液体分子从表面逃速成蒸气,同时蒸气分子因碰撞而凝结成浓相。当两者的速率相等时,就达到了动态平衡,此时气相中蒸气密度不再改变,因而具有一定的饱和蒸气压。测定液体饱和蒸气压,可深入了解纯液体饱和蒸气压和温度的关系——克劳馅斯—克拉贝龙方程式,求算被被测液体在实验温度范围内的平均摩尔气化热与正常沸点。。
二、实验目的
1、明确液体饱和蒸气压的定义及气液平衡的概念,了解饱和蒸气压与温度的关系-即克-克方程。
2、测定水在不同外压下的沸点,计算测定温度范围内水的平均摩尔气化热及常压下的沸点。
3、掌握气压计的构造和使用方法。
三、实验原理
在一定温度下,液体与其蒸气达到气液平衡时蒸气的压力,称为液体的饱和蒸气压或称蒸气压。当温度升高时,液体的蒸气压也增大,当蒸气压等于外压时,液体就沸腾,此时的温度就是该压力下液体的沸点。
液体的蒸气压随热力学温度的变化关系可用克拉贝龙方程表示:
dP/dT = △Hv / [T(Vg - Vl)]
式中:△Hv:摩尔汽化热;
Vg:蒸气的摩尔体积;
Vl:液体的摩尔体积。
积分后可得:
lgp = A/T + B dT = △Hv / [T(Vg - Vl)]
式中:A = -△Hv/2.303R;B为积分常数。
由实验测定液体的一系列不同温度下的蒸气压数据,然后用lgp对1/T(或1000/T)作图,求出斜率A,再由A求出△Hv。
四.实验仪器及试剂
蒸气压测定装置一套;真空泵1台;气压计一个,调压变压器1台。
五、实验步骤
1、如图装好装置:
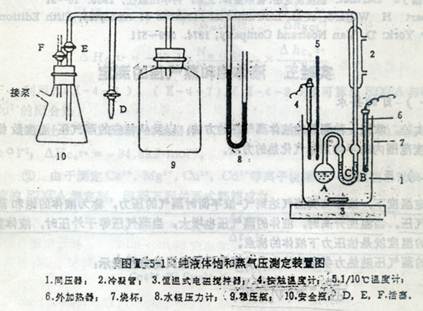
2、记录室内大气压,开启冷凝水。
3、检查系统是否漏气。
4、在60~80℃温度范围内测量纯苯的p-T数值:
打开恒温式电磁搅拌器,接触温度计调至60℃,接上外加热器加热。当接近60℃时,断开外加热器,使升温速度尽可能减慢,约每分钟不超过1℃,令同压器内液体苯与水浴温度尽可能接近平衡。
开启活塞E,关闭放空活塞F及开真空泵抽气,减压一段时间,让A球内液面上的空气被排干净。关闭活塞E,打开放空活塞F,停泵。这时A球内的蒸气通过U型管由C向B缓慢地冒泡,U型管液面B比C高。注意调节水浴温度使温度波动很小,并使温度转为稍有下降的趋势,仔渐调节D阀,放入少量空气,使由B管排出的气泡刚好停止放出,但U型管B端的液面仍比C端稍高。注意观察,待温度稍下降,使B端液面与C端齐高时,立即记录温度读数及水银压力计读数(温度读数要迅速,压力计读数可稍慢)。
再把温度升高,使浴温基本上稳定在第二个较高(约高3℃)的温度点上。重复上述操作,记录第二个温度、压力数据,直至苯在常压下的正常沸点为止,相隔约3℃测一个点,共约8~10个点数据。
六、数据记录

七、实验注意事项
1、真空泵在开泵前,必须观察袖标宙中油面的高低。若油面低于袖标直径的四分之三,不可启动。
2、开泵前,必须用手将主轮按箭头方向旋转数困,以排出泵中的存油,否则将喷泊闯车。
3、在开泵前,首先将三通活塞慢慢与系统接通,抽气的速度以气泡一个个逸出为宜,这样可以避免等位计内液体沸腾过剧,致使8管内的液体抽尽(完)。
4、等位计中液面间的空气必须排除干净 。
5、液体蒸气压与温度有关,故测定过程控温精度须在土O.1一土0.2K。 6
6、在升温时需随时注意调节活塞H使等位计月管液面保持等位,不发生沸腾,也不能使液体倒灌入4球内。
7、在停止实验时,应缓设地先将三通活塞打开.使系统通大气,再使油气泵通大气(防止系中的油倒灌),然后切断电源,最后关闭冷却水,使实验装置复原。
8、整个实验过程中,要严防空气倒灌,否则.实验要重做。为了防止空气倒灌,在每次读取平衡温度和平衡压力数据前,应先关闭活塞G.然后缓慢城压,使空气缓缓进入测量系统。
八、思考题:
1、 △Hv为什么是实验温度范围内的平均值?
在克拉贝龙方程dP/dT = △Hv / [T(Vg - Vl)]中,△Hv被认为是一个常数,所以积分后求出来的△Hv必然是在实验温度范围内的平均值,不然它在克拉贝龙方程中就不能算是一常数。
2、 △vapHm随温度升高而减小,试解释之。根据下式:
d(△vapHm)= [δ(△vapHm)/δT]pdT + [δ(△vapHm)/δP]TdP
推导出单组分系统两相平衡的相变焓(△vapHm)随温度变化的关系式,即Planck方程:
d(△vapHm)/dT = △Cp + △vapHm/T - △vapHm[δln△V/δT]p
(1)∵lgp = A/T + B = -△vapHm/2.303RT +B
∴△vapHm = -(lgp – B)*2.303RT
∴T↑,△vapHm↓
(2)∵d(△vapHm)= [δ(△vapHm)/δT]pdT + [δ(△vapHm)/δP]TdP
∴d(△vapHm)/dT = [δ(△vapHm)/δT]p + [δ(△vapHm)/δP]TdP/dT
= △Cp + [δ(△vapHm)/δP]T*△vapHm / [T△V]
= △Cp + △vapHm/T - △vapHm[δln△V/δT]p
九、预备实验数据处理:
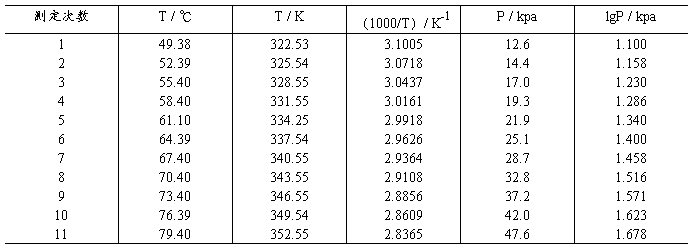
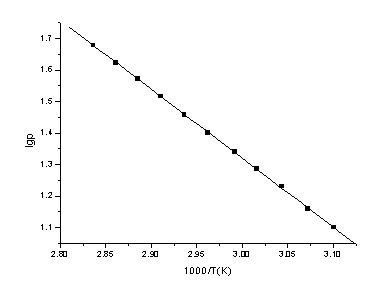
Linear Regression Y = 7.88156-2.18714 X
直线斜率A=-△Hv/2.303R, △Hv=41.86 kJ/mol
