1、使用比重瓶应注意哪些问题?
答:(1)拿比重瓶时应手持其颈部;
(2)比重瓶加满溶液后,瓶内及塞子上的毛细管要不能有气泡产生;
(3)称量前必须用滤纸把比重瓶的外表面擦干净,然后再放到天平上称量。
2、如何使用比重瓶测量颗粒状固体物的密度?
答:(1)将比重瓶洗净干燥,装入一定量的研细的待测固体(装入量视瓶大小而定),称量记为m1。(2)再向瓶中注入部分已知密度为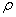 的液体,将瓶敞口放入真空干燥器内,用真空泵抽气约10min,将吸附在固体表面的空气全部除去。然后向瓶中注满液体,塞上塞子。恒温(t℃)10min后,取出比重瓶擦干外壁,并用滤纸吸去塞帽毛细管口溢出的液体,称重为m1’。(3)增加加入待测固体的量,重复步骤(1)(2),并记装入固体后称重为m2,装满液体恒温后称重为m2’。(4)根据下述公式计算待测固体的密度ρs。
的液体,将瓶敞口放入真空干燥器内,用真空泵抽气约10min,将吸附在固体表面的空气全部除去。然后向瓶中注满液体,塞上塞子。恒温(t℃)10min后,取出比重瓶擦干外壁,并用滤纸吸去塞帽毛细管口溢出的液体,称重为m1’。(3)增加加入待测固体的量,重复步骤(1)(2),并记装入固体后称重为m2,装满液体恒温后称重为m2’。(4)根据下述公式计算待测固体的密度ρs。

3、为提高溶液密度测量精度,可作哪些改进?
答:(1)准确称量以计算溶液的质量分数;
(2)多次测量同一组成溶液的质量,结果取其平均值;
(3)每次称量瓶都要烘干;
(4)动作要敏捷,以减少挥发引起的误差。
第二篇:偏摩尔体积的测定
实验四 偏摩尔体积的测定
【实验目的】
1.掌握测定二组分溶液偏摩尔体积的方法;
2.加深对偏摩尔量概念的认识。
【实验原理】
恒温恒压下,由A、B两物质形成二组分溶液,其物质的量分别为nA和nB。该溶液的任何容量性质Y的全微分可表示为:
dY=(?Y?YT,P,nBdnA+(T,P,nAdnB (4 .1) ?nA?nB
?nBA如果定义YA≡(?Y)T,P,n和YB≡(?Y)T,P,n ?nAB
则 dY=YAdnA+YBdnB (4 .2) YA和YB分别为物质A和B的某种容量性质Y的偏摩尔量。
若溶液的容量性质为体积V,则VA、VB分别为A和B的偏摩尔体积,定义为: VA=(?V?V)T,P,nA (4 .3) )T,P,nB VB=(?nB?nA
有 dV=VAdnA+VBdnB (4.4) 溶液总体积V与nA、nB、T、p有关,即:
V=V(nA、nB、T、p) (4.5)
当T、p一定时,
V=nA(
对式(4.6)微分
dV=nAdVA+VAdnA+nBdVB+VBdnB (4 .7)
将式(4 .7)与式(4 .4)比较、整理后得到
nAdVA+nBdVB=0 (4 .8)
?V?V)T,P,nB+nB(T,P,nA (4.6) ?nA?nBdVAnxxB (4.9) =?B=?B=dVBnAxAxB?1
式中 xA和xB分别为组分A和B的摩尔分数。
式(4.8)为吉布斯-杜亥姆公式。由式(4.9)可见,VA和VB间存在着函数关系。VA和VB彼此不是独立的。VA的变化将引起VB的变化,若VA不变,VB也保持不变,当xB为一定值,即溶液浓度一定时,dVA一定,dVB也就一定了。
偏摩尔体积的物理意义可从两个角度理解:一是在温度、压力及溶液浓度一定的情况下,在一定量的溶液中加入极少量的A(由于加入A的量极少,可以认为溶液浓度没有发生变化),此时,系统体积的改变量与所加入A的物质的量之比即为该温度、压力及溶液浓度下的A的偏摩尔体积。二是可以将A的偏摩尔体积理解为:在一定温度、压力及溶液浓度的情况下,将1 mol A加入到大量的溶液中(由于溶液量大,可以认为加入1 mol A,溶液浓度没有发生改变),此时,溶液体积改变量则为该温度、压力及溶液浓度下的A的偏摩
??尔体积。偏摩尔体积与纯组分的摩尔体积Vm不同。因为只涉及A分子本身之间的作V,Am,A
用力,而VA则不仅涉及A分子本身之间的作用力,还有B分子之间以及A与B分子之间的作用力。而且这三种作用力对溶液总体积的影响将随溶液中A、B分子的比例而变,亦即随溶液浓度而变。定量的描述这些分子间的相互作用力是十分困难的,在大多数情况下,可简
?单的用Vm和VA进行比较,以作定性的说明。 ,A
实验中,利用VA和VB与一些实验直接测定量的关系,经过数据处理,求算VA和VB。下面介绍用Q~b图求测偏摩尔体积的方法。
由式(4.3)和(4.6)可得
V=nAVA+nBVB (4.10)
式(4.10)可改写为
? V=nAVm (4.11) ,A+nBQ
式中 Q定义为B的表观摩尔体积。Vm,A为纯A的摩尔体积。由式(4.11)可得:
Q=?V?nAVm,A?
nB (4 .12)
由物质的量分别为nA和nB的物质A和B配成溶液,其体积质量为ρ,则溶液的体积
V=nAMA+nBMB
ρ
。把此关系式代入式(4.12)得 式中 MA和MB分别为物质A和B的摩尔质量(g·mol-1)
? (4.13) Q=1(nAMA+nBMB?nAVm,A)nBρ
当溶液组成用质量摩尔浓度bB表示时,式中 nA=1000,n=b BBMA
Q=11000+bBMB1000(? ?bBρMAm,A
因为M
?A=ρA,ρA为纯A的体积质量。 Vm,A
所以 Q=1(1000+bBM
ρbB
Q=B?1000 ρAM1000(ρA?ρ)+B (4.14) bBρρAρ
由式(4.14)可知,与Q有关的量bB、ρA、ρ都可实验测得。所以Q可由这些测量值计算而得。进而只要找到VA、VB与Q的关系,则偏摩尔体积可求。为此,先把式(4.11)对nB求导,得
VB=(
而 VA=?V?Q)T,P,nA=Q+nB()T,P,nA (4.15) ?nB?nBV?nBVB (4.16) nA
式(4.16)中的V和VB分别用式(4.11)和(4.15)的关系代入,得
VA=
1nA
??2?Q?
(4.17) ()?nVnBT,P,nA??Am,A
?nB??
?Q
,便可求算VA、VB。上述计?nB
从式(4.15)和(4.17)可以看出,已知nA、nB、Q、
算方法,对于二组分溶液未加任何限制,所以原则上适用于所有的二组分溶液系统。
因为溶液组成用质量摩尔浓度表示,故
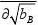
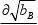
(
?Q?QT,P,nA=(T,P,nA=T,P,nA (4.18) ?nB?bBB
将式(4.18)代入式(4.15)得
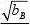
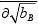
VB=Q因为
T,P,nA (4.19)
nA=
所以
10001000
==55.51
M(H2O)18.016
b?Q (4.20) 1?B(?)55.512B?B
2
VA=V?mA
对于强电解质稀薄水溶液,德拜-休克尔理论证明了其表观摩尔体积Q与B呈线性关系。
o
如图4.1所示。对于Q~B线上任一点P(B、Q),有Q?Q=
?Q?
bB
B
Q=Qo+
B
?Q?B
则 VB=Qo+
32
B(
?Q
T,P,nA (4.21) ?B
制一每一溶液可得计算曲线
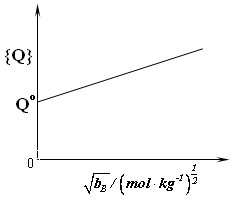
综上所述,为求偏摩尔体积,在实验时要先配系列不同质量摩尔浓度的溶液,在恒温恒压下测定溶液及纯溶剂的体积质量,由式(4.14)计算每一的Q值,作Q~bB图。若是强电解质稀薄水溶液,一条直线,直线斜率为?Q
?bB
,由式(4.20)和(4.21)
VA和VB 。对于其它二组分溶液,作Q~bB图,
上各点的斜率为?Q
?
bB
,再由式(4.19)和(4.20)计算
VA和VB
。
【仪器试剂】
分析天平1台(公用);玻璃恒温水浴全套(公用);密度瓶1个;100 mL烧杯5个;
50 mL烧杯1个;50 mL称量瓶1个。
NaCl(分析纯);蒸馏水。
【实验步骤】
1. 打开电子天平,预热30 min以上。调节恒温槽温度为30.00±0.10℃
2.称取约5.0 g NaCl固体于称量瓶中,放入110℃~120℃的烘箱中烘约2 h,然后取出放入干燥器中,冷却后称重,计算出NaCl的水份含量。
3.将洗净烘干的密度瓶从干燥器中取出,放到电子天平上准确称量其质量为m1。 4.用称量法配制质量摩尔浓度为0.4 mol·kg-1的NaCl水溶液100 mL。
5.用配好的溶液润洗密度瓶3次(注意同时润洗毛细管),然后装满,盖上带有毛细管的磨口塞,让瓶内的水从毛细管口溢出(瓶内及毛细管中均不能有气泡存在)。将密度瓶放入小烧杯中,向烧杯中加水至瓶颈以下,放入恒温槽恒温15 min。此时恒温槽中的水位要略高于烧杯中的水位,以保证烧杯中水的温度能与恒温槽中的水温相同。
6.将密度瓶从恒温槽中取出(只可拿瓶颈处),迅速用滤纸刮去毛细管口的液体并将密度瓶的瓶壁擦干,再准精确称量得到m3。
7.配制质量摩尔浓度为0.6、0.8、1.0、1.2 mol·kg-1的NaCl水溶液各100 mL,用步骤5、6所述方法获得各浓度溶液装满密度瓶并恒温后的质量。
8.用自来水洗净密度瓶,再用去离子水反复润洗至完全洁净,装满去离子水,恒温后称取其质量得到m2。
【注意事项】
1. 拿密度瓶时手不接触瓶颈外的其它部位,避免瓶中的水溶液体积发生变化。 2. 配制溶液时先将100 mL的空烧杯去皮,然后称量一定质量的NaCl固体,再将水加到烧杯的100 mL的刻度线上称重,然后计算出质量摩尔浓度。
bB=WNacl×1000 MNacl×W水
3. 按下式计算溶液NaCl溶液在温度t时的体积质量
ρ(t)=m3?m1ρ(H2O,t) m2?m1
4. 恒温过程中毛细管里始终充满液体。
5. 在一种溶液恒温的过程中进其它溶液配制的工作,以节约实验时间。
【数据记录与处理】
1. 列出原始数据。
2. 计算出每一溶液的bB、B、ρ、和Q值。 3.作Q-B图,由图求?Q
?B及Q0值。
4.计算30℃及实验压力下,bB=0.500mol·kg-1和bB=1.000mol·kg-1时水和NaCl的偏摩尔体积。
【思 考 题】
1. 在什么条件下,表观摩尔体积Q与B呈线性关系?
2. 为什么纯物质的摩尔体积与其在混合体系中的偏摩尔体积不同?
