偏摩尔体积测定实验报告
一、实验目的
1) 配制不同浓度的NaCl水溶液,测定各溶液的密度。
2) 计算溶液中各组分的偏摩尔体积。
3) 学习用比重管测定液体的密度。
二、实验原理
根据热力学概念,体系的体积V为广度性质,其偏摩尔量则为强度性质。设体系有二组分A,B,体系的总体积V是nA, nB、温度、压力的函数,即
V=f(nA ,nB,T,P) (C9.1)
组分A、B的偏摩尔体积定义为
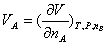
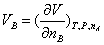 (C9.2)
(C9.2)
在恒定温度和压力下
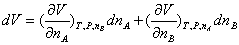 (C9.3)
(C9.3)
dV=VAdnA + VBdnB (C9.4)
偏摩尔量是强度性质,与体系浓度有关,而与体系总量无关。体系总体积由式C9.4积分而得
V = nAVA+nBVB (C9.5)
在恒温恒压条件下对式C9.5微分
dV=nAdVA+VAdnA十nBdVB+VBdnB
与式C9.4比较,可得吉布斯-杜亥姆(Gibbs-Duhem)方程
nAdVA+nBdVB =0 (C9.6)
在B为溶质、A为溶剂的溶液中,设VA*为纯溶剂的摩尔体积;Vf,B定义为溶质B的表观摩尔体积,则
 (C9.7)
(C9.7)
V= nAVA*+nBVf,B (C9.8)
在恒定T、P及nA条件下,将式C9.8对nB偏微分,可得
 (C9.9)
(C9.9)
由式C9.5、C9.8得
 (C9.10)
(C9.10)
将式C9.9代入式C9.10
 (C9.11)
(C9.11)
bB为B的质量摩尔浓度(bB =nB/(nAMA);Vφ,B为B的表观摩尔体积;ρ、ρA*为溶液及纯溶剂A的密度;MA、MB为A、B二组分的摩尔质量。可得
 (C9.12)
(C9.12)
本实验测定NaCl水溶液中NaCl和水的偏摩尔体积,根据德拜-休克尔(Debye—Huckel)理论,NaCl水溶液中NaCl的表观偏摩尔体积Vf,B 随 变化呈线性关系,因此作如下变换
变化呈线性关系,因此作如下变换
 (C9.13)
(C9.13)
将式C9.13代入C9.11和C9.9,可得
 (C9.14)
(C9.14)
 (C9.15)
(C9.15)
配制不同浓度的NaCl溶液,测定纯溶剂和溶液的密度,求不同bB时的Vf,B,作Vf,B~ 图,可得一直线,从直线求得斜率
图,可得一直线,从直线求得斜率 。由式C9.14、C9.15计算VA、VB 。
。由式C9.14、C9.15计算VA、VB 。
三、实验仪器
分析天平 恒温槽
烘干器 比重管(或比重瓶)
磨口塞锥形瓶(50ml) 烧杯(50ml、250ml)
洗耳球 量筒50ml
药勺 滤纸
NaC1(A.R.) 无水乙醇(A.R.)
四、实验步骤
1) 调节恒温槽至设定温度,如25℃,恒温槽水温至少应比室温高5℃。
2) 配制不同组成的NaCl水溶液:用称量法配制质量百分比约为:1%、4%, 8%、12%和16%的NaCl水溶液,先称锥形瓶(注意带盖),然后小心地加入适量的NaCl再称量,用量筒加入所需蒸馏水(约40m1)后再称量;用减量法分别求出NaCl和水的质量,并求出它们的百分浓度。各溶液所需NaCl 和水的量,应在实验前估算好。
3) 参见本书B8-1部分,了解用比重管测液体密度的方法。洗净、干燥比重管,将比重管先用自来水洗涤,再用去离子水洗涤,然后用无水乙醇涮洗,最后进行干燥。在分析天平上称量空比重管(注意带盖)。
4) 将比重管装满去离子水,放入恒温槽内恒温10min,然后调比重管内液体的量,使比重管内液面一端在刻度线上,一端与管口齐平,注意比重管内液体内不应有气泡,将比重管戴上盖子,注意在戴盖子时要小心,不能将管内液体挤出。擦干比重管外部,在分析天平上再称量。重复本步骤一次。
5) 将已进行步骤4操作的比重管用待装溶液涮洗3次(或干燥),再装满NaCl水溶液,放入恒温槽内恒温10min。为了节省时间,可以将盛NaCl水溶液的磨口塞锥形瓶放入恒温槽内恒温10min以上,将恒温后的溶液装入比重管后再放入恒温槽内恒温2min。然后调比重管内液体的量,使比重管内液面一端在刻度线上,一端与管口齐平,注意比重管内液体内不应有气泡,将比重管戴上盖子,注意在戴盖子时要小心,不能将管内液体挤出。擦干比重管外部,在分析天平上称量。重复本步骤操作一次。
6) 用上述步骤5的方法对其它浓度NaCl溶液进行操作。
五、数据处理
表C9.1 实验数据


六、思考题
1)偏摩尔体积能小于零吗?
答:可以,当某个物质,在等温等压等特定条件下,往其溶液再加1mol该物质,如果体积变小就是负的偏摩尔体积.实际上总有些物质会在某些时候,比如温度特别低,气压特别大的时候,做这个实验,溶液体积会变小. 那么在这个温度,气压下,该物质的偏摩尔体积就是负的了.
2) 在偏摩尔体积测定实验操作中如何减小称量误差?
答:在使用比重管称量水的过程中要求管中没有气泡。解决方法是可以取一大烧杯装三分之二的水,将比重管浸入水面以下,在水中盖上盖子就可以避免气泡的产生,使称量误差减小。
第二篇:偏摩尔体积的测定
偏摩尔体积测定
1 实验目的及要求
1) 配制不同浓度的NaCl水溶液,学习用密度瓶测定各溶液的密度。
2) 计算溶液中各组分的偏摩尔体积。
2 原理
设体系有二组分A,B,体系的总体积V是nA, nB、温度、压力的函数,即
V=f(nA ,nB,T,P) (C9.1)
组分A、B的偏摩尔体积定义为

 (C9.2)
(C9.2)
在恒定温度和压力下
 (C9.3)
(C9.3)
dV=VAdnA + VBdnB (C9.4)
体系总体积由式C9.4积分而得
V = nAVA+nBVB (C9.5)
在恒温恒压条件下对式C9.5微分
dV=nAdVA+VAdnA十nBdVB+VBdnB
吉布斯-杜亥姆(Gibbs-Duhem)方程
nAdVA+nBdVB =0 (C9.6)
在B为溶质、A为溶剂的溶液中,设VA*为纯溶剂的摩尔体积;Vf,B定义为溶质B的表观摩尔体积,则
 (C9.7)
(C9.7)
V= nAVA*+nBVf,B (C9.8)
(C9.11)
bB为B的质量摩尔浓度(bB =nB/(nAMA);Vφ,B为B的表观摩尔体积;ρ、ρA*为溶液及纯溶剂A的密度;MA、MB为A、B二组分的摩尔质量。可得
 (C9.12)
(C9.12)
据德拜-休克尔(Debye—Huckel)理论,NaCl水溶液中NaCl的表观偏摩尔体积Vf,B 随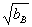 变化呈线性关系,
变化呈线性关系,
 (C9.14)
(C9.14)
 (C9.15)
(C9.15)
配制不同浓度的NaCl溶液,测定纯溶剂和溶液的密度,求不同bB时的Vf,B,作Vf,B~ 图,可得一直线,从直线求得斜率
图,可得一直线,从直线求得斜率 。由式C9.14、C9.15计算VA、VB 。
。由式C9.14、C9.15计算VA、VB 。
3 仪器与试剂
分析天平 恒温槽
烘干器 比重管(或比重瓶)
磨口塞锥形瓶(50ml) 烧杯(50ml、250ml)
洗耳球 量筒50ml
药勺 滤纸
NaC1(A.R.) 无水乙醇(A.R.)
4 实验步骤
1) 调节恒温槽至设定温度,如25℃,恒温槽水温至少应比室温高5℃。
2) 配制不同组成的NaCl水溶液:用称量法配制质量百分比约为:1%、4%, 8%、12%和16%的NaCl水溶液,先称锥形瓶(注意带盖),然后小心地加入适量的NaCl再称量,用量筒加入所需蒸馏水(约40m1)后再称量;用减量法分别求出NaCl和水的质量,并求出它们的百分浓度。各溶液所需NaCl 和水的量,应在实验前估算好。
3) 参见本书B8-1部分,了解用比重管测液体密度的方法。洗净、干燥比重管,将比重管先用自来水洗涤,再用去离子水洗涤,然后用无水乙醇涮洗,最后进行干燥。在分析天平上称量空比重管(注意带盖)。
4) 将比重管装满去离子水,放入恒温槽内恒温10min,然后调比重管内液体的量,使比重管内液面一端在刻度线上,一端与管口齐平,注意比重管内液体内不应有气泡,将比重管戴上盖子,注意在戴盖子时要小心,不能将管内液体挤出。擦干比重管外部,在分析天平上再称量。重复本步骤一次。
5) 将已进行步骤4操作的比重管用待装溶液涮洗3次(或干燥),再装满NaCl水溶液,放入恒温槽内恒温10min。为了节省时间,可以将盛NaCl水溶液的磨口塞锥形瓶放入恒温槽内恒温10min以上,将恒温后的溶液装入比重管后再放入恒温槽内恒温2min。然后调比重管内液体的量,使比重管内液面一端在刻度线上,一端与管口齐平,注意比重管内液体内不应有气泡,将比重管戴上盖子,注意在戴盖子时要小心,不能将管内液体挤出。擦干比重管外部,在分析天平上称量。重复本步骤操作一次。
6) 用上述步骤5的方法对其它浓度NaCl溶液进行操作。
5 数据记录与处理
1) 从手册查得实验温度下纯水的密度,计算各浓度NaCl溶液的密度。
2) 计算各浓度NaCl溶液的 ,计算各浓度NaCl溶液的Vf,B,作Vf,B~
,计算各浓度NaCl溶液的Vf,B,作Vf,B~ 图,求直线的斜率
图,求直线的斜率 。
。

K=255.26
3)根据式C9.14、C9.15计算各浓度NaCl溶液的VA、VB。计算时应该从Vf,B~ 图上求相应bB对应的Vf,B 。
图上求相应bB对应的Vf,B 。
4)本实验记录的数据和计算步骤较多,应将数据和计算结果列表。可以通过计算机编程处理数据,或直接使用工具软件(例如Excel)处理数据。
表C9.1 实验数据

6 注意事项
1) 掌握使用比重管测定液体密度的方法。
2) 应将水煮沸除气处理后再使用。
7 思考题
1) 偏摩尔体积有可能小于零吗?
有可能。如在无限稀释的硫酸镁溶液中加入1mol硫酸镁时,溶液的体积缩小了,此时硫酸镁的偏摩尔体积就小于零。
2) 在实验操作中如何减小称量误差?
1.比重瓶加满溶液后,塞子上的毛细管要充满溶液不能有气泡产生;
2.称量前必须用滤纸把比重瓶的外表面擦干净,然后再放到天平上称量;
3.称量前后都要烘干。
8.实验分析
由实验结果可以看出水的偏摩尔体积随氯化钠的浓度的增大而减小,氯化钠的偏摩尔体积逐渐增大。吉布斯-杜亥姆(Gibbs-Duhem)方程nAdVA+nBdVB =0 符合实验原理中的上述公式。
