姓名:舒睿 学号:5603111040 试验时间:第八周,星期3 ,14点
实验九 EDTA标准溶液的配制和标定
一、 实验目的:
1.进一步掌握分析天平的正确使用;
2.掌握正确的滴定操作方法。
3学习EDTA 标准溶液的配制和标定方法;
4.掌握配位滴定指示剂的指示原理、终点的判断。
5. 掌握定量分析实验报告的正确表示(格式、内容、有效数字等)
二、原理
乙二胺四乙酸二钠简称EDTA,由于EDTA与大多数金属离子形成稳定的1:1型螯合物,故常用作配合滴定的标准溶液。
标定EDTA溶液的基准物有:Zn,ZnO,CaCO3,Cu,Bi ,Ni,Pb MgSO4·7H2O,等。通常选用的标定条件应尽可能与测定条件一致,以免引起系统误差,如果用被测元素的纯金属或化合物作基准物质,就更为理想。
如果EDTA溶液用于测定pb2+,Bi3+,则宜用纯金属锌作基准物标定EDTA,用铬黑T作指示剂,用氨缓冲溶液,在pH=10进行标定。也可用二甲酚橙作指示剂,用六次甲基四胺调节酸度,在pH=5~6进行标定。
本实验用CaCO3作基准物,在pH≧12的NaOH缓冲液中,以钙指示剂, 标定EDTA。溶液由酒红色变为纯蓝色为终点。反应如下:
滴定前 : Ca2++ HInd2-(纯蓝) CaInd-(酒红)+ H+
滴定开始至终点:
Ca2+ + H2Y2- CaY2- + H+
pH≧12
终点:
CaInd-(酒红)+H2Y2- CaY2- + HInd2-(纯蓝)
pH≧12
计算EDTA浓度
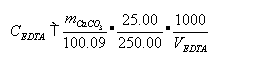
三、试剂
1、乙二胺四乙酸二钠(Na2H2Y·2H2O)
摩尔质量为372.2。1g/2人。
2、 CaCO3 (A·R)
3、NH3-NH4Cl缓冲溶液
4、钙指示剂
四、主要步骤
①0.005mol/L EDTA 溶液的配制:1g 乙二胺四乙酸二钠→于500mL 的烧杯中,加水溶解(必要时可以温热,以加快溶解或加 200mL 温水)用玻棒搅拌均匀→配成500mL溶液(每两人配一份)
②0.005mol/L EDTA 溶液的标定:
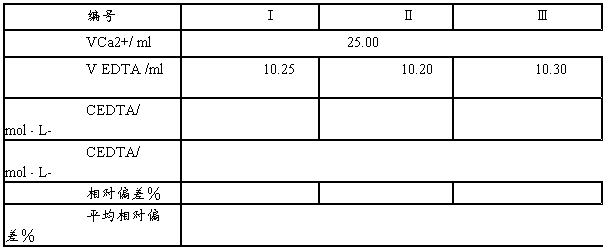
准确称取0.15-0.20g CaCO3(100烧杯中)→少量水润湿,盖上表面皿→5mL1∶1HCl从杯嘴逐滴加入?至完全溶解→加热微沸?→定容至250mL → 移取25.00mL 钙标准溶液→加约25mL水和10mL10%NaOH及少许固体钙指示剂→用EDTA滴定至溶液由紫红色→蓝绿色为终点。
平行测定三份。
五、数据记录及处理
表一 标准溶液的配制

表二 EDTA溶液的标定
六、 思考题:
1. EDTA标准溶液和Zn、CaCO3标准溶液的制备方法有何不同?
2. 配位滴定中为什么要加入缓冲溶液?
第二篇:EDTA标准溶液的配制与标定
EDTA标准溶液的配制与标定(3学时)
一、目的要求
1.掌握EDTA标准溶液的配制和标定方法
2.理解配位滴定的原理及其滴定特点
3.学会用二甲酚橙指示剂和钙指示剂判断反应终点
二、实验原理
乙二胺四乙酸(简称EDTA,常用H4Y表示)难溶于水,分析化学中通常使用其二钠盐。乙二胺四乙酸二钠盐的溶解度为120g?L-1,可配制0.3mol?L-1以下的溶液。通常以间接法配制标准溶液。
标定EDTA溶液常用的基准物有Zn、ZnO、CaCO3、Bi、Cu、MgSO4?7H2O、Hg、Ni、Pb等。通常选用其中与被测物组分相同的物质作为基准物,这样,滴定条件一致,可减少系统误差。本实验主要学习CaCO3和Zn或ZnO作为基准物,以钙指示剂和二甲酚橙指示剂为金属指示剂标定EDTA标准溶液原理及方法。
金属指示剂是一些有色的有机配合剂,在一定条件下能与金属离子形成有色配合物,其颜色与游离指示剂的颜色不同,因此用它能指示滴定过程中金属离子浓度的变化情况,但其用量要适当。配位反应比酸碱反应进行慢,在滴定过程中,EDTA溶液滴加速度不能太快,尤其近终点时,应逐滴加入,充分摇动。
以CaCO3为基准物时,用钙指示剂作为指示剂。在pH≥12条件下,游离的钙指示剂为纯蓝色,Ca2+与钙指示剂(常以H3In表示)结合形成比较稳定的酒红色的CaIn-配位离子,使溶液呈现酒红色。当用EDTA标准溶液滴定时,由于EDTA能与Ca2+形成比CaIn-离子更稳定的无色的CaY2-离子,反应到达化学计量点时释放出游离的钙指示剂,溶液的颜色由酒红色变为纯蓝色,反应方程式为:
CaIn-(酒红色)+H2Y2-CaY2-(无色)+HIn2-(纯蓝色)+H+
当有Mg2+离子存在时,颜色变化更敏锐,因此在只有Ca2+存在时,常常加入少量Mg2+离子。用此方法标定的EDTA标准溶液,可用于测定石灰石或白云石中CaO、MgO

含量,也可以
用于测定水中钙硬度。
以Zn或ZnO为基准物时,用二甲酚橙作为指示剂。在pH=5~6条件下,游离的二甲酚橙为黄色,Zn2+与二甲酚橙结合形成比较稳定的紫红色配合离子,使溶液呈现紫红色。当用EDTA标准溶液滴定时,由于EDTA能与Zn2+形成更稳定的无色CaY2-离子,反应到达化学计量点时释放出游离的二甲酚橙指示剂,溶液的颜色由紫红色变为亮黄色。
用此方法标定的EDTA标准溶液,可用于铅、铋混合液中铅、铋含量的测定,也可以用于水总硬度测定。
三、仪器与试剂
1.仪器
分析天平,50mL酸式滴定管,25mL移液管,250mL容量瓶,常用玻璃仪器若干。
2.试剂
(1)以CaCO3为基准物时所用试剂
乙二胺四乙酸二钠(固体,分析纯),CaCO3(基准试剂),NaOH溶液(10%),
氨缓冲溶液(pH≈10),钙指示剂(固体),氨水(1:1),
镁溶液(溶解1gMgSO4?7H2O于水中,稀释至200mL),铬黑T
(2)以ZnO(或Zn)为基准物时所用试剂
乙二胺四乙酸二钠(固体,分析纯),ZnO(基准试剂),氨水(1:1),六次甲基四胺(20%),二甲酚橙指示剂(0.5%),盐酸(1:1)
四、参考步骤
1.0.02mol?L-1EDTA标准溶液的配制
在台秤上称取3.8g乙二胺四乙酸二钠,溶于100mL去离子水中,微热溶解后,转移到500mL试剂瓶中,再加入400mL去离子水,摇匀。如有混浊,应过滤。
2.以CaCO3为基准物标定EDTA溶液
(1)0.02mol?L-1钙标准溶液的配制
准确地称取在110℃干燥的CaCO3基准物0.3~0.4g(准确至0.1mg)于小烧杯中,盖以表面皿,加少量去离子水润湿后,缓慢地滴加1:1的HCl3~5mL,用水把可能溅到表面皿上的溶液冲洗杯中,加热至完全溶解。冷却后,将溶液定量转移到250mL容量瓶中,稀
释至刻度,摇均匀。
(2)标定
a.强碱性介质中用此法
用25mL移液管移取钙标准溶液25.00mL于250mL的锥形瓶,加入25mL水、2mL镁溶液、5mL10%NaOH溶液和绿豆大小的钙指示剂,摇均匀后,用EDTA溶液滴定到溶液由红色变为蓝色,即为终点,记录消耗EDTA溶液的体积,平行三次,要求消耗体积的极差小于0.05mL。根据CaCO3的质量和消耗EDTA溶液的体积,计算EDTA标准溶液的准确浓度。
b.氨性缓冲溶液中用此法
用25mL移液管移取钙标准溶液25.00mL于250mL的锥形瓶,加入10mLpH≈10氨缓冲溶液和2滴铬黑T指示剂,摇均匀后,用EDTA溶液滴定到溶液由紫红色变为蓝绿色,即为终点,记录消耗EDTA溶液的体积,平行三次,要求消耗体积的极差小于0.05mL。根据CaCO3的质量和消耗EDTA溶液的体积,计算EDTA标准溶液的准确浓度。
3.以ZnO为基准物标定EDTA溶液
(1)0.02mol?L-1锌标准溶液的配制
准确称取在800~1000℃灼烧过的ZnO基准物0.2~0.3g(准确至0.1mg)于小烧杯中,加少量去离子水润湿后,缓慢地滴加1:1的HCl5mL,同时搅拌至完全溶解。然后,将溶液定量转移到250mL容量瓶中,稀释至刻度并摇均匀。
(2)标定
用25mL移液管移取锌标准溶液于250mL的锥形瓶,加入约30mL水,2滴二甲酚橙指示剂,摇均匀后,先加1:1的氨水至溶液由黄色刚变橙色,然后滴加20%六次甲基四胺至溶液呈稳定的紫红色后,再多加3mL。用EDTA溶液滴定到溶液由紫红色变为亮黄色,即为终点,记录消耗EDTA溶液的体积。平行三次,要求消耗体积的极差小于0.05mL。根据ZnO的质量和消耗EDTA溶液的体积,计算EDTA标准溶液的准确浓度。
五、实验数据记录与处理以ZnO为基准物标定EDTA溶液
编号
实验项目
(称量瓶+基准物)质量
倾出后(称量瓶+基准物)质量
取出基准物的质量
容量瓶的体积
移取基准液的体积
溶液终读数
溶液初读数
EDTA溶液体积
溶液的浓度
溶液的平均浓度
相对平均偏差
六、问题与思考
1.以ZnO为基准物,以二甲酚橙为指示剂标定EDTA溶液浓度的原理是什么?溶液的pH值应控制在什么范围?若溶液为强酸性,应怎样调节?
2.配位滴定法与酸碱滴定法相比,有哪些不同点?滴定操作过程中应注意哪些问题?
(任乃林)
