凝固点降低法测定摩尔质量
报告人:同组人: 实验时间20##年06月28日
一.实验目的
1.用凝固点降低法测定尿素的摩尔质量。
2.掌握固点降低法测摩尔质量的原理。
二.实验原理
理想稀薄溶液具有依数性,凝固点降低就是依数性的一种表现。即对一定量的某溶剂,其理想稀薄溶液凝固点下降的数值只与所含非挥发性溶质的粒子数目有关,而与溶质的特性无关。
假设溶质在溶液中不发生缔合和分解,也不与固态纯溶剂生成固溶体,则由热力学理论出发,可以导出理想稀薄溶液的凝固点降低值?Tf(即纯溶剂和溶液的凝固点之差)与溶质质量摩尔浓度bB之间的关系:
 (1)
(1)
由此可导出计算溶质摩尔质量MB的公式:
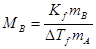
 (2)
(2)
以上各式中: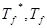 分别为纯溶剂、溶液的凝固点,单位K;mA、mB分别为溶剂、溶质的质量,单位kg;Kf为溶剂的凝固点降低常数,与溶剂性质有关,单位K·kg·mol-1;MB为溶质的摩尔质量,单位kg·mol-1。
分别为纯溶剂、溶液的凝固点,单位K;mA、mB分别为溶剂、溶质的质量,单位kg;Kf为溶剂的凝固点降低常数,与溶剂性质有关,单位K·kg·mol-1;MB为溶质的摩尔质量,单位kg·mol-1。
若已知溶剂的Kf值,通过实验测得?Tf,便可用式(2)求得MB。也可由式(1)通过?Tf-mB的关系,线性回归以斜率求得MB。
通常测定凝固点的方法是将溶液逐渐冷却,使其结晶。但是,实际上溶液冷却到凝固点,往往并不析出晶体,这是因为新相形成需要一定的能量,故结晶并不析出,这就是所谓过冷现象。然后由于搅拌或加入晶种促使溶剂结晶,由结晶放出的凝固热,使体系温度回升。
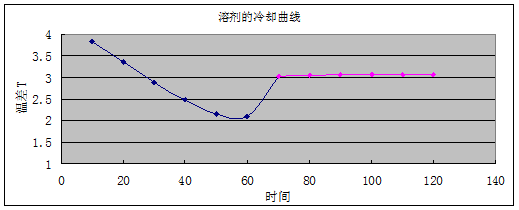
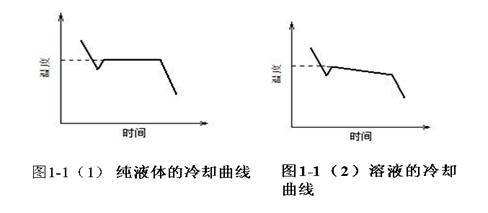
从相律看,溶剂与溶液的冷却曲线形状不同。对纯溶剂,固-液两相共存时,自由度f=1-2+1=0,冷却曲线出现水平线段,其形状如图1(1)所示。对溶液,固-液两相共存时,自由度f=2-2+1=1,温度仍可下降,但由于溶剂凝固时放出凝固热,使温度回升,回升到最高点又开始下降,所以冷却曲线不出现水平线段,此时应按图1(3)
所示方法加以校正。
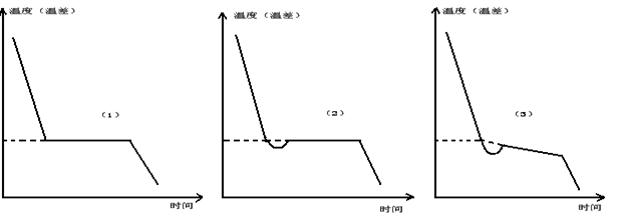
图1 各种冷却曲线
(1)理想状态下的溶剂 (2)有过冷的溶剂 (3)有过冷的溶液
本实验通过测定纯溶剂与溶液的温度与冷却时间的关系数据,绘制冷却曲线,从而得到两者的凝固点之差?Tf,进而计算待测物的摩尔质量。
三.仪器和试剂
凝固点测定仪,精密电子温差测量仪,电子天平,移液管(50mL),尿素,粗盐,冰。
四.实验步骤
1.准备冷浴
冰水浴槽中装入三分之二的冰和三分之一的水,将温度传感器插入冷浴中,取适量粗盐与冰水混合,使冷浴温度达到-2℃~-3℃,将电子温差测量仪采零、锁定,将定时时间间隔为设10s。
2.溶剂冷却曲线的测定
用移液管向清洁、干燥的凝固点管内加入50mL纯水,插入洁净的搅拌环和温度传感器,不断搅拌,观察水温的变化,当水温接近1℃时,开始记录“温差”值,并加快搅拌速度,待温度回升后,恢复原来的搅拌,如此可以减少数据的组数。通常水温的变化规律为“下降→上升→稳定”,即有过冷现象。当温度达到稳定段后,在稳定段再读数5~7组,即可结束读数。
取出凝固点管,用手捂住管壁片刻,同时不断搅拌,使管中固体全部融化,重复测定溶剂温度随时间的变化关系,共三次,每次的稳定段读数之差不超过0.006℃,三次平均值作为纯水的凝固点。
3.溶液冷却曲线的测定
用电子天平称量约0.4g的尿素。如前将凝固点管中的冰融化,将准确称量的尿素加入管中(若在步骤2的搅拌时带出较多的水,可重新移取50ml),待其溶解后,同步骤2测定溶液的温度随时间的变化关系,共三次。
五.数据处理
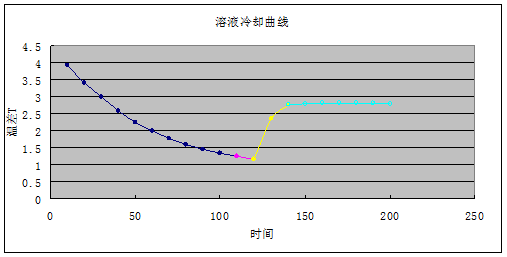
各取一组合理数据,在坐标纸上绘制纯溶剂和溶液的冷却曲线,分别找出纯溶剂和溶液的凝固点,并求出凝固点?Tf,用相关公式计算出尿素的摩尔质量,并与理论值进行比较
由图知,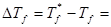 (3-2.75)℃=0.25℃
(3-2.75)℃=0.25℃
所以由公式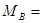
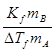 得,
得,
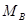 =
= Kg/mol=60.1g/mol
Kg/mol=60.1g/mol
六.注意事项
1.实验所用的凝固点管必须洁净、干燥。
2.冷却过程中的搅拌要充分,但不可使搅拌桨超出液面,以免把样品溅在器壁上。
3.结晶必须完全融化后才能进行下一次的测量。
4.凝固点测定仪经“清零”、“锁定”后,其电源就不能关闭。
七.思考题
1.根据什么原则考虑加入溶质的量?太多或太少影响如何?
答:根据稀溶液依数性, 溶质加入量要少;太多不符合稀溶液,太少凝固点下不明显。
2.什么叫凝固点?凝固点降低的公式在什么条件下才适用?它能否用于电解质溶液?
答:固体溶剂与溶液成平衡的温度称为溶液的凝固点。含非挥发性溶质的双组分稀溶液的凝固点低于纯溶剂的凝固点,当确定了溶剂的种类和数量后,溶剂凝固点的降低值仅取决与所含溶质分子的数目。对于理想溶液或浓度很稀的溶液,根据范特霍夫凝固点降低公式知道:在溶液浓度很稀时,如果溶质与溶剂不生成固溶体,溶液的凝固点降低值 与溶质的质量摩尔浓度 (mol·kg-1)成正比。一般只适用于强电解质稀溶液。其次凝固点不应太
高或太低,应在常温下易达到。
第二篇:物化实验报告_凝固点实验报告
华南师范大学实验报告
学生姓名_______ ________ 学 号____ ____
专 业___ 化学教育_____ 年级、班级____2009级6班_____
课程名称___ 物理化学实验____ 实验项目凝固点降低法测相对分子质量
实验类型 □验证 □设计 □综合 实验时间_ 20## _年 12 月 14 日
实验指导老师_____ _____ 实验评分
一、实验题目:凝固点降低法测相对分子质量
二、实验目的:
① 明确溶液凝固点的定义及获得凝固点的正确方法。
② 掌握凝固点降低法测分子量的原理,加深对稀溶液依数性的理解。
③ 掌握贝克曼温度计的使用。
④ 测定环己烷的凝固点降低值,计算萘的相对分子质量。
三、实验原理:
物质的相对分子质量是了解物质的一个最基本而且重要的物理化学数据,其测定方法有多种。凝固点降低法成的物质的相对分子质量是一个简单又比较准确的方法,在溶液理论研究和实际应用方面都具有重要的意义。
凝固点降低是稀溶液的一种依数性,这里的凝固点是指在一定压力下,溶液中纯溶剂开始析出的温度。由于溶质的加入,使固态纯溶剂从溶液中析出的温度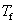 比纯溶剂的凝固点
比纯溶剂的凝固点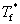 下降,其降低值
下降,其降低值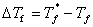 与溶液的质量摩尔浓度成正比,即
与溶液的质量摩尔浓度成正比,即
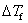 =
=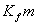
式中,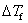 为凝固点降低值;m为溶质质量摩尔浓度;
为凝固点降低值;m为溶质质量摩尔浓度;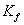 为凝固点降低常数,它与溶剂的特性有关。
为凝固点降低常数,它与溶剂的特性有关。
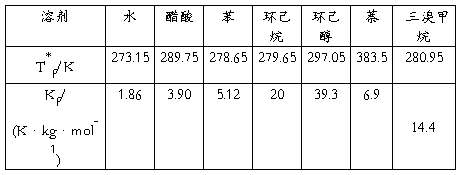
表1给出了部分的溶剂凝固点降低常数值。
表1 几种溶剂的凝固点降低常数值
若称取一定量的溶质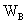 (g)和溶剂
(g)和溶剂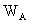 (g),配成稀溶液,则此溶液的质量摩尔浓度
(g),配成稀溶液,则此溶液的质量摩尔浓度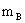 为
为
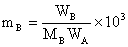 mol/kg
mol/kg
式中,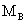 为溶质的相对分子质量。则
为溶质的相对分子质量。则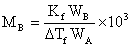 g/mol
g/mol
若已知某溶剂的凝固点降低常数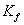 值,通过实验测定此溶液的凝固点降低值
值,通过实验测定此溶液的凝固点降低值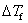 ,即可计算溶质的相对分子量
,即可计算溶质的相对分子量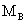 。
。
通常测凝固点的方法有平衡法和贝克曼法(或步冷曲线法)。本实验采用后者。其基本原理是将纯溶剂或溶液缓慢匀速冷却,记录体系温度随时间的变化,绘出步冷曲线(温度-时间曲线),用外推法求得纯溶剂或稀溶液中溶剂的凝固点。
纯溶剂步冷曲线:纯溶剂逐步冷却时,体系温度随时间均匀下降,到某一温度时有固体析出,由于结晶放出的凝固热抵消了体系降温时传递给环境的热量,因而保持固液两相平衡,当放热与散热达到平衡时,温度不再改变。在步冷曲线上呈现出一个平台;当全部凝固后,温度又开始下降。从理论上来讲,对于纯溶剂,只要固液两相平衡共存,同时体系温度均匀,那么每次测定的凝固点值应该不变。但实际上由于过冷现象存在,往往每次测定值会有起伏。当过冷现象存在时,纯溶剂的步冷曲线如图1-1(1)所示。即先过冷后足够量的晶体产生时,大量的凝固热使体系温度回升,回升后在某一温度维持不变,此不变的温度作为纯溶剂的凝固点。
稀溶液的步冷曲线:稀溶液凝固点测定也存在上述类似现象。没有过冷现象存在时,溶液首先均匀降温,当某一温度有溶剂开始析出时,凝固热抵消了部分体系向环境的放热,在步冷曲线上表现为一转折点,此温度即为该平衡浓度稀溶液的凝固点,随着溶剂析出,凝固点逐渐降低。但溶液的过冷现象普遍存在。当某一浓度的溶液逐渐冷却成过冷溶液,通过搅拌或加入晶种促使溶剂结晶,由结晶放出的凝固热抵消了体系降温时传递给环境的热量,当凝固放热与体系散热达到平衡时,温度不再回升。此固液两相共存的平衡温度即为溶液的凝固点。
通常测定凝固点的方法是将溶液逐渐冷却,使其结晶。但是,实际上溶液冷却到凝固点,往往并不析出晶体,这是因为新相形成需要一定的能量,故结晶并不析出,这就是所谓过冷现象。然后由于搅拌或加入晶种促使溶剂结晶,由结晶放出的凝固热,使体系温度回升。
从相律看,溶剂与溶液的冷却曲线形状不同。对纯溶剂,固-液两相共存时,自由度f=1-2+1=0,冷却曲线出现水平线段。对溶液,固-液两相共存时,自由度f=2-2+1=1,温度仍可下降,但由于溶剂凝固时放出凝固热,使温度回升,回升到最高点又开始下降,所以冷却曲线不出现水平线段,此时应加以校正。
本实验通过测定纯溶剂与溶液的温度与冷却时间的关系数据,绘制冷却曲线,从而得到两者的凝固点之差?Tf,进而计算待测物的摩尔质量。
四、注意事项:
1、凝固点的确定较为困难。先测一个近似凝固点,精确测量时,在接近近似凝固点时,降温速度要减慢,到凝固点时快速搅拌。
2、千万不要过冷,若过冷太甚,凝固的溶剂过多,溶液的浓度变化过大,所得凝固点偏低。
3、溶液的冷却曲线与纯溶剂的冷却曲线不同,不出现平台,只出现拐点,即当析出固相,温度回升到平衡温度后,不能保持一定值,因为部分溶剂凝固后,剩余溶液的浓度逐渐增大,平衡温度要逐渐下降。
4、用凝固点降低法测相对分子质量只适用于非挥发性溶质且非电解质的稀溶液。
5、插入贝克曼温度计不要碰壁与触底。
五、仪器与试剂:
凝固点测定仪 1套 贝克曼温度计 1支 普通温度计(0—50℃) 1支
移液管(50mL) 1支 烧杯 2个 环己烷(AR)、萘(AR)、冰
六、实验步骤:
1. 仪器安装:连接凝固点测定仪、精密数字温度温差仪等;
2. 调节寒剂温度:调节寒剂温度为4℃左右。
3.溶剂凝固点的测定:
1)仪器装置如图所示。用移液管向清洁、干燥的凝固点管内加入20mL环己烷,插入贝克曼温度计探头,不要碰壁与触底。
2)先将盛环己烷的凝固点管直接插入寒剂中,均匀搅拌,使环己烷的温度逐渐降低,当冷到6.6℃左右,要快速搅拌(以搅棒下端擦管底),幅度要尽可能的小,待温度回升后,恢复原来的搅拌速度,同时观察贝克曼温度计读数,直到温度回升稳定为止,此温度即为水的近似凝固点。 同时每隔15秒记录一个温度读数。
3)取出凝固点管,用手捂住管壁片刻,同时不断搅拌,使管中固体全部熔化,将凝固点管放在空气套管中,缓慢搅拌,使温度逐渐降低,当温度降至近似凝固点时,自支管加入少量晶种,并快速搅拌(在液体上部),待温度回升后,再改为缓慢搅拌。直到温度回升到稳定为止,记下稳定的温度值,重复测定二次,每次之差不超过0.006℃,二次平均值作为环己烷的凝固点。
4)溶液凝固点的测定:
取出凝固点管,如前将管中冰溶化,用分析天平精确称重0.1722 g萘,加入凝固点管中,待全部溶解后,测定溶液的凝固点。测定方法与环己烷的相同,先测近似的凝固点,再精确测定,但溶液凝固点是取回升后所达到的最高温度。重复二次,取平均值。
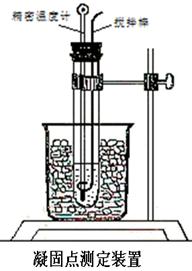
七、实验数据与处理:
粗测环己烷近似凝固点:6.47℃
精测环己烷凝固点:
表1第一次精测环己烷凝固点时间-温度记录(15s一次)温度:℃
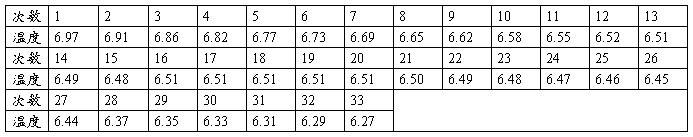

可得,环己烷的凝固点是6.511℃
表二:第2次精测环己烷凝固点时间-温度记录(15s一次)温度:℃
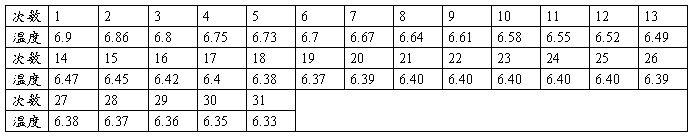

可得,环己烷的凝固点是6.400℃
即得环己烷的凝固点的平均值:(6.511+6.400)/2=6.4555℃
表3 第一次精测加萘后环己烷溶液凝固点时间-温度记录(15s一次)温度:℃


可得,溶液的凝固点是4.788℃
表3 第二次精测加萘后环己烷溶液凝固点时间-温度记录(15s一次)温度:℃
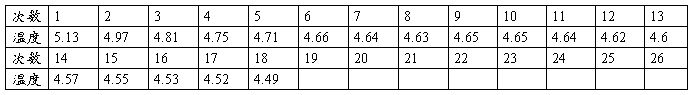

可得,溶液的凝固点是4.833℃
即得溶液的凝固点的平均值:(4.788+4.833)/2=4.8105℃
室温:18.30C 气压:1020.4hPa
(1)环己烷密度 P=0.79707+10^(-3)*(-0.8879)*18.3+10^(-0.972)*18.3^(2)
=0.7805g/ml
环己烷质量 W环=0.7805g/ml*20ml=15.61g
(2)称取萘的质量为:0.1722g
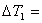 6.4555℃-4.8105℃=1.645℃
6.4555℃-4.8105℃=1.645℃
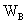 =0.1722g
=0.1722g 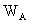 =15.61g
=15.61g  K.kg/mol
K.kg/mol
将上面数据代入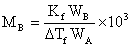 中 得到
中 得到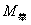 =134.19g/mol
=134.19g/mol
八、思考与讨论:
查文献可得:萘的相对分子质量为128.18 g/mol ,而在本实验中的结果为:134.19g/mol, 相对误差为 4.69%。
原因分析:
①实验仪器的误差:因为该实验需要用到的温度是纯的环己烷溶液的凝固点与环己烷的萘溶液的凝固点的差值,如果本身仪器的读数与环境实际温度存在单向的偏差,而我们在做实验的时候没有校正,就会带来偏差,又由于计算的过程用的是两次凝固点的差值,所以偏差就可以相互抵消,从而没有造成太大的影响。因此,实验时,可让测定仪的探头与冰浴接触,得到一个读数,同时在冰浴槽中放入一支温度计,对比两者的温度差值,就可以得到该仪器的温度偏差读数,最后在处理实验数据时,就可以对实验数据进行校正,以确保实验数据的科学性。
②因为在本实验中,搅拌速度的控制是做好本实验的关键,每次测定应按要求的速度搅拌,并且测溶剂与溶液凝固点时搅拌条件要一致。但是每次的搅拌速度快慢一致很难做到,会产生误差;
③冰槽的很难控制在理想的温度,在测量时会有细微跳动。过高会导致冷却太慢,过低则测不出正确的凝固点,导致实验也产生误差。
九、思考题:
1、为什么要先测近似凝固点?
答:防止过冷,节省时间。
2、根据什么原则考虑加入溶质的量?太多或太少影响如何?
答:根据稀溶液依数性,溶质加入量要少,而对于称量相对密度来说,溶质又不能太少。
3、测凝固点时,纯溶剂温度回升后有一定恒定阶段,而溶液则没有,为什么?
答:从相律分析,溶剂与溶液的冷却曲线不同。对纯溶剂两相共存时,自由度f =1-2+1=0.冷却曲线出现水平线段。对溶液两相共存时,自由度f =2-2+1=1,温度仍可下降,但由于溶剂凝固时放出凝固热,使温度回升,但回升到最高点又开始下降,所以冷却曲线不出现水平线段。
4、影响凝固点精确测量的因素有哪些?
溶液过冷程度控制;冰水浴温度控制在3。50C左右;搅拌速度控制,温度升高,快速搅拌;溶剂溶质精确测量,浓度不能太高。
十、参考文献
【1】何广平,男俊民 等. 物理化学实验 。北京:化学工业出版社,2007,12
【2】韩喜江,张云天。物理化学实验。哈尔滨:哈尔滨工业出版社,2004,4
【3】傅献彩,沈云霞,姚天杨。物理化学,第四版。北京:高等教育出版社,1990
