凝固点降低法测定摩尔质量
姓名: 学号: 班级:(同组实验者:)
实验日期:提交报告日期:
实验助教:
1 引言
1.1 实验目的
1.用凝固点降低法测定尿素的摩尔质量。
2.学会用步冷曲线对溶液凝固点进行校正。
3.通过本实验加深对稀溶液依数性的认识。
1.2 实验原理[1]
稀溶液具有依数性,凝固点降低是依数性的一种表现,它与溶液质量摩尔浓度的关系为
??f=?f???f=?f×?B
式中:??f为凝固点降低值,?f?、?f分别为纯溶剂、溶液的凝固点;?B为溶液质量摩尔浓度,?f为凝固点降低常数,它只与所用溶剂的特性有关。若稀溶液是由质量为?B的溶质溶于质量为?A的溶剂中构成,上式可写为
1000?B??f=?f BA
即
?B=?f1000?BfA
式中:?f单位为(K·kg)/mol;?B为溶质的摩尔质量,单位为g/mol。
若已知溶液的?f值,则可通过实验测出溶液的凝固点降低值??f,利用上式可求出溶质的摩尔质量。
常用溶剂的?f值见下表1。
表 1 常用溶剂的?f值
溶剂
水
苯
萘
环己烷
樟脑
环己醇 ?f?/K 273.15 278.683 353.440 279.69 451.90 279.694 ?f/(K·kg·mol?1) 1.853 5.12 6.94 20.0 37.7 39.3
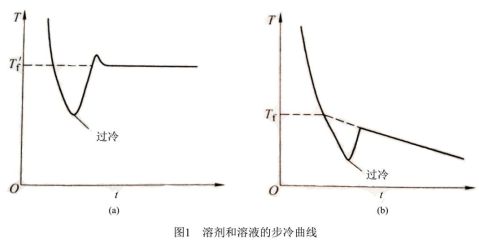
实验中要测量溶剂和溶液的凝固点之差。对于纯溶剂如图1(a),将溶剂逐渐降低至过冷(由于新相形成需要一定的能量,故结晶并不析出),温度降低至一定值时出现结晶,当晶体生成时,放出的热量使体系温度回升,而后温度保持相对恒定。纯溶剂在一定压力下,凝固点是固定不变的,直到全部液体凝固成固体后才会下降。相对恒定的温度即凝固点。 对溶液来说,除温度外还有溶液浓度的影响。当溶液温度回升后,由于不断析出溶剂晶体,溶液的浓度逐渐增大,凝固点逐渐降低。因此,凝固点不是一个恒定的值。如把回升的最高点温度作为凝固点,这时由于已有溶剂晶体析出,溶液浓度大于起始浓度,这时的凝固点不是原浓度溶液的凝固点。要精确测量,应测出步冷曲线,按图1(b)所示,外推至?f校正。
1
2 实验操作
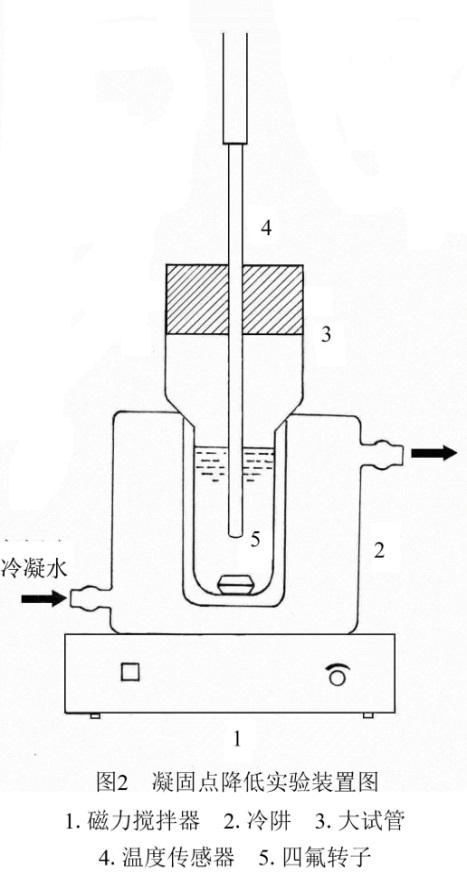
2.1 实验药品、仪器型号及测试装置示意图
SWC-ⅡD型精密数字温度温差计,冷阱,大试管,移液管(25mL),78-2型双向磁力加热搅拌器(江苏金坛市荣华仪器制造有限公司),DC-2010节能型智能恒温槽(宁波新芝生物科技股份有限公司),分析天平(公用),洗耳球,烧杯。
尿素(分析纯)。
装置如图2。
2.2 实验条件
室温18.0 ℃,大气压101.98 kPa,湿度32.9%。
2.3 实验操作步骤及方法要点
1.将恒温槽温度调至-6 ℃左右,通入冷阱。室温下,
用移液管移取25mL去离子水加入大试管。调整数字温
度计测温探头,使探头顶端处于液体中下部。调整磁力
搅拌器转速旋钮至适当旋转速度,保持恒定。
2.溶剂凝固点的测定。观察数字温度计变化,此时
温度逐渐降低,当温度降低至1 ℃后,每半分钟记一次
温度。当温度降低到最低点之后,温度开始回升,此时
晶体已经在析出。直到升至最高,一段时间内恒定不变。
此时温度即溶剂的凝固点,记下温度值。
取出大试管,不要使溶剂溅到橡皮塞上,手捂住试
管下部片刻或用手抚试,用手温将晶体全部融化(不要
升温过多,避免以后实验降温时间过长)。
将大试管放回冷阱,重复上述操作。如此重复数次,
直到取得三个偏差不超过±0.005℃的值。取其平均值作为溶剂去离子水的凝固点。
3.溶液凝固点的测定。取出大试管,在管中加入0.4 g左右(准确到0.0002g)的尿素,注意不要粘于管壁上(可先将尿素压成片)。拿掉磁力搅拌器上的冷阱,将大试管直接放在磁力搅拌器上搅拌至全部溶解,按装置图将仪器装好。观察数字温度计,当温度降至1 ℃时,半分钟记录一次温度值,当温度降至最低开始回升后(晶体析出),记下最高点温度(用此点估算尿素的摩尔质量)。此后再记录6~7个点,实验结束。
4. 关闭恒温槽,整理仪器。
3 结果与讨论
3.1 原始实验数据
2
1.纯溶剂(去离子水)凝固点测量:如下表2、3、4,加入体积为25 mL。
表2去离子水凝固点测量第一组 时间/s 0 30 60 90 120 150 180 210 240 270 300 330
表 3 去离子水凝固点测量第二组
时间/s 0 30 60 90 120 150 180 210 240 270 时间/s 0 30 60 90 120 150 180 210 240 270 3
温度/℃ 0.957 0.897 0.839 0.782 0.727 0.671 0.614 0.560 0.508 0.455 0.402 0.351
时间/s 360 390 420 450 480 510 540 570 600 630 660 690
温度/℃ 0.302 0.258 0.207 0.157 0.111 0.064 0.020 -0.025 -0.069 -0.110 -0.154 -0.195
时间/s 720 750 780 810 840 870 900 930 960 990 1020 1050
温度/℃ -0.238 -0.278 -0.318 -0.357 -0.397 -0.436 -0.472 -0.511 -0.549 -0.586 -0.624 -0.661
时间/s 1080 1110 1140 1170 1200 1230 1260 1290 1320 1350 1380 —
温度/℃ -0.601 0.207 0.230 0.236 0.230 0.232 0.231 0.226 0.228 0.227 0.228 —
温度/℃ 0.952 0.898 0.844 0.789 0.735 0.681 0.628 0.575 0.522 0.470 时间/s 330 360 390 420 450 480 510 540 570 600 温度/℃ 0.369 0.320 0.270 0.222 0.175 0.127 0.081 0.035 -0.009 -0.052 时间/s 660 690 720 750 780 810 840 870 900 930 温度/℃ -0.139 -0.182 -0.222 -0.264 -0.305 -0.343 -0.383 -0.421 -0.459 0.181 时间/s 990 1020 1050 1080 1110 1140 1170 1200 1230 — 温度/℃ 0.230 0.232 0.233 0.233 0.236 0.234 0.233 0.234 0.234 — 温度/℃ 0.964 0.920 0.874 0.830 0.785 0.740 0.693 0.646 0.597 0.550 时间/s 330 360 390 420 450 480 510 540 570 600 温度/℃ 0.453 0.405 0.359 0.311 0.265 0.218 0.172 0.128 0.083 0.037 时间/s 660 690 720 750 780 810 840 870 900 930 温度/℃ -0.048 -0.091 -0.133 -0.175 -0.216 -0.254 -0.295 -0.334 -0.372 -0.018 时间/s 990 1020 1050 1080 1110 1140 1170 1200 — — 温度/℃ 0.224 0.228 0.228 0.227 0.228 0.228 0.228 0.226 — —
2. 尿素溶液凝固点测量:如表5,尿素称量值0.3999 g,加入大试管后滤纸称量值0.0014 g;温度回升后最高点温度为-0.280 ℃。
表 5溶液凝固点测量 时间/s 0 30 60 90 120 150 180 210 240 270 300 330 360 390 420 450 480
温度/℃ 0.970 0.936 0.900 0.866 0.832 0.795 0.761 0.726 0.691 0.656 0.624 0.593 0.558 0.527 0.497 0.466 0.435
时间/s 510 540 570 600 630 660 690 720 750 780 810 840 870 900 930 960 990
温度/℃ 0.404 0.373 0.343 0.313 0.281 0.250 0.218 0.186 0.155 0.122 0.091 0.058 0.026 -0.006 -0.037 -0.068 -0.099
时间/s 1020 1050 1080 1110 1140 1170 1200 1230 1260 1290 1320 1350 1380 1410 1440 1470 1500
温度/℃ -0.128 -0.160 -0.189 -0.219 -0.249 -0.276 -0.305 -0.335 -0.363 -0.393 -0.423 -0.454 -0.486 -0.518 -0.551 -0.584 -0.591
时间/s 1530 1560 1590 1620 1650 1680 1710 1740 1770 1800 1830 1860 1890 1920 — — —
温度/℃ -0.634 -0.669 -0.551 -0.290 -0.282 -0.281 -0.282 -0.282 -0.283 -0.285 -0.284 -0.284 -0.286 -0.286 — — —
3.2 计算的数据结果
1.溶剂的步冷曲线
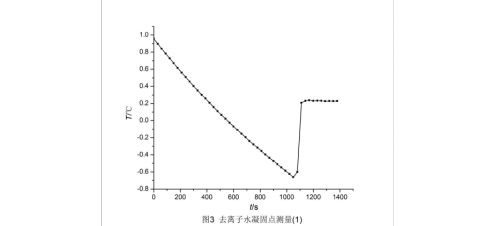
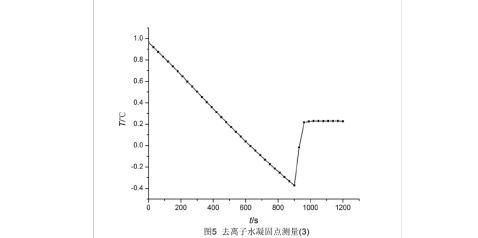
利用origin软件,作出三组去离子水凝固点测量的步冷曲线,如图3、4、5。三组测得的凝固点温度分别为0.228 ℃、0.234 ℃、0.228 ℃。
4
2.溶液的步冷曲线
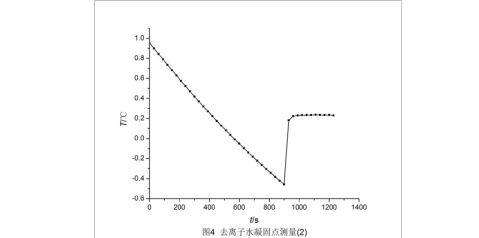
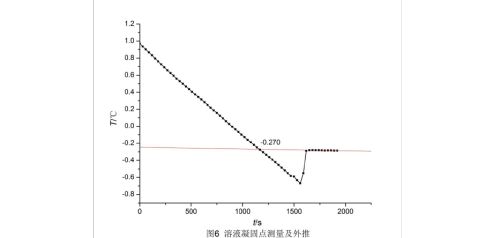
作出溶液的步冷曲线,并进行外推,如下页图6,外推的溶液的凝固点为-0.270 ℃。 给出外推直线方程为
?=?2.05556×10?5??0.24667
5
3. 尿素摩尔质量计算
三组测得溶剂凝固点分别为0.228 ℃、0.234 ℃、0.228 ℃,取平均值得
?f?=0.230 ℃
溶液凝固点
?f=?0.270 ℃
加入的尿素质量
?B=0.3985 g
18.0 ℃下,取水的密度为998.595 g/mL,得
?A=24.96g
查表得溶剂的凝固点降低常数为
?f=1.853K·kg·mol?1
则尿素的摩尔质量
1000?B?B=?f fA
1000?B=?f ?f??f ?A
=59.17g/mol
尿素的摩尔质量实际值为60.05 g/mol,绝对误差-0.88 g/mol,相对误差-1.47%。
3.3 讨论分析
1.冷阱内需要干燥,冷阱与大试管间不能直接接触,否则会造成局部过冷。实验中采用卫生纸将大试管周围垫起,建议可配备橡胶圈,隔热效果会更好。
2. 实验中需要控制好冷却速度,冷却过快会导致凝固时体系不平衡,影响实验结果;磁子的转速要合适,保证液体的均匀性,防止局部过冷。
3. 实验中有时液体过冷度较高但仍不结晶,可用镊子夹取少量冰屑加入大试管作为凝结核,但速度要快,不要让其熔化,也不能加得过多,否则会影响溶液浓度。图6
中步冷曲
6
线下降至-0.6 ℃附近时有一点明显不符合变化趋势,这是因为加冰屑时探头移出时间过长所致。
4. 误差分析:电子天平的不确定度计0.0001 g,移液管的不确定度计0.03mL,温度计的不确定度是0.001 ℃。
(1)标准相对误差
?f?测量的标准偏差
2× 0.228?0.230 2+(0.234?0.230)2?= =0.0035 ℃ 考虑仪器误差,并取95%的置信度,合成为?f?的不确定度
??f?= ×0.001 +(4.303×
可求得??f的不确定度
22???f= ???+?? ff20.00352=0.0088℃ = 0.0088+0.001
=0.0088℃
则标准相对误差
??B?ln?B2
2?ln?B2
2?ln?B2
2= ??B+ ??A+ ???f BBAf
??B2??A2???f2= + + BAf
0.0320.00882 ×0.0001= + + =1.8%
?B的标准误差
??B=1.07g/mol
即
?B=(59.17±1.07) g/mol
(2)平均相对偏差
?f?测量的平均偏差
??f?=
则凝固点降低的平均偏差
???f=0.003+0.001=0.004 ℃
?B的平均偏差
??B=0.0002 g
则?B的平均偏差 0.002×2+0.004=0.003℃ 7
??B=
即 ??B??B??B ??B + ??A + ???f BAf=0.57 g/mol
?B=(59.17±0.57) g/mol
平均相对偏差为
??B ??B ??A ???f =++ BBAf
0.00020.030.004=++=0.97%
由上述计算过程,可知误差来源应主要来自温度的测量,其次是移液误差。
4 结论
实验测得尿素的摩尔质量为59.17 g/mol,与理论值60.05 g/mol,相对误差-1.47%。 5 参考文献
[1] 贺德华,麻英,张连庆.《基础物理化学实验》.北京:高等教育出版社,2008.43-48.
[2] 朱文涛,王军民,陈琳.《简明物理化学》.北京:清华大学出版社,2008。
6 附录
思考题
1.实验中所配溶液浓度,太浓或太稀都会使实验结果产生较大的误差。为什么?
答:因为在推导凝固点降低的公式时,用到了理想稀薄溶液的条件,即溶液凝固点的降低于溶质的浓度成比例只适用于稀溶液,浓溶液不具有这种依数性,所以不能采用浓度很大的溶液,实际上浓溶液在结晶时有可能会同时将部分溶质带入晶体里,而不是仅析出溶剂。
若溶液浓度太低,凝固点降低值很小,会带来测量的相对误差偏大,故也不能选择浓度很小的溶液。
2.测凝固点时,纯溶剂温度回升后能有一相对恒定阶段,而溶液则没有。为什么?
答:利用相律分析,纯溶剂独立组分数C=1,结晶时系统相数P=2,大气压力不变时,则结晶时系统自由度
??=???+1=0
说明结晶时纯溶剂温度不变,即温度回升后能有一相对恒定阶段。
而对溶液来说,独立组分数C=2,结晶时系统相数P=2,大气压力不变时,则结晶时系统自由度
??=???+1=1
即结晶时溶液温度不恒定。
3.为什么会产生过冷现象?
答:可用弯曲固体表面现象来解释,在凝固点时,若开始有小晶体析出,由于晶体体积很小,并且是凹液面,液体的表面张力作用会在晶体上产生一个指向晶体内部的很大的附加压力,根据Young-Laplace公式,附加压力大小为
??=2?式中:?为晶体曲率半径,?为液体表面张力。
再由化学势与压力的关系,在附加压力作用下,小晶粒的化学势会高于液体的化学势,晶粒会再次熔化成液体。因此会产生过冷现象,同等温度下,固体化学势降低比液体快。在更低的温度下才会结晶。
8
4.原理中计算公式的导出作了哪些近似处理,如何判断本实验中这些假设的合理性? 答:做了如下近似:
(1)析出的第一粒固体是纯溶剂,溶质没有析出;
(2)凝固点温度变化较小,纯溶剂的摩尔熔化热不随温度变化;
(3)凝固点温度变化较小,溶液凝固点可近似看作为纯溶剂凝固点;
(4)溶液为理想稀薄溶液;
实验中,加入尿素后,溶质的摩尔分数为0.005?1,因此溶液可近似看作理想稀薄溶液,并可认为溶质没有析出,凝固点下降值仅有0.5 K,与溶剂的凝固点温度273.38 K相比可忽略,最终结果也符合公式。可认为本实验中上述假设是合理的。
9
第二篇:物化实验报告_凝固点降低法测定摩尔质量
凝固点降低法测定摩尔质量
丛乐 2005011007 生51
实验日期:20##年10月13日星期六 提交报告日期:20##年10月27日星期六
助教老师:刘马林
1 引言
1.1实验目的
1. 用凝固点降低法测定萘的摩尔质量
2. 学会用步冷曲线对溶液凝固点进行校正
3. 通过本实验加深对稀溶液依数性的认识
1.2 实验原理
稀溶液具有依数性,凝固点降低是依数性的一种表现,它与溶液质量摩尔浓度的关系为:
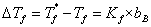
其中,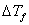 为凝固点降低值,
为凝固点降低值,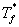 、
、 分别为纯溶剂、溶液的凝固点,
分别为纯溶剂、溶液的凝固点,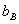 为溶液质量摩尔浓度,
为溶液质量摩尔浓度,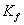 为凝固点降低常数,它只与所用溶剂的特性有关。如果稀溶液是由质量为
为凝固点降低常数,它只与所用溶剂的特性有关。如果稀溶液是由质量为 的溶质溶于质量为
的溶质溶于质量为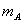 的溶剂中而构成,则上式可写为:
的溶剂中而构成,则上式可写为:
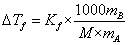
即
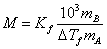 (*)
(*)
式中: 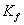 ——溶剂的凝固点降低常数(单位为
——溶剂的凝固点降低常数(单位为 );
);
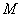 ——溶质的摩尔质量(单位为
——溶质的摩尔质量(单位为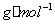 )。
)。
如果已知溶液的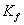 值,则可通过实验测出溶液的凝固点降低值
值,则可通过实验测出溶液的凝固点降低值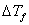 ,利用上式即可求出溶质的摩尔质量。
,利用上式即可求出溶质的摩尔质量。
常用溶剂的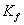 值见下表。
值见下表。
表1 常用溶剂的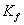 值
值
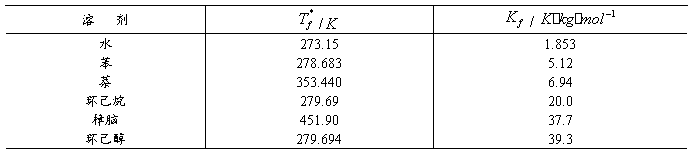
实验中,要测量溶剂和溶液的凝固点之差。对于纯溶剂如图1(a)所示,将溶剂逐渐降低至过冷(由于新相形成需要一定的能量,故结晶并不析出),温度降低至一定值时出现结晶,当晶体生成时,放出的热量使体系温度回升,而后温度保持相对恒定。对于纯溶剂来说,在一定压力下,凝固点是固定不变的,直到全部液体凝固成固体后才会下降。相对恒定的温度即为凝固点。
对于溶液来说,除温度外还有溶液浓度的影响。当溶液温度回升后,由于不断析出溶剂晶体,所以溶液的浓度逐渐增大,凝固点会逐渐降低。因此,凝固点不是一个恒定的值。如把回升的最高点温度作为凝固点,这时由于已有溶剂晶体析出,所以溶液浓度已不是起始浓度,而大于起始浓度,这时的凝固点不是原浓度溶液的凝固点。要精确测量,应测出步冷曲线,按下一页图1(b)所示方法,外推至 校正。
校正。

图1 溶剂和溶液的步冷曲线
2 实验操作
2.1 实验药品、仪器型号及测试装置示意图
1.仪器
TSW-3型 精密数字温度计(-12-12℃,0.002℃)
CJ-2型 磁力搅拌器 (北京林元佳业科技有限公司)
HS-4型 精密恒温浴槽(可制冷,-20-100℃)
冷阱 大试管 移液管(25ml)分析天平(公用) 秒表(E7-1,上海手表五厂)
2.药品
环己烷(分析纯,密度0.778g/ml),萘(分析纯,摩尔质量:128.17)
3.测试装置示意图(见下图)
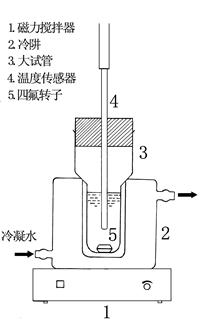
图2 凝固点降低法测定摩尔质量实验装置示意图
2.2 实验条件
表2 实验条件

2.3 实验操作步骤及方法要点
1.仪器装置
仪器装置如上一页图2所示,将恒温槽温度调至2℃左右,通入冷阱。在室温下,用移液管移取25ml环己烷,加入大试管。调整数字温度计的测温探头,使探头顶端处于液体的中下部。调整磁力搅拌器转速旋钮至适当旋转速度,保持恒定。
2.溶剂凝固点的测定
观察数字温度计的变化,此时温度逐渐降低,当温度降低到最低点之后,温度开始回升,说明此时晶体已经在析出。直到升至最高,在一段时间内恒定不变。此时温度即为溶剂的凝固点,记下温度值。
取出大试管,不要使溶剂溅到橡皮塞上,用手捂住试管下部片刻或用手抚试,用手温将晶体全部融化(注意不要使温度升高过多,避免以后实验的降温时间过长)。
将大试管放回冷阱,重复上述操作。如此再重复数次,直到取得三个偏差不超过 0.005℃的值。取其平均值作为溶剂环己烷的凝固点。
0.005℃的值。取其平均值作为溶剂环己烷的凝固点。
3.溶液凝固点的测定
取出大试管,在管中加入0.15g左右(准确到0.0002g)的萘,注意不要粘于管壁上(可先将萘压成片)。拿掉磁力搅拌器上的冷阱,将大试管直接放在磁力搅拌器上搅拌至全部融解,然后按装置图将仪器装好。观察数字温度计,当温度降至6℃时打开秒表,半分钟记录一次温度值,当温度降至最低开始回升后每15秒记录一个值,到最高点,将最高点温度记录下来(用此点估算萘的摩尔质量)。此后再恢复到半分钟记录一个值,记录6~7个点,实验结束。
环己烷溶液倒入回收甁。
3 结果与讨论
3.1 原始实验数据
1) 原始实验相关数据记录
表3 原始实验相关数据记录表

2) 原始实验测量数据
(a)溶剂凝固点测定原始数据
表4 溶剂凝固点测定原始数据记录表

在实验中,一共进行六次凝固点测定,取其中差距最小的三次,取平均值后作为溶剂的凝固点,即溶剂凝固点Tf*=6.388℃。
(b)溶液凝固点测量原始数据
表5溶液凝固点测量原始数据记录表
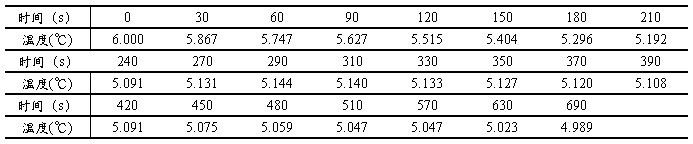
3.2计算的数据、结果
a) 利用冷却曲线计算溶液凝固点Tf
利用Origin Pro软件将表5中的数据用作图法表示出来,可得到实验中溶液的冷却曲线。结果如下图3所示:

图3 测定所得的溶液步冷曲线。测定体系由0.1525g萘与25.0mL环己烷组成,当系统温度降至6.000℃时开始记录,横坐标为时间,纵坐标为所测得的溶液温度,从而得到溶液的步冷曲线。
为得到准确的溶液凝固点,将溶液凝固后温度回升又下降的部分做反向延长线,与开始的温度下降线相交,分别选取线性程度较好的有效数据区进行线性拟合,所得到两条直线的交点即为溶液的凝固点Tf。结果如下图4所示:
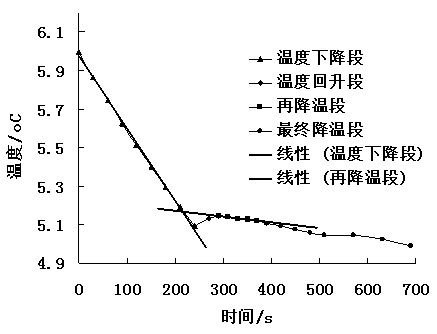
图4 步冷曲线有效数据区线性拟合结果。步冷曲线即图3中曲线,取开始温度下降段和再降温段进行线性拟合,所得直线的交点即为所求溶液的凝固点。
根据图4所得到的结果,两条曲线的线性拟合结果分别为:
y = -0.0038x + 5.979(R2=0.9985),y = -0.0003x + 5.2334(R2=0.9928)。
联立两个方程,求解两直线交点的坐标,可得溶液凝固点的温度值为:Tf = 5.169℃。
综上,用步冷曲线法得到溶液凝固点为5.169℃。
b) 根据凝固点变化计算萘的摩尔质量
利用前述凝固点测定结果,可根据公式(*),即 计算萘的摩尔质量。
计算萘的摩尔质量。
由已知: ΔTf= Tf*- Tf= 6.388℃ - 5.169℃ = 1.219℃ = 1.219K
mB= 0.1525g,mA = ρ x V = 0.778×25.0 = 19.45g,Kf = 20.0 K·kg·mol-1
将以上数据代入前述计算公式,得
萘的摩尔质量为MB= 20.0 × 1000 × 0.1525 / (1.219 × 19.45) = 128.6 g/mol
3.3讨论分析
1) 测定数据处理结果的误差分析及其与文献值的比较
(a)测定溶质(环己烷)凝固点的结果与文献值的比较
由文献值(见表3)可知,环己烷凝固点为6.3°C,而本次实验中的最终结果为6.388°C。将实验值与文献值进行比较可知:实验结果与文献值的相对误差ε = (6.388-6.3/6.388)×100%=1.378%。这一误差相对而言是比较大的,说明我们的测量和文献值有较大的偏差。
(b)测定溶质(环己烷)凝固点的测量误差分析
测定溶质凝固点时,对于三组数据(4中第3,4,5组的数据)进行误差分析可得:
平均误差: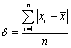 ,可得δ = 0.0113
,可得δ = 0.0113
标准误差: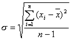 ,可得σ = 0.0161
,可得σ = 0.0161
因此测量结果精确度可用标准误差表示为:Tf*=6.388±0.0161 (℃)
(c)测定溶质(环己烷)凝固点过程中产生误差的可能原因及分析
对溶质环己烷的凝固点测量中,产生误差的可能原因如下:
首先,我们在测定过程中的每一次测定的条件可能不同,从而导致测定结果的误差较大。例如,测定时虽然我们十分注意仪器的装配,但如果大试管的管壁不慎碰到了冷阱,很有可能导致所测定的温度不准确。同时,磁力搅拌器的转速不均匀或者中途发生变化可能导致溶质结晶过程中各部分的热传导率等物理化学性质不均一,从而导致测量误差。另一方面,综合各次测定的结果,我们发现每一次测量误差的绝对值和符号总是使测量结果永远朝一个方向偏,由此推断在测定过程中存在系统误差。对于系统误差的具体分析请参见下文中对异常现象的分析和讨论。
(d)测定萘摩尔质量的结果与文献值的比较
由文献值(见表3)可知,萘的摩尔质量为128.17 g·mol-1,而本次实验中根据测定数据计算出的最终结果为128.6 g·mol-1。将实验值与文献值进行比较可知:实验结果的相对误差ε = (128.6-128.17/128.6)×100%=0.334%。误差相对而言比较小,说明我们得到的实验结果值与文献值相当接近。因此,我们在实验所采取的测定萘的摩尔质量的方法相对而言还是比较准确的。
(e)测定萘摩尔质量过程中的产生误差的可能原因及分析
如前所述,实验结果与文献值相比偏大,这可能是由以下几个方面的因素造成的:
i. 数据处理中的近似:在推导摩尔质量的计算公式过程中,进行了必要的数学近似,例如认为纯溶剂的摩尔熔化焓是常数,Tf*×Tf = (Tf)2等。在一般实验条件下,这些处理虽然不会对实验结果产生显著的影响,但是在测量过程较为精确时,则可能导致测量结果出现微小的偏大。
ii.实验条件的改变:在测量溶剂和溶液的凝固点的时候,实验条件很可能出现改变,这其中包括环境因素和人为因素的影响。比如环境温度的改变导致实验温度的改变,冷阱中循环水的温度不稳定也可能导致实验条件的变化。
iii. 测量体系的改变:在实验数据的处理过程中认为测量体系的组成没有变化,但是在实际情况中,很可能由于操作原因改变测量体系的组成。具体而言,在加入萘的时候可能会导致溶质环己烷有微量蒸发,或者在称取萘的过程中出现的操作失误。这些改变可能使得体系中mA减小或者mB增大,从而使得实验结果偏大。
iv. 测定仪器的误差:测量过程中,精密温度计的数值并不是很稳定,有时会出现波动现象。此外,在记录过程中,数据是人为判读和记录的,所以测定的温度值可能与实际有所差异。这样会导致根据测定数据所作的步冷曲线与实际曲线有所不同,也可能导致最后测量结果的误差。
(f)考虑称量、移液和温度测量三项误差来源的误差计算
若Y为间接测量值,Xk为直接测量值,则两者之间关系可以表示为:Y = f(Xk)
结果的相对不确定度公式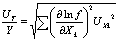
称量过程的误差为0.0002g,数字精密温度记测量误差为0.001℃,移液管误差为0.01ml,则有:
 ;
;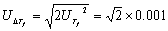 ;
; 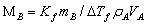
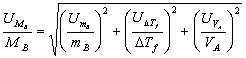

从而,称量、移液和温度测量三项误差来源的误差分别为0.0014,0.0012和0.00040。
综合以上结果,得:MB=128.6×(1±0.002)=(128.6±0.26)g/mol
由结果可知,误差的主要来源是称量(0.0014)和测温(0.0012)过程中所产生的误差。
2) 对实验中异常现象的分析和讨论
(a) 对溶剂(环己烷)凝固点测定中异常系统误差的分析
综合各次对溶剂(环己烷)凝固点的测定结果,我们发现每一次测量误差的绝对值和符号总是使测量结果永远朝一个方向偏,由此推断在测定过程中存在系统误差。其分析如下:
一方面,进行前两次测定时我们调整过磁力搅拌器的转速,可能使测量结果不准确,但在随后的四次测定中系统的配置没有过任何改变,因此最有可能的解释是搅拌器本身转速不稳定。另一方面,由于在随后的溶液凝固点测定过程中没有出现温度测定的异常情况,所以可以排除数字温度计出现故障的可能。此外,还有一种可能是我们所取的环己烷含有杂质。但是由于其他组没有出现相同的问题,所以可能是在向大试管转移液体的过程中引入杂质。最后,我们认为比较关键的原因是:我们组的实验位置距离恒温槽较近,因此在测量过程中,冷阱中循环水的温度很可能始终偏低,从而导致我们的测定结果始终向一个方向偏移。
(b) 对溶剂(环己烷)步冷曲线中稳定温度的分析
测定溶剂凝固点的过程中,实验的最后阶段应能够测得一个比较稳定温度值。但是在达到稳定之前,我们发现温度计的显示数值在很小的范围内(约0.002℃)会有短暂时间的波动,而且这种波动是无规律的。形成这个现象的可能原因有:当过冷液体刚刚开始结晶时,溶液处于两相共存的状态,但是由于搅拌不可能完全均匀,因此使得体系各个部分的温度和物理性质在不均匀的变化(特别是热传导性质和密度)。因此温度探头所接触部分的液体温度有可能产生无规则变化。
3) 对仪器装置、操作步骤、实验方法的改进意见和实验体会
完成全部实验和后期数据处理后,我深切地感受到这次实验利用我们所掌握的物化知识,从实验的角度对我们进行了一次充分的训练。最后所取得的实验结果是次要的,而我们所掌握的物化实验方法和实验过程的总结才是关键。结合实验具体过程和感受,我对本项试验有如下几点建议:
(a) 数据记录过程:在本次实验过程中,数据是人为判读和记录的,因此很可能会引入偶然误差,可以考虑利用一台同步记录仪进行温度数值的记录。
(b) 恒温槽的功能:在本次试验中由于恒温槽的限定,使得溶液降温的速度基本是恒定的,如果可能的话可以考虑使用一种降温速度可调整的恒温槽,在不需要记录温度的开始阶段快速降温,在数据记录段则正常降温。
(c) 装置的设计:试验中大试管的管壁较容易碰到冷阱,如能够在大试管和冷阱之间增加一个密封圈(可采用橡胶质地),就可以使得大试管的定位更加稳定,对增强实验结果的稳定性和准确性有益。
(d) 实验的重复型检验:一次实验并不能得到令人信服的结论,测量对象,测量条件的变化和仪器带来的系统误差都会影响到实验结果的重复性。因此,如果要验证贝克曼法的准确程度和适用范围,我们还需要进行进一步的实验,比如更换其他的溶质,或者对步冷曲线进行多次测量检验等。
(e) 最后,在本次物理化学实验的过程中,物理化学实验室的刘马林助教老师对我们进行了耐心的指导,给予了我们热情的帮助。当我们在实验中出现了问题,老师也没有过多责备我们,而是悉心地进行讲解,帮助我们想办法调整和修正,继续后续的实验。如果没有各位老师和助教的辛勤准备和付出,我们绝对无法顺利的完成本次的实验。您辛苦乐,非常感谢您!
4 结论
本次实验通过凝固点降低法(贝克曼法)测定了萘的摩尔质量,测定结果汇总如下:
环己烷纯溶剂凝固点: Tf*= 6.388℃。
萘的环己烷溶液凝固点:Tf = 5.169℃.
萘的摩尔质量: MB = 128.6 g/mol
本实验的结果与文献值相比的误差很小,证实了利用此方法测定摩尔质量的可行性与准确性。同时,本实验也验证了稀溶液依数性理论的正确性和实用性。在一定条件下,我们可以把较稀的溶液当作理想溶液来处理,利用其依数性测定有关的物理化学性质。而由此得到的结果和真实值的误差较小,在精确度要求不是非常高的情况上可以满足测定的要求。
5 参考文献
[1]张连庆等.步冷曲线法-对凝固点降低测定摩尔质量的改进.大学化学.北京:大学化学编辑部,2006.第21卷.第二期.54~56.
[2]清华大学化学系物理化学实验编写组.物理化学实验.北京:清华大学出版社,1991.45~53.
[3]朱文涛.物理化学(上册). 北京:清华大学出版社,1995.190~192.
[4]王军民 薛芳渝 刘芸 物理化学.北京:清华大学出版社 1993.
[5]孟尔熹, 实验误差与数据处理, 上海:上海科学技术出版社,1988.
6 附录
思考题:
1)实验中所配溶液浓度,太浓或太稀都会使实验结果产生较大的误差,为什么?
答:在本次实验中,溶液的浓度应使得测定过程中有部分溶质凝固析出,但还有一部分剩余溶液,且其浓度应当保持在一定的值。因此,如果溶液太稀,可能在析出的时候会完全析出,从而使得测量的凝固点温度不准确。另一方面,溶液浓度太小会使得凝固点的变化量太小,从而使实验中的误差对结果的影响很大,造成结果不准确。而如果溶液太浓,首先就会使得溶液的性质不符合稀溶液的依数性原理,使得计算公式不适用于所测定的体系,造成较大的实验误差。
2)测凝固点时,纯溶剂温度回升后能有一相对恒定阶段,而溶液则没有,为什么?
答:由分析纯级别的环己烷所构成的溶剂在凝固时所生成的晶体纯度很高,性质均以稳定,晶格排列较为规则整齐。因此,在测量仪器可探测得范围内,纯溶剂的温度回升后会遵循理想晶体凝固的性质而具有固定的凝固点(此时属于固相、液相共存状态),即实验中的温度相对恒定阶段。而溶液由于在凝固过程中不断发生组成变化, 其凝固温度就不断降低, 直到另一组分(溶质)也从溶液中饱和析出,因此没有温度相对恒定阶段。
3)为什么会产生过冷现象?
答:在凝固过程中,新生的固相在生成时由于其颗粒直径很小,比表面能较高,所以体系很难自发地向能量较高的方向进行。此时即便温度降低到相变点(凝固点)以下,相变过程也无法发生,从而导致体系的温度低于凝固点,即过冷现象(此体系成为过冷液体)。在此状况下,若体系的能量升至很高或收到外界干扰(比如投入大小适宜的晶核),液体即会迅速凝固为固体,发生相变过程。
4)原理中计算公式的导出作了哪些近似处理,如何判断本实验中这些假设的合理性?
答:在计算公式的推导过程从 出发,进行了一下几项近似处理:
出发,进行了一下几项近似处理:
a) 测定溶液符合稀溶液依数性,为理想稀薄溶液(溶质分子在溶液中的活度近似等于1)。
b) 纯溶剂的摩尔溶化焓不随温度T变化。
c) Tf*·Tf = (Tf)2
d) 析出的第一粒固体是纯固体
实验中溶剂的浓度很小,所以析出的固体可近似认为是纯固体。溶液可以近似认为是理想稀薄溶液。因为DTf较小,其变化而导致摩尔熔化热的变化可以忽略,也因此可以近似认为Tf*·Tf = (Tf)2。最终实验结果与理论值较吻合,说明推导过程中的这些近似是合理的。
