凝固点降低法测定摩尔质量
——实验日期:20xx年12月27日
姓名:王海全学号:1215030210 班级:矿物加工工程1202
一、 实验目的
(一)用凝固点降低法测定萘的摩尔质量。
(二)加深对稀溶液依数性质的理解。
二、 实验原理
非挥发性溶质二组分溶液,其稀溶液具有依数性,凝固点降低就是依数性的一种表现。根据凝固点降低的数值,可以求出溶质的摩尔质量。
在溶剂中加入溶质时,溶液的凝固点比纯溶剂的凝固点低,其凝固点降低值Δ??与溶质的质量摩尔浓度?成正比。
Δ??=??0???=???
式中,??0为纯溶剂的凝固点;??为浓度为?的溶液的凝固点;??为溶剂的凝固点降低常数。 若已知某种溶剂的凝固点降低常数??,并测得溶剂和溶质的质量分别为??和??的稀溶液的凝固点降低值Δ??,则可以通过下式计算溶质的摩尔质量??。
??=
式中,??的单位为?·??·????1。 ??·?? ??
三、 凝固点的确定方法
(一)纯溶剂的凝固点确定方法
纯溶剂的凝固点为其液相和固相共存的平衡温度。若将液态的纯溶剂逐步冷却,在未凝固前温度将随时间均匀下降。开始凝固后因放出凝固热而补偿了热损失,体系将保持液-固两相共存的平衡温度而不变,直到全部凝固,温度再继续下降。冷却曲线如图1中1所示。
但在实际过程中,液体温度达到或稍低于其凝固点时,晶体并不析出,此现象即过冷现象。此时若加以搅拌或加入晶种,促使晶核产生,则大量晶体迅速形成,并放出凝固热,使体系温度迅速回升到稳定的平衡温度,待液体全部凝固后,温度再逐渐下降。冷却曲线如图1中2所示。
(二)溶液的凝固点确定方法
溶液的凝固点是该溶液与溶剂的固相共存的平衡温度,冷却曲线与纯溶剂不同。当有溶剂凝固析出时,剩余溶液的浓度逐渐增大,因而溶液的凝固点也逐渐下降。因有凝固热放出,冷却曲线的斜率发生变化,即温度的下降速度变慢,如图1中3所示。本实验要求测定已知浓度溶液的凝固点。如果溶液过冷程度不大,析出固体溶剂的量很少,对原始溶液浓度影响不大,则以过冷回升的最高温度作为该溶液的凝固点,如图1中4所示。
确定凝固点的另一种方法是外推法,如图2所示,首先记录绘制纯溶剂与溶液的冷却曲线,作曲线后面部分(已经有固体析出)的趋势线并延长使其与曲线的前面部分相交,其交点即为凝固点。
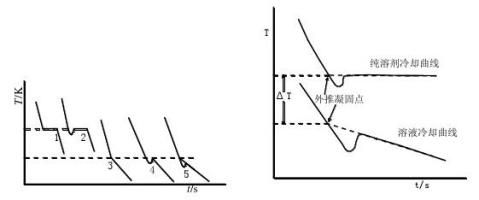
图1 纯溶剂和溶液的冷却曲线 图2 外推法求纯溶剂和溶液的凝固点
四、 仪器和试剂
(一)仪器
1.凝固点管、凝固点管塞、凝固点管套管;
2.小搅拌杆、大搅拌杆;
3.水浴缸、水浴缸盖;
4.精密电子温差仪、温度计;
5.移液管(25mL)、洗耳球;
6.天平(0.001g)。
(二)工具
锤子、保温瓶、试管、环形搅拌棒、移液管、贝克曼温度计一支、分析天平、滤纸、冰块;
(三)试剂
环己烷(A.R)、萘(A.R.)
五、 实验步骤
(一)如图安装实验装置

(二)测定纯溶剂环己烷的凝固点
1.
2.
3.
4.
5.
6.
7.
8. 取25.00mL环己烷→移液管→凝固点管; 将精密温差仪探头插入凝固点管,均匀搅拌(慢档),冷却至温度显示基本不变; 按面板上的“置零”钮,此时温差仪显示“0.000”; 拿出冰水浴中的凝固点管(用卫生纸擦干、擦净),用手捂热至结晶完全熔化(精密显示仪约6-7℃); 将凝固点管放入套管,套管放入冰水浴搅拌(慢档),每30秒记录温度(以精密温差仪的报时为准); 当液体开始析出晶体时(不直接观察样品管,观察精密温差仪示数下降开始变慢时)继续读数10分钟; 重复步骤4、5、6 一次; 测量结束后,保留凝固点管内环己烷用作接下来测量实验中萘的溶剂。
(三)测定萘的环己烷溶液的凝固点
1.
2.
3.
4.
5.
6. 用分析天平称取萘0.1000-0.1200g(实测0.1193g)→实验步骤(二)中保留的凝固点管→搅拌至完全溶解; 将凝固点管放入套管,套管放入冰水浴搅拌(慢档),每30秒记录温度(以精密温差仪的报时为准); 当液体开始析出晶体时(不直接观察样品管,观察精密温差仪示数下降开始变慢时)继续读数10分钟; 拿出冰水浴中的凝固点管(用卫生纸擦干、擦净),用手捂热至结晶完全熔化(精密显示仪约6-7℃); 重复步骤2、3一次; 测量结束,实验完毕。整理仪器,清洗凝固点管、搅拌器、温差仪探头,将环己烷倒入废液瓶。 注意事项:
1. 测温探头擦干后再插入凝固点管。不使用时注意妥善保护测温探头。
2. 加入固体样品时要小心,勿粘在壁上或撒在外面,以保证量的准确。
3. 熔化样品和溶解溶质时切勿升温过高,以防超出温差仪量程。
六、 数据记录及处理
(一)溶剂(环己烷)数据处理与计算
数据记录:

数据处理:

纯溶剂(环己烷)平台范围步冷曲线 纯溶剂(环己烷)步冷曲线
注:红色折线为溶剂(环己烷)温度数据组1,蓝色折线为溶剂(环己烷)温度数据组2。
解:观察图像,得t=1050s、1080s、1110s时的数据1、2值最接近,取作平台平均温度的计算。
由数据组1中t=1050s、1080s、1110s时的数据求得平均平台温度为
?1=0.037+0.040+0.041=0.039? 由数据组2中t=1050s、1080s、1110s时的数据求得平均平台温度为
?2=
取平均值得
??0=
?1+?2=0.046? 0.053+0.050+0.052=0.052?
(二)溶液凝固点(萘的环己烷溶液)数据处理与计算
数据记录:
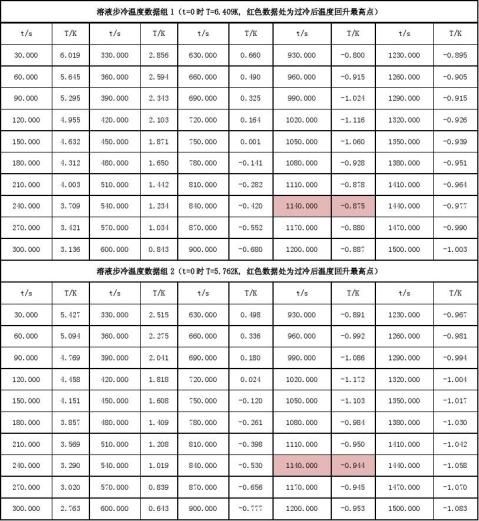
数据处理:
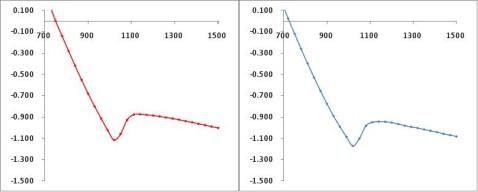
数据组1外推法求凝固点步冷曲线
数据组1:
数据组2外推法求凝固点步冷曲线
溶液至过冷前(t<1020s)步冷数据点拟合直线方程为:y = -0.0043x + 3.3243 溶液完全凝固后(t> 1140s)步冷数据点拟合直线方程为:y = -0.0004x - 0.4475 交点处?1= -0.836K 数据组2:
溶液至过冷前(t<1020s)步冷数据点拟合直线方程为:y = -0.0040x + 3.0749 溶液完全凝固后(t> 1170s)步冷数据点拟合直线方程为:y = -0.0004x - 0.4466 交点处?2= -0.838K 取平均值得:
??=
?1+?2
=?0.837?
(三)萘的摩尔质量计算与误差分析
摩尔质量计算:
测得实验室室温为15℃
则实验溶剂环己烷质量为??=?·?= 0.7971?0.8879?10?3?15 ?25=19.5945?
溶质萘的质量??=0.1193?
???=??0???=0.046? ?0.837 =0.883?
查表得??=20.0?·??·????1
由公式得
??=??·??20.0·1000·0.1193==137.90358?·????1 ??误差计算:
137.90358?128.17052η=?100%=1.60% 产生误差(测定结果偏大)的原因可能有以下几点:
1. ?Tf测定值偏小
2. 溶质在溶液中缔合或生成配合物
七、 思考题
(一)如果溶质在溶液中离解、缔合和生成配合物,对摩尔质量测量值如何影响?
答:溶质在溶液中离解,就会使有效质点增多,导致溶液凝固点降低大小比理论值更大,由公式??=??·??
Δ??·???Tf增
大,则MB减小,摩尔质量测定值偏小;溶质在溶液中缔合或生成配合物则会使摩尔质量测定值偏大。
(二)加入溶质的量太多或太少有何影响?
答:加入溶质太少,溶液凝固点下降不会呈现公式所呈现的比例关系,实际值会比公式计算所得理论值小,所以使摩尔质量测定值偏大;加入溶质太多,实际值会比公式计算所得理论值大,所以使摩尔质量测定值偏小。
(三)利用反应物、产物的某物理性质间接测量浓度进行动力学研究,应满足什么条件?
答:晶体内分子或原子的排列是有规律的,而液体内则是无规律的。而结晶中心有助于这种无序到有序的转化。液体越纯净,结晶中心越难形成。如果降低至凝固点以下仍未形成,就会产生过冷现象。
第二篇:凝固点降低法测定物质的摩尔质量
凝固点降低法测定物质的摩尔质量
实验五 凝固点降低法测定物质的摩尔质量
一、目的
1、用贝克曼冰点下降测定器测定纯水及各种已知浓度的凝固点,由此推求蔗糖的摩尔质量。
2、掌握溶液凝固点的测定技术。
3、学会使用贝克曼温度计。
二、基本原理
溶液的凝固点低于纯溶剂的凝固点,这是自然界的较为普遍现象,根据溶液热力学推证得:对理想稀溶液来说,凝固点的下降数值与溶质的质量摩尔浓度成正比。即:
?Tf=Tf?Tf=kfb2
(1)
式中:Tf:纯溶剂凝固点
Tf:溶液凝固点
kf:凝固点下降常数(以水为溶剂时,其kf=
1.862K·kg·mol-1)
b2:溶质的质量摩尔浓度
若称得质量为m2的溶质溶于质量为m1的溶剂中,则溶质的质量摩尔浓度为: **
? 1 ?
工科基础化学实验系列教材 物理化学实验
b2=m2M2m2= (2) m1m1M2
式中M2为溶质的摩尔质量。将(2)代入(1)式中整理后得:
M2=kf
?Tf?m2 (3) m1
从(3)看出,如已知溶剂的kf 值,则只要求得△Tf , 溶质的摩尔质量即可算出。因此,本实验的关键是准确测定溶剂及溶液的凝固点。
纯溶剂的凝固点是它的液相和固相平衡共存的温度,溶液的凝固点是该溶液的液相与溶剂的固相平衡共存的温度。在一定外压下,溶液的凝固点随溶液浓度增大而降低。若将纯溶剂或溶液逐步冷却,其各类冷却曲线见图5-1。
图5-1
Ⅰ,Ⅱ为纯溶剂的冷却曲线。Ⅲ、Ⅳ、Ⅴ为溶液的冷却曲线 ? 2 ?
凝固点降低法测定物质的摩尔质量
在实际过程中,往往出现如图5-1中Ⅱ、Ⅳ、Ⅴ中的过冷现象.所谓过冷现象,即是将液体缓慢冷却到凝固点以下时,并无固相立即析出,而过冷液体是热力学的不稳定状态; 经搅拌可析出固体, 放出的凝固潜热使液体温度回升,直到液相与固相达成平衡.由图可以看出,实验中稍有过冷现象(如图5-1·Ⅳ),则所测凝固点偏差不大,对分子量测定无显著影响,如过冷严重(如图5-1·Ⅴ),则所测之凝固点将偏低,影响分子量的测定结果.因此在测定过程中尽可能减轻过冷程度(如搅拌溶液、采用内外管装置等)。
三、仪器及药品
贝克曼温度计
1支
? 3 ?
1
标准温度计(0~50℃)10
1支
烧杯1000ml,250ml
各1个
贝克曼冰点下降测定器
1套(如图5-2) 移液管25ml,5ml
各1支
带铁夹的铁架台
1个
蔗糖(AR)及滤纸、粗食盐、冰块若干
工科基础化学实验系列教材 物理化学实验
称量瓶
1个
四、实验步骤
1、调好贝克曼温度计(在教师指导下操作):
将贝氏温度计水银球浸入冰水混合液(0℃)的烧杯中按附录2-1所示调节方法调节,直到使贝氏温度计读数调在4~5刻度之间。调节好后将其靠牢在铁架台的铁夹中,其水银球部在使用前一直插在冰水中,以备随时取用。
2、装好贝克曼冰点下降测定器
(1)按图5-2装置。首先把冰块捣成约2cm3大小的碎块,然后将冰块轻轻送至冰瓶底部,约装入4cm高的冰块后,用五个手指摄一撮粗盐均匀撒在冰块上。将洗净烘干的贝氏测定器外管架在冰瓶中间,然后在外管周围再加入4cm高的冰块,再摄一撮盐均匀撒在周围,如此重复操作,直至外管周围被冰盐混合物包围,但注意外管内不能掉入冰盐混合物。
(2)用移液管准确地吸取25.00ml蒸馏水,注入冼净烘干的内管中(见图5-2),并插入干净的搅拌器及一支干净的0~50℃的1标10准温度计。将内管插到1000ml的冰盐水混合液中一边搅拌,一边冷却,直至冷却至0.5℃左右,取出0~50℃温度计,将备用的贝氏温度计擦净后插入内管,塞好橡皮塞(注意温度计不要和玻璃壁相碰,亦不要与搅拌器相摩擦)。迅速将装好的内管从冰盐水中取出,擦净其外壁,架入外管中,到此装置完毕。
3、测定蒸馏水凝固点
? 4 ?
凝固点降低法测定物质的摩尔质量
首先用搅拌器均匀地上下搅拌, 同时注意勿使溶液溅到上部管壁或塞上。待管内温度下降至贝氏温度计有刻度可读时开始读数、记录。每隔30秒钟读记温度一次。一直记录到完成类似图5~1中Ⅰ或Ⅱ冷却曲线为止。曲线中一般约有十个左右连续不变的T值即为Tf值。(注意:此值实质就相当于0℃)。数据记录完毕后将内管取出,用手指握管同时轻轻搅拌,以手温或室温使管内冰块完全融化后取出贝氏温度计放稳在冰水烧杯中浸泡备用。
4、测不同浓度下蔗糖溶液的凝固点
(1)用称量瓶在分析天平上称取5克左右的蔗糖,准确至0.001克。用长纸槽小心地将其送入上述蒸馏水中搅拌,直至蔗糖全部溶解后,将内管插入烧杯中冷至摄氏0.5℃,然后按图(5-2)装好装置。以测纯水的凝固点的同样方法测定其凝固点。稍有不同的是所完成的曲线应是类似于图5-1中的Ⅳ或Ⅴ,数据的终止记录应以完成曲线为准。应注意ab段至少读十五个下降的数据。
(2)用移液管准确地移取5.00ml蒸馏水,将其从支管口注入到内管中,注意避开贝氏温度计而注入。然后用手指加热内管,并搅拌使内管中冰融化,即可以开始测其凝固点,完成该浓度溶液的冷却曲线。
用以上同样量的蒸馏水、同样的方法,分别再测两次浓度稀释后溶液的凝固点,完成各浓度溶液的冷却曲线。即共加入蒸馏水三次,每次5ml。 0
五、数据记录和结果处理
1、以时间为横坐标,温度为纵坐标,作出每次实验的冷却
? 5 ?
工科基础化学实验系列教材 物理化学实验
曲线,求纯水冰点和四个浓度的蔗糖溶液的凝固点及ΔTf。
2、按(3)式分别计算出各个浓度下的蔗糖分子量,然后以M2为纵坐标,b2为横坐标作图,用外推法求出b2→0时的蔗糖分子量。如果误差太大,就用平均法求出蔗糖分子量。
3、将求得结果与蔗糖分子量的理论值(342.3)比较, 求相对误差, 并进行误差讨论。
六、思考题
1、凝固点降低法测分子量的公式在什么条件下才能应用?
2、在冷却过程中,测凝固点时内管中液体有哪些热交换存在?它们对凝固点的测定有何影响?
七、注意事项
1、贝氏温度计属精密贵重玻璃仪器,注意轻拿轻放、放牢靠。实验完毕最先取出贝氏温度计放稳。切勿在实验过程中将其倒置或撞碰、跌落。
2、本实验测定过程中常有过冷现象产生,其溶液的凝固点是在过冷曲线上升后的下降曲线的反向延长线与过冷前的下降曲线相交点处。
3、实验中的搅拌要连续、均匀。上下搅拌幅度大致与液体高度一致。
? 6 ?
