20##~20##学年度金山中学高二年级月考
化学试题 2012.10
可能用到的相对原子质量:C:12 O:16 S:32 Al:27
一、单项选择题(本题包括8小题,每小题3分,共24分)
1、未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是( )
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
A.①②③④ B.⑤⑥⑦⑧ C.③⑤⑥⑦⑧ D.③④⑤⑥⑦⑧
2、下列过程中△H小于零的是( )
A. 氯酸钾分解制氧气 B. 氯化铵分解得氨气
C.碳酸钙分解得二氧化碳 D. 实验室制备氢气
3、下列说法正确的是( )
A.热化学方程式中,若没有注明温度和压强,则表示反应热是在标准状况下测得的数据
B.升高温度或加入催化剂,可以改变化学反应的反应热
C.据能量守恒定律,反应物的总能量一定等于生成物的总能量
D.反应产物的总焓大于反应物的总焓时,反应吸热,ΔH>0
4、同温同压下,下列各反应为放热反应,下列各热化学方程式中反应热最小的是( )
A.2A ( l ) + B ( l ) = 2C (g ) △H1 B.2A ( g ) + B ( g ) = 2C (g ) △H2
C.2A ( g ) + B ( g ) = 2C ( l ) △H3 D.2A ( l ) + B ( l ) = 2C ( l ) △H4
5、一定温度下在容积恒定的密闭容器中,进行如下可逆反应:A(s)+2B(g) C(g)+D(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是( )
①容器内气体的压强 ②混合气体的密度
③混合气体的总物质的量 ④体系的温度
A.②④ B.②③
C.②③④ D.只有④
6、右图中的曲线是在其他条件一定时反应:2NO(g)+O2(g)2NO2(g)(正反应放热)中NO的最大转化率与温度的关系。图上标有A、B、C、D、E五点,其中表示未达到平衡状态,且v正>v逆的点是( )
A.A或E B.C C.B D.D
7、某可逆反应L(s)+G(g) 3R(g) (正反应为吸热反应),下图表示外界条件温度、压强的变化对上述反应的影响。试判断图中y轴可以表示( )
A.平衡混合气中R的质量分数
B.达到平衡时G的转化率
C.平衡混合气中G的质量分数
D.达到平衡时L的转化率
8、已知反应:
①101kPa时,2C(s) +O2(g)==2CO(g);ΔH=-221 kJ/mol
②稀溶液中,H+(aq)+OHˉ(aq)==H2O(l);ΔH=-57.3 kJ/mol。下列结论正确的是( )
A.碳的燃烧热小于110.5 kJ/mol
B.①的反应热为221 kJ/mol
C.稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出的热量小于57.3 kJ
二、双项选择题(共4小题,每小题6分,计24分,每小题有2个正确答案,
全选对得6分,只选一个且正确得3分,选错或不答该小题不得分。)
9、对于一定条件下进行的化学反应,2SO2(g)+O2(g)2SO3(g),改变下列条件,可以提高反应物中活化分子百分数的是( )
A.升高温度 B.增大压强 C.使用催化剂 D.增大反应物浓度
10、100 mL 6mol/L H2SO4跟过量锌粉反应,在一定温度下,为了减缓反应进行的速率,
但又不影响生成氢气的总量,可向反应物中加入适量的( )
A.碳酸钠固体 B.醋酸钠固体 C.硫酸钠溶液 D.硝酸钾溶液
11、将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:
2A(g)+B(g)2C(g)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法,其中正确的是( )
A.用物质A表示的反应平均速率为0.3 mol·L-1·s-1
B.用物质B表示的反应的平均速率为0.6 mol·L-1·s-1
C.2 s时物质A的转化率为70%
D.2 s时物质B的浓度为0.7 mol·L-1
12、某温度下,在一体积恒定容器中,反应2A(g)+B(g)2C(g)达到平衡时,A、B和C的物质的量分别为4 mol、2 mol和4 mol。保持温度和容积不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是( )
A.均减半 B.均加倍 C.均增加1 mol D.均减少1 mol
三、填空题
13、(12分)写出下列反应的热化学方程式。
(1)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) ΔH=+64.39kJ/mol
2H2O2(l)=2H2O(l)+O2(g) ΔH=-196.46kJ/mol
H2(g)+1/2 O2(g)=H2O(l) ΔH=-285.84kJ/mol
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为 。(2)在298K下,C、Al的单质各1mol完全燃烧,分别放出热量aKJ和bKJ。又知一定条件下,Al能将C从CO2置换出来,写出此置换反应的热化学方程式
(3)25℃,1.01×105Pa下,1g 硫粉在氧气中充分燃烧放出 9.36kJ热量,写出表示硫燃烧热的热化学方程式
14、(16分)常温下,取两片质量相等、外形和组成相同表面经过砂纸打磨(完全除掉了氧化物)的铝片,分别加入到盛有体积相同、c(H+)相同的稀硫酸和稀盐酸溶液的两支试管(相同体积)中制取H2。实验现象如下表:

(1)写出以上反应的离子方程式______________________________________ 。
(2)分析上表数据,你得出的结论是: 。
(3)你认为出现以上现象的可能原因是(写出一个即可):
______________________________ ____ ___________________ _;
(4)请设计实验对你的假设进行验证:
__________________________________________________ ___________;
(5)如果上述假设都成立,要使以上稀硫酸与铝反应产生的氢气速率加快,可以采取的措施有(列举三个):
15、(10分)现有T1℃的密闭容器中存在如下反应:2SO2 (g) + O2(g) 2SO3(g) △H<0。已知c(SO2)始=0.4mol/L,c(O2)始=1mol/L经测定该反应在该温度下的平衡常数K≈19,试判断:
(1)当SO2转化率为50%时,该反应是否达到平衡状态,理由是 ;若未达到,反应向 进行。(填“正反应”或“逆反应”)
(2)已知T2>T1,则该反应T2℃下的平衡常数________19。(填“>”“<”或“=”)
(3)达平衡状态时, SO2的转化率α应为 (列出与α有关的计算公式即可)
16、(14分) (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示________________,K值大小与温度的关系是:温度升高,K值__________(填一定增大、一定减小、或可能增大也可能减小)。
(2)已知反应Cl2+H2OHCl+HClO,写出该反应化学平衡常数的表达式
(3)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
CO(g)+H2O(g)CO2(g)+H2 (g) ΔH=-QkJ/mol (Q>0)
CO和H2O浓度变化如下图,则0~4 min的平均反应速率v(CO)=______ mol/(L·min)
(4)t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3 min~4 min之间反应处于_________状态;C1数值_________0.08 mol/L (填大于、小于或等于)。
②反应在4 min~5 min问,平衡向逆方向移动,可能的原因是_______,表中5 min~6 min之间数值发生变化,可能的原因是_______。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
汕头金山中学高二月考化学考试答卷
班级:________ 姓名:________ 学号:________ 成绩:________
一、单项选择题(24分)

二、双项选择题(24分)

三、填空题(52分)
13、(12分,每空4分)
(1)_____________________________________________________________________
(2)_____________________________________________________________________
(3)_____________________________________________________________________
14、(18分)
(1)_____________________________ _
(2)_______________ _______________
(3)_______________________ _____ __
(4)____ ______
(5)
15、(6分)
(1)____________________________________ _ ____
(2)______________(3)________________________________________
16、(16分)
(1)______________________________ _______________________________
(2)______________________________
(3)______________________________
(4)______ ____ _____ ____ ______ ___ _______ __
汕头金山中学高二月考试题化学试卷答案
一、单选(3×8=24)

二、不定项选择(4×6=24)
13、(1) Cu(s)+H2O2 (l)+2H+(aq)=Cu2+(aq)+2H2O(l) △H= —319.68kJ.mol-1
(2) 4Al(s)+ 3CO2(g)=3C(s)+ 2Al2O3(s),△H= (3a-4b)kJ/mol
(3)S(s)+O2(g)=SO2(g)△H= —299.52kJ/mol (每个方程式各3分)
14、 (1)2Al+6H+==2Al3++3H2↑(2′)
(2)Al在c(H+)相同的盐酸中反应比在硫酸中快得多。(2′)
(3)①Cl-对铝与H+反应有促进作用;②SO42-对铝与H+反应有抑制作用。(3′)
(4)①向以上稀硫酸中加入少量的氯化钠或氯化钾(或其他可溶性氯化物)固体,如果都能使反应速率加快,则假设①成立;②向以上稀盐酸中加入少量的硫酸钠或硫酸铵(或其他可溶性硫酸盐)固体,如果都能使反应速率减慢,则假设②成立。(3′)
(5)①加入含有Cl-的可溶性氯化物;②增加H+浓度;③加热;④将铝片改换成铝丝⑤利用不活泼金属或不活泼金属可溶性盐形成原电池等。(每个2分)
15、(1)没有达到平衡 因为浓度商Qc=1.1≠19,所以未达到平衡(2′) 正方向(2′)
(2)<(2′) (3)K = (0.4α)^2 / [0.4(1-α)]^2 · (1-0.2α) = 19 (3′)
16(1)可逆反应的进行程度越大 可能增大也可能减小
(2)K=[c(H+)·c(Cl-)·c(HClO)]/c(Cl2)
(3)0.03 (2′) (4)①平衡 大于 ②d a (每空2分)
(5)0.1mol/L(4′)
第二篇:高二化学(选修)第二学期期中考试试卷
清华园教育网
高二化学(选修)第二学期期中考试试卷
命题人:孙明林 李大宁
注意事项:
1. 第I卷64分,第II卷56分,共120分,考试时间为100分钟。
2. 请将答案统一填写在答题纸上。可能用到的相对原子质量:
H—1 C—12 N—14 O—16
第I卷
一、选择题(每小题只有一个选项符合题意.3分×8题=24分)
1.第一次用无机物制备有机物尿素,开辟人工合成有机物先河的科学家是( )
A.德国的维勒 B.英国的道尔顿
C.德国的李比希 D.俄罗斯的门捷列夫
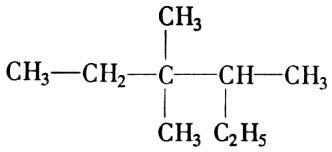
2.有机物 的正确命名为 ( )
A.2—乙基—3,3—二甲基戊烷 B.3,3—二甲基—4—乙基戊烷
C.3,3,4—三甲基已烷 D.2,3,3——三甲基已烷
3.下列有关说法不正确的是
A.具有相同通式的有机物不一定互为同系物
B.分子组成相差一个或若干个CH2原子团的化合物一定互为同系物
C.分子式为C3H8与C6H14的两种有机物一定互为同系物
D.两个相邻同系物的相对分子质量数值一定相差14
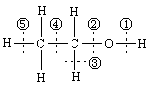
4. 乙醇分子结构中各种化学键如右图所示,关于乙醇在各种反应中断裂键的说明不正确的是
A.和金属钠反应是键①断裂
B.和浓硫酸共热到170℃时断键②和⑤
C.和浓硫酸共热到140℃时断键②,其它键不断
D.和浓氢溴酸混合加热时断键②
5.据报道,近来发现了一种新的星际分子氰基辛炔,其结构式为
清华园教育网
清华园教育网
HC≡C—C≡C-C≡C-C≡C-C≡N.对该物质判断正确的是:
A.晶体的硬度与金刚石相当 B.能使酸性高锰酸钾溶液褪色
C.不能发生加成反应 D.不能使溴水褪色
6.以下实验能获得成功的是
A.用酸性KMnO4溶液鉴别乙烯和乙炔
B.将铁屑、溴水、苯混合制溴苯
C.在苯和硝基苯采用分液的方法分离
D.将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色
7、由溴乙烷制取乙二醇,依次发生反应的类型是
A.消去、加成、水解 B.取代、加成、水解
C.水解、消去、加成 D.消去、水解、取代
8.要检验某溴乙烷中的溴元素,正确的实验方法是
A.加入溴水振荡,观察水层是否有棕红色出现
B.滴入AgNO3溶液,再加入稀硝酸呈酸性,观察有无浅黄色沉淀生成
C.加入NaOH溶液共热,然后加入稀硝酸呈酸性,再滴入AgNO3溶液,观察有无浅
黄色沉淀生成
D.加入NaOH溶液共热,冷却后滴入AgNO3溶液,观察有无浅黄色沉淀生成
二、选择题(共8题,每小题有1—2个选项符合题意.4分×10=40分)
9.设阿伏加德罗常数为NA,则下列说法正确的是
A.15g甲基(-CH3)所含有的电子数是NA
B.常温常压下,4g氦气所含有的原子数目为NA
C.标准状况下,1L戊烷充分燃烧后生成的气态产物的分子数为5/22.4 NA
D.常温常压下,1mol丙烷所含有的共价键数目为12NA
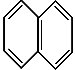
10.
)的同系物。则萘和萘的同系物分子组成通式是:
A.CnH2n-6(n≥11) B.CnH2n-12(n>10)
C.CnH2n-10(n≥10) D.CnH2n-12(n≥10)
11.下列各醇中,能发生消去反应生成(CH3)2C==CH2且能发生催化氧化的是
CH2OH
A.CH3-OH B.CH 3 H
CH3
清华园教育网
都属于萘(
结构简式:
清华园教育网
C. D.
12.描述CH3—CH==CH—C≡C—CF3分子结构的下列叙述中,正确的是
A.6个碳原子有可能在一条直线上 B.6个碳原子一定都在同一平面上
C.此分子最多有8个原子在同一平面上 D.此分子至少有8个原子在同一平面上
13.下列各组混合物中,不论两种物质以何种比例混合,只要总物质的量一定,经过完全燃烧后,产生的CO2质量不变的是
A.乙炔和苯 B.甲醛(HCHO)与葡萄糖(C6H12O6)
C.乙醇和乙酸 D.丙烯和丙烷
14.两种气态烃的混合物共0.1 mol ,充分燃烧后得3.58 L(标准状况下)CO2和3.6 g水,下列说法正确的是
A.一定有甲烷 B.一定有乙烯 D.可能有乙烷 D.可能有丙炔
15.下列化学式及结构式中,从成键情况看不合理的是
HHA.CH3N B.CH4Si D.CH4S H
16.工业上将苯的蒸气通过赤热的铁能合成一种可作传热载体的化合物。该化合物分子中苯环上的一氯代物有3种。1mol该化合物催化加氢时最多消耗6molH2。这种化合物可能是 C.CH2SO S A. B. C. D.
17.利用某些有机物的同分异构体间的转化可用来贮存热能,如原降冰片二烯(NBD)经太阳照射后转化成四环烷(Q)的的反应:△H=+88.62kJ·mol —1
下列说法不正确的是: ...
A.NBD、Q、甲苯三者互为同系物 B. NBD、Q、甲苯三者是同分异构体
清华园教育网
清华园教育网
C.92gNBD经太阳照射后完全转化为Q时需吸收88.62kJ热量 D.NBD可开发为贮能材料
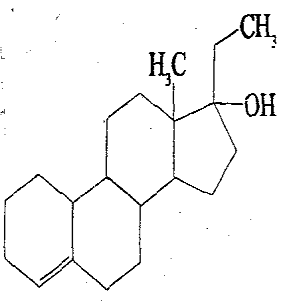
18.为实现2008北京“科技奥运”战略,我国兴奋剂检测生物芯片装置已定型和批量生产,可快捷检测常见的16种兴奋剂。已知某兴奋剂乙基雌烯醇(etylestrenol)的结构如右图所示。下列叙述中正确的是
A、该物质可以视为酚类
B、在浓硫酸作用下,分子内消去一个水分子,产物有二种同
分异构体
C、能使溴的四氯化碳溶液褪色
D、该物质分子中的所有碳原子均共面
第II卷
三.实验题 (共18分)
19.(4分)下列叙述正确的是________________(选对一个给2分,多选、错选一个扣1分,本题不出现负分)。
A.不慎把苯酚溶液沾到了皮肤上,应立即用大量水冲洗。
B.甲、乙两种有机物具有相同的相对分子质量和不同结构,则甲和乙一定是同分异构体。
C.浓溴水滴入苯酚溶液中立即产生2,4,6-三溴苯酚的白色沉淀。
D.溴的苯溶液中加少量铁粉后会剧烈反应,并放出大量的热,但该现象不能说明苯和溴的取代反应就是放热反应。
E.分离沸点相差30℃以上的混溶液体,应采用的方法是分馏
F.实验室使用体积比为1:3的浓硫酸与乙醇的混合溶液制乙烯时,为防加热时反应混合液出现暴沸现象,除了要加沸石外,还应注意缓慢加热让温度慢慢升至170℃。
G.除去混在苯中的少量苯酚,加入过量溴水,过滤。
20. (14分)为探究实验室制乙烯及乙烯和溴水的加成反应。甲同学设计了如图所示的实验装置,并进行了实验。当温度升至170℃左右时,有大量气体产生,产生的气体通入溴水中,溴水的颜色迅速褪去。甲同学认为达到了实验
目的。
乙同学仔细考察了甲同学的整个实验过程,发现当
温度升到100℃左右时,无色液体开始变色,到160℃
左右时,混合液全呈黑色,在170℃超过后生成气体速
清华园教育网
清华园教育网
度明显加快,生成的气体有刺激性气味。由此他推出,产生的气体中应有杂质,可能影响
乙烯的检出,必须除去。据此回答下列问题:
(1)写出甲同学实验中两个反应的化学方程式:
___________________________、__________________________。
(2)乙同学观察到的黑色物质是_____________,刺激性气体是_____________。乙同学
认为刺激性气体的存在就不能认为溴水褪色是乙烯的加成反应造成的。原因是(用化学方程
表示):_____________________。
(3)丙同学根据甲乙同学的分析,认为还可能有CO、CO2
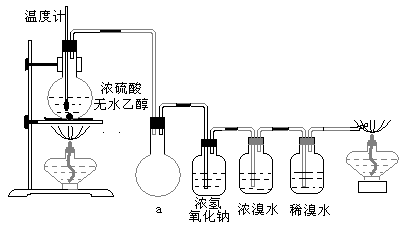
两种气体产生。为证明CO
存在,他设计了如下过程(该过程可把实验中产生的有机产物除净):发现最后气体经点燃
是蓝色火焰,确认有一氧化碳。
①设计装置a的作用是____________________
②浓溴水的作用是_______________________,稀溴水的作用是____________________。
四、填空题。(共22分)
21.(8分)按要求完成下列问题
(1)甲基的电子式(2)通式为CnH2n+2的最简单同系物的分子式
(3)相对分子质量为72且沸点最低的烷烃的结构简式 _____________________
(4)1,3-丁二烯的键线式
22.(14分)按以下步骤可从
已略去).
清华园教育网
合成(部分试剂和反应条件
清华园教育网
请回答下列问题:
(1)B、F的结构简式为:B F 。
(2)反应①~⑦中属于消去反应的是 (填代号)。
(3)根据反应,写出在同样条件下
CH2=CH—CH=CH2与等物质的量Br2发生加成反应的化学方程式:
(4)写出第④步的化学方程式(有机物写结构简式,注明反应条件).
(5)A—G这七种有机物分子中含有手性碳原子的是(填序号) 。 (6)核磁共振谱是测定有机物分子结构最有用的工具之一。在有机物分子中,不同位置的氢原子在质子核磁共振谱(PMR)中给出的峰值(信号)也不同,根据峰(信号)
HO
H可以确定有机物分子中氢原子的种类和数目。例如:乙醛的结构式为: H,其
PMR谱中有2个信号峰,其强度之比为3∶1。则下列有机物分子中,在质子核磁共振谱中能给出三种峰(信号)且强度之比为1∶1∶2的是 。
A. B. C. D.
五、计算题(共16分)
23.一种气态烷烃和一种气态烯烃的混合物共10g,平均相对分子质量为25。使混合气通过足量溴水,溴水增重8.4g。通过计算回答:
① 混合物的物质的量
② 混合物的组分、体积之比
清华园教育网
清华园教育网
24.现有A、B两种链状饱和一元醇的混合物0.3 mol,其质量为13.8g。已知①A和B碳
原子数均不大于4,且A<B;②A和B分子中均不含有支链,且都能被催化氧化生成醛。
(1)混合物中A可能的分子式;B可能的分式。
(2)若n(A):n(B)=1:1时,A的名称;B的名称
(3)若n(A):n(B)≠1:1时,
A的结构简式为 B的结构简式为 则n(A):n。
清华园教育网
