高二化学 期中考试试卷
期中考试试卷
考生注意:1 考试时间:90分钟 试卷总分:100分
2 可能用到的相对原子质量:H. 1 N. 14 O. 16 S. 32 Fe . 56
一 选择题(请将题后唯一符合题意的序号填入题后的表格中。每题3分,共54分)
1.下列元素中,既有游离态又有化合态存在于自然界的是
A 氮元素 B 磷元素 C 氯元素 D 钠元素
2. 下列说法中可以充分说明反应: P(气)+Q(气)  R(气)+S(气) , 在恒温下已达平衡状态的是( )
R(气)+S(气) , 在恒温下已达平衡状态的是( )
A P、Q、R、S的浓度不再变化 B P、Q、R、S的分子数比为1:1:1:1
C 反应容器内P、Q、R、S共存 D 反应容器内总质量不随时间而变化
3.常温下,下列气体不能共存的是
A NO和CO2 B SO2和O2 C NH3和HCl D NH3和O2
4.下列气体中不能用排空气法收集的是
A CO2 B NO C NH3 D NO2
5.下列用途中,应用了氮气的不活泼性的是
A 合成氨 B 贮存粮食 C 制硝酸 D 液态氮作致冷剂
6. 下列电离方程式或离子方程式正确的是
A.NaHCO3电离:NaHCO3==Na++H++CO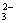 B CO
B CO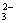 水解:CO
水解:CO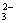 +H2O
+H2O H2CO3+2OH
H2CO3+2OH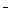
C.NH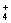 水解:NH4+
水解:NH4+ +H2O
+H2O NH3·H2O+H+ D. H3PO4电离:H3PO4==3H++PO
NH3·H2O+H+ D. H3PO4电离:H3PO4==3H++PO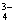 .
.
7.现有下列物质:⑴ 浓硫酸 ⑵ 浓盐酸 ⑶ 浓硝酸 ⑷ 稀盐酸 ⑸ 稀硝酸 ⑹ 稀硫酸,其中在常温时能用铝或铁容器盛放的一组物质是
A ⑴⑵⑶ B ⑵⑶⑹ C ⑷⑸⑹ D ⑴⑶
8.下列各组物质之间的反应,既是化合反应又是氧化还原反应的是
A 氨气和硝酸反应 B 一氧化氮和氧气反应
C 氨气和氧气反应 D 氨气和水反应
9. 对某雨水水样的分析数据如下:c(Ca2+)=3.0×10-6mol/L,c(NH4+)=2.0×10-6mol/L,c(Cl-)=3.5×10-6mol/L,c(NO3-)=4.5×10-6mol/L,c(SO42-)=5.0×10-6mol/L,则此雨水的pH为( ) A. 3 B. 4 C. 5 D. 6
 10.在N
2 + 3H
2
10.在N
2 + 3H
2
 2NH
3合成氨的反应中,分别采取下列措施,不能使反应速率加快的是( )
2NH
3合成氨的反应中,分别采取下列措施,不能使反应速率加快的是( )
A 增大氮气的浓度 B 扩大容器的体积 C 使用催化剂 D 升高温度
11.在Fe2(SO4)3和FeSO4 的混合物中,已知硫元素的质量分数为23.6%,则混合物中铁元素的质量分数为 ( )
A 23.6% B 47.2% C 29.2% D 70.8%
12.在一定的条件下,PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,则与1molCr3+反应所需PbO2的物质的量为( )
A.3.0 mol B. 1.5 mol C. 1.0 mol D. 0.75 mol
13 下列反应中,氮元素既被氧化又被还原的是( )
A N2 + O2 === 2NO B N2 + 3H2 === 2NH3
C 3NO2 + H2O === 2HNO3 + NO D 4NH3 + 5O2 ==== 4NO + 6H2O
14 某温度下,反应N2O4 2NO2 (正反应为吸热反应)在密闭容器中进行达到平衡。下列说法正确的是( )
2NO2 (正反应为吸热反应)在密闭容器中进行达到平衡。下列说法正确的是( )
A 升高温度平衡正向移动 B 压缩体积增大压强平衡正向移动
C 加入催化剂平衡正向移动 D 加入NO2平衡正向移动
15 CH3COOH溶液与NaOH 溶液反应,若反应后溶液的pH值为7,那么( )
A. CH3COOH与NaOH 的质量相等 B. CH3COOH与NaOH的物质的量相等
C. CH3COOH过量 D. NaOH过量
16. 普通5号干电池的正极材料、负极材料及放电时的电压分别为( )
A.锰、锌、1.5V B.碳、锌、1.5V C.碳、锌、2V D.锰、锌、1.2V
17.把80mLNaOH溶液加入到120mL盐酸溶液中,所得溶液的pH=2,若反应前两者的浓度相同,它们的浓度是 ( )
A. 0.5mol/L B. 0.1mol/L C. 0.05mol/L D. 1mol/L
18. 下列几种铁板,在镀层被破坏后,最耐腐蚀的是( )
A 镀锌铁板 .B. 镀铜铁板 C. 镀锡铁板 D. 镀铅铁板

 二 非选择题(共26分)
二 非选择题(共26分)
19.(5 分) 氮族元素位于元素周期表中第( )族,包括( )、( )、( )(填元素名称)锑、铋等五种元素,它们原子结构中相同的是最外层中都有( )个电子。
20. (4 分)在下列化学反应中: 2SO2+O2D 2SO3 , 如果2 min内SO2的浓度由6 mol/L下降为2mol/L,那么用SO2浓度来表示的化学反应速率为 mol/(L®min), 用O2浓度来表示的化学反应速率为 mol/(L®min).
21. (4分)氨分子中含有3个( )共价键(填“极性”或“非极性”),分子形状呈( ),氨是一种( )溶于水的气体,它的水溶液显( )性(填“酸”或“碱”或“中”)。
22.(6分) FeSO4·7H2O晶体在空气中易被氧化,为检验其是否已被氧化,可取少量样品溶于适量水后加入 溶液检验;如已氧化,可向其中加入过量 以除去其中的Fe3+,反应的离子方程式为 。
23.(3分)将10mL 0.1mol/L 氨水与120mL 0.1mol/L 盐酸混合后,溶液中各种离子的物质的量浓度的大小顺序是 。
24. (4分) (4分)将NaBiO3固体(黄色、微溶)加入MnSO4和H2SO4的混合溶液里加热,溶液显
紫色(Bi3+无色)。配平该反应的下列离子方程式.
___NaBiO3+___Mn2++ ___H+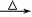 ___Na++ ___Bi3+ + ___ _______ + ___ _________
___Na++ ___Bi3+ + ___ _______ + ___ _________
常温下,高锰酸钾与盐酸反应可生成氯气,同时MnO4-被还原成Mn2+,写出这一反应的
离子方程式_______________________________________________________。
三、实验题(6分)
25. 判断下列实验操作的正误。对的在括号内打“√”,错的在括号内打“×”。
( )A、将二氧化硫气体通入石蕊溶液中,检验二氧化硫是否有漂白性;
( )B、制取Fe(OH)2沉淀时,将吸取了NaOH溶液的胶头滴管的尖端插入新制备的FeSO4溶液中,再慢慢挤出NaOH溶液。
( )C、向某未知溶液中先加入稀硝酸酸化后,再加入Ba(NO3)2溶液,检验是否含SO42-
四、推断题(8分)
26.下图①--⑩分别代表有关反应物中的一种物质,它们均为中学化学中常见物质,已知①--⑤和⑥--⑩中分别含有同一种元素,反应⑤→①+O2的反应条件未标出,填写空白:
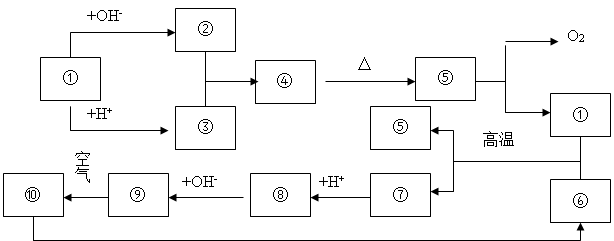
1、写出下列有关物质化学式:①________⑦ _________
2、写出①→②反应的离子方程式______ _____
3、写出⑨→⑩反应的方程式_____ ______
五、计算题(6分)
27. 在40 ml 0.10 mol/L BaCl2溶液中,加入过量0.10 mol/L H2SO4溶液,使沉淀完全。将反应的混合物过滤,在滤液中加入25mL 0.20 mol/LNaOH溶液至中性,计算过量的H2SO4溶液的体积。
高二化学期中考试(答卷)
一、单项选择题答题卡(每小题3分,共54分)

二 非选择题(共26分)
19.(5 分) 氮族元素位于元素周期表中第(VA )族,包括( 氮 )、(磷)、(砷 )(填元素名称)锑、铋等五种元素,它们原子结构中相同的是最外层中都有(5)个电子。
20. (4 分)在下列化学反应中: 2SO2+O2D 2SO3 , 如果2 min内SO2的浓度由6 mol/L下降为2mol/L,那么用SO2浓度来表示的化学反应速率为 2 mol/(L®min),
用O2浓度来表示的化学反应速率为 1 mol/(L®min).
21. (4分)氨分子中含有3个( 非极性 )共价键(填“极性”或“非极性”),分子形状呈(直线型 ),氨是一种(极易)溶于水的气体,它的水溶液显(碱)性(填“酸”或“碱”或“中”)。
22.(6分) FeSO4·7H2O晶体在空气中易被氧化,为检验其是否已被氧化,可取少量样品溶于适量水后加入 KSCN 溶液检验;如已氧化,可向其中加入过量铁粉 以除去其中的Fe3+,此过程的离子方程式为 2Fe3+ + Fe = 3 Fe2+ 。
23.(3分)将10mL 0.1mol/L 氨水与120mL 0.1mol/L 盐酸混合后,溶液中各种离子的物质的量浓度的大小顺序是 C(Cl-)> C(H+) >C(NH4+) > C(OH-) 。
24. (4分) (4分)将NaBiO3固体(黄色、微溶)加入MnSO4和H2SO4的混合溶液里加热,溶液显
紫色(Bi3+无色)。配平该反应的下列离子方程式.
__5_NaBiO3+_2_Mn2++ _14_H+ _5_Na++ _5_Bi3+ + _2 MnO4- + _7H2O _
_5_Na++ _5_Bi3+ + _2 MnO4- + _7H2O _
常温下,高锰酸钾与盐酸反应可生成氯气,同时MnO4-被还原成Mn2+,
写出这一反应的离子方程式______ 2MnO4- + 10Cl- + 16H+ = 2Mn2+ + 5Cl2↑+ 8H2O
三、实验题(6分)
25.判断下列实验操作的正误。对的在括号内打“√”,错的在括号内打“×”。
(×)A、将二氧化硫气体通入石蕊溶液中,检验二氧化硫是否有漂白性;
(√)B、制取Fe(OH)2沉淀时,将吸取了NaOH溶液的胶头滴管的尖端插入新制备的FeSO4溶液中,再慢慢挤出NaOH溶液。
(×)C、向某未知溶液中先加入稀硝酸酸化后,再加入Ba(NO3)2溶液,检验是否含SO42-
四、推断题(8分)
26. Al Fe
2Al + 2OH―+ 2H2O = 2AlO2―+ 3H2#
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
五、计算题(6分)
27. 在40 ml 0.10 mol/L BaCl2溶液中,加入过量0.10 mol/L H2SO4溶液,使沉淀完全。将反应的混合物过滤,在滤液中加入25mL 0.20 mol/LNaOH溶液至中性,计算过量的H2SO4溶液的体积。
解: OH- + H+ = H2O
n (NaOH) = 25Ð0.20 Ð 10-3 = 5Ð 10-3mol
n(H2SO4) =2.5Ð 10-3mol
V(H2SO4)= 25mL
第二篇:高二化学期中普通班
项城二高2013—2014学年第一学期期中考试
高二化学试卷(普通班)
命题人:张攀峰 2013.11.01 (考试时间:90分钟 试卷满分:100分)
第Ⅰ卷 选择题
一、选择题(每题只有一个正确答案。共18道小题,每小题3分,共54分。) 1.下列关于热化学反应的描述中正确的是( )
A.HCl和NaOH反应中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H =2×(-57.3)kJ/mol
B.CO(g)的燃烧热△H=—283.0kJ/mol,则2CO2(g)===2CO(g)+O2(g)反应的△H= +2×283.0kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D. S(g)+O2(g)===SO2(g) ΔH=a;S(s)+O2(g)===SO2(g) ΔH=b;则a>b 2.下列事实不能用勒夏特列原理解释的是
A. 溴水中有下列平衡Br2+H2

O HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
B. 合成氨反应,为提高氨的产率,理论上应采取降低温度的措施
C. 反应CO(g)+NO2

(g) CO2(g)+NO(g) △H<0,达平衡后,升高温度体系颜色变深
D. 对于

2HI(g)
H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
3.如图表示反应2SO2(g)+O2(g)
2SO3(g) ΔH<0的正反应速率随时间的变化情况,试根据
此曲线判断下列说法可能正确的是( ) A.t1时减小了SO2的浓度,增加了SO3的浓度
B.t1时降低了温度,平衡向正反应方向移动 C.t1时减小了压强,平衡向逆反应方向移动 D.t1时增加了SO2和O2的浓度,平衡向正反应方向移动 4.反应mA(s)+nB(g)
pC(g) ΔH<0,在一定温度下,平衡时B的体积分数(B%)与压强变化
的关系如图所示,下列叙述中一定正确的是
①m+n>p ②x点表示的正反应速率大于逆反应速率 ③n>p ④x点比y点时的反应速率慢 ⑤若升高温度,该反应的平衡常数增大
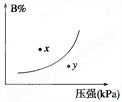
A.①②⑤ B.只有②④ C.只有①③ D.①③⑤ 5.以下一定能说明化学平衡发生移动的是( )
A.正、逆反应速率改变 B.加入催化剂 C.增大压强
D.化学平衡常数的改变
6.下列描述中,不符合生产实际的是( )
A.合成氨工业中,N2和H2的最佳配比应为物质的量之比1:3 B.手机上用的锂离子电池属于二次电池
C.工业上电解饱和食盐水制烧碱,用离子交换膜阻止0H-移向阳极 D.甲醇燃料电池可把化学能转化为电能 7.下列有关电化学知识的描述中正确的是( )
A.原电池的正极和电解池的阳极均发生氧化反应 B.氢燃料电池的正极是通入氢气的那一极
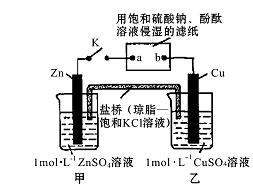
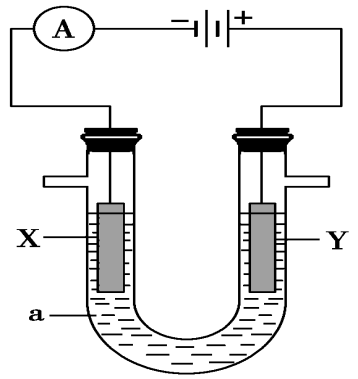
C.镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)耐腐蚀 D.铅蓄电池充电时电源的正极接蓄电池标“-”的一极 8.将右图所示实验装置的K闭合,下列判断正确是( ) A.Cu电极上发生氧化反应
B. 电子沿Zn?a?b?Cu路径流动 C.片刻后甲池中c(SO42—)增大 D.片刻后可观察到滤纸a点变红色
9.下列各组中,每种电解质溶液电解时只生成氢气和氧气的是( )
A.HCl、 CuCl2、 Ba(OH)2 B. NaOH、CuSO4、 H2SO4 C.NaOH、H2SO4、 Ba(OH)2
D.NaBr、 H2SO4、 Ba(OH)2
10.下图中A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,C为盛有稀硫酸的电解槽,e、f为Pt电极。接通电源后,发现d点显红色。下列有关说法正确的是 ( ) A.电源A上的a极是正极
B.d极上的电极反应方程式为2Cl--2e-
=Cl2↑ C.e、f极上产生的气体体积比为
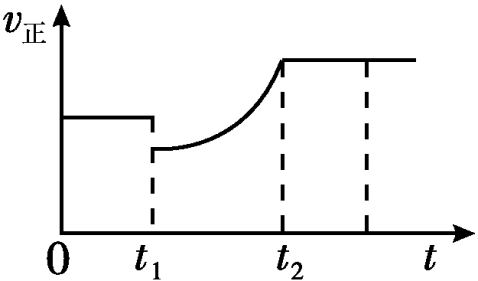
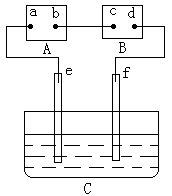
2:1
D.C中溶液的pH增大
11.按A图装置进行实验,若图B的X轴表示流入电极的电子的量,则Y轴不可能表示的情况是( )
A.c(Ag) B.c(NO3) C.溶液的c(H)
12.下图是298 K时N2与H2反应过程中能量变化的曲线图。下列叙述正确的是

+
+
-
D. Z单质的金属活动性较Y强
15.反应FeO(s)+C(s)=Fe(s)+CO(g); △H>0,ΔS>0,下列说法正确的是
A.低温下自发进行,高温下非自发进行 B.任何温度下均为非自发进行 C.高温下能自发进行,低温下非自发进行 D.任何温度下均为自发进行 16.已知反应:2SO2(g)+O2

(g)
SO3(g) ΔH<0。某温度下,将2 mol SO2
和1 mol O2置于10 L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是 (
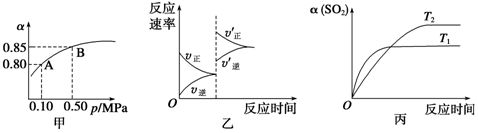
)
D.银棒质量
-
A.该反应的热化学方程式为:N2 + 3H22NH3 △H =-92 kJ·mol1 B.向一密闭容器中加入1 molN2和3 molH2充分反应后,放出92 kJ热量 C.b曲线可能是加入催化剂时的能量变化曲线
D.加入正催化剂可增大正反应速率,降低逆反应速率
13.在一定温度下,向密闭容器中充入1.0molN2和3.0molH2,反应达到平衡时测得NH3的物质的量
为0.6mol。若在该容器中开始时充入2. 0 molN2和6.0molH2,则平衡时NH3的物质的量为 ( )
A、若为定容容器,n(NH3)=1.2mol B、若为定压容器,n(NH3) >1.2mol C、若为定容容器,n(NH3)>1.2mol D、若为定压容器,n(NH3)<1.2mol
14. 下图为一电化学综合实验装置。其中装置D为用加有酚酞的淀粉碘化钾溶液润湿的长条滤纸,c、d为铂片。整套装置工作一 段时间后,发现铂片d的周围变为蓝色。下列有关说法错误的是( )
A.铂片c上发生的反应为2H++2e-══H2↑,c周围变为红色 B.装置C中,b电极周围的颜色变深
C. 装置A、B之间倒置的U形管,是沟通两装置的离子通道
A.由图甲知,A点SO2的平衡浓度为0.4 mol/L
B.由图甲知,B点SO2、O2、SO3的平衡浓度之比为2∶1∶2
C.达平衡后,缩小容器容积,则反应速率变化图象可以用图乙表示
D.压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1
17.某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变
化规律(图中P表示压强,T表示温度,n表示物质的量):
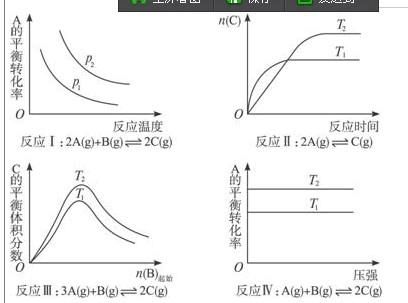
根据以上规律判断,下列结论正确的是( ) A.反应Ⅰ:△H>0,P2>P1

B.反应Ⅱ:△H>0,T1>T2
C.反应Ⅲ:△H>0,T2>T1;或△H<0,T2<T1 D.反应Ⅳ:△H<0,T2>T1
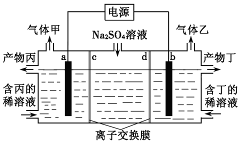
18.电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如右图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为1∶2,以下说法正确的是 A.a极与电源的负极相连 B.产物丙为硫酸溶液
C.离子交换膜d为阴离子交换膜 D.a电极反应式:2H++2e= H2↑
-
20.(13分)电解原理在化学工业中有广泛的应用。下图表示一个电解池,装有电解液a;X、
Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
第Ⅱ卷(非选择题共46分)
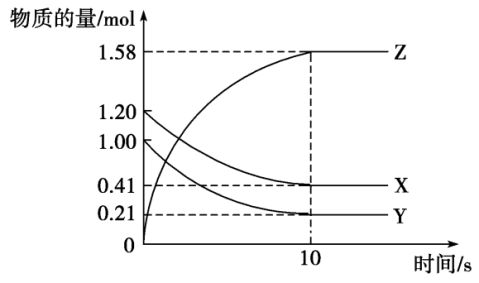
19.(15分)一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示:
酞试液,则:
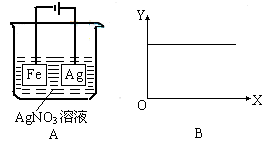
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚 ①电解池中X极上的电极反应式为____________________,在X极附近观察到的现象是__________________。
②Y电极上的电极反应式为_________________,检验该电极反应产物的方法是_______________________。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是________,电极反应式为____________。
(1)从反应开始到10 s,用Z表示的反应速率为_______________,X的物质的量浓度减少
了________,Y的转化率为____________________________。
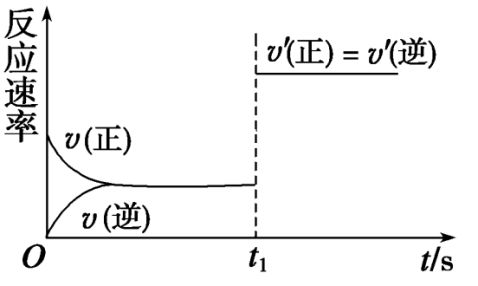
(2)该反应的化学方程式为_________________________________________________。 (3)10 s后的某一时刻(t1)改变了外界条件,其速率随时间的变化图象如图所示:
②Y电极的材料是________,电极反应式为_____________。 (说明:杂质发生的电极反应不必写出)
③溶液中的c(Cu2)与电解前相比________(填“变大”、“变小”或“不变”)。
+
(3)如利用该装置实现铁上镀锌,电极X上发生的反应为________________________,电
解池盛放的电镀液的浓度与电解前相比________(填“变大”、“变小”或“不变”)。 21.(8分)在0.5 L的密闭容器中,一定量的氮气和氢气进行如下化学反应:
N2(g)+3H2(g)
2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如下表:
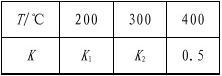
则下列说法符合该图象的是________。 A.t1时刻,增大了X的浓度 C.t1时刻,缩小了容器体积
B.t1时刻,升高了体系温度 D.t1时刻,使用了催化剂
请完成下列问题:
(1)试比较K1、K2的大小,K1
________K2(填“>”“=”或“<”)
(2)下列各项能作为判断该反应达到化学平衡状态的依据的是________(填字母编号)
a.容器内N2、H2、NH3的浓度之比为1∶3∶2 b.v正(N2)=3v逆(H2)
c.容器内压强保持不变 d.混合气体的密度保持不变
(3)400 ℃时,反应2NH3(g)
N2(g)+3H2(g)的化学平衡常数K的值为______,当测
得NH3和N2、H2的物质的量分别为3 mol和2 mol、1 mol时,该反应的v正(N2)______ v逆(N2)(填“>”“<”或“=”)
22.(10分)t ℃时,将3 mol A和1 mol B气体通入体积为2 L的密闭容器中(容积不变),发生反应:
3A(g)+B(g)
xC(g)。2 min时反应达到平衡状态(温度不变),剩余了0.8 mol B,
并测得C的浓度为0.4 mol·L-
1,请填写下列空白:
(1)从开始反应至达到平衡状态,生成C的平均反应速率为________。 (2)x=________;平衡常数K=________。
(3)若继续向原平衡混合物的容器中通入少量氦气(假设氦气和A、B、C都不反应)后,化
学平衡________(填写字母序号)。 A.向正反应方向移动
B.向逆反应方向移动
C.不移动
(4)若向原平衡混合物的容器中再充入a mol C,在t ℃时达到新的平衡,此时B的
物质的量为n(B)=________mol。
项城二高2013—2014学年第一学期期中考试
高二化学普通班答案
一、选择题(每题只有一个正确答案。共18道小题,每小题3分,共54分)
19题:(15分)(每空3分)
(1)0.079 mol/(L·s) 0.395 mol/L 79.0% (2)X(g)+Y(g)
2Z(g)
(3)CD 20题:(13分)
(1)①(2分)2H++2e-
===H2↑, 有气体放出,溶液变红。
②(3分)2Cl-
-2e-
===Cl2↑,把湿润的淀粉碘化钾试纸放在Y电极附近,试纸变蓝色,说明生成了Cl2 。
(2)①(2分)纯铜, Cu2+
+2e-
===Cu 。
②(2分)粗铜, Cu-2e-===Cu2+
。
③(1分)变小。
(3)(3分)Zn2++2e-
===Zn , 不变。
21题:(8分)(每空2分)
(1) > (2) c (3) 2 >
22题:(10分)(每空2分)
(1)0.2 mol·L-1·min-
1 (2)4 0.037 (3) C (4) (0.8+0.2a)
项城二高2013—2014学年第一学期期中考试
高二化学(普通班)答题卡
一、选择题(每题只有一个正确答案。共18道小题,每小题3分,共54分)
第Ⅱ卷(非选择题共46分)
19.(15分)
(1)____________ ___, _______ _, ____________________________。
(2)_________________________________________________。
(3)_____ ___。
20.(13分)
(1)①________________ ____,
。
②_______________ __,
____________。
(2)①______ __, _____ _______。
②_____ __, _____ ________。
③______ __
(3)____________________ ___, ________
21.(8分)
(1)_______ _ (2)_____ ___
(3)____ __, ____ __
22.(10分) (1)。
(2)x=____ ___;平衡常数K=_____ ___。
(3)________(填写字母序号)。
(4)___ __mol
