实验十三 硫酸铜的提纯
一、实验目的
1. 了解用重结晶法提纯物质的原理;
2. 学习台天平的使用以及加热蒸发、重结晶等基本操作。
二、实验原理
可溶性晶体物质可用重结晶法提纯, 根据物质溶解度的不同, 一般可先用溶解、过滤的方法,除去易溶于水的物质中所含难溶于水的杂质, 然后再用重结晶法使少量易溶于水的杂质分离, 重结晶的原理是由于晶体物质的溶解度一般随温度的降低而减小, 当加热的饱和溶液冷却时, 待提纯的物质首先以结晶析出, 而少量杂质由于尚未达到饱和, 仍留在溶液中。
粗硫酸铜晶体中的杂质通常以硫酸亚铁、硫酸铁为最多, 当蒸发浓缩硫酸铜溶液时, 亚铁盐易被氧化为铁盐, 而铁盐易水解有可能生成 Fe(OH)3 沉淀, 混杂于析出的硫酸铜结晶中, 所以在蒸发过程中溶液应保持酸性。
若亚铁盐或铁盐含量较多, 可先用过氧化氢 (H2O2 )将 Fe2+ 离子氧化为 Fe3+ 离子, 再调节溶液的 pH 值至约为 4, 使 Fe3+ 水解为 Fe(OH)3 沉淀而除去。
2Fe2+ + H2O2 + 2H+ = 2Fe3+ + 2H2O
Fe3+ + 3H2O = Fe(OH)3 ↓ + 3H+
三、实验用品
1. 仪器
电子台天平,烧杯,量筒,铁圈,石棉铁丝网,布氏漏斗,硫酸铜回收瓶,抽滤瓶,酒精灯,铁架,蒸发皿,点滴板。
2. 试剂
H2SO4 (0.1mol/L) 固体硫酸铜, 氢氧化钠(0.5 mol/L), 过氧化氢 3%, pH 试纸
四、操作步骤
1. 称量和溶解
用电子台天平称量粗硫酸铜晶体 8 克, 放入已洗涤干净的 l00mL 烧杯中, 用量筒量取 35-40mL 水加入上述烧杯中。然后将烧杯放在石棉铁丝网上加热, 并用玻璃棒搅拌,当硫酸铜完全溶解时, 立即停止加热。
2. 沉淀
往溶液中加入 1.5mL 3% H2O2 溶液, 加热, 逐滴加入 0.5 mol/L NaOH 溶液直至 pH ≈4( 用 pH 试纸检验), 再加热片刻, 使红棕色 Fe(OH)3 沉降。
3. 过滤
将折好的滤纸放入漏斗中, 从洗瓶中挤出少量水湿润滤纸, 使之紧贴在漏斗内壁上。将漏斗放在漏斗架上。趁热过滤硫酸铜溶液, 滤液接受在清洁的蒸发皿中。从洗瓶中挤出少量水淋洗烧杯及玻璃棒, 洗涤水也必须全部滤入蒸发皿中。按同样操作再洗涤一次。将过滤后的滤纸及不溶性杂质投入废液缸中。
4. 蒸发和结晶
在滤液中加入 3-4 滴 lmol/L H2SO4 使溶液酸化。然后在石棉铁丝网上加热、蒸发、浓缩〈勿加热过猛以防液体溅失〉至溶液表面刚出现蓝色固状物薄层时, 立即停止加热〈注意不可蒸干〉。 让蒸发皿冷却至室温或稍冷片刻,再将蒸发皿放在盛有冷水的烧杯上冷却, 使 CuSO4?5H2O 晶体析出。
5. 吸滤分离
将蒸发皿内CuSO4?5H2O晶体全部移到预先铺上滤纸的布氏漏斗中, 抽气过滤,尽量抽干, 并用干净的玻璃棒轻轻挤压布氏漏斗上的晶体, 尽可能除去晶体间夹带的母液。停止抽气过滤, 取出晶体, 把它摊在两张滤纸之间, 用手指在纸上轻压以吸干其中的母液。用台天平称量硫酸铜, 计算产率。最后将硫酸铜晶体放入塑料袋中(不要密封口子)。
五、思考题
1. 溶解固体时加热和搅拌起什么作用 ?
2. 用重结晶法提纯硫酸铜, 在蒸发滤液时, 为什么加热不可过猛? 为什么不可将滤液蒸干?
3. 过滤操作中应注意哪些事项 ?
4. 除杂质铁时,为何要将Fe2+ 氧化为Fe3+ ?最后为何将pH调至4?偏高或偏低将产生什么影响?
第二篇:粗硫酸铜提纯
一、实验目的
(1)学习粗硫酸铜提纯的原理和方法,掌握水浴加热、常压过滤、减压过滤、蒸发浓缩结晶、重结晶等基本操作技能。
二、实验原理
1.粗硫酸铜提纯的原理
粗硫酸铜晶体中的主要杂质是Fe3+、Fe2+ 以及一些可溶性的物质如Na+ 等。
Cu2+ 与Fe3+ 的分离可以利用溶度积的差异,因为氢氧化铁的Kθsp= 4×10 –38,而氢氧化铜的Kθsp= 2.2×10 –20,当c(Fe3+) 降到10 –6 mol?L-1时,
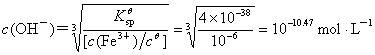
pH = 3.53
而此时溶液中允许存在的Cu2+ 量为
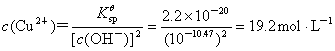
大大超过了CuSO4?5H2O的溶解度,所以Cu2+ 不会沉淀。从上述计算可以粗略看出,Cu2+ 与Fe3+ 是可以利用溶度积的差异,适当控制条件(如pH等),达到分离的目的。
由Cu(OH)2与Fe(OH)2的溶度积计算,Cu2+ 与Fe2+ 似乎也可以用分步沉淀法分离,但由于Cu2+ 是主体,Fe2+ 是杂质,这样进行分步沉淀会产生共沉淀现象(Cu(OH)2沉淀吸附、包裹少量Fe2+ 杂质的现象),达不到分离目的。因此在本实验中先将Fe2+ 在酸性介质中用H2O2氧化成Fe3+ :
2Fe2+ + H2O2 + 2H+ = 2Fe3+ + 2H2O
然后采用控制pH在3.7~4.0沉淀Fe3+,达到Fe3+、Fe2+ 与Cu2+ 分离的目的。从氧化反应中可见,应用H2O2作氧化剂的优点是不引入其它离子,多余的H2O2可利用热分解去除而不影响后面分离。
溶液中的可溶性杂质可采用重结晶方法分离。根据物质的溶解度不同,特别是CuSO4?5H2O晶体的溶解度随温度的降低而显著减少,当热的CuSO4饱和溶液冷却时,CuSO4?5H2O先结晶析出,而少量易溶性杂质由于尚未达到饱和,仍留在母液中,通过过滤,就能将易溶性杂质分离。
2. 目视比色法检验产品的杂质含量(铁的含量)的原理
目视比色法是确定杂质含量的常用方法,在确定杂质含量后便能定出产品的纯度级别。将产品配成溶液,在比色管中加入显色剂显色、定容,与在同样条件下显色、定容的一系列不同浓度的标准溶液(标准色阶)进行颜色比较(方法是从管口垂直向下观察),如果产品溶液的颜色比某一标准溶液的颜色浅,就可确定杂质含量低于该标准溶液中的含量,即低于某一规定的限度,所以这种方法又称为限量分析。
由于本实验的产品溶液Cu2+本身有颜色,干扰Fe3+ 的比色观察,因此在比色检验前需要首先在产品溶液中加入过量的6mol?dm–1氨水,使微量的Fe3+ 杂质沉淀、过滤分离出来,沉淀用热的2mol?dm–1 HCl溶解后收集到比色管中,加入25% KSCN溶液显色(生成[Fe(SCN)n]3–n血红色络合物,n=1~6)、定容,然后与标准色阶比较,从而确定产品中杂质铁的含量范围。
三、仪器和药品
仪器:
150mL烧杯1个,100mL烧杯2个,玻璃棒2根,量筒(100mL、10mL)、洗瓶、玻璃漏斗(7.5cm)、蒸发皿(250mL)、布氏漏斗(8cm)、抽滤瓶(250mL)、铁架台、铁圈、石棉网各1个,比色管(25mL)、带刻度吸量管(5mL)各一支
电子天平、可调电炉、循环水式真空泵、同步热分析仪(STA 409 PC)
广泛pH试纸、定性滤纸(12.5cm、7cm)
药品:
2mol?L–1 NaOH 、1mol?L–1 H2SO4、2 mol?L–1 HCl、6mol?L–1 NH3?H2O、3% H2O2、25% KSCN、粗硫酸铜
四、实验步骤
1.粗硫酸铜的提纯
(1)称量和溶解
称取粗硫酸铜10g(混入0.03g硫酸亚铁、0.07g硫酸铁),放入150 mL洁净烧杯中,加入约40mL水,2mL 1mol?L–1 H2SO4,加热、搅拌直至晶体完全溶解,停止加热。
(2)氧化和沉淀
边搅拌边往溶液中慢慢滴加约2mL 3% H2O2,加热片刻(若无小气泡产生,即可认为H2O2分解完全),然后边搅拌边滴加2mol?L–1 NaOH溶液,直至溶液的pH≈3.7~4.0,再加热片刻,让Fe(OH)3加速凝聚,取下,静置,待Fe(OH)3沉淀沉降。
(3)常压过滤
先将上层清液沿玻璃棒倒入贴好滤纸的漏斗中过滤,下面用蒸发皿承接。待清液滤完后再逐步倒入悬浊液过滤,过滤近完时,用少量蒸馏水洗涤烧杯,洗涤液也倒入漏斗中过滤。待全部滤完后,弃去滤渣。
(4)蒸发浓缩和结晶
将蒸发皿中的滤液用1mol?L–1 H2SO4调至pH 1~2后,加热蒸发浓缩(勿加热过猛,注意搅拌以免液体飞溅而损失),浓缩过程中注意用药匙刮下边缘上过早析出的晶体。直至溶液表面刚出现薄层结晶(晶膜)时,立即停止加热,让其自然冷却到室温(勿要用水冷),慢慢地析出CuSO4?5H2O晶体。
(5)减压过滤
待蒸发皿底部用手摸感觉不到温热时,将晶体与母液转入已放好滤纸的布氏漏斗中进行抽滤,用玻璃棒将晶体均匀地铺满滤纸,并轻轻地压紧晶体,尽可能抽去晶体间夹带的母液。停止抽滤,取出晶体,摊在滤纸上,再覆盖一张滤纸,用手指轻轻挤压,吸干其中的剩余母液。最后将吸干的晶体称重。
(6)重结晶
上述产品放于100mL烧杯中,按每克产品加3 mL蒸馏水的比例加入蒸馏水。加热,使产品全部溶解。趁热常压过滤,用蒸发皿承接滤液。滤液冷至室温,待其慢慢地析出CuSO4?5H2O晶体(若不析出晶体,可稍微小火加热蒸发浓缩滤液,直至溶液表面刚出现薄层结晶(晶膜)时,立即停止加热,让其自然冷却到室温)。减压过滤抽干,取出晶体,摊在滤纸上,用另一张滤纸轻轻挤压吸干其中的剩余母液,称重。
2. 产品中杂质含量(铁含量)的检验(目视比色法)
称取1.0g提纯后的产品于100mL烧杯中,用10mL水溶解,加入1mL 1mol?L–1 H2SO4、1mL 3% H2O2,加热,使Fe2+ 完全氧化成Fe3+,继续加热煮沸,使剩余的H2O2完全分解。
取下溶液冷却后,逐滴加入6mol? L–1氨水,先生成浅蓝色的沉淀,继续滴入6mol? L–1氨水,搅拌直至沉淀完全溶解,呈深蓝色透明溶液。常压过滤,并用6mol?L–1 氨水洗涤沉淀和滤纸至无蓝色,弃去滤液,滤纸上的沉淀用滴管滴入3mL热的2mol? L–1HCl溶解,用25mL比色管承接。然后用吸量管移取2.00mL 25% KSCN溶液至比色管中,用水稀至刻度,摇匀,与标准色阶比较,确定产品的纯度等级。
附:系列标准溶液(标准色阶)的配制:(老师已预先配好)
称1.000g纯Fe粉,用40mL 1:1 HCl溶解,溶完后,滴加10% H2O2,直至Fe2+完全氧化成Fe3+,过量的H2O2加热分解除去,冷却后,移入1000mL 容量瓶中,以水稀至刻度,摇匀。此液为1.00mg Fe3+ /mL。
移取此液5.00mL于500mL容量瓶中,加入2mL1:1 HCl,以水稀至刻度,摇匀。此液为0.010mg Fe3+ / mL。
标准色阶配制(要求现用现配):移取0.010 mg Fe3+ /mL标准溶液1.00mL、3.00mL、6.00mL,分别置于三支25mL比色管(分别标号①、②、③)中,加入3mL 2mol?L–1 HCl,并用吸量管移取2.00mL 25% KSCN溶液至比色管中,用水稀至刻度,摇匀。
附表1:标准色阶中各比色管的Fe3+ 浓度

附表2:产品纯度检验的判断标准

注意事项
1、粗硫酸铜晶体要充分溶解:加热溶解时用玻璃棒搅拌,玻璃棒不能碰着烧杯壁;
2、pH值的调整(pH=4):加入NaOH溶液调节pH值时,必须逐滴加并在搅拌均匀后再测pH值;
3、加入NaOH除三价铁离子时,要逐滴加入,pH要控制在4左右,防止氢氧化铜沉淀的生成;
4、浓缩、结晶程度的掌握:加热蒸发浓缩时火勿太大,以免溶液暴沸飞溅;
5、抽滤操作 (布氏漏斗装置减压过滤):提纯后的晶体应用滤纸尽可能吸干水分;
6、氧化剂H2O2要稍过量,使杂质二价铁离子充分氧化
