九年级常用化学方程式分类归纳
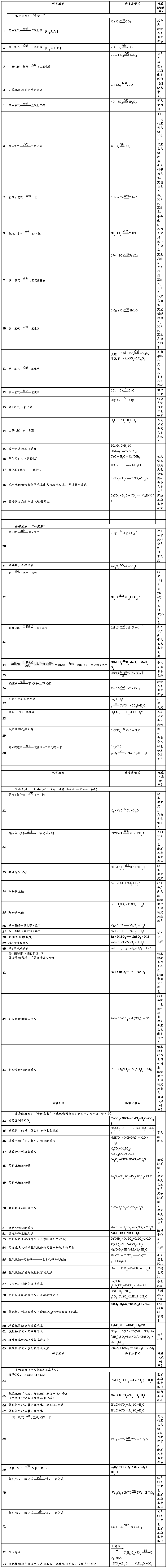
第二篇:化学方程式分类归纳
化学方程式分类归纳:
一、化合反应
1.单质的燃烧 2Mg+O2 2MgO 3Fe+2O2
Fe3O4 S+O2
SO 2 4P+5O22P2O5 2H2+O2
2H2O C+O2 CO2(氧气充足) 2C+O2
2CO(氧气不充足) 4Al+3O2 2Al2O3 2.有毒气体CO的燃烧(尾气的处理)2CO+O2
2CO
2 3.非金属氧化物与水的反应 CO2+H2O===H2CO3 SO2+H2O===H2SO3 SO3+H2O===H2SO4 4.金属氧化物与水反应
CaO+H2O===Ca(OH)2 (放热反应)Na2O+H2O===2NaOH
5.二氧化碳通过炽热的碳层 CO2+C
2CO (吸热反应)
二、分解反应
1.实验室制取氧气 2H2O2
2H2O+O2↑
2KMnO4 K2MnO4+MnO2+O2↑
2KClO3
△2KCl+3O
2↑ 2.其它分解反应 2HgO +O2↑
2H2O
2H2↑+O2↑
H2CO3=== H2O+CO2↑ CaCO3
CaO+CO2↑(工业制取二氧化碳)Ca(HCO3)2===CaCO3+CO2↑+H2O
三、置换反应
1.气体与固体间的置换反应 CuO+H2
Cu+H
2O FeO23+3H2
2Fe+3H2O 2.固体与固体间的置换反应 2CuO+C
2Cu+CO2↑
2Fe+3C2O3 4Fe+3CO2↑
3.液体与液体间的置换 (1)金属与酸的置换 Zn+2HCl===ZnCl2+H2↑ Zn+H2SO4===ZnSO4+H2↑ Mg+2HCl===MgCl2+H2↑ Mg+H2SO4===MgSO4+H2↑ Fe+2HCl===FeCl2+H2↑ 2Al+6HCl===2AlCl3+3H2↑ 2Al+3H2SO4===Al2(SO4)3+3H2↑ (2)金属与盐溶液的置换 Fe+CuSO4===Cu+FeSO4 Fe+CuCl2===Cu+FeCl2 Zn+CuSO4===Cu+ZnSO4
Cu+2AgNO3===2Ag+Cu(NO3)2 四、复分解反应
1.金属氧化物+酸→盐+水 Fe2O3+6HCl===2FeCl3+3H2O Fe2O3+3H2SO4===Fe2(SO4)3+3H2O CuO+2HCl===CuCl2+H2O CuO+H2SO4===CuSO4+H2O 2.酸+碱→盐+水 NaOH+HCl===NaCl+H2O 2NaOH+H2SO4===Na2SO4+2H2O Ca(OH)2+H2SO4===CaSO4+2H2O
Al(OH)3+3HCl===AlCl3+3H2O (治疗胃酸过多) Cu(OH)2+2HCl===CuCl2+2H2O 3.酸+盐→新酸+新盐
AgNO3+HCl===AgCl↓+HNO3 BaCl2+H2SO4===BaSO4↓+2HCl
CaCO3+2HCl===CaCl2+H2O+CO2↑(实验室制取CO2)
Na2CO3+2HCl===2NaCl+H2O+CO2↑ NaHCO3+HCl===NaCl+H2O+CO2↑ 4.碱+盐→新碱+新盐
2NaOH+CuSO4===Cu(OH)2↓+Na2SO4 3NaOH+FeCl3===Fe(OH)3↓+3NaCl Ca(OH)2+Na2CO3===CaCO3↓+2NaOH 2NH4Cl+Ca(OH)2===CaCl2+2NH3↑+2H2O (NH4)2SO4+2NaOH===Na2SO4+2NH3↑+2H2O 5.盐+盐→新盐+新盐
BaCl2+Na2SO4===BaSO↓4+2NaCl AgNO3+NaCl===AgCl↓+NaNO3 Na2CO3+CaCl2===CaCO3↓+2NaCl
五、其他反应
1.非金属氧化物+碱→盐+水 - 1 -
CO2+Ca(OH)2===CaCO3↓+H2O(检验CO2气体) CO2+2NaOH===Na2CO3+H2O SO2+2NaOH===Na2SO3+H2O SO3+2NaOH===Na2SO4+H2O 2.有机物的燃烧 CH4+2O2
CO2+2H2O C2H5OH+3O2
2CO2+3H2O 3、CO还原金属氧化物(不是置换反应) CuO+COCu+CO2
Fe2O3+3CO 2Fe+3CO2 Fe3O4+4CO
3Fe+4CO
2 一、常见物质的颜色 1.固体或晶体的颜色
银白色:Mg Fe Al Ag Hg
白色:P(白磷) P2O5 MgO KClO3 CuSO4 NaCl Na2CO3 NaHCO3 黑色:C CuO MnO2 Fe3O4 红色:Cu P(红磷) HgO Fe2O3 暗紫色:KMnO4 淡黄色:S
绿色:Cu2(OH)2CO3 K2MnO4 蓝色:CuSO4·5H2O 2.溶液中离子的颜色
含Cu2+的盐溶液 蓝色 含Fe3+的盐溶液 棕黄色 含Fe2+的盐溶液 浅绿色 3.沉淀的颜色
白色沉淀且不溶于稀硝酸或酸的物质有:BaSO4、AgCl(就这两种物质)
蓝色沉淀:Cu(OH)2、CuCO3 红褐色沉淀:Fe(OH)3 二、火焰的颜色
淡蓝色 H2 、S在空气中燃烧 蓝色 CO 、CH4在空气中燃烧 蓝紫色 S在氧气中燃烧 三、离子的共存
离子能否共存取决于两种离子相遇后能否生成水、气 体或沉淀,如能生成上述物质则不能共存。常见的有:五、特殊反应的物质
1.在空气中能自燃,燃烧时产生大量白烟的是白磷。 2.溶于水显碱性的气体是氨气。
3.可使黑色固体CuO还原成亮红色金属Cu的还原性气体是H2和CO,还原性固体是C。 六、常见物质的名称、俗称、化学式
氧化铁 四氧化三铁 氧化亚铁 氧化铜 二氧化氮 Fe2O3 Fe3O4 FeO CuO NO2 氧化钠 二氧化硅 氧化钾 氧化钙 Na2O SiO2 K2O CaO
酸:组成:“氢离子+酸根离子” 读作“某酸”或“氢某酸”
盐酸 硫酸 硝酸 碳酸 磷酸 醋酸 有机物: 甲烷 乙醇 乙酸 CH4 C2H5OH CH3COOH 九、计算式 1.有关化学式的计算
相对分子质量=各元素的相对原子质量×原子个数之和 元素的质量比=各元素的相对原子质量×原子个数之比 某元素的质量分数=(某元素的相对原子质量×原子个1.H+ 与OH- 反应会生成H2O。
2.H+与CO32- (HCO3-)反应会生成H2CO3 ,分解后生成 H2O 和 CO2气体。
3.NH4+与OH- 会反应生成 NH3和 H2O 4.Ca2+ 与CO32- 反应生成 CaCO3 沉淀,
Cu2+ 、Fe3+与 OH- 反应生成 Cu(OH)2 . Fe(OH)3 沉淀 Ag+
与 Cl-
反应生成AgCl沉淀,
Ba2+与SO42-、CO32- 反应生成 BaSO4 、BaCO3沉淀 四、元素之最、物质之最
1.地壳中含量最多的金属元素是铝。 2.地壳中含量最多的非金属元素(元素)是氧。 3.空气中含量最多的物质是氮气。 4.天然存在最硬的物质是金刚石(C)。
5.最简单的有机物是甲烷CH4。 6.金属活动顺序表中活动性最强的金属是钾。 7.相对分子质量最小的氧化物是水。 8.相同条件下密度最小的气体是氢气。 9.导电性最强的金属是银。 10.相对原子质量最小的原子是氢。
11.熔点最低的金属是汞。 12.人体(生物细胞)中含量最多的元素是氧。 13.组成化合物种类最多的元素是碳。 14.日常生活中应用最广泛的金属是铁
15.人体中含量最多的金属元素是钙。 16.空气中含量最多的元素是氮。
17.宇宙中含量最多的元素是氢。 18.相对分子质量最小的物质是氢气。
19.熔点最高的金属是钨。 20.人类冶炼最多的金属是铁。
21.人体中含量最多的物质是水。
学名 俗名 化学式 HCl H2SO4 HNO3 H2CO3 H3PO4 CH3COOH 汞 水银 Hg 碱:组成:“金属离子+氢氧根离子” 读作“氢氧化某”或“氢氧化亚某”
硫 硫磺 S 氢氧化钠 氢氧化钾 氢氧化钙 氢氧化钡 氨水 氧化钙 生石灰 CaO NaOH KOH Ca(OH)2 Ba(OH)2 NH3?H2O 氢氧化钙 熟石灰、消石灰 Ca(OH)2 氢氧化铝 氢氧化镁 氢氧化铁 氢氧化铜 氢氧化钠 烧碱、火碱、苛性钠 NaOH Al(OH)3 Mg(OH)2 Fe(OH)3 Cu(OH)2 碳酸钠 纯碱、口碱、苏打 Na硝酸盐:组成:“金属离子+硝酸根离子” 读作“硝酸2CO3 某”或“硝酸亚某”
碳酸氢钠 小苏打 NaHCO3 硝酸银 硝酸钠 硝酸钙 硝酸铜 固体二氧化碳 干冰 CO2 AgNO3 NaNO3 Ca(NO3)2 Cu(NO3)2 碳酸钙 石灰石、大理石 CaCO3 硝酸铝 硝酸铵 硝酸钡 五水合硫酸铜 蓝矾、胆矾 CuSOAl(NO3)3 NH4NO3 Ba(NO3)2
4·5H2O 盐酸盐(氯化物):组成:“金属离子+氯离子” 读作乙酸 醋酸 CH3COOH “氯化某”或“氯化亚某”
乙醇 酒精 C2H5OH 氯化钠 氯化钙 氯化钾 氯化锌 氯化铜 碱式碳酸铜 铜绿 Cu2(OH)2CO3 NaCl CaCl2 KCl ZnCl2 CuCl2 氯化氢气体的水溶液 盐酸 HCl 氯化铝 氯化银 氯化铁 氯化亚铁 氯化铵 氢氧化钙的水溶液 石灰水 Ca(OH)AlCl3 AgCl FeCl3 FeCl2 NH4Cl 2 硫酸盐:组成:“金属离子+硫酸根离子” 读作“硫酸七、一些混合物的主要成分
某”或“硫酸亚某”
生铁 、钢 :Fe 铁锈: Fe2O3 硫酸锌 硫酸铝 硫酸镁 硫酸钙 硫酸铜 石灰石、大理石 :CaCO3 煤 : C ZnSO4 Al2(SO4)3 MgSO4 CaSO4 CuSO4 瓦斯、天然气、沼气: CH4 石灰水: Ca(OH)2 硫酸亚铁 硫酸钡 硫酸钠 硫酸铵 硫酸铁 八、常见化合物的化学式:
FeSO4 BaSO4 Na2SO4 (NH4)2SO4 Fe2(SO4)3 氧化物:组成:“某元素+氧元素” 名称:“氧化某”、碳酸盐:组成:“金属离子+碳酸根离子” 读作“碳酸“氧化亚某”、“几氧化几某”
某”或“碳酸亚某”
水 过氧化氢 一氧化碳 二氧化碳 二氧化锰 碳酸钾 碳酸钠 碳酸钙 碳酸钡 碳酸氢铵 碳酸铵HK2CO3 Na2CO3 CaCO3 BaCO3 NH4HCO3 (NH4)2CO3 2O H2O2 CO CO2 MnO2 五氧化二磷 二氧化硫 三氧化硫 氧化镁 氧化铝 其它盐:高锰酸钾 锰酸钾 氯酸钾 碱式碳酸铜(铜绿) P KMnO4 K2MnO4 KClO3 Cu2(OH)2CO3 2O5 SO2 SO3 MgO Al2O3
- 2 -
数)÷物质的相对分子质量×100%
物质中某元素的质量=物质的质量×某元素的质量分数 混合物中某元素质量分数= 混合物中某化合物的质量 分数 × 该元素在化合物中的质量分数
2.原子结构中的计算式
相对原子质量=某元素的相对原子质量÷(一个碳原子质量×1/12)
相对原子质量=质子数 + 中子数 在原子里:
原子序数=核电荷数=核内质子数=核外电子数 3.有关纯度的计算式
纯度=(纯物质质量÷不纯物质量)×100% 纯度(含量)(质量分数)=1-杂质含量 纯物质的质量=不纯物质量×纯度 不纯物的质量=纯物质质量÷纯度 4.有关溶质质量分数的计算式
溶质的质量分数 = (溶质质量÷溶液质量)×100% 溶质质量=溶液质量×溶质的质量分数 溶液质量=溶质质量÷溶质的质量分数 溶液质量=溶质质量+溶剂质量 十、化合价
金属化合价:一价金属钾钠银(氢),二价金属钙镁钡锌; 一、二价铜汞,二三价铁,三价金属铝和金 非金属化合价: -1价氟、氯、溴 -2价氧和硫, -3价氮和磷 +4价碳和硅
原子团化合价:+1价:NH4 -1价:OH NO3 -2价:CO3 SO4
化合价原则:在单质中,元素的化合价为0 ;在化合物里,各元素的化合价的代数和为0。
