1.0 目的
概述CPC稳定性考察指导原则,它对实际情况中要求有特定的技术和具有特殊性的产品保留了充分的灵活性。通过稳定性试验提供产品在各种环境因素如温度、湿度和光等条件下影响下,其质量随时间变化的情况,并且由此建立所推荐的贮存条件和效期或复验期。
2.0 范围
适用于中肽公司的客户肽、客户GMP肽及药物肽产品的影响因素试验、加速试验和长期稳定性试验的研究。
3.0 定义
3.1影响因素试验:是在比加速更剧烈条件下进行的,目的是了解影响产品稳定性的因素及可能的降解途径和降解产物,为制剂工艺筛选、包装材料和容器的选择、贮存条件的确定等提供依据。同时为加速试验和长期试验应采用的温度和湿度等条件提供依据,还可为分析方法的选择提供依据。
3.2 加速稳定性试验:是对产品模拟市售包装,在超常条件下进行的稳定性试验,目的是通过加快市售包装中产品的化学或物理变化速度来考察药品稳定性,对药品在运输、保存过程中可能会遇到的短暂的超常条件下的稳定性进行模拟考察,并初步预测样品在规定的贮存条件下的长期稳定性。
3.3 长期稳定性试验:指对产品模拟实际贮藏条件和包装进行物理、化学和微生物学特性的稳定性评价,目的是考察药品在运输、保存、使用过程中的稳定性;为有效期和贮存条件的确定提供最终的依据。
4.0 职责
4.1 参与此项实验的所有人员均应遵循此规程。
4.2 QC经理负责对操作和记录进行指导和审核。
4.3 QA负责监督和检查。
5.0 方法

5.7 评价分析
5.7.1若三批样品的平行测定数据表明,平行测定结果变化拫小,说明产品是稳定的,则不进行统计分析;
5.7.2 将实验所得的数据按95%的可信限进行统计分析,得出合理的有效期;若三批样品的统计分析结果差别较小,则取平均值为有效期,若差别较大,则取最短的为有效期。
6.0 稳定性实验方案设计要求
6.1 样品信息:样品来源、批号、质量标准号、包装及包装规格、样品量;
6.2 仪器设备:稳定性试验所需设备名称,规格型号及设备位号,效期等信息;
6.3 稳定性考察指标:根据样品的质量标准或客户的需求,确定相应的稳定性考察指标,并写出每个指标对应的检测方法文件的编号和质量标准号;
6.4 稳定性试验方法
6.5 试验结果和结论:列表进行总结。
6.6 原始数据
6.7 检测成本计算
6.7.1 计算每个考察指标所需样品、试剂等原料用量,检测时间,进样针数及所需设备成本;
6.7.2 计算该样品整个稳定性考察周期所需检测成本。
7.0 稳定性试验报告填写注意事项
7.1 在总结表的 “时间”栏:注明每个考察时间点的日期;
7.2 外观项:填写每次所目测到的实际的颜色和外观;
7.3 有数据结果的项:填写实际所计算出的结果数据;
7.4 结果数据要求:根据有效数字的修约08-0012或四舍五入法进行。 8.0 参考资料: ICH Q1A
9.0 稳定性试验方案模板

Page 1 of XX

The stabilty protocol of XXXX
Written by:
Approved by (QA):
TABLE OF CONTENTS
Section 1.0 目的PURPOSE
Section 2.0 范围/方案描述SCOPE/PROJECT DESCRIPTION
Section 3.0 考察小组PROJECT TEAM
Section 4.0 职责RESPONSIBILITIES
Section 5.0 签名备案PROTOCOL EXECUTORS LOG
Section 6.0 文件确认REFERENCES
Section 7.0 设备和物料EQUIPMENTS AND MATIRAL
Section 8.0 方案执行程序PROTOCOL EXECUTION PROCEDURE Section 9.0 方案接受标准PROTOCOL ACCEPTANCE CRITERIA Section 10.0 方案实施结论PROTOCOL CONCLUSION
Section 11.0 偏差/异常条件DEVIATIONS/EXCEPTIONAL CONDITIONS Section 12.0 回顾、审批APPROVAL
方案中记录格式Format of Records in protocol: 方案执行程序中In protocol execution procedure:


方案实施结论中In protocol conclusion

第二篇:稳定性试验规定,稳定性指导原则,稳定性试验方法
东莞百航仪器厂-国内先进稳定性试验设备生产厂家-药品稳定性试验箱-保质期试验箱
FDA药物稳定性试验指导原则
药品稳定性试验规定
每年底制定下年度原料和制剂成品稳定性试验书面计划,内容包括:规格标准、检验方法、检验周期、每批数量、考查项目、考查频次、时间等。经批准后执行,新开发的制剂品种在开发阶段应制定稳定性计划。
3 公司药品生产用原料稳定性试验可采用影响因素试验法:
3.1 将一批供试品除去包装以后,平放在平皿中,在以下条件下按规定贮存,检测重点考查项目各项质量指标的变化情况。重点考查项目包括:性状、熔点、含量、有关物质、吸湿性及根据药品性质选定的考查项目。
影响因素试验条件:
3.1.1 暴露在常温空气中;
3.1.2 高温试验,温度分别为60℃、40℃两个温度水平;
3.1.3 高湿试验,湿度分别为90%±5%、75%±5%两个湿度水平;
3.1.4 强光照射试验,照度为4500LX±500LX
4 制剂稳定性试验:
4.1 加速试验:取供试品三批,按市售包装,在温度40℃±2℃,相对温度75%±5%的条件下放置6个月,在第一个月、第二个月、第三个月、第六个月末取样检测各剂型规定的重点考查项目的质量指标变化情况。片剂的重点考察项目为:性状、含量、有关物质、崩解时限或溶出度。硬胶囊剂的重点考查项目为:外观、内容物色泽、含量、有关物质、崩解时限或溶出度、水份。液体制剂的重点考察项目为:性状、相对密度、含量、pH值、微生物限度检查。3个月后测试符合要求,有效期暂定为2年,6个月后测试符合要求有效期暂定为3年。
4.2 长期试验:取供试品三批,按市售包装,在规定保存条件下贮存,每年检测一次,重点考查项目的质量指标变化情况,观察3年的检验结果,以确定产品的贮存期或有效期。 5 严格按照批准的书面稳定性计划,做好试验记录,如发现异常情况,采取措施及时调整。 6 试验结束后,对试验结果进行数理统计后处理,评定并作出结论。写出稳定性试验报告,所有资料归档保存。
留样观察管理制度
留样的环境及要求
根据本公司生产的品种的贮存需用,设专用的留样观察室,分为常温区、阴凉区,留样室要求避光、干燥、通风、防虫鼠。
4.2 设专人负责留样样品管理工作,留样管理员应了解样品性质和贮存方法。
4.2.1 每天记录留样室的温度与相对湿度(双休日、节假日除外),如有偏差,应采取相应的措施,使其符合要求。
4.2.2 留样品种要登记,并按品种、规格、批号分别排列整齐,每个柜内的品种、批号应有明确的标志,并易于识别,以便定期进行稳定性考察和用户投诉时查证。
4.2.3 按时观察一般留样并做好记录。
4.2.4 及时汇总重点留样检验结果,并做好留样观察记录。
4.2.5 凡在留样观察期间发现样品质量变化情况异常的或不符合质量标准的,应及时写出检验报告(一式四份:一份送质量部、一份送车间、一份送主管领导、一份留底),必要时请示总经理收回药品,以确保人民用药安全有效。
东莞百航仪器厂-国内先进稳定性试验设备生产厂家-药品稳定性试验箱-保质期试验箱
东莞百航仪器厂-国内先进稳定性试验设备生产厂家-药品稳定性试验箱-保质期试验箱
4.2.6 每年进行一次留样观察分析总结,分析留样中的质量问题,分送到分管领导及有关科室和车间。
4.2.7 对留样到期报废的样品和考察期内已变质的产品统一清理,集中销毁,并做好销毁记录。
4.2.8 所有的留样观察的样品及备查样品要做好保管工作,一般留样样品在用户投诉和观察物料外观、性状是否有质量问题时使用,特殊情况需经质量管理部部长方可使用,但要做如实记录。重点留样样品用于稳定性考察实验,所需样品的量有检验中心主任按中国药典核算并有质量部部长批准,但要做好重点留样检验记录。
4.3 留样观察办法
4.3.1 留样观察方式:一般分为重点留样观察和一般留样观察。
4.4 留样范围
4.4.1 重点留样:新产品、工艺变革产品、质量不稳定的产品、质量标准改革或升级、生产过程出现异常的产品、用户来信有疑问的产品、从未生产过的品种待工艺稳定后留三批。
4.4.2 一般留样:成品每批均需留样,应留到有效期后一年。
4.4.3 原料(中药材):首次进货、改变供应商、产品在生产怀疑是原料引起的质量问题等应留样。
4.4.4. 包装材料:印字包装每版、印字包装首次进货。
4.5 留样的数量(以能满足留样检验为限)
4.5.1 重点留样:每年根据留样范围及生产的实际情况决定重点留样的批次,除特殊情况外,每产品留足三批,每批留足有效期后一年的检测量。留样考察周期如在观察期内发现质量不稳定应增加抽样批次和数量。
4.6 留样观察频次:0个月、3个月、6个月、9个月、12个月、18个月、24个月、36个月。
4.7 留样观察项目
4.7.1 一般留样:观察外观、性状,如有明显变化,要查找原因或做有关项目检查。
4.7.2 重点留样:
4.7.2.1 0个月所有品种按质量标准的规定全项检验。
4.7.2.2 其他月除装量,其他项目全部检验。
4.7.3 原料,中药材成品检验分析问题来源于原料应针对该项目进行检验。如成品检验无异常只观察性状。
4.7.4 印字包装材料:检查外观、颜色。
4.8 留样保存期:
4.8.1 原料:一般留样三个月,中药材留样一年。
4.8.2 成品:一般留样留到有效期后一年,重点留样品种已到考察期未变质的产品,留一批继续观察直至变质为止,为公司提供质量变化依据。
4.8.3 印字包装材料:留样一年。
4.9 记录规范与保存
4.9.1 一般留样:每剂型装订一本,每批按留样观察频次观察性状一次并记录。
4.9.2 重点留样:按留样检验周期到期由留样观察员将样品分发到各检验员手中,检验记录由留样观察员统一汇总归档。液色
原料药与药物制剂稳定性试验指导原则
稳定性试验的目的是考察中药在温度,湿度,光线,微生物的影响下随时间变化的规律.为中药的生产,包装,贮存,运输条件提供科学依据,同时根据试验结果建立药品的有效期.
稳定性试验的基本要求有以下几个方面:
东莞百航仪器厂-国内先进稳定性试验设备生产厂家-药品稳定性试验箱-保质期试验箱
东莞百航仪器厂-国内先进稳定性试验设备生产厂家-药品稳定性试验箱-保质期试验箱
(1)稳定性试验包括加速试验与长期试验.加速试验与长期试验要求用三批供试品进行.
(2)中药制剂的供试品应是放大试验的产品,其处方与工艺应与大生产一致.每批放大试验的规模,丸剂应在10000g或10000丸左右,片剂10000片左右,胶囊剂10000粒左右,大体积包装的制剂(如静脉输液,口服液等)每批放大规模的数量至少应为各项试验所需总量的10倍.特殊品种,特殊剂型所需数量,根据情况,灵活掌握.
(3)供试品的质量标准应与各项基础研究及临床验证所使用的供试品质量标准一致.
(4)加速试验与长期试验所用供试品的容器和包装材料及包装方式应与上市产品一致.
(5)研究中药稳定性,要采用专属性强,准确,精密,灵敏的分析方法并对方法进行验证,以保证中药稳定性试验结果的可靠性.在稳定性试验中,应重视降解产物的检查.
(6)由于放大试验比大规模生产的数量要小,故申报者应在获得批准后,从放大试验转入大规模生产时,对最初通过生产验证的三批大规模生产的产品仍需进行加速试验与长期稳定性试验.
1,加速试验
此项试验是在超常的条件下进行,其目的是通过加速中药的化学或物理变化,探讨中药的稳定性,为中药审评,工艺改进,包装,运输及贮存提供必要的资料.供试品要求3批,按市售包装,在温度40℃±2℃,相对湿度75%±5%的条件下放置6个月.所用设备应能控制温度±2℃,相对湿度±5%,并能对真实温度与湿度进行监测.在试验期间第1个月,2个月,3个月,6个月末各取样一次,按稳定性重点考察项目检测.在上述条件下,如6个月内供试品经检测不符合制订的质量标准,则应在中间条件下即温度30℃±2℃,相对湿度60%±5%的情况下进行加速试验,时间仍为6个月.合剂,糖浆剂,搽剂,酒剂,流浸膏剂,注射液等含水性介质的制剂可不要求相对湿度.加速试验,建议采用隔水式电热恒温培养箱(20~60℃).箱内放置具有一定相对湿度饱和盐溶液的干燥器,设备应能控制所需的温度,且设备内各部分温度应该均匀,并适合长期使用.也可采用恒湿恒温箱或其他适宜设备.
对温度特别敏感的中药制剂,预计只能在冰箱(4~8℃)内保存使用,此类中药制剂的加速试验,可在温度25℃±2℃,相对湿度60%±10%的条件下进行,时间为6个月.
合剂,糖浆剂,搽剂,酒剂,酊剂,浸膏剂, 流浸膏剂,软膏,眼膏,膏药剂,栓剂,气雾剂,露剂,橡胶膏剂,巴布膏剂,洗剂,泡腾片及泡腾颗粒宜直接采用温度30±2℃,相对湿度60%±5%的条件进行试验,其他要求与上述相同.
对于包装在半透性容器的中药制剂,如塑料袋装溶液,塑料瓶装滴眼剂,滴鼻剂等,则应在相对湿度20%±2%的条件(可用CH3COOK?1.5H2O饱和溶液,25℃,相对湿度22. 5%)进行试验. 2,长期试验
长期试验是在接近中药的实际贮存条件下进行,其目的是为制订中药的有效期提供依据.供试品三批,市售包装,在温度25℃±2℃,相对湿度60%±10%的条件下放置12个月.每3个月取样一次,分别于0个月,3个月,6个月,9个月,12个月,按稳定性重点考察项目进行检测.12个月以后,仍需继续考察,分别于18个月,24个月,36个月取样进行检测.将结果与0月比较以确定药品的有效期.由于实测数据的分散性,一般应按95%可信限进行统计分析,得出合理的有效期.如三批统计分析结果差别较小,则取其平均值为有效期限;若差别较大,则取其最短的为有效期.数据表明很稳定的药品,不作统计分析.
对温度特别敏感的中药制剂,长期试验可在温度6℃±2℃的条件下放置12个月,按上述时间要求进行检测,12个月以后,仍需按规定继续考察,制订在低温贮存条件下的有效期.
稳定性试验考察计划
质保部20xx年度
东莞百航仪器厂-国内先进稳定性试验设备生产厂家-药品稳定性试验箱-保质期试验箱
东莞百航仪器厂-国内先进稳定性试验设备生产厂家-药品稳定性试验箱-保质期试验箱
产品质量稳定性考察计划
为考察我公司所有生产品种的质量稳定性,决定对所有生产品种进行长期稳定性考察试验,为确保患者能够安全、有效的用药和对各品种试行标准转正及有效期确定等提供有效的数据。
一、 稳定性考察要点:
药品剂型 药典收载 主要检验项目 备 注
片 剂 中国药典二部 重量差异、崩解时限(溶出度、释放度)、有关物质检查、含量测定
胶 囊剂 中国药典二部 装量差异、崩解量限、(溶出度、释放度)水分、含量测定等 颗 粒剂 中国药典一、二部 装量差异、水分、(干燥失重)、溶化性、粒度、含量测定等
二、 具体方案:
1.对各品种生产的前三批进行稳定性考察,每批拟计划一定量(注:各品种剂型留样量一览表见附页)进行考察。其余批次只做一般留样考察,留样量为三次复检的全项检验量。
2.考察方法:
2.1加速试验:
2.1.1按市售包装,在温度40℃±2℃、相对湿度75%±5%的条件下放置六个月,在试验期间第1个月、2个月、3个月、6个月末分别取样一次,按稳定性考察要点项目进行检验。
2.1.2在上述条件下,如6个月内供试品经检测不符合制定的质量标准,则应在如下条件温度30℃±2℃、相对湿度65%±5%情况下进行加速试验,时间仍为六个月。
2.2长期试验:
2.2.1按市售包装,在温度18~26℃、相对湿度60%±15%的条件下放置12个月.每3个月取样一次,分别于0个月,3个月,6个月,9个月,12个月末取样,按各剂型品种具体的稳定性考察要点项目进行检验。12个月后,仍继续考察,分别于18个月,24个月,36个月、42个月、48个月(以此类推)末取样检测。将结果与0月比较以确定药品有效期。
2.2.2对原辅料、半成品等在留样存储期进行质量稳定性跟踪考察,做到原辅料使用前的质量有效评估,确保成品安全、有效、稳定。
2.2.3由于实测数据的分散性,按95%可信限进行统计分析,得出合理的有效期。如三批统计数据分析差别较小,则取平均值为有效期。若差别较大,则取其最短的为有效期。同时能够明确各剂型品种的安全性、稳定性及有效性。
三、 方案实施:
本方案由质量部完成,记录上述所有数据,并对试验过程中异常情况记录。
四、在产品正式生产阶段,已建立了详细的生产工艺资料,可将实验室的数据和生产情况相结合,用具有代表性的批号产品对稳定性进行考察,进一步修正产品的有效期。如果需要改变工艺、处方、包装,就必须重新进行稳定性的研究。如:活性成分的来源或合成工艺有变化,制剂工艺有变化,制剂中的辅料、外观、颜色及包装有变化,都必须重新考虑有关稳定性的问题。
如果以上的变化影响了产品的稳定性,应该对产品重新设计。在此阶段一般可用加速实验的方法进行有关稳定性的研究,并将目前的产品与原有的产品进行稳定性的比较。但最后的结论仍应该在完全的、正常的稳定性研究基础上得出。
鉴于此,特对成品初拟留样观察和稳定性试验考察计划:
1、 根据每月生产计划,如果生产计划有新的品种即将生产,按照药典规定及留样观察管理规程的观察周期对每一新增品种进行长期重点留样试验考察,直至三年(转正)后。
2、 如果没有新增的品种,按照留样观察管理标准的相关规定及上年生产状况(尤其是有偏差的产品)进行产品稳定性试验重点考察及一般留样观察,考察的数量、时间、项目等可东莞百航仪器厂-国内先进稳定性试验设备生产厂家-药品稳定性试验箱-保质期试验箱
东莞百航仪器厂-国内先进稳定性试验设备生产厂家-药品稳定性试验箱-保质期试验箱
以根据产品的特性另行规定。下表是常年生产的品种,对规格、全检量、留样量(一般、重点)、有效期、考察期进行数字统计罗列,以期对留样观察及稳定性试验做到逐步完善,其目的是为了确保药品在使用的时候仍能够安全、有效、稳定;同时也给下列工作带来方便:
(1)新产品的处方筛选或改进处方和制备工艺;
(2)确定产品的安全、有效及稳定性、预测有效期;
(3)确定原辅料在使用前的安全、有效、稳定;
(4)确定处方中个别原料的投料量;
(5)在原料改变时作各批产品稳定性的相关试验。
附表:各剂型药品重点留样数量一览表
剂 型 包装规格 一次全检量(袋) 一般留样量(盒) 重点留样量(盒) 有效期(月) 考察期(月)
颗
粒
剂 小儿氨酚黄那敏颗粒 6代/盒 15袋 8 25 24个月 24个月
8代/盒 15袋 6 19
9代/盒 15袋 5 17
10代/盒 15袋 5 15
11代/盒 15袋 5 14
12代/盒 15袋 4 13
复方氨酚那敏颗粒 50代/包 15小袋 1中袋 3中袋 24个月 24个月
盐酸金刚烷胺颗粒 6代/盒 20袋 10 34 24个月 24个月
8代/盒 20袋 8 25
9代/盒 20袋 7 23
10代/盒 20袋 6 20
11代/盒 20袋 6 20
12代/盒 20袋 5 17
小儿复方磺胺甲噁唑颗粒 6代/盒 15袋 8 25 24个月 24个月
8代/盒 15袋 6 19
9代/盒 15袋 5 17
10代/盒 15袋 5 15
11代/盒 15袋 5 14
12代/盒 15袋 4 13
小儿化痰止咳颗粒 6代/盒 15袋 8 25 36个月 36个月
8代/盒 15袋 6 19
9代/盒 15袋 5 17
10代/盒 15袋 5 15
11代/盒 15袋 5 14
12代/盒 15袋 4 13
胶
囊
剂 维U颠茄铝胶囊(III) 12粒/板×1板/盒 60粒 15 50 24个月 24个月 9粒/板×2板/盒 60粒 10 34
45粒/瓶 60粒 3 14
东莞百航仪器厂-国内先进稳定性试验设备生产厂家-药品稳定性试验箱-保质期试验箱
东莞百航仪器厂-国内先进稳定性试验设备生产厂家-药品稳定性试验箱-保质期试验箱
人工牛黄甲硝胶囊 12粒/板×1板/盒 60粒 15 50 36个月 36个月
9粒/板×2板/盒 60粒 10 34
片剂 马来酸氯苯那敏片 24片×2板/盒 180片 12 38 24个月 24个月
愈创甘油醚片 100片/瓶 60片 2 6 24个月 24个月
东莞百航仪器厂-国内先进稳定性试验设备生产厂家-药品稳定性试验箱-保质期试验箱
稳定性试验标准操作规程(SOP)
点击次数:1554 发布时间:2009-6-17 22:34:26
1. 稳定性试验的内容:
1.1 加速破坏试验,预测样品的有效期;
1.2 样品在规定的保存条件下观察若干年限的检测结果。
2.稳定性试验的基本要求:
2.1 稳定性试验包括影响因素试验、加速试验和长期试验。
2.1.1 影响因素试验适用于原料药的考察,用 1 批原料药进行;
2.1.2 加速试验和长期试验适用于原料药与药物制剂,要求用 3 批供试品进行。
2.2 原料药供试品是一定规模生产的,供试品量相当于制剂稳定性实验所要求的批量,原料药合成工艺路线、方法、步骤应与大生产一致。药物制剂的供试品应是放大试验的产品,其处方与生产工艺应与大生产一致。
2.3 供试品的质量标准应与各项基础研究及临床验证所使用的供试品质量标准一致。
2.4 加速试验与长期试验所用供试品的容器和包装材料及包装方式应与上市产品一致。
2.5 研究药物稳定性,要采用专属性强、准确、精密、灵活的药物分析方法和有关物质的检查方法,并对方法进行验证以保证药物稳定性试验结果的可靠性。在稳定性试验中,应重视有关物质的检查。
3.原料药的稳定性试验:
3.1 影响因素试验
3.1.1 高温试验
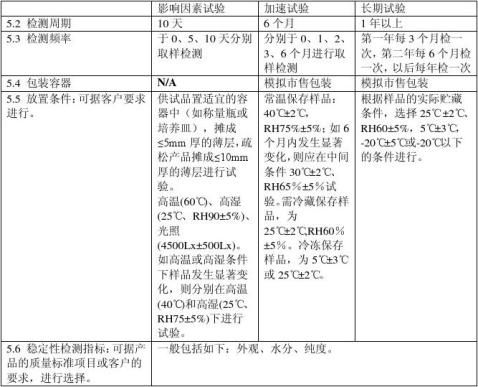
供试品置于适宜的密封洁净容器中,60℃ 温度下放置 10 天,在第 5 天和第10 天取样,按稳定性重点考察项目进行检测。若供试品有明显变化(如含量下降5%),则在40℃条件下同法进行试验。若 60℃ 无明显变化,不再进行40℃试验。
3.1.2 高湿度试验:
供试品置于恒湿密闭容器中,在25℃分别于相对湿度90%±5%条件下放置10天,于第5天和第10天取样,按稳定性重点考察项目要求检验,同时准确称量试验前后供试品的重量,以考察供试品的吸湿潮解性能。若吸湿增重5%以上,则在相对湿度75%±5% 条 件下,同法进行试验;若吸湿增重5%以下,且其他考察项目符合要求,则不再进行此项试验。
3.1.3 强光照射试验:
供试品放在装有日光灯的光照箱或其他适宜的光照装置内,于照度为 4500lx±500lx 的条件下放置10 天,于第 5 天和第 10 天取样,按稳定性重点考察项目进行检测,特别要注意供试品的外观变化。此外,根据药物的性质,必要时可设计实验,探讨 pH 值与氧及其他条件对药物稳定性的影响,并研究分解产物的分析方法。
3.1.4 加速试验:
此项试验是在超常的条件下进行的。其目的是通过加速药物的化学或物理变化,探讨药物的稳定性,为药品审评、包装、运输及储存提供必要的资料。要求提供按市售包装的 3 批东莞百航仪器厂-国内先进稳定性试验设备生产厂家-药品稳定性试验箱-保质期试验箱
东莞百航仪器厂-国内先进稳定性试验设备生产厂家-药品稳定性试验箱-保质期试验箱
供试品,在温度40℃±2℃、相对湿度 75%±5% 的条件下放置 6 个月。所用设备应能控制温度±2℃,相对湿度±5%,并能对真实温度和湿度进行检测。在试验期间第1个月、2个月、3个月、6个月末各取样一次,按稳定性重点项目检测。
3.1.5 长期试验:
3.1.5.1 长期试验是在接近药物的实际储存条件下进行,其目的为制订药物的有效期提供数据。供试品要求 3 批,市售包装,温度在25℃±2℃、相对湿度 60%±10% 的条件下放置12 个月,每 3 个月取样一次,分别于0个月、3个月、6个月、9个月、12个月按稳定性重点考察项目进行检测。12个月以后,分别于18个月、24个月、36个月仍需继续考察,取样进行检测。将结果与 0月的数据比较,以确定药物的有效期.
3.1.5.2 对温度特别敏感的药物,长期试验可在6℃±2℃ 的条件下放置12个月,按上述时间要求进行检测,12个月以后仍需按规定继续考察,制订在低温储存条件下的有效期。原料药进行加速试验和长期试验所用的包装应采用模拟小桶,但所用材料与封条应与大桶一致。
4.药物制剂的稳定性试验:
4.1 加速试验:
4.1.1 此项试验是在超常的条件下进行的。其目的是通过加速药物的化学或物理变化,探讨药物的稳定性,为药品审评、包装、运输及储存提供必要的资料。要求提供按市售包装的 3 批供试品,在温度40℃±2℃、相对湿度 75%±5% 的田间下放置 6 个月。所用设备应能控制温度±2℃,相对湿度±5%,并能对真实温度和湿度进行检测。在试验期间第1个月、2个月、3个月、6个月末各取样一次,按稳定性重点项目检测。
4.1.2 在上述条件下,如 6 个月内供试品经检测不符合制订的质量标准,则应在中间条件下,即在温度30℃±2℃、相对湿度 60%±5% 的情况下,再进行加速试验,时间仍为6 个月。对温度特别敏感的药物,预计只能在冰箱中保存(4-8℃),此种药物的加速试验,可在温度25℃±2℃、相对湿度60%±10%的条件下进行,时间也为 6 个月。
4.2 长期试验:
4.2.1 长期试验是在接近药物的实际储存条件下进行,其目的为制订药物的有效期提供数据。供试品要求 3 批,市售包装,温度在25℃±2℃、相对湿度 60%±10% 的条件下放置12 个月,每 3 个月取样一次,分别于0个月、3个月、6个月、9个月、12个月按稳定性重点考察项目进行检测。12个月以后,分别于18个月、24个月、36个月仍需继续考察,取样进行检测。将结果与0月的数据比较,以确定药物的有效期。
4.2.2 对温度特别敏感的药物,长期试验可在6℃±2℃的条件下放置12个月,按上述时间要12个月以后仍需按规定继续考察,制订在低温储存条件下的有效期。有些药物制剂还应考察使用过程中的稳定性。
质量标准——稳定性试验指导原则1
稳定性试验的目的是考察原料药或药物制剂在温度、湿度、光线的影响下随时间变化的规律,为药品的生产、包装、贮存、运输条件提供科学依据,同时通过试验建立药品的有效期。
稳定性试验的基本要求是:
(1)稳定性试验包括影响因素试验、加速试验与长期试验。影响因素试验用一批原料东莞百航仪器厂-国内先进稳定性试验设备生产厂家-药品稳定性试验箱-保质期试验箱
东莞百航仪器厂-国内先进稳定性试验设备生产厂家-药品稳定性试验箱-保质期试验箱
药进行。加速试验与长期试验要求用三批供试品进行。
(2)原料药供试品应是一定规模生产的,供试品量相当于制剂稳定性试验所要求的批量,原料合成工艺路线、方法、步骤应与大生产一致。药物制剂供试品应是放大试验的产品,其处方与工艺应与大生产一致。药物制剂如片剂、胶囊剂,每批放大试验的规模,片剂至少应为10000片,胶囊剂至少应为10000粒。大体积包装的制剂(如静脉输液等)每批放大规模的数量至少应为各项试验所需总量的10倍。特殊品种、特殊剂型所需数量,根据情况另定。
(3)供试品的质量标准应与临床前研究及临床试验和规模生产所使用的供试品质量标准一致。
(4)加速试验与长期试验所用供试品的包装应与上市产品一致。
(5)研究药物稳定性,要采用专属性强、准确、精密、灵敏的药物分析方法与有关物质(含降解产物及其他变化所生成的产物)的检查方法,并对方法进行验证,以保证药物稳定性结果的可靠性。在稳定性试验中,应重视降解产物的检查。
(6)由于放大试验比规模生产的数量要小,故申报者应承诺在获得批准后,从放大试验转入大规模生产时,对最初通过生产验证的三批大规模生产的产品仍需进行加速试验与长期稳定性试验。本指导原则分两部分,第一部分为原料药,第二部分为药物制剂。
1.原料药
原料药要进行以下试验。
(1)影响因素试验此项试验是在比加速试验更激烈的条件下进行。其目的是探讨药物的固有稳定性、了解影响其稳定性的因素及可能的降解途径与降解产物,为制剂生产工艺、包装、贮存条件和建立降解产物分析方法提供科学依据。供试品可以用一批原料药进行,将供试品置适宜的开口容器中(如称量瓶或培养皿),摊成≤5mm厚的薄层,疏松原料药摊成≤10mm厚薄层,进行以下试验。当试验结果发现降解产物有明显的变化,应考虑其潜在的危害性,必要时应对降解产物进行定性或定量分析。
①高温试验供试品开口置适宜的洁净容器中,60℃温度下放置10天,于第5天和第10天取样,按稳定性重点考察项目进行检测。若供试品有明显变化(如含量低于规定限度)则在40℃条件下同法进行试验。若60℃无明显变化,不再进行40℃试验。
②高湿度试验供试品开口置恒湿密闭容器中,在25℃分别于相对湿度90%±5%条件下放置10天,于第5天和第10天取样,按稳定性重点考察项目要求检测,同时准确称量试验前后供试品的重量,以考察供试品的吸湿潮解性能。若吸湿增重5%以上,则在相对湿度75%±5%条件下,同法进行试验;若吸湿增重5%以下,其他考察项目符合要求,则不再进行此项试验。恒湿条件可在密闭容器如干燥器下部放置饱和盐溶液,根据不同相对湿度的要求,可以选择NaCl饱和溶液(相对湿度75%±1%,15.5~60℃),KNO3饱和溶液(相对湿度92.5%,25℃)。
③强光照射试验供试品开口放在装有日光灯的光照箱或其他适宜的光照装置内,于照度为4500lx±500lx的条件下放置10天,于第5天和第10天取样,按稳定性重点考察项目进行检测,特别要注意供试品的外观变化。
关于光照装置,建议采用定型设备“可调光照箱”,也可用光橱,在箱中安装日光灯数支使达到规定照度。箱中供试品台高度可以调节,箱上方安装抽风机以排除可能产生的热量,箱上配有照度计,可随时监测箱内照度,光照箱应不受自然光的干扰,并保持照度恒定,同时防止尘埃进入光照箱内。
此外,根据药物的性质必要时可设计试验,探讨pH值与氧及其他条件对药物稳定性的影响,并研究分解产物的分析方法。创新药物应对分解产物的性质进行必要的分析。
(2)加速实验此项试验是在规定的条件下进行。其目的是通过加速药物的化学或物理东莞百航仪器厂-国内先进稳定性试验设备生产厂家-药品稳定性试验箱-保质期试验箱
东莞百航仪器厂-国内先进稳定性试验设备生产厂家-药品稳定性试验箱-保质期试验箱
变化,探讨药物的稳定性,为制剂设计、包装、运输、贮存提供必要的资料。供试品要求三批,按市售包装,在温度40℃±2℃,相对湿度75%±5%的条件下放置6个月。所用设备应能控制温度±2℃,相对湿度±5%,并能对真实温度与湿度进行监测。在试验期间第1个月、2个月、3个月、6个月末分别取样一次,按稳定性重点考察项目检测。在上述条件下,如6个月内供试品经检测不符合制订的质量标准,则应在中间条件下即在温度30℃±2℃、相对湿度65%±5%的情况下(可用Na2CrO4饱和溶液,30℃,相对湿度64.8%)进行加速试验,时间仍为6个月。加速试验,建议采用隔水式电热恒温培养箱(20~60℃)。箱内放置具有一定相对湿度饱和盐溶液的干燥器,设备应能控制所需温度,且设备内各部分温度应该均匀,并适合长期使用。也可采用恒湿恒温箱或其他适宜设备。
对温度特别敏感的药物,预计只能在冰箱中(4~8℃)保存,此种药物的加速试验,可在温度25℃±2℃、相对湿度60%±10%的条件下进行,时间为6个月。
点考察
百航仪器bh-388稳定性试验箱,能同时模拟三个不同环境测试系统,可快速,精确的测试出产品稳定性周期。
FDA药物稳定性试验指导原则
东莞百航仪器厂-国内先进稳定性试验设备生产厂家-药品稳定性试验箱-保质期试验箱
