原料药稳定型研究方案
原料药,研究其稳定性是在考察其在温度、湿度、光线的影响下随时间变化的规律,为其生产、包装、贮存、运输条件和有效期的确定提供科学依据。本试验采用高温、高湿、光照等试验方法,通过目测法鉴定其外观,通过水分测定仪测定水分,通过电位滴定仪测定其含量。
我们这次所做的影响因素条件为:高温条件为为60℃±2℃,高湿为90%±5%,加速条件为:40℃±2℃、RH75%±5%;长期试验条件为:25℃±2℃,RH60%±5来考察产品的稳定性。
考察项目及检测方法
1外观
方法:目测法
2水分、含量
水分测定方法:水分滴定仪
含量测定方法:电位滴定仪
3.1高温试验
取采用包装批号为NH-130101的样品,在60℃±2℃条件下放置10天,于第0天、第5天、第10天取样,检测相关指标。
3.2高湿试验
取采用包装批号为NH-130101的样品,于25℃±2℃、RH75%±5%条件下放置10天,在第0天、第5天和第10天取样,检测相关指标。
3.3光照试验
取采用包装批号为NH-130101的样品,在光强度为4500lx±500lx的光源下,距光源30cm,放置10天,在0天、5天和10天取样,测定相关指标。
3.4加速试验
取采用包装的三批次样品,批号分别为:NH-130101、NH-130102、NH-130103试验条件为40℃±2℃、RH75%±5%,试验时间从2013.01.01开始,为6个月,分别于0、1、2、3、6个月取样检测。
3.5长期试验
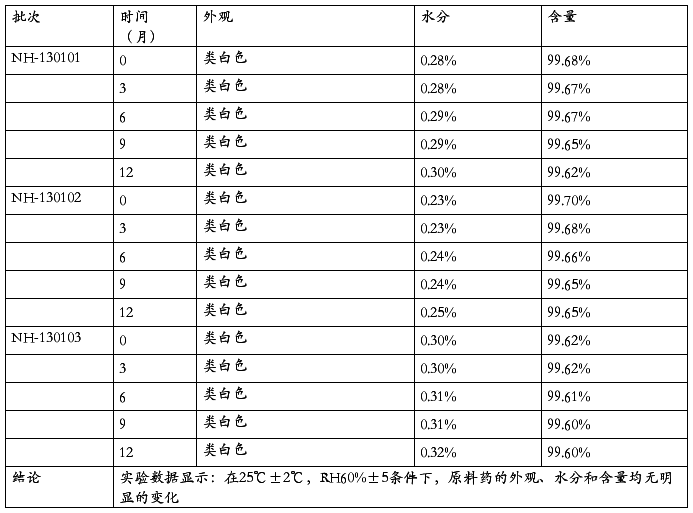
取采用包装的三批次样品,批号分别为:NH-130101、NH-130102、NH-130103,试验条件为25℃±2℃,RH60%±5,试验时间从2013.01.01开始,取样时间点为0月、3月、6月、9月、12月。
4试验结果
4.1高温试验

4.2高湿试验

4.3光照试验

4.4加速试验

4.5 长期试验
5、总结:
通过以上实验数据,由此得出以下结论,原料药在高温、光照条件下均比较稳定,在湿度为90%的条件下,样品的水分略有提高,在温度40℃,RH75%的条件下,产品的外观、水分和含量均无明显的变化,在常温条件下,温度为25℃,RH为60%的条件下,外观、水分和含量均无明显的变化,产品质量比较稳定,因此,建议保存条件为常温条件下,密封干燥处保存。
第二篇:原料药稳定性研究SOP
原料药稳定性考察sop
一、研究目的
稳定性研究是基于对原料药及其生产工艺的系统研究和理解,通过设计试验获得原料药的质量特性在各种环境因素(如温度、湿度、光线照射等)的影响下随时间变化的规律,并据此为药品的处方、工艺、包装、贮藏条件和复验期/有效期的确定提供支持性信息。
二、试验内容
原料药稳定性研究包括强制条件试验、加速试验、长期试验、中间条件试验
三、试验设计
1.强制条件试验
①定义:
强制条件试验主要是考察原料药对光、湿、热、酸、碱、氧化等的稳定性,了解其对光、湿、热、酸、碱、氧化等的敏感性,主要的降解途径及降解产物,并据此进一步验证所用分析方法的可行性、确定加速试验的放置条件及为选择合适的包装材料提供参考。
②样品要求:
中试第一批 参比制剂
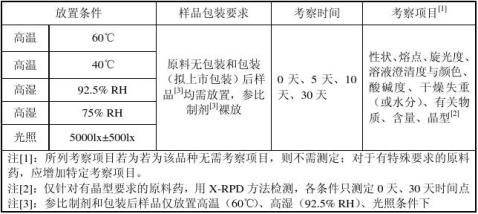
③试验设计
④放样及取样要求
A.无包装样品:
固体原料药:将3倍于5天、10天、30天检样总需量的原料药细粉平铺于表面皿中,厚度一般不超过3mm。分别与5天、10天、30天取3倍检样量的样品包装于铝箔袋内,封口,贴好标签(注明品名、批号、放置条件、取样时间),置于干燥器内,待检。最好取样后立即安排检样。
液体原料药:高温、光照条件下样品应将3倍于5天、10天、30天检样总需量的原料药分装于1~5ml的无色安瓿瓶中,封口放置;高湿条件下样品将3倍于5天、10天、30天检样总需量的原料药分装于1~5ml的无色西林瓶中,敞口放置。分别与5天、10天、30天取3倍检样量的样品(西林瓶封口),贴好标签(注明品名、批号、放置条件、取样时间),放于具有避光作用的纸袋或黑色塑料袋内,置于干燥器内,待检。最好取样后立即安排检样。
B.包装样品:将3倍于单点检样量的原料药分别包装于铝箔袋(或其他拟上市包装中),贴好标签(注明品名、批号、放置条件、取样时间),标签用透明胶带加固。分别放置于各试验条件下,与5天、10天、30天分别取样,置干燥器,待检。
C.参比制剂:裸放,满足有关物质3倍检样量,于30天先取1倍检样量检测,其余样品继续放置。
③检样要求
A.原料药:首先测定高温(60℃)、高湿(92.5% RH)、光照条件下的无包装样品,若各项质量指标均无明显变化,则其他条件及包装后样品无需测定。若某一条件下质量指标发生明显变化则需测定该条件下包装样品和较低试验条件下的样品。
B.参比制剂:于30天时取样检查有关物质,若有关物质无明显增加,则各条件下需继续留样考察,于60天、90天时取样检测。
2.加速试验
①定义:
加速试验是采用超出贮藏条件的试验设计来加速原料药的化学降解或物理变化的试验;是正式稳定性研究的一部分。
加速试验数据还可用于评估在非加速条件下更长时间的化学变化,以及在短期偏离标签上注明的贮藏条件(如运输过程中)时对质量产生的影响;但是,加速试验结果有时不能预测物理变化。
②样品要求:
连续生产的三批中试规模样品或生产规模样品(需冷冻保存样品取一批) ③试验设计
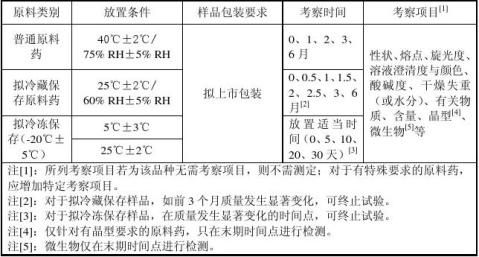
将包装于拟上市包装(或与拟上市包装材质相同的包装)内的3倍于检样总需量的原料药细粉放置于加速试验恒温恒湿箱内。分别与相应时间点取3倍检样量的样品包装于铝箔袋内,封口,贴好标签(注明品名、批号、放置条件、取样时间),置于干燥器内,待检。最好取样后立即安排检样。
⑤检样要求
各时间点取样后应及时检样,将检测结果与前面以各检测的时间点的进行进行对比分析,出现异常情况应及时报告。
2.中间条件试验
①定义:
中间试验是为拟在25℃下长期贮藏的原料药设计的在30℃/65%RH条件下进行的试验,目的是适当加速试验原料药或制剂的化学降解或物理变化。
长期试验的放置条件为30℃±2℃/65%RH±5%RH,则无需进行中间条件试验。
②样品要求:
连续生产的三批中试规模样品或生产规模样品
③试验设计
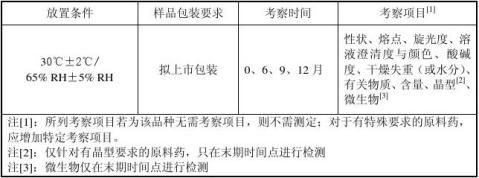
④放样及取样要求
将包装于拟上市包装(或与拟上市包装材质相同的包装)内的3倍于检样总需量的原料药细粉放置于中间条件试验恒温恒湿箱内。分别与相应时间点取3倍检样量的样品包装于铝箔袋内,封口,贴好标签(注明品名、批号、放置条件、取样时间),置于干燥器内,待检。最好取样后立即安排检样。
⑤检样要求
A.各时间点取样后应及时检样,将检测结果与前面以各检测的时间点的进行
进行对比分析,出现异常情况应及时报告。
B.若加速试验6个月内各质量指标未发生明显变化,则无需检样。
3.长期试验试验
①定义:
长期试验是为确定在标签上建议(或批准)的复验期进行的在拟定贮藏条件下的稳定性研究。
②样品来源:
连续生产的三批中试样品或生产规模样品
③试验设计
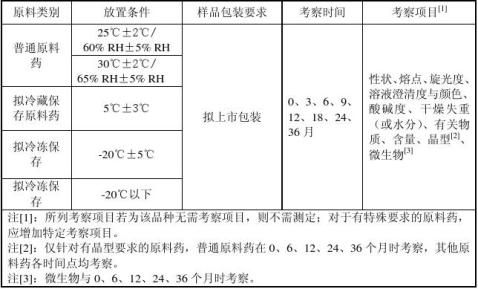
④放样及取样要求
对于稳定性较好的普通原料药,建议放置条件为30℃±2℃/65% RH±5% RH。 将包装于拟上市包装(或与拟上市包装材质相同的包装)内的3倍于检样总需量的原料药细粉放置于长期试验恒温恒湿箱内。分别与相应时间点取3倍检样量的样品包装于铝箔袋内,封口,贴好标签(注明品名、批号、放置条件、取样时间),置于干燥器内,待检。最好取样后立即安排检样。
⑤检样要求
各时间点取样后应及时检样,将检测结果与前面以各检测的时间点的进行进行对比分析,出现异常情况应及时报告。
⑥注册申报试验数据要求
新原料药长期试验应包括至少3个注册批次、12个月的试验数据,并应同时承诺继续考察足够的时间以涵盖其复验期。仿制原料药长期试验应包括至少3个注册批次、6个月的试验数据,并应同时承诺继续考察足够的时间以涵盖其复验期。
三、稳定性承诺
当申报注册的3个生产批次样品的长期稳定性数据已涵盖了建议的复验期,则认为无需进行批准后的稳定性承诺;但是,如有下列情况之一时应进行承诺:
1、如果递交的资料包含了至少3个生产批次样品的稳定性试验数据,但尚未至复验期,则应承诺继续进行研究直到建议的复验期。
2、如果递交的资料包含的生产批次样品的稳定性试验数据少于3批,则应承诺继续进行研究直到建议的复验期,同时补充生产规模批次至少至3批,并进行直到建议复验期的长期稳定性研究。
3、如果递交的资料未包含生产批次样品的稳定性试验数据(仅为注册批次样品的稳定性试验数据),则应承诺采用生产规模生产的前3批样品进行长期稳定性试验,直到建议的复验期。
四、名词
1、中试规模批次(Pilot scale batch)
按照和模拟生产规模生产的原料药或制剂批次。对固体口服制剂,中试规模一般至少是生产规模的十分之一。
2、申报注册批次(Primary batch)
用于正式稳定性研究的原料药或制剂批次,其稳定性数据在注册申报时可分别用于建立复验期或货架期。原料药申报批次至少是中试规模;制剂3个批次中至少2个批次是中试规模,另1个批次的规模可小一些,但必须采用有代表性的关键生产步骤。申报注册批次也可以是生产批次。
3、生产批次(Production batch)
使用申报时确认的生产厂房及生产设备,以生产规模生产的原料药或制剂批次。
4、承诺批次(Commitment batchs)
注册申报时承诺的在获得批准后开始进行或继续完成稳定性研究的原料药或制剂的生产规模批次。
