甘薯ADK基因反义表达载体构建
基 因 工 程
实
验
报
告
2009级生物科学(师范) 1 班 第 1
组
甘薯ADK基因反义表达载体构建
甘薯ADK基因反义表达载体构建
(西南大学生命科学学院,重庆400715)
摘要:以甘薯为材料,提取甘薯的基因组DNA,以其基因组DNA为模板在体外克窿甘薯ADK基因核心片段并电泳检测基因的纯度。然后,将含有目的基因ADK基因的基因片段与T载体用限制酶BamHⅠ+XbaⅠ进行双酶切后连接,将带有目的基因的T载体导入大肠杆菌DH5?感受态细胞中,扩增之后,在加有相应抗生素的LB平板上筛选阳性克隆、筛选并PCR检测鉴定。最后,对表达载体进行酶切鉴定。
关键词:甘薯;腺苷酸激酶基因(adk);反义载体;双酶切;PCR检测鉴定
英文摘要:For the materials with sweet patato extraction, the genomic DNA, with its genomic DNA gallery for template in vitro ADK genes, sweet core fragments and electrophoresis gene purity. Then, the purpose ADK genes with T carrier, with a purpose to connect the genes DH5a escherichia coli T ectors to feel normal cells, the expansion in the corresponding after plate screening of antibiotic LB positive cloning. At the same time, the extract of high quality sweet RNA in RNA, electrophoresis its purity.
Keywords: sweet potato; adenylate kinase gene (adk); antisense carrier; digestion; PCR detection and identification
1.综述
1.1甘薯
甘薯(Ipomoea batatas (L. ) Lam.)属旋花科(Convolvulaceae)甘薯属(Ipomoea)蔓生一年生草本植物,染色体数为2n=6x=90。在我国因各地语言差异,甘薯的中文俗名较多,又名番薯、白薯、地瓜、山芋、红芋、红苔、红薯等,其英文一般写作sweet potato,在美国也有写为sweetpotato。19xx年美国甘薯合作者组织规定用Sweetpotato表示甘薯,以便更准确地表达甘薯的特性及与Potato(马铃薯)相区别。目前,此表达方式已在美国、澳大利亚等许多英语国家采用,并逐步被其他国家或地区的甘薯研究者所接受。目前学术界一致公认甘薯起源于热带美洲,经“Kumara"路线、"Batata"路线、"Kamote"路线传播到世界各地。由于甘薯具有耐旱、耐痔,繁殖力强、适应性广、栽培简便、产量高,用途广泛等特点,现已在全世界广泛栽培。我国的甘薯栽培己有400多年的历史。据史料记载,甘薯于16世纪的1563-1594年间,经陆海多种渠道传入我国。在我国,甘薯的栽
甘薯ADK基因反义表达载体构建
培分布很广,南起海南诸岛,北至内蒙古,西北达陕西、陇南和新疆一带,东北经辽宁、吉林延展到黑龙江南部,西南抵藏南和云贵高原。四川盆地、黄淮海、长江流域和东南沿海各省是我国甘薯的主产区
1.2 ADK基因
腺昔酸激酶(EC.2.7.4.3, adenylate kinase, ADK)催化ATP和AMP合成两分子ADP的可逆反应,是调控这三种前体分子在淀粉代谢库和核酸代谢库中分配的关键酶。IbADK全长1314bp,其编码区长度为855bp,编码长度为284个氨基酸残基的ADK蛋白(IbADK);生物信息学预测IbADK分子量为30.86kDa,等电点为6.46
1.3 反义载体
将目的基因与载体用相同限制性内切酶酶切后,将目的片段反向插入载体中,可以起到基因沉默的目了,构建过程主要是酶切,连接检测,最后测序确定。
1.4质粒(Plasmid)
是一种染色体外的稳定遗传因子,大小从1-200kb不等,为双链、闭环的DNA分子,并以超螺旋状态存在于宿主细胞中。质粒主要存在于细菌、放线菌和真菌细胞中,他具有自主复制和转录能力,能在子代细胞中保持恒定的拷贝数,并表达所携带的遗传信息。
1.5 转化(Transformation)
是将外源DNA分子引入受体细胞,使之获得新的遗传性状的一种手段,它是微生物遗传、分子遗传、基因工程等研究领域的基本实验技术。
2.材料与方法
2.1材料
2.1.1大肠杆菌 :含PHB载体质粒的大肠杆菌;含PMD-T-aIbADK质粒的大肠杆菌;大肠杆菌DH5α菌株。
2.1.2仪器
PCR扩增仪,PCR用薄壁管,电泳仪,恒温水浴锅,THZ-C水平摇床1台,冷冻离心机1台,涡旋仪1台,超净工作台1台,移液枪 1套,锥形瓶若干,培养皿2套,室内使用的大中型枪头各2盒,浮标1个,室内使用的1.5mL的EP管若干,涂棒1根,凝胶成像系统1台,恒温培养箱1台,一次性PE手套,计时器1个,药勺若干。
2.1.3试剂
氨苄青霉素,AP/Amp:溶于无菌水,0.22μm滤膜过滤。
卡那霉素,km/Kan:溶于无菌水,0.22μm滤膜过滤。
TIANGEN质粒小提试剂盒(离心柱型);BamHΙ、XbalΙ(Fermentas公司);
甘薯ADK基因反义表达载体构建
ddH2O;TIANGEN普通琼脂糖凝胶DNA回收试剂盒(离心柱型);DNAligation连接试剂盒;CaCl21瓶;常规PCR试剂1套;上游引物FaADK;下游引物RaADK;TBE缓冲液;回收级琼脂糖;溴化乙锭; Taq DNA聚合酶;10×PCR buffer;MgCl2;dNTP;marker(DL2000、λDNA/HindⅢ各1支)。
2.1.4培养基
LB液体培养基:蛋白胨10g/L,酵母提取物5g/L,NaCl 10g/L,pH7.0,灭菌后4℃保存。
LB琼脂平板(400ml、800ml):蛋白胨10g/L,酵母提取物5g/L,NaCl 10g/L,琼脂15g/L,pH7.0,灭菌后冷至60℃左右铺平板,视具体需要加相应抗生素做成Amp(50mg/L)或Kan(50mg/L)等平板。
2.2方法
2.2.1 质粒DNA的提取、纯化、电泳检测及酶切
1.将含有PHB载体质粒的大肠杆菌和含有PMD-T-aIbADK质粒的大肠杆菌接种在加相应抗生素(Kan、Amp)的LB液体培养基中摇菌培养至合适浓度后,采用TIANGEN质粒小提试剂盒(离心柱型)抽提质粒(具体方法与步骤见试剂盒说明)。
2.抽提的质粒DNA用琼脂糖凝胶电泳检测、并拍照。
3.对提取的PHB载体质粒和PMD-T-aIbADK质粒进行BamHⅠ、XbalⅠ双酶切鉴定。37?C水浴过夜反应,结束后加入5?L的10×Loading Buffer停止反应,再进行琼脂糖凝胶电泳检测、照相。
2.2.2酶切片段的回收及与表达载体的连接反应
1.用TIANGEN普通琼脂糖凝胶DNA回收试剂盒(离心柱型)对酶切后目的基因片段aIbADK(小片段)和pHB载体骨架(大片段)进行切胶回收(操作步骤见试剂盒说明)。
2.将回收的目的基因片段aIbADK和pHB载体骨架进行连接。16?C过夜。
2.2.3大肠杆菌感受态细胞的制备
用CaCl2法制备大肠杆菌DH5?感受态细胞
2.2.4重组质粒的转化、筛选及PCR检测鉴定
1.将制备好的感受态细胞与已纯化的质粒DNA及5-10μlDNA连接物混匀,冰上放置30min后,42?C水浴热激90sec,迅速取出立即放于冰上2min,室温再放置3-5min。
2.加入LB液体培养基培养至菌复苏,离心去800μl上清,剩余菌液每100μl涂布于加相应抗生素的LB固体培养基,7?C倒置培养。
3. 以挑取的单菌落菌液为模板,用反义引物:FaADK,RaADK进行PCR扩增目的基因。反应完成后,将PCR产物用1%琼脂糖凝胶电泳进行检测,并拍照。
甘薯ADK基因反义表达载体构建
2.2.5反义表达载体的酶切鉴定
1.工程菌活化。
2..采用TIANGEN质粒小提试剂盒(离心柱型)抽提表达载体质粒(PHB-aIbADK)。
3..进行BamHⅠ、XbalⅠ双酶切,琼脂糖凝胶电泳检测,并拍照。
3.实验结果与分析
3.1质粒DNA的提取
1 2 3 M2 M1 4 5 6
图3.1 抽提的质粒DNA电泳图
M1: DNA分子量标准DL2000(TaKaRa),从上到下大小分别为2000 bp,1000 bp,750 bp,500 bp,250 bp,100 bp
M2: DNA分子量标准λHindIII (TaKaRa),从上到下大小分别为23130 bp,9416 bp,6557 bp,4361 bp,2322 bp,2027 bp,564 bp,125 bp
泳道1、2、3:pHB质粒
泳道4、5、6:PMD-T-aIbADK质粒
分析:
(1).我们小组的条带为第1与第4条带,从图中可以看出条带明显,亮度高,说明提取的DNA含量高。
(2).我们组能得到明显亮带,证明我们在提取的过程中菌量适宜,操作规范,反应条件控制得当。
3.2双酶切鉴定
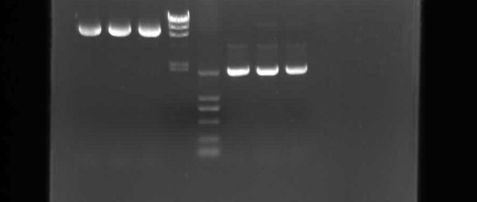
甘薯ADK基因反义表达载体构建
1 2 3 M1 M2 4 5 6
图3.2 PHB载体质粒和PMD-T-aIbADK质粒
进行BamHⅠ、XbalⅠ双酶切后电泳图
M1: DNA分子量标准DL2000(TaKaRa)
M2: DNA分子量标准λHindIII (TaKaRa)
泳道1、2、3:pHB被BamHI+XbaI完全双酶切的电泳结果
泳道4、5、6:pMD-T-aIbADK被BamHI+XbaI完全双酶切的电泳结果
分析:
(1)图中第1与第4条带使我们组的实验结果,从图中可以看出我们小组的目的条带大多呈现较粗且明亮,分布适当均处于预算位置附近,证明酶切效果明显,操作无误。
(2)图中其他模糊的条带可能是由于电泳时间不足造成的。
3.3连接转化后的大肠杆菌平板
图3.3 长有转化子的平板
分析:从图中可以看出两个平板上都长有菌落,但菌落数较小但较小,分布均匀,说明可能大部分ADK基因均与质粒连接,或者是带有目的基因的质粒没有成功导入大肠杆菌,所以在加有抗生素的LB

平板上具有抗性基因的大肠杆菌比较少、
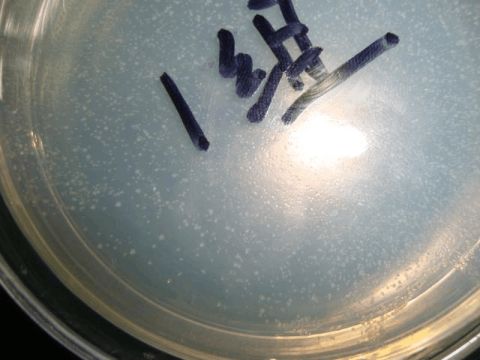
甘薯ADK基因反义表达载体构建
菌落较小也可能是培养的时间不够,大肠杆菌菌落还没有长出来
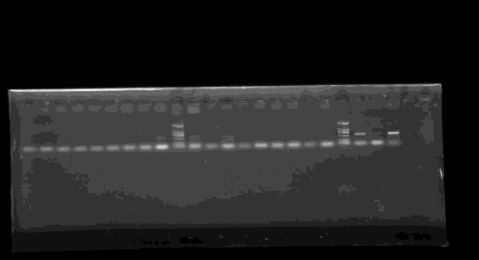
3.4 PCR产物电泳检测结果
分析:在此步骤中,从图中可以看出,一,二,三班均有菌转化成功,但是一班,二班条带过于模糊不清晰。
由电泳图可见电泳后本应出现两个条带,但只有一部分有两个电泳条带出现,切其中一个条带相比于其他小组尤其是最后一个小组来说较为模糊。
分析:为什么条带不是很亮的原因:加试剂时有误差;PCR只循环了31次,通常为33次;取菌量可能较少。
目的片段对应marker区段有误的原因:引物问题,扩增了编码区内的小片段,但是对实验结果没有影响。
3.5 反义表达载体的酶切鉴定
由3.4结果可知,我们小组的PCR产物较少,故换用3班4组1号菌株进行反义表达载体的酶切鉴定,结果如下图所示:
1 2 3 4 M2 M1 5 6 7 8
pHB
问题片段

aIb
ADK
图3.5 反义表达载体pHB-aIbADK双酶切鉴定
M1: DNA分子量标准DL2000(TaKaRa)
M2: DNA分子量标准λHin
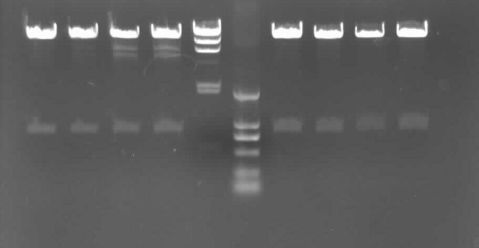
dIII (TaKaRa)

甘薯ADK基因反义表达载体构建
泳道1-4(1班)、5-7(2班)、8(3班):pHB-aIbADK被BamHI+XbaI完全双酶切的电泳结果。
分析:此图中1~4泳道的为三班一号菌种,是09一班实验结果。5~8泳道为三班2号菌种,是09二三班实验结果。可明显看到条带,但是第3,4泳道在PHB目的基因下方还有条带,这是不正常的,应该只出现PHB和ADK条带,如同5~8泳道一样。
结果分析:第3、4条带出现模糊片段
可能原因:1、所使用的1号菌可能有污染
2、酶切过程中可能有污染
3、质粒提取时,加入P3后离心,沉淀均附着在EP管壁上,于是进行了2次离心,离心前震荡EP管动作过大,可能混有基因组DNA片段或质粒本身受到破坏
4.实验小结
本次基因工程实验历时近一周的时间,当然我们相信,我们也交出了一份满意的答卷。本次实验是我们小组四个成员的团结合作,相互协作,合理分工密共同完成的。整个实验的流程充分的体现了这一点。其次,这次实验给我们留下了深刻的印象,而这一点应该是和本次实验独特的特点密不可分的。这次实验最大的特点就是实验具备较强的连贯性,实验步骤一环扣一环,相互联系,统一为一个整体,少了任何一部,或者任何一步出现错误,都得重新再来。这充分体现了本次实验的最大的特点:操作严密,具有较强的技术性。实验中,一旦忽略了某一技术环节中的细节,可有可能会造成实验的失败。所以,细心是实验的关键,操作规范是实验的原则。
本次试验不走较多较为复杂,从常用试剂及培养基的制备 、质粒DNA的提取、纯化、电泳检测及酶切 、酶切片段的回收及与表达载体的连接反应 、大肠杆菌DH5?感受态细胞的制备、重组质粒的转化、筛选及PCR检测鉴定 到最后表达载体的酶切鉴定,在其中我深刻的体会到实验是一门操作性很强的科目,只有自己亲自动手操作了才能正真掌握其中的要点。总体来说,我们组的实验进行的很顺利,其中既有我们小组成员的密切配合,也离不开老师的悉心指导。简而言之,这个实验让我学到了,试验是一个精细活,做实验不仅要求你要具有清晰地逻辑思维,还要要考虑到很多细节,遵循实验的严谨性和科学性。
第二篇:西北农林科技大学生命学院大三上基因工程实验报告


小麦 GAPDH 截短体的重组与表达
(一) 实验思路:
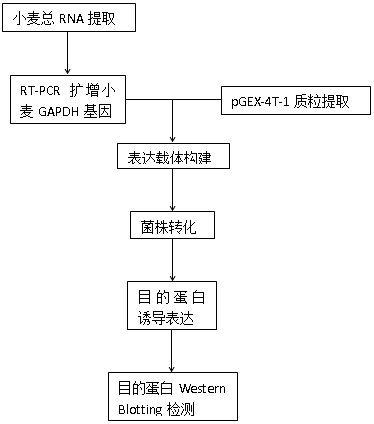
(二) 实验及仪器:
高速冷冻离心机、低温冰箱、液氮罐、研钵、剪刀、镊子、PCR扩增仪、台式离心、恒温水浴锅、微量移液器、培养皿、带帽试管、涂布器、无菌操作台(含酒精灯、接种环、灭菌牙签等)、恒温摇床、1.4ml EP 管、培养皿、电转印、摇床、紫外灯、恒温水浴箱、电泳仪系统、凝胶成像系统等
(三) 实验步骤:
1. 小麦总 RNA 提取(Trizol 法)
1.1 材料:小麦幼苗
1.2 试剂配制及器具处理
① 0.1%的 DEPC H2O(DEPC:焦碳酸二乙酯)
② 器具处理:试剂瓶、量筒、研钵、大小枪头和 1.5ml 和 0.2ml 的 EP 管等用纱布刀、镊子和药匙等 160℃烘烤 6h 以上。
③ 无 RNA 酶灭菌水(DEPC H2O):用将高温烘烤的玻璃瓶 (180℃×2h)装蒸馏水,然后加入 0.1%的 DEPC(体积/体积),处理过夜后高压灭菌。
④ Trizol 试剂
⑤ 75%乙醇:用新打开的无水乙醇和 DEPC 处理过的水配制 75%乙醇(用高温灭菌器皿配制),然后装入高温烘烤的玻璃瓶中,存放于低温冰箱。
⑥ 氯仿(最好用新的)。
⑦ 异丙醇(最好用新的)。
1.3 操作步骤
1.3.1 Trizol 法提取总 RNA
① 先在研钵中加入液氮,再将小麦叶片剪成小段在液氮中磨成粉末,用液氮预冷的药匙取 50~100mg 组织粉末加入已盛有 1ml 的 Trizol 液的 EP 管中(注意研磨粉末总体积不能超过所用 Trizol 体积的 10%),充分混合均匀。
② 室温放置 5min,然后加入 200µL 的氯仿,盖紧 EP 管并剧烈摇荡 15 秒钟。
③ 12000rpm 离心 10min,取上层水相于一新的 EP 管中 (千万不要将中间的沉淀层和下层液混入,否则重新离心分离),加入 500µL 异丙醇,温和颠倒混匀。室温放置 10min,12000rpm 离心 10min。
④ 小心地弃去上清液,加入 1ml 的 75%乙醇,涡旋混匀,4℃下 12000rpm 离心 5min。
⑤ 重复步骤④。
⑥ 弃去上清液(尽量将残余液体除去),室温或真空干燥 5~10min (注意不要干燥过分,否则会降低 RNA 的溶解度)。用 30µL DEPC 处理过的水将 RNA 溶解,必要时可 55℃~60 ℃水浴10 min。RNA 可进行 mRNA 分离,或贮存于 70%乙醇并保存于-70℃。
[注意]
① 整个操作要带口罩及一次性手套,并尽可能在低温下操作。
② 加氯仿前的匀浆液可在-70℃保存一个月以上RNA 沉淀在70%,乙醇中可在 4℃保存一周,-20℃保存一年。
2. RT-PCR 扩增目的基因 cDNA
2.1 试剂
① RNA 模板
② Olig (dT)18
③ 反转录缓冲液
④ dNTP
⑤ M-MULV 反转录酶
⑥ RNA 抑制剂(RNasin)
⑦ Premix EX Taq DNA 聚合酶
⑧ PCR 特异引物
2.2 操作步骤
2.2.1 RNA 的反转录
采用 Thermo Scientific (Fermentas) RevertAid First Strand cDNA Synthesis Kit
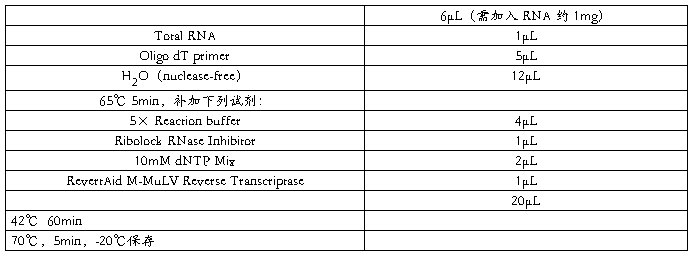
2.2.2 PCR 扩增目的基因
2.2.2.1 用表达引物扩增目的基因(25µL 体系)
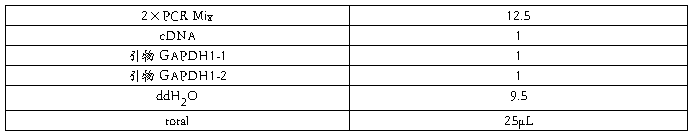
PCR程序:
95℃ 1min
 95℃ 10s
95℃ 10s
58℃ 20s 35cycles
72℃ 45s
72℃ 10min
16℃
PCR产物进行电泳并做胶回收
3. 核酸琼脂糖电泳分析
3.1 试剂
① TAE 缓冲液(50×):用时需稀释 50 倍
② 点样缓冲液 Loading buffer(10×):含 0.25%溴酚蓝和 40%甘油
③ 溴乙啶染色液(EB):10mg/ml 溴乙啶,注意 EB 具致癌作用。
④ 琼脂糖
3.2 操作步骤
3.2.1 琼脂糖凝胶的制备
称 1g 琼脂糖加入 100ml TAE 缓冲液中加热熔化。
3.2.2 胶板制备
将凝胶槽清洗干净,在一端插好梳子。然后倒入熔化好的琼脂糖,待凝胶完全凝固后,将凝胶槽移至电泳槽(槽中已加入 TAE 缓冲液),拔掉梳子。注意:缓冲液要高出胶面 2mm。
3.2.3 点样
每个样品中加入 1/10 体积 Loading buffer(10×),混匀后小心地加入点样孔中,要避免相互污染。
3.2.4 电泳
接通电源,80V 电压电泳 40min 左右,当溴酚蓝到达凝胶前沿约 2 ㎝处时停止电泳。
3.2.5 观察及照相
将凝胶取出,在 EB 溶液中浸泡 10min 后,用凝胶成像系统照相。
4. pGEX 4T-1质粒的提取
4.1 实验材料
含质粒的大肠杆菌
4.2 试剂
质粒提取试剂盒(天根生物科技)
4.3 操作步骤
4.3.1 培养细菌
将带有质粒的大肠杆菌接种于 LB 平板培养基上,37℃培养 24 h,然后从平板上挑取单菌落,接种于 5 mL 液体培养基中,37℃培养 12 h。
4.3.2 提取步骤
① 柱平衡步骤:向吸附柱 CP3 中(吸附柱放入收集管中)加入 500µL 的平衡液 BL, 12,000rpm(~13,400×g)离心 1min,倒掉收集管中的废液,将吸附柱重新放回收集管中。(请使用当天处理过的柱子)
② 取1-5 mL过夜培养的菌液,加入离心管中,使用常规台式离心,12,000rpm(~13,400 ×g)离心 1min,尽量吸除上清(菌液较多时可以通过多次离心将菌体沉淀收集到一个离心管中)。
③ 向留有菌体沉淀的离心管中加入 250µL 溶液 P1(请先检查是否已加入 RNaseA),使用移液器或涡旋振荡器彻底悬浮细菌沉淀。
④ 向离心管中加入 250µL 溶液 P2,温和地上下翻转 6-8 次使菌体充分裂解。
⑤ 向离心管中加入 350µL 溶液 P3,立即温和地上下翻转 6-8 次,充分混匀,此时将出 现白色絮状沉淀。12,000rpm(~13,400×g)离心 10min,此时在离心管底部形成沉淀。
⑥ 将上一步收集的上清液用移液器转移到吸附柱 CP3 中(吸附柱放入收集管中),注意尽量不要吸出沉淀。12,000rpm(~13,400×g)离心 30-60 sec,倒掉收集管中的废液,将
⑦ 吸附柱 CP3 放入收集管中。
⑧ 向吸附柱 CP3 中加入 600µL 漂洗液 PW(请先检查是否已加入无水乙醇),12,000rpm(~13,400×g)离心 30-60sec,倒掉收集管中的废液,将吸附柱 CP3 放入收集管中。
⑨ 重复操作步骤 7。
⑩ 将吸附柱 CP3 放入收集管中,12,000rpm(~13,400×g)离心 2min,目的是将吸附柱中残余的漂洗液去除。
? 将吸附柱 CP3 置于一个干净的离心管中,向吸附膜的中间部位滴加 50-100µL 洗脱缓冲液 EB,室温放置 2 min,12,000rpm(~13,400×g)离心 2min 将质粒溶液收集到离心管中。
4.3.3 琼脂糖凝胶电泳法检测提取的质粒DNA
5. 表达载体和目的片段的酶切
5.1 试剂
① BamHⅠ
② SalⅠ
③ BamHⅠ buffer
④ 质粒提取试剂盒
5.2 操作步骤
5.2.1 在 LB 液体培养基中接入带 pGEX 4T-1 质粒的菌种,在 37℃下 200rpm 摇菌过夜。参见实验 8 的方法提取质粒。
5.2.2 质粒 DNA 和目的片段的酶切
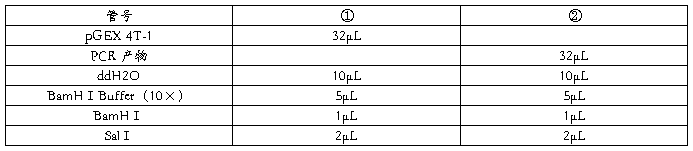
6. 载体和外源 DNA 的连接反应
6.1 试剂
① 目标 DNA 片段(PCR 扩增产物)
② 载体(pGEX 4T-1 酶切回收产物)
③ 10×ligation 缓冲液
④ T4 DNA 连接酶
⑤ ddH2O
6.2 操作步骤
取一个 200µL 的 EP 管依次加入下列试剂:
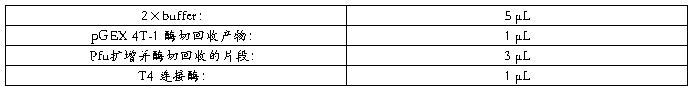
离心30Sec,使反应体系充分混合,16~22℃连接 3~4h。
7. 感受态细胞的制备及转化(氯化钙法)
7.1 实验材料
大肠杆菌 Top 10 或 BL21(DE3)PlysS
7.2 试剂
① LB 培养基(液体和固体培养基配置方法参见附录 2)
② 氨苄青霉素
7.3 操作步骤
7.3.1 感受态的制备
① 从 LB 平板上挑取单克隆于 5ml LB 培养基中,37℃ 200rpm 摇菌 12~16h。
② 将活化过的菌按 1~5%的体积比接种到新的 LB 液体培养基中,37℃ 200rpm 摇菌约 2h,OD 600 约为 0.4。
③ 取 1.5ml 摇好的菌液于一个1.5ml 的 EP 管中,4℃ 4000rpm 离心 3min,弃上清。
④ 加 250µL 0.1M 的 CaCl2(灭菌预冷)温和悬浮菌体,4℃ 6000rpm 离心 1min 弃上清。
⑤ 加 200µL 0.1M 的 CaCl2(灭菌预冷)温和悬浮菌体,即为感受态细胞。置于 4℃ 存放。12h 内使用效果最佳。
注意:无菌操作和保持低温。 培养物处于对数生长期是制备感受态细胞的关键。 如果要求高转化效率,不建议使用简单深冻保存的感受态细胞。
7.3.2 转化
① 将盛有感受态细胞的 EP 管放置于冰上 10min,加入 10µL 连接产物(若加质粒,则 只需加 1µL),温和混匀,冰浴 20~30min。
② 42℃热激 90S。冰浴 5~10min。
③ 加入 800µL LB 液体培养基,37℃培养 45~60min。4000rpm 离心 2min,弃去 800µL 上清液,剩余混匀用来涂板。
④ 取含有 50~100g/ml Amp 的 LB 平板培养基(若进行蓝白斑筛选,在培养皿上先涂布 4µL 200mg/ml 的 IPTG 和 40µL 20mm/ml 的 X-Gal),涂板。
⑤ 37℃倒置培养 16~20h。
8. 克隆的筛选和快速鉴定
8.1 试剂
① Taq DNA 聚合酶
② 10×buffer(含 MgCl2)
③ dNTP
④ Loading buffer
8.2 操作步骤
8.2.1 提取质粒测定
取一培养皿在底部标记,待转化的细菌菌落长直径到 2mm 时,用接种针(或用灭菌的牙签、小枪头)挑取单克隆菌落,划在培养皿上作好标记的方格内;同时在对应编号的培养管中接种,培养管中含5ml LB 液体培养基。
培养皿 37℃培养 6h 后 4℃保存。培养管 37℃振荡培养 12h 左右。用培养管中的菌液提取质粒。酶切电泳检查质粒或进行质粒 PCR 鉴定。
8.2.2 菌落 PCR 鉴定法
直接用接种针或牙签挑取少许菌体加入 20的 PCR 反应体系中。
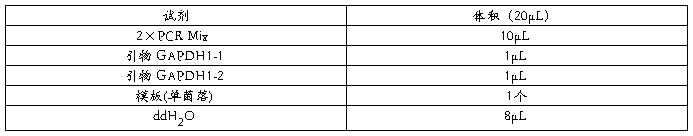
PCR程序:
94℃ 3min
 94℃ 30s
94℃ 30s
58℃ 30s 30 cycles
72℃ 45s
72℃ 10min
电泳检测 PCR 产物,挑选对应的阳性克隆菌落。
9. 目的基因诱导表达
① 分别挑取对照菌和重组菌菌落,接入 5ml 含 Amp(100g/ml)的 LB 培养液,37℃振荡培养过夜。
② 分别取 500µL 过夜培养物接入 5ml 含 Amp(100g/ml)的 LB 培养液,37℃振荡培养 2h 左右,至对数中期(OD 600=0.5~0.6)。
③ 向诱导管中加入 IPTG 使其浓度达到 0.6mmol/L,25℃振荡培养过夜,收菌取样进行蛋白电泳检测。
10. Western Blotting
10.1 试剂
10.1.1 细菌培养和诱导表达
① LB 液体培养基
② IPTG
③ Amp
10.1.2 电泳试剂
① 30%丙烯酰胺溶液:丙烯酰胺 29.0g,甲叉双丙烯酰胺 1.0g,加水至 100ml,棕色瓶 4℃保存。
② 1.5 mol/L Tris-HCl 分离胶缓冲液 pH8.8(4×):取18.15g Tris,用1 mol /L HCl 调pH至 8.8,加水至 100ml,4℃保存。
③ 0.5 mol /L Tris-HCl 浓缩胶缓冲液,pH6.8(8×):取 11.96g Tris,用1 mol /L HCl 调至pH 6.8,加水至 100ml,4℃保存。
④ 电极缓冲液(pH8.3):取 14.49g 甘氨酸,3.02g Tris,加 100ml 10%SDS,加水至 1 升,4℃保存。
⑤ 10% SDS:取 10g SDS 加水至 100ml,完全溶解后室温保存。
⑥ 10%过硫酸铵溶液(AP):临用前现配。
⑦ 染色液(0.25%考马斯亮蓝 R-250、50%甲醇、7%乙酸):考马斯亮蓝 R-250 2.5g、甲醇(可用无水乙醇代替)500ml、70ml 冰乙酸,溶解后补足水至总体积 1000ml。
⑧ 脱色液(30%甲醇、7%乙酸):甲醇(可用无水乙醇代替)300ml,冰乙酸 70ml,补足水至 1000ml。
⑨ 样品缓冲液(2×):H 2O 2.4ml,浓缩胶缓冲液 1.0ml、甘油 0.8ml、10% SDS 3.2ml,beta -巯基乙醇 0.4ml,0.025%(W/V)溴酚兰 0.2ml。
⑩ TEMED(四甲基乙二胺)
10.1.3 转移和杂交试剂
① 转移缓冲液:3.03g Tris、14.4g 的 Glycine、200ml 甲醇、定容到 1L。
② TBS:0.1M 的 Tris、0.9%的 NaCl、pH 7.5
③ TTBS:TBS 中含 0.1%的 Tween-20
④ 预染的蛋白 marker
⑤ 硝酸纤维素膜
⑥ 脱脂奶粉
⑦ anti-GST 单克隆抗体
⑧ goat-anti-mouse-IgG-HRP(HRP,horseradish peroxidase,辣根过氧化物酶)
⑨ 3,3'diaminobenzidine(DAB,二氨基联苯胺)
⑩ DAB 增强剂
10.2 电泳
① 准备步骤
将凝胶板水洗涤干净,然后使其自然风干或烘干。梳子临用前用无水乙醇擦拭,让其挥发至干。安装玻璃板、板条,并将玻璃板固定在灌胶架上。 按下表配制适合浓度的分离胶,摇匀后迅速在两玻璃板间隙中灌注分离胶,小心在胶上覆盖一层 25%的乙醇。
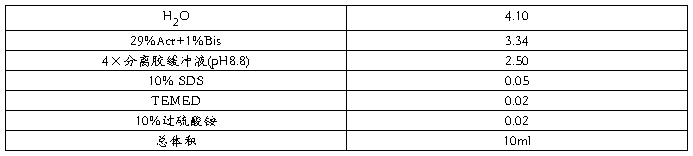
在分离胶聚合的过程(约 30min)中,按下表配制 5%的浓缩胶,注意 TEMED 应在灌胶前才加入。
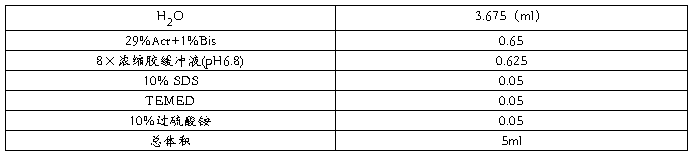
分离胶聚合完全后,倒去乙醇,用滤纸吸干胶面上的残余水。
灌注浓缩胶,立即插入干净的梳子,避免产生气泡。
浓缩胶聚合完全后,小心拔出梳子,用移液器吸取电极缓冲液清洗加样孔数次,以除去未聚合的丙烯酰胺。将胶板固定于电泳槽上,上下槽各加入电极缓冲液。
② 上样
1)将实验 10 获得的细胞裂解液按 1:1 比例加入 2×SDS 上样缓冲液混合,100℃沸水浴10min。10000rpm 离心 1min,置冰上用上清液来点样电泳。
2)用微量进样器加样,每个点样孔中加入 20µL 样品,同时点蛋白 marker。每次应洗涤加样器,最后在空白加样孔中加入等体积的 SDS 样品溶解液。
③ 电泳
装好冷凝水系统,打开电源,电压为 100V,电泳直至染料到达离凝胶底部 1cm 处。
④ 染色
从电泳装置上卸下胶板,小心撬开玻璃板取出凝胶,将胶板放入考马斯亮蓝 R250染色液中染色 2h 以上。
⑤ 脱色
移出凝胶放入脱色液中脱色至本底无色为止。根据电泳结果分析诱导菌株有无表达目的基因。
10.3 杂交
① 将电泳后的胶板取出,裁取和胶等大的硝酸纤维素膜,按照:海绵-滤纸-胶-硝酸纤维素膜-滤纸-海绵的顺序装入电转印槽中,注意硝酸纤维素膜一定要朝向正极一侧。
② 加入转膜缓冲液,放在冰水浴中 60V 电压(150mA)转印 2h。(整个过程应带手套操作)
③ 取出硝酸纤维素膜用 TBS 冲洗一次。室温下,在脱色摇床上用含 10%脱脂奶粉的 TBS封闭硝酸纤维素膜 1h。倒掉封闭液,用 TTBS(含 0.1%的吐温-20)洗膜 10min。
④ 取 1µL anti-GST 单克隆抗体(一抗),稀释在 500µL 含少量脱脂奶粉(2%的奶粉)的TTBS(含吐温-20,0.05%)中,将稀释的一抗均匀点在一干净的塑料膜(长和宽大约分别是膜的 2.5 倍和 1.5 倍)上,要求点一抗的面积同硝酸纤维素膜等大。小心地将硝酸纤维素膜有蛋白一侧铺在一抗上,注意排除气泡,同时保持湿度。25℃放置 2h(或 4℃过夜)。
⑤ 用 TBS 洗膜 2 次,用 TTBS(含吐温-20,0.05%)洗 1 次,每次需持续约 10min。
⑥ 取 1µL goat-anti-mouse-IgG-HRP(二抗),稀释在 500µL 含 2%的奶粉的 TTBS(含吐温-20,0.05%)中,同样,将稀释的二抗均匀点在一干净的塑料膜上。小心地将硝酸纤维素膜有蛋白一侧铺在二抗上,注意排除气泡,同时保持湿度。25℃放置 1h。
⑦ TTBS(含吐温-20,0.05%)洗膜 4~5 次,每次 5min,将硝酸纤维素膜装入杂交袋中。
⑧ 在 EP 管中按 1ml BAD 增强剂兑 50µL DAB 配制显色液,配好的显色液避光保存,30min内有效。
⑨ 在杂交袋中加入显色液,室温下显色 2~30min,当有清晰的棕褐色条带出现时,用水冲洗硝酸纤维素膜终止反应,观察并分析结果,干燥保存。
(四) 实验结果:
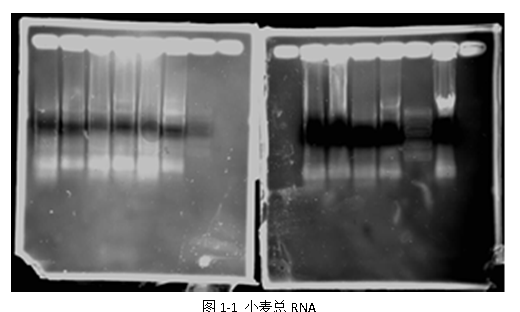
1) 小麦总RNA提取及电泳分析
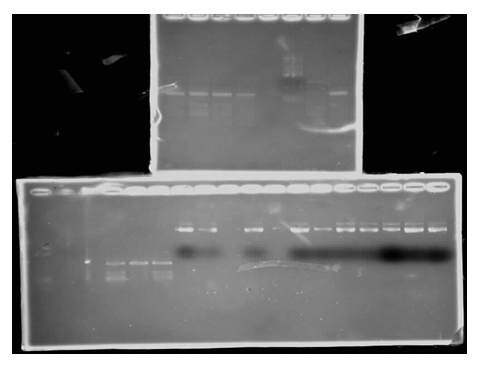
2) pGEX 4T-1质粒的提取及RT-PCR的cDNA的电泳检测
3) 表达载体及目的基因酶切
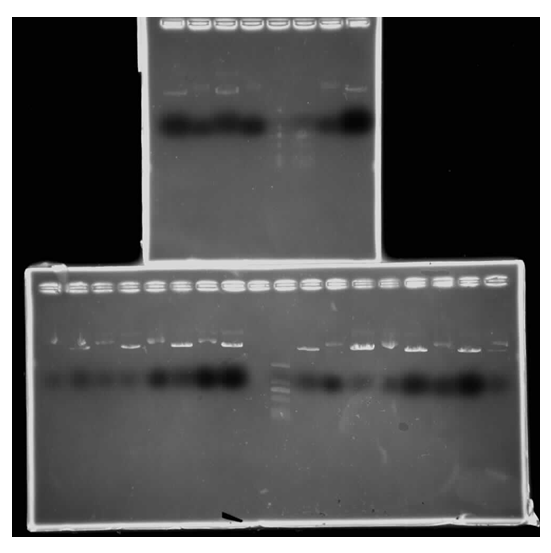
4) 克隆筛选及快速检测

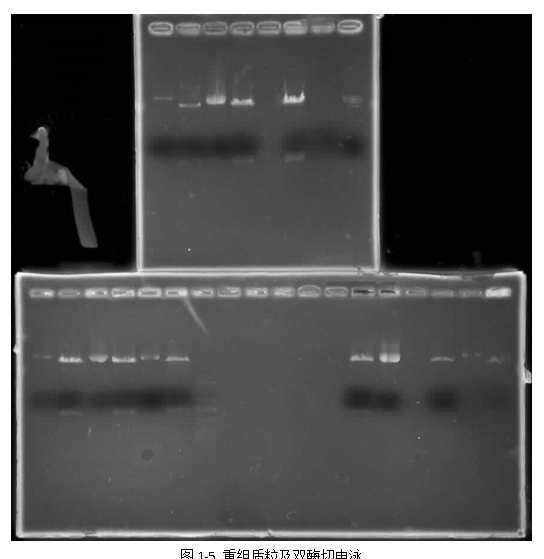
5) 质粒DNA双酶切及胶回收
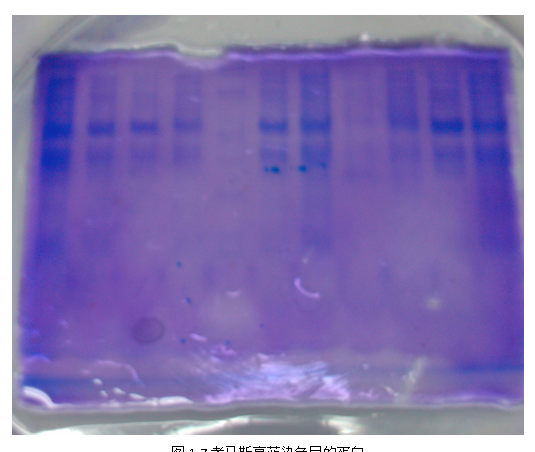
6) Western Blotting
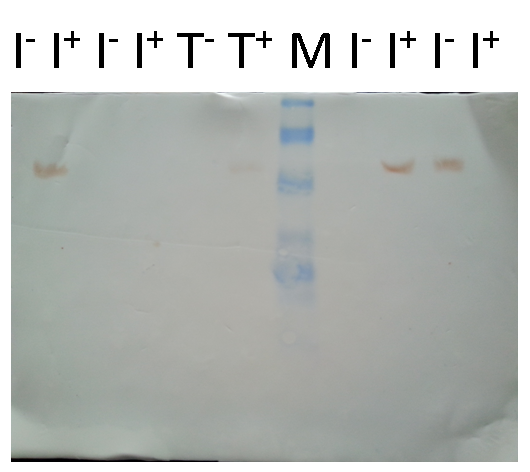
图注:
I-:对照组
I+:实验组(IPTG诱导)
T-:Top10对照组(不加入IPTG)
T+:实验组(加入IPTG)
M: marker
(五) 实验数据:
1) 如图1-1所示,RNA提取并不是非常成功,基本出现了各沉降级的代表RNA,电泳条带最下端为18s RNA,各泳道RNA均出现降解,图中泳道的黑块为过量的loading buffer,Marker 泳道也不清晰,因此泳道弥散不能排除电泳自身的问题。同时,RNA的质量不高,其泳道存在为RNA降解的弥散,以及存在杂质造成的拖尾。
2) 如图1-2所示,pGEX 4T-1的提取较为成功,RT-PCR亦转录出相应的目的基因。小块胶及大块胶左数6个泳道上均为反转录的目的基因,存在几个对照组没有成功转录的情况,剩余大胶上的泳道为未连接目的基因的质粒,同样存在不成功的对照组实验,质粒提取的条带亮度清晰,说明质粒提取的丰度较高。
3) 如图1-3所示,小胶中,目的基因片段酶切为一个条带,大胶中质粒酶切呈现出两个条带,未切割的对照组质粒条带亮度高,切割后的质粒泳道中,靠胶孔近的为切割后的质粒条带,条带亮度较被切割出来的小片段高,在质粒切割组的泳道最远端,为切割产生的DNA小片段。
4) 如图1-4所示,电泳图中可清晰看见重组质粒的电泳条带。(实验操作人员因不慎将胶块打碎,对检测无较大影响)
5) 如图1-5重组质粒双酶切电泳图显示,质粒成功导入感受态细胞且携带目的基因片段,图中实验泳道质粒经双酶切后产生一亮一暗两个条带,其中较暗条带为质粒切割出来的DNA小分子片段,较亮条带为切割后剩余质粒分子,其较旁边的对照组质粒迁移速度快,距点样孔更远。
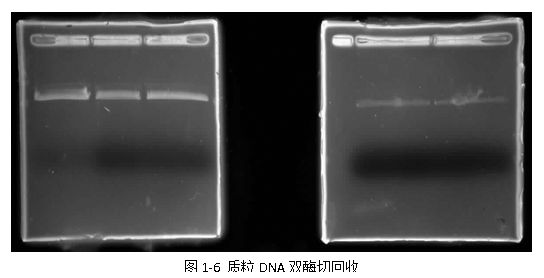
6) 图1-6为质粒双酶切后的DNA胶回收效果好,条带命令,未发现有降解和污染。
7) 图1-7、1-8均为对目的蛋白的检测,I-,I+均出现目的蛋白条带,marker条带模糊。
(六) 实验分析
实验并不符合预期结果,全班仅有我组诱导表达出目的蛋白,但同时未受诱导I-的同样也表达出了目的蛋白。有分析为lac操纵子的泄漏表达,但是介于I-、I+的蛋白条带亮度一样,其原因是实验操作人员,将点样顺序颠倒。
实验各阶段效果亦不佳,出RNA现条带弥散,个别对照组无实验结果现象,均为实验操作不当所致。最后一步考马斯亮蓝染色表达蛋白,第一次染色未能成功,为染色时间不足所致,最后进行再次染色,获得蛋白条带。各实验中效果最好要数质粒双酶切胶回收,其条带清晰,丰度高。
我组最后取得了目的蛋白,是非常幸运的,实验还是要踏踏实实地做。
