实验七 铅、铋混合溶液中铅、铋含量的连续测定
一、实验日期: 年 月 日
二、实验目的:
三、基本原理:
四、实验步骤:
14
五、实验数据及结果计算:
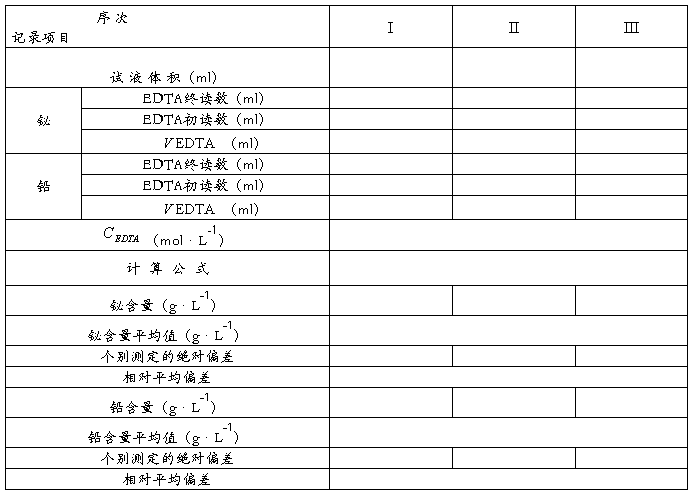
六、讨论:
15
实验十 高锰酸钾标准溶液的配制和标定
一、实验日期: 年 月 日
二、实验目的
三、基本原理
四、实验步骤
22
五、实验数据及结果计算
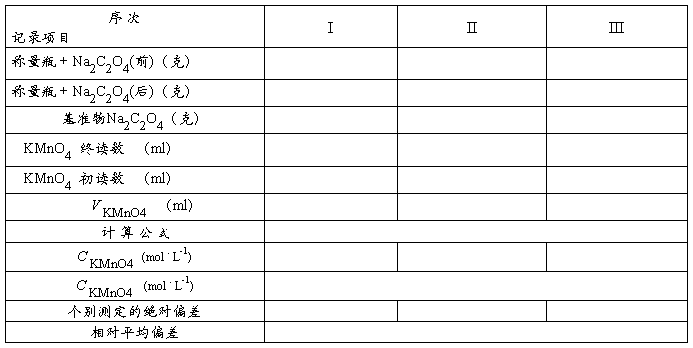
六、讨论
23
附:
高锰酸钾标准溶液的配制和标定
一 目的
1.了解高锰酸钾标准溶液的配制方法和保存方法。
2.掌握用 Na2C2O4 作基准物标定高锰酸钾溶液浓度的原理、方法及滴定条件。
二 原理
市售的高锰酸钾常含有少量杂质,如硫酸盐、氯化物及硝酸盐等,因此不能用准确称量的高锰酸钾来直接配制准确浓度的标准溶液。KMnO4 氧化力强,还易和水中的有机物、空气中的尘埃及氨等还原性物质作用;KMnO4 能自行分解,其分解反应如下:
4KMnO4 +2H2O = 4MnO2↓ + 4KOH+3O2↑
分解速度随溶液的pH值而改变。在中性溶液中,分解很慢,但Mn2+ 离子和MnO2 能加速KMnO4的分解,见光则分解得更快。由此可见,KMnO4 溶液的浓度容易改变,必须正确地配制和保存。正确配制和保存的KMnO4 溶液应呈中性,不含MnO2,这样,浓度就比较稳定,放置数月后浓度大约降低0.5%。但是如果长期使用,仍应定期标定。
KMnO4 标准溶液常用还原剂草酸钠Na2C2O4作其基准物来标定。Na2C2O4不含结晶水,容易精制。用Na2C2O4标定
24
KMnO4 溶液的反应如下:
2MnO4- + 5H2C2O4+6H+ = 2Mn2++10CO2↑+8H2O
滴定时可以用MnO4-离子本身的颜色指示滴定终点。
三、试剂
KMnO4(固),Na2C2O4(A.R.或基准试剂),1moL/L H2SO4溶液。
四、步骤
1. 0.02moL/L KMnO4溶液的配制:称取计算量的KMnO4溶于适当量的水中,加热煮沸 20—30min(随时加水以补充因蒸发而损失的水)。冷却后在暗处放置7—10d(天),然后用玻璃砂芯漏斗或玻璃纤维过滤除去MnO2等杂质。滤液贮于洁净的玻塞棕色瓶中,放置暗处保存。如果溶液经煮沸并在水浴上保温1h,冷却后过滤,则不必长期放置,就可以标定其浓度。
2. KMnO4溶液浓度的标定:准确称取计算量(称准至0.0002g)的烘过的Na2C2O4基准物于250mL锥形瓶中,加水约10mL使之溶解,再加30mL 1moL/L 的H2SO4溶液并加热至75—85ºC,立即用待标定的KMnO4溶液滴定(不能沿瓶壁滴入)至呈粉红色经30s不褪即为终点。
重复滴定2—3次。根据滴定所消耗的KMnO4溶液体积和基准物的质量,计算KMnO4溶液的浓度。
25
实验十一 石灰石中钙含量的测定
一、实验日期: 年 月 日
二、实验目的:
三、基本原理:
四、实验步骤:
26
五、实验数据及结果计算:

六、讨论:
27
附:
石灰石中钙的测定
一、 目的
1. 学习沉淀分离的基本知识和操作(沉淀、过滤及洗涤等)。
2. 了解用高锰酸钾法测定石灰石中钙含量的原理和方法尤其是结晶草酸钙沉淀和分离条件及洗涤CaC2O4沉淀的方法。
二、 原理
石灰石中的主要成分是CaCO3,较好的石灰石含约45—53%,此外还含有SiO2、Fe2O3、Al2O3及MgO等杂质。
测定钙的方法很多,快速的方法是络合滴定法,较精确的方法是本实验采用的高锰酸钾法。后一种方法是将Ca2+离子沉淀为CaC2O4,将沉淀滤出并洗净后,溶于稀H2SO4溶液,再用KMnO4标准溶液滴定与Ca2+离子相当的C2O42-离子,根据所用KMnO4的体积和浓度计算试样中钙或氧化钙的含量。主要反应如下:
Ca2++ C2O42-= CaC2O4↓
CaC2O4+H2SO4 = CaSO4+H2C2O4
5H2C2O4+2MnO4- + 6H+ = 2Mn2++10CO2↑+8H2O
此法用于含Mg2+离子及碱金属的试样时,其他金属阳
28
离子不应存在,这是由于它们与C2O42- 离子容易生成沉淀或共沉淀而形成正误差。
当[Na+]>[Ca2+]时,Na2C2O4共沉淀形成正误差。若Mg2+离子存在,往往产生后沉淀。如果溶液中含Ca2+离子Mg2+离子量相近,也产生共沉淀。如果过量的C2O42- 离子浓度足够大,则形成可溶性草酸镁络合物[Mg(C2O4)2]2-;若在沉淀完毕后即进行过滤,则此干扰可减少。当[Mg2+]>[Ca2+]时,共沉淀影响很严重,需要进行再沉淀。
按照经典方法,需要碱性溶剂熔融分解试样,形成溶液,分离除去SiO2和Fe3+、Al3+离子,然后测定钙。但是其手续太烦。若试样中含酸不溶物较少,可以用酸溶样,Fe3+、Al3+离子可用柠檬酸铵掩蔽,不必沉淀分离,这样就可以简化步骤。
CaC2O4是弱酸盐沉淀,其溶解度随溶液酸度增大而增加,在pH≈4时,CaC2O4的溶解损失可以忽略。一般采用在酸性溶液中加入(NH4)2C2O4,再滴加氨水逐渐中和溶液中H+离子,使[C2O42-]缓缓增大,CaC2O4沉淀缓慢形成,最后控制溶液pH值在3.5—4.5。这样,既可使CaC2O4沉淀完全,又不致生成Ca(OH)2或Ca(OH)2C2O4沉淀,能获得组成一定、颗粒粗大而纯净的CaC2O4沉淀。
其他矿石中的钙,液可用本法测定。
29
三、 器和试剂
6moL/L HCl 溶液,1moL/L H2SO4 溶液,2moL/L HNO3溶液(滴瓶装),0.1%甲基橙,3moL/L 氨水(滴瓶装),10%柠檬酸铵,0.25moL/L (NH4)2C2O4溶液,0.1% (NH4)2C2O4溶液,0.1moL/L AgNO3 溶液(滴瓶装),0.02moL/L KMnO4标准溶液。
玻璃砂芯漏斗(4号,25—30mL)。
四、 步骤
准确称取石灰石试样0.5—1g,置于250mL烧杯中,滴加少量水使试样湿润,盖上表皿,缓缓滴加6moL/L HCl 溶液10mL,同样不断摇动烧杯。待停止发泡后,小心加热煮沸2min,冷却后,仔细将全部物质转入250mL容量瓶中,加水至刻度,摇匀,静置使其中酸不溶物沉降(也可以称取0.1—0.2g试样,用6moL/L HCl 溶液7—8mL溶解,得到的溶液不再加HCl 溶液,直接按下述条件沉淀CaC2O4)。
准确吸取50mL清液(必要时将溶液用干滤纸过滤到干烧杯中后再吸取)2份,分别放入400mL烧杯中,加入5mL10%柠檬酸铵溶液和120mL水,加入甲基橙2滴,加6moL/L HCl溶
液5—10mL 至溶液显红色,加入15—20mL0.25moL/L (NH4)2C2O4溶液,(若此时又沉淀生成,应在搅拌下滴加
30
6moL/L HCl溶液至沉淀溶解,注意勿加多。)加热至70—80ºC,在不断搅拌下以每秒1—2滴的速度滴加3moL/L 氨水至溶液由红色变为橙黄色,继续保温约30min并随时搅拌,放置冷却。
用中速滤纸(或玻璃砂芯漏斗)以倾泻法过滤。用冷的0.1% (NH4)2C2O4溶液用倾泻法将沉淀滤出3—4次,再用冷水洗涤至洗液不含Cl-离子为止。
将带有沉淀的滤纸贴在原贮沉淀的烧杯壁上(沉淀向杯内)。用50mL1moL/L H2SO4 溶液仔细将滤纸上沉淀洗入烧杯,用水稀释至100mL,加热至75—85ºC,用0.02moL/L KMnO4标准溶液滴定至溶液呈粉红色。然后将滤纸浸入溶液中,用玻璃棒搅拌,若溶液褪色,再滴入KMnO4溶液,直至粉红色经30s不褪即达终点。
根据KMnO4用量和试样质量计算试样含钙(或CaO)百分率。
31
实验十二 邻二氮杂菲分光光度法测定铁
一、实验日期: 年 月 日
二、实验目的:
三、基本原理:
四、实验步骤:
32
五、实验数据及结果计算:
记录数据

数据处理
六、讨论:
33
第二篇:分析化学仪器实验报告
实验报告
学号:51130606120 专业:分析化学 姓名:朱琳嶺 我们小组介绍了TEM透射电子显微镜,荧光显微镜,气相色谱仪,电化学工作站(循环伏安法),差热分析仪,差热扫描量热仪,流式细胞仪,高效液相色谱仪。
一.气相色谱仪
仪器原理:气相色谱仪的流动相为气体,它测定的是气体或液体样品,对于液体样品,它通过加热使其气化,然后通过载气将样品送入色谱柱,色谱柱中为固定相,由于样品中各组分在固定相和流动相有不同的分配系数而在两相中做相对运动,经过反复多次的吸附-解吸的分配过程,各组分在移动速度上产生较大的差别,被分离成单个组分依次从柱内流出,通过检测器时,样品浓度被转换成电信号,从而实现分离检测。
使用方法:
①安装色谱柱:打开色谱仪柱箱,安装色谱柱,适当旋紧两端固定螺丝,保证不漏气。
②通气:按气相色谱仪各种气体压力的要求接入气体:载气普通氮气 N2 0.5 MPa,燃气H2 0.3 MPa,空气0.3 MPa。
③点火:打开GC主机电源开关,设置柱箱温度(70℃),进样器温度(300℃),检测器温度(300℃),待信号1为0.0时点火。 ④建立方法文件:打开计算机电源,打开信号灯,启动工作站,建立新的文件名,设定采样参数,调零。
⑤样品测定:记录数据
⑥关机:调低柱箱温度(20℃),进样器温度(80℃以下),检测器温度(80℃以下)。达到设定温度后,顺序关闭空气,GC主机电源,氢气,氮气,计算机总电源开关。
使用中注意事项:
①进样应注意问题:手不要拿注射器的针头和有样品部位、不要有气泡,吸样时要慢、快速排出再慢吸,反复几次,进样速度要快(但不易特快),每次进样保持相同速度,针尖到汽化室中部开始注射样品。 ②安装色谱柱注意问题:
1. 安装拆卸色谱柱必须在常温下。
2. 填充柱有卡套密封和垫片密封,卡套分三种,金属卡套,塑料卡套,石墨卡套,安装时不易拧的太紧。垫片式密封每次安装色谱柱都要换新的垫片(岛津色谱是垫片密封)。
3. 色谱柱两头是否用玻璃棉塞好。防止玻璃棉和填料被载气吹到检测器中。
4. 毛细管色谱柱安装插入的长度要根据仪器的说明书而定,不同的色谱汽化室结构不同,所以插进的长度也不同。需要说明的如果你用毛细管色谱柱采用不分流,汽化室采用填充柱接口这时与汽化室连接毛细管柱不能探进太多,略超出卡套即可。
在本专业中的应用:
①用于分离气体或液体混合物。
②根据保留时间等数据定性分析气体或液体混合物组分
③根据谱图定量分析气体或液体混合物中的各组分的含量。 ④可与其它分析仪器联用来达到检测目的。
二.差热分析仪
仪器原理:差热分析法是在程序控温下,测量物质与参比物之间温度差随温度或时间变化的一种技术。在温度程序控制下,试样在加热(冷却)过程中,凡有物理变化或化学变化发生时,就有吸热(或放热)效应发生,若以在实验温度范围内不发生物理变化和化学变化的惰性物质作参比物,试样和参比物之间就出现温度差,温度差随温度变化的曲线称差热曲线或 DTA曲线。差热分析是研究物质在加热(或冷却)过程中发生各种物理变化和化学变化的重要手段。 使用方法:
①开启水源,使水流畅通,水流量不要太大,呈流状即可。
②打开各单元电源,预热20分钟。计算机电源需后开先关,即在其它部件电源打开后再打开计算机系统的电源,在计算机关闭后再关闭其他单元电源。
③逆时针旋开炉盖,装样。
④打开差热分析仪应用软件,设置参数
⑤打开温度监控系统,设置参数
⑥当温度达到起始温度时,采样软件出现采样曲线
⑦采样结束后,存盘返回
⑧关闭电炉,当炉体冷却后关闭各个单元电源及计算机电源
注意事项:
①待测样品一般为粉末或片状颗粒,且为不易渗透,无腐蚀,低膨胀样品。
②若在保护气氛或特定气氛下升温,左边为进气口,右边为出气口,气体压力不得大于0.4MPa。
③在采样设置中,起始温度和结束温度的设置为估计采样温度反应的范围,且前后各扩展50℃,升温速度一般选择10-20℃/min。 ④在温控曲线下载完毕,点击运行后,要注意观察输出电压显示,若在数秒内输入电压迅速上升,此时应点击恒温,使其进入放电状态,直至输出电压降为零伏,然后再点击运行,开启电炉,进入升温状态。 在本专业中的应用:
①可以分析待测物的成分组成
②可以研究物质发生化学反应时所伴随的物理及化学变化 ③可以检验微量物的存在
④可与其它仪器联用来实现对分析物的定性定量分析
