实验一 电子分析天平的操作及称量练习
学院/专业/班级:______________________________ 姓名:
学号:________________ 实验日期______年__月__日 教师评定:______________
【实验目的】
① 了解电子天平的构造及主要部件;
② 掌握电子天平的基本操作,掌握实物称量的技术;
③ 掌握准确、简明、规范地记录实验原始数据的方法。
【实验原理】
电子天平有顶部承载式(吊挂单盘)和底部承载式(上皿式)两种,根据电磁力补偿工作原理,使物体在重力场中实现力的平衡或通过电磁矩的调节,使物体在重力场中实现力矩平衡,整个过程均由微处理器进行计算和调控。秤盘加载后,即接通了补偿线圈的电流,计算器就开始计算冲击脉冲,达到平衡后,显示屏上即自动显示出天平所承载的质量值。
电子天平具有自动调零、自动校准、自动“除皮”和自动显示称量结果等功能,因此操作简便,称量快速,还能与计算机、打印机等联用,可在数秒内将所称量的质量显示并打印出来。
【仪器及试剂】
仪器:电子分析天平(型号:________________);保干器;称量瓶;称量纸;试剂勺;小烧杯等
试剂:练习使用试剂(干燥处理后,装入称量瓶中,保存于保干器内)
【实验步骤】
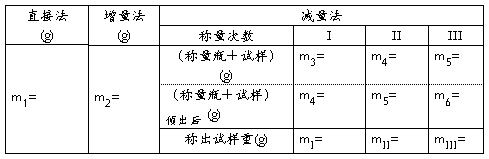
【数据记录及处理】
【思考与讨论】
实验二 食醋中总酸度的测定
学院/专业/班级:______________________________ 姓名:
学号:________________ 实验日期______年__月__日 教师评定:______________
【实验目的】
1.进一步掌握滴定管、移液管、容量瓶的规范操作方法;
2.学习食醋中总酸度的测定方法;
3.了解强碱滴定弱酸的反应原理及指示剂的选择。
【实验原理】
食醋是以粮食、糖类或酒糟等为原料,经醋酸酵母菌发酵而成。食醋的味酸而醇厚,液香而柔和,它是烹饪中一种必不可少的调味品。常用的食醋主要有“米醋”、“熏醋”、“糖醋”、“酒醋”、“白醋”等,根据产地、品种的不同,食醋中所含醋酸的量也不同,食醋的酸味强度的高低主要是由其中所含醋酸量(HAc,其含量约为3 %~8 %)的大小决定。除含醋酸以外,食醋中还含有对身体有益的其它一些营养成分,如乳酸、葡萄糖酸、琥珀酸、氨基酸、糖、钙、磷、铁、维生素B2等等。
用NaOH标准溶液测定时,醋酸试样中离解常数Ka? ³10-7的弱酸都可以被滴定,其滴定反应为:
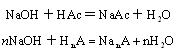
因此,上述测定的为食醋中的总酸量。分析结果通常用含量最多的 HAc表示。本实验滴定类型属强碱滴定弱酸,滴定突跃在碱性范围,其理论终点的 pH值在8.7左右,可选用酚酞作为指示剂。
【实验试剂】
KHC8H4O4 (基准物,105°C烘至恒重于干燥器内保存备用);NaOH溶液:500 g×L-1
酚酞指示剂:2 g×L-1(乙醇溶液);食醋试样(待测)
【实验步骤】
(1)0.1 mol×L-1 NaOH标准溶液的配制与标定
①用10 mL量筒量取500 g×L-1 NaOH溶液_____mL,倾入_____mL的聚乙烯试剂瓶中,用水洗涤量筒数次,洗涤液并入试剂瓶中,稀释至_____mL,摇匀后备用。
②用减重法称取_____ ~ _____ g的KHC8H4O4置于三个编好号*的锥形瓶中,分别加入20~30 mL蒸馏水,小心摇动,使其溶解(慎用玻棒!*),然后加入2滴酚酞指示剂,用所配制NaOH溶液滴定至溶液呈微红色且30 s内不褪色为终点,记下所消耗NaOH的体积,计算所配制NaOH溶液的浓度。
(2)食醋试液总酸度的测定
①用移液管移取待测试液_____mL至_____mL容量瓶中,用煮沸并冷却后的水定容。
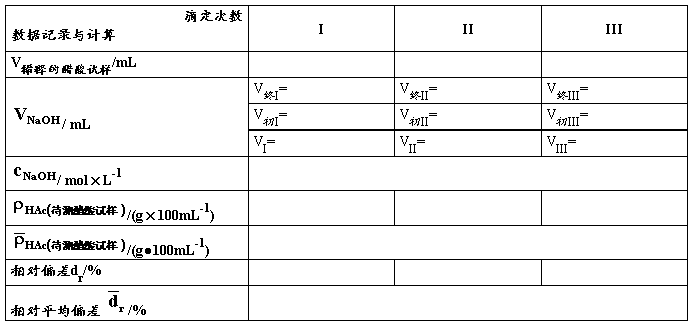
②用25 mL移液管移取上述试液至250 mL锥形瓶中,滴加2~3滴酚酞指示剂,用NaOH标准溶液滴定至溶液呈微红色并保持30 s内不褪色即为终点,记下所消耗NaOH的体积。根据NaOH标准溶液的浓度和滴定时消耗的体积,求算食醋中的总酸量ρHAC(单位为g·100mL-1 )。
【数据记录及处理】
表1. NaOH溶液的标定(PP为指示剂)
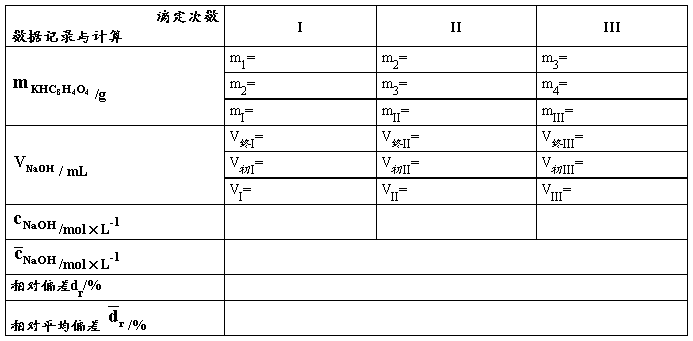
*表格后应附主要计算公式(平均值、标准差的公式不必列出),用表格中的符号表示即可,此处给出实例,以后请同学自行列出公式。
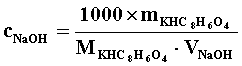 (例)
(例)
表2. 食醋试液总酸度的测定
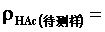
【思考与讨论】
实验三 自来水总硬度的测定
学院/专业/班级:______________________________ 姓名:
学号:________________ 实验日期______年__月__日 教师评定:______________
【实验目的】
① 掌握EDTA标准溶液的配制与标定方法;
② 熟悉金属指示剂的变色原理和使用原则,掌握对滴定终点的判断。
【实验原理】
【实验试剂】
乙二胺四乙酸二钠盐(Na2H2Y·2H2O AR);CaCO3基试剂(在110°C干燥2小时后装入试剂瓶,保存于干燥器中。);HCl溶液:6 mol×L-1;氨水溶液:1:1(浓氨水与水等体积混合);氨性缓冲溶液:pH=10
Mg-EDTA溶液;EBT指示剂:EBT与NaCl的固体混合物;甲基红指示剂:0.5g·L-1 (60%乙醇溶液);
自来水样
【实验步骤】
(1)0.01 mol×L-1 Zn2+标准溶液的配制
准确称取0.2034 g(偏差可在±10%以内)*于小烧杯,加入 6 mol×L-1 HCl 2~3 mL*,用玻棒搅拌至完全溶解*,转移至250 mL 容量瓶中,用水定容后摇匀。
(2)0.01 mol×L-1 EDTA标准溶液的配制与标定
①称取_____g EDTA二钠盐固体于小烧杯中,加入适量水溶解(可适当加温、搅拌),冷却后转移至试剂瓶中稀释至_____mL,摇匀。
②移取25.00 mL Zn2+标准溶液于250 mL锥形瓶中,加入20~30 mL水,不断摇动下,逐滴*加入1:1的氨水直至白色沉淀产生,继续滴加至白色沉淀恰好完全溶解。加入_____mL pH=10的氨性缓冲溶液和适量EBT指示剂(此时溶液为酒红色),用所配制的EDTA溶液滴定至溶液由酒红色变为纯蓝色为终点,平行滴定三次,计算所配制EDTA溶液的准确浓度。
(3)水样总硬度的测定
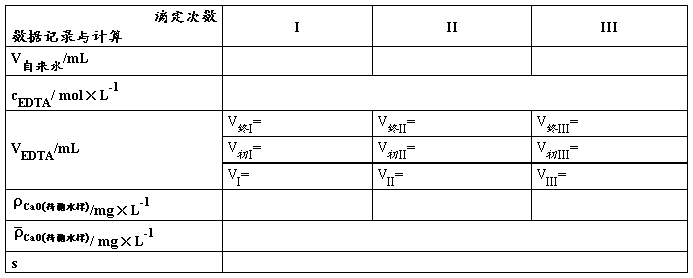
移取澄清水样_____mL于锥形瓶中,加入_____mL氨性缓冲溶液及适量铬黑T指示剂,立即用0.01 mol·L -1 EDTA标准溶液滴定,近终点要慢滴多摇,颜色由紫红色变为纯蓝色即为终点。平行滴定三份,所耗EDTA标准溶液体积应不大于0.05 mL。根据EDTA标准溶液的浓度及用量等计算水的总硬度,实验结果以“mg·L-1”表示。
【数据记录及处理】
表1. Zn2+标准溶液的配制


表2. EDTA溶液的配制与标定(EBT为指示剂)
称取EDTA g溶于 水中

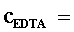
表3. 自来水样的总硬度测定(EBT为指示剂)
 /mg×L-1=
/mg×L-1=
【思考与讨论】
实验四 市售双氧水中过氧化氢含量的测定
学院/专业/班级:______________________________ 姓名:
学号:________________ 实验日期______年__月__日 教师评定:______________
【实验目的】
①学习高锰酸钾法测定过氧化氢的原理和方法;
②掌握滴定终点的准确判断。
【实验原理】
【实验试剂】
Na2C2O4 (基准物,105°C下干燥2小时存于保干器中备用)
KMnO4溶液:_____mol×L-1
H2SO4溶液:3 mol×L-1
市售双氧水(待测样品)
【实验步骤】
(1)0.02 mol×L-1 KMnO4标准溶液的配制与标定
①量取_____mL_____mol×L-1的KMnO4溶液于_____mL烧杯中,稀释至_____mL,摇匀备用。
②准确称取_____ ~ _____g Na2C2O4至于250 mL锥形瓶中,加入30 mL水及15 mL 3 mol×L-1 H2SO4溶液,溶解后加热至70~80°C(刚好冒出蒸气),趁热用KMnO4溶液进行滴定,开始滴定时要慢而摇动均匀,一定等前一滴KMnO4的红色完全褪去后再滴入下一滴,随着滴定过程的进行,滴定速度可适当加快,直至滴定的溶液呈微红色色并保持半分钟不褪色即为终点。注意整个过程中温度应该保持在60°C以上。平行滴定三份,计算所配制的KMnO4溶液的准确浓度。
(2)市售双氧水中H2O2含量的测定
①用吸量管吸取1.00 mL 市售双氧水(30 %)于250 mL容量瓶中,加水定容后充分摇匀。
②用移液管移取25.00 mL上述稀释过后的双氧水溶液,置于250 mL锥形瓶中,加入20 mL 3 mol·L-1 H2SO4 ,用KMnO4 标准溶液滴定到溶液呈微红色并保持30秒不褪色即为终点。平行测定3次,计算市售双氧水中H2O2的含量。
【数据记录及处理】
表1. KMnO4标准溶液的配制与标定
量取_____mL_____mol×L-1KMnO4溶液稀释至_____mL
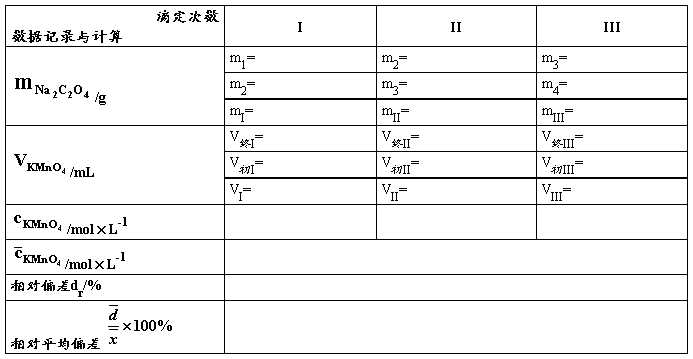

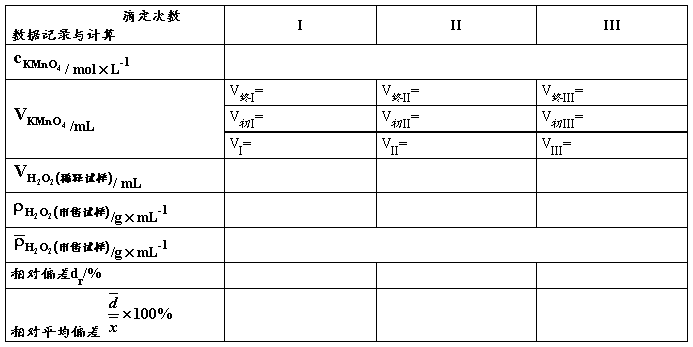
表2. 市售双氧水中H2O2含量的测定
移取 mL的双氧水试样至 mL的容量瓶中,用水稀释至刻度。(稀释倍数n= )

【思考与讨论】
实验五( 3-1)水中微量铁的测定—邻菲啰啉分光光度法
学院/专业/班级:______________________________ 姓名: __
学号:________________ 合作者:______________
实验日期______年__月__日 教师评定:_____________
【实验目的】
①学习选择分光光度法实验条件的方法;
②学习分光光度法测定微量铁的基本原理及方法;
③掌握分光光度计的使用方法
【实验原理】
【实验仪器及试剂】
仪器:
分光光度计(型号: );比色皿一套;50 mL容量瓶7个;吸量管;移液管;量筒;废液杯
试剂:
铁标准工作溶液:_____mg×L-1(0.5% H2SO4溶液)
邻菲啰啉溶液:5 g×L-1(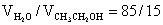 )
)
盐酸羟胺溶液:100 g×L-1
HAc-NaAc缓冲溶液:pH=4.6
【实验步骤】
(1)Fe2+标准系列溶液和待测试样的配制:
在8个50 mL容量瓶(编好号码*)中,用吸量管或移液管依次加入铁标准工作溶液____mL、____mL、____mL、____mL、____mL、____mL及____mL待测水样(水样平行做2份),然后在所有容量瓶中分别加入1mL盐酸羟胺溶液,摇匀后放置1 min,再分别加入1.5 mL邻菲啰啉溶液和5 mL HAc-NaAc缓冲溶液,用水定容摇匀后放置10分钟待测定。
(2)Fe2+-邻菲啰啉络合物吸收曲线的绘制
以试剂空白(指加入标准工作溶液0.00 mL的容量瓶,即1号瓶)为参比溶液,用已配好的系列标准溶液(2-6号瓶)中的某一个溶液(选择任意一瓶均可,但是习惯选择系列中次浓的溶液,即5号瓶)为待测液,采用1cm比色皿,分别测定波长为480、490、500、505、510、515、520、530、550、580 nm时的吸光度。以波长λ为横坐标, 吸光度为纵坐标绘制吸收曲线,并从曲线上求出最大吸收波长λmax。
(3)标准曲线的绘制
调节波长于λmax处,用1cm比色皿,以试剂空白为参比溶液,按浓度由低到高的顺序(2-6号瓶)依次测定标准系列溶液的吸光度。以浓度c(mg×mL-1)为横坐标,吸光度A为纵坐标绘制校正曲线。
(4)未知水样中铁含量的测定
于λmax处,用1cm比色皿,以试剂空白为参比溶液,将待测水样(7和8号瓶)推入光路中,测定吸光度,通过标准曲线及试样稀释倍数,计算待测水样中铁的含量(mg×mL-1)。
【数据记录及处理】
(1)Fe2+-邻菲啰啉络合物吸收曲线的绘制:
表1. Fe2+-邻菲啰啉络合物在不同波长下的吸光度值

lmax=____ nm
(2)标准曲线及待测水样的测定:
表2. 标准系列及待测水样吸光度的测定
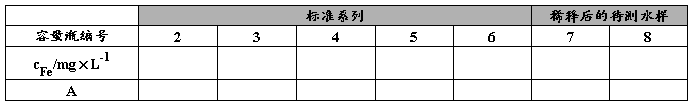
图1. Fe2+-邻菲啰啉络合物吸收曲线(图打印成适当大小,贴在此处)
图2. Fe的标准曲线(图打印成适当大小,贴在此处)
(3)待测试样中Fe的含量(利用拟合方程求算,注意稀释倍数,以mg×L-1表示)
【思考与讨论】
1.采用邻菲啰啉分光光度法测定微量铁,该法测得的为什么是水中亚铁和高铁的总量?
2.用邻菲啰啉分光光度法测定铁时,为什么测定前需加入还原剂盐酸羟胺?
3.本实验中,各试剂的加入,哪些必须很准确?哪些不必很准确?为什么?
4. 在本实验的显色反应过程中,各种试剂的加入顺序是否有要求?为什么?
5. 根据自己的实验数据,计算测定波长下的摩尔吸收系数。
实验六 (3-11)氟离子选择性电极法测定牙膏中游离氟的含量
(综合性实验)
学院/专业/班级:______________________________ 姓名: __
学号:________________ 合作者:______________
实验日期______年__月__日 教师评定:______________
【实验目的】
①掌握直接电位法测定的原理;
②了解总离子强度调节缓冲溶液的意义和作用;
③掌握直接电位法测定牙膏中游离的氟离子含量的操作及数据处理方法。
【实验原理】
【实验仪器及试剂】
仪器:
pH-mV计(型号: );氟离子选择电极;饱和甘汞电极;电磁搅拌器(配搅拌子)
试剂:
氟离子标准储备溶液:1.00 g·L-1(称取氟化钠基准试剂(105~110℃干燥处理两小时,冷却)0.2210 g于小烧杯中,用去离子水中溶解后,转移至100 mL容量瓶中,用去离子水定容,摇匀后即贮存于聚乙烯瓶中;氟离子标准工作溶液:100.00 mg·L-1(吸取1.00 g·L-1氟离子标准溶液25.00 mL于250.0 mL容量瓶中,用去离子定容,摇匀后即贮存于聚乙烯瓶中;
总离子强度调节液(TISAB):称取58.0 gNaCl、12 g柠檬酸于1000 mL烧杯中,加入500 mL去离子水,57 mL冰醋酸,搅拌至溶解,将烧杯放入冷水中,缓慢加入6 mol·L-1 NaOH(约150 mL),一直调节pH=5.5~6.5之间,冷却至室温,加去离子水稀释至1000 mL。
待测牙膏试样:(厂家: )
【实验步骤】
1. 氟离子电极使用前的准备:
将电极与仪器相连接,氟电极接______极,饱和甘汞电极接______极,将两支电极浸泡在去离子水中,打开电位计,此时电位值在本底值附近(氟离子选择性电极产品说明书有注明,如果相差太多,需对电极进行处理)。
2. 氟离子系列标准溶液的配制
在6个50 mL容量瓶(编好号码*)中,用吸量管依次加入________mg·L-1的氟标准溶液________、________、________、________、_________、_______mL,然后分别加入10 mL TISAB溶液,用去离子水定容。
3. 牙膏样品的处理(平行处理2份)
准确称取_____g左右的牙膏(精确至1 mg即可)至小烧杯中,加去离子水溶解(如不溶,可预先在沸水浴上加热溶化,冷却到室温),然后移入50 mL的容量瓶中(7、8号瓶),再加入10 ml 总离子强度调节缓冲溶液(TISAB),用去离子水定容。
4. 游离氟离子含量测定之方法一:标准曲线法
将配制好的氟离子系列标准溶液按照浓度由低到高的顺序依次转入干的塑料杯中,放入搅拌子并插入电极,开动搅拌器4-5 min后,读取平衡电位,根据所得数据可以绘制E-lgcF-标准工作曲线。相同方法测定处理后试样的平衡电位,(*由于方法二中也需要用到此电位值及试样体积,此处需将全部处理好的试样转移至干燥的塑料烧杯中),根据标准曲线、处理后试样体积及称取的样品质量可计算出牙膏试样中游离氟的含量。
5. 游离氟离子含量测定之方法二:单次标准加入法
将处理好的试样全部转移至干燥的塑料烧杯中测定平衡电位值,记作E1(*该步骤与方法一相同,因此该数据为两种方法共用),在上述烧杯杯中再加入______mL______mg·L-1氟标准溶液,并测定其平衡电位值,记作E2。根据有关数据计直接计算出牙膏试样中游离氟的含量。
【数据记录及处理】
1. 氟电极电位本底值:____________mV;7号容量瓶样品质量:______g,8号容量瓶样品质量:______g
2. 方法一:标准曲线法测定牙膏中游离氟的含量
表1. 标准系列及待测牙膏试样电位值的测定

图1. 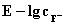 标准工作曲线图(图打印成适当大小,贴在此处)
标准工作曲线图(图打印成适当大小,贴在此处)
拟合方程表达式及相关系数:
牙膏中游离氟的含量(mg·g-1):(给出具体计算过程)
3. 方法二:单次标准加入法测定牙膏中游离氟的含量
7号容量瓶加标前后平衡电位E1/mV=__________;E2/mV=__________。
8号容量瓶加标前后平衡电位E1/mV=__________;E2/mV=__________。
氟离子电极的响应斜率S(即方法1中E-lgcF标准工作曲线的斜率)=
牙膏中游离氟的含量(mg·g-1):(给出具体计算过程)
4. 根据你的测定结果判断该牙膏是否符合国家所规定标准?
【思考与讨论】
实验七(3-15)气相色谱柱温变化对分离度的影响
(3-16) 气相色谱柱定量分析法——校正面积归一法
学院/专业/班级:______________________________ 姓名: __
学号:________________ 合作者:_______________________________________________
实验日期______年__月__日 教师评定:______________
【实验目的】
1.了解气相色谱仪的基本结构和工作原理;
2.了解气相色谱定量分析的基本原理;
3. 学习气相色谱仪的使用;
4. 学习色谱柱温变化对峰分离的影响。
5. 学习校正面积归一法。
【实验原理】
【实验仪器及试剂】
仪器:气相色谱仪(型号_______________________________)(配热导池检测器),微量注射器
试剂:乙酸乙酯(色谱纯);乙酸丁酯(色谱纯);乙酸戊酯(色谱纯);乙酸乙酯﹑乙酸丁酯﹑乙酸戊酯的混合物试样。
【实验步骤】
1. 实验色谱条件:
色谱柱:______m´______mm(不锈钢柱);固定相:________________________
流动相:高纯N2气;流量:______mL×min-1 柱前压力:____________;
色谱柱温度:__________________ °C;进样口温度:__________________ °C;
检测器温度:________________ °C ;量程(桥电流):_______________
进样量:____________
2. 气相色谱仪的开机﹑关机:
①开启载气:首先检查钢瓶的低压阀是否置于关闭状态,然后打开钢瓶总阀门,观察高压表上所示的压力是否稳定,若压力稳定无漏气现象,则顺时针方向旋转低压阀调节螺杆,使低压压力表指示0.5 MPa。旋转色谱仪上的载气旋钮,调节流量至所需值,一般为每分钟30毫升即可;②开启色谱仪总电源开关,设置柱温度、进样温度、检测温度,待这三个温度基本稳定后,再设置量程即桥电流;③待色谱基线平直后,准备灯亮即可进样分析;④当实验完毕,首先将量程(桥电流)设置为0 mA ,略打开色谱柱箱门,让冷空气少量进入柱箱,使柱温降至室温,进样温度﹑检测温度降至80 °C 以下时,才可以关闭色谱仪总电源;⑤最后关闭钢瓶总阀门,当载气流量为零时,才能关闭钢瓶的低压阀。
3. 进样操作方法:
①用微量注射器吸取少量试样洗涤注射器3次,若注射器中有空气泡,可将注射器插入溶液中,将注射器芯子来回抽动,在吸取排除溶液的过程中将空气排除,然后缓慢吸取试液;②左手扶着注射器的针杆尾部,右手拿着注射器,将针头垂直插入进样口(针头应插入长度的三分之二以上),用右手食指轻按注射器芯子将溶液推入,随后将注射器拔出。整个操作要求稳当﹑连贯﹑瞬间完成。
【数据记录及处理】
表1. 柱温变化对分离度的影响
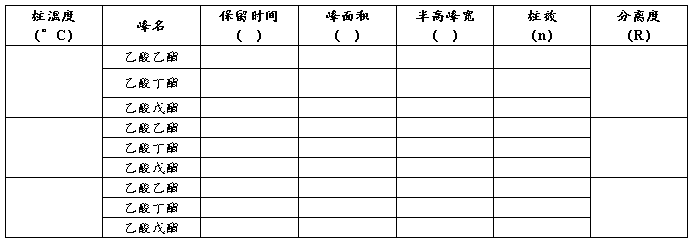
表2 色谱分析数据记录及处理

计算过程:
【思考与讨论】
实验八 设计性实验
学院/专业/班级:______________________________ 姓名: __
学号:________________ 实验日期______年__月__日 教师评定:______________
【待选实验题目】
①阿司匹林片剂中乙酰水杨酸含量的测定
②鸡蛋壳中钙含量的测定
③胱氨酸试剂纯度的测定
④生理盐水中氯离子含量的测定
【实验要求】
①由学生自行选做上述的一个实验题目(但保持每个实验题目的选作人数基本相等),然后由学生根据本课程的理论及实验知识,查阅相关文献,独立设计实验方案,由教师审阅通过后进行实验,并完成实验报告;
②在实验设计时应遵循以下原则:(1)首先确定分析方法及滴定方式;(2)根据所测样品的大概含量(教师提供),自己确定如何称取试样;(3)要考虑到实验中干扰因素及排除方法;(4)试剂及指示剂尽量选择实验室提供的试剂;(5)在保证实验准确度要求的前提下,要尽量节约使用试剂及试样;
③在考虑上述几点后,与实验前完成预习报告,包括(1)分析方法及简单原理;(2)所需试剂;(3)具体实验步骤;(4)实验注意事项;(5)参考资料;(6)数据记录及处理的表格及相关计算公式;
④教师审阅通过后,学生自行完成实验及实验报告,并对自己设计的实验方案进行评价及问题讨论,如果实验中的实际做法与预习报告有差异,以加以说明或重新写过。
所选实验题目:_______________________________________________
【分析方法及简单原理】
【所需实验试剂】
【具体实验步骤】
【实验注意事项】
【参考资料】
【数据记录及结果处理】
【实验方案评价及问题讨论】
