




化学实验上课要求
一、 实验课前,要认真预习实验内容,了解实验目的、原理、步骤以及所需仪器、化学药品。并写好预习报告,无预习报告或预习不合格者不允许做实验。
二、 上课应提前10分钟进入实验室,进入实验室时,必须用学生卡进行刷卡签到,按实验台号就坐。不许迟到,如果不按时到课,按缺课处理。病假、事假要有医院或相应部门的证明,才能补做实验,否则本次实验成绩为零分。
三、 进入实验室,要服从安排,遵守纪律,令行禁止。不准喧哗打闹、接打手机、随意更换座位、随意搬动或调换他组的仪器、药品等;不准乱丢纸屑、废物,不做与实验无关的事。
四、 实验前,认真听讲,仔细观察老师演示,进一步明确实验目的、操作要点及注意事项。进一步了解仪器装置的构造、原理、化学药品的性能。不要提前摆弄仪器或做实验。
五、 实验时,应根据实验教材上所规定的方法、步骤和试剂用量规范操作,仔细观察实验现象,认真详实地将实验过程中观察到的实验现象和测定的数据记录在报告上,不得杜撰原始数据,按时完成实验。
六、 实验过程中应该保持肃静,严格遵守实验守则。自觉养成良好的实验习惯,始终保持实验桌面布局合理、环境整洁。随时注意室内整洁卫生,火柴杆、纸张等废物只能丢入废物缸内,不能随地乱丢,更不能丢入水槽,以免堵塞下水道。
七、 实验结束后要及时清洗仪器并将所有的实验用品归回原位摆放整齐,清洁实验台面,公用仪器、试剂药品等都整理整齐。举手经指导教师检查,在实验报告上签字后方能离开实验室。
八、 实验课结束后由班长安排值日生打扫实验室公共卫生。
九、 爱护公共财产,节约水电、器材和药品,如因不守纪律、违章操作,损坏仪器设备,浪费器材或药品,要照价赔偿。
十、 独立完成实验报告。实验报告要按规定格式书写,字迹要工整,叙述要简明扼要,实验记录和数据处理应使用表格形式,作图要准确清楚,报告要整齐清洁。
十一、 在做完实验的一周之内,由学委将全班同学的实验报告按学号排好交到72#308室,逾期按没交实验报告处理。
预习报告
一、实验目的
二、实验原理(文字说明、公式推导、反应方程式等)
三、实验步骤
四、数据记录(表格形式,可另附页)
实验报告
一、实验数据处理(以一组数据为例,列出详细的计算公式及过程,可另附页)
二、结果讨论(问题讨论、误差分析)
三、思考题
第二篇:分析化学实验报告本-材料学院
实验一 电子分析天平的操作及称量练习
学院/专业/班级:______________________________ 姓名:
学号:________________ 实验日期______年__月__日 教师评定:______________
【实验目的】
①掌握电子分析天平的基本操作和粉末状样品的称量方法;
②开始培养准确、简明地记录原始数据的习惯,不得涂改数据,不得将测量数据记录在实验报告以外的任何地方。
【实验原理】
电子天平有顶部承载式(吊挂单盘)和底部承载式(上皿式)两种,根据电磁力补偿工作原理,使物体在重力场中实现力的平衡或通过电磁矩的调节,使物体在重力场中实现力矩平衡,整个过程均由微处理器进行计算和调控。秤盘加载后,即接通了补偿线圈的电流,计算器就开始计算冲击脉冲,达到平衡后,显示屏上即自动显示出天平所承载的质量值。
电子天平具有自动调零、自动校准、自动“除皮”和自动显示称量结果等功能,因此操作简便,称量快速,还能与计算机、打印机等联用,可在数秒内将所称量的质量显示并打印出来。
【仪器及试剂】
仪器:电子分析天平(型号:________________);保干器;称量瓶;称量纸;试剂勺;小烧杯等
试剂:练习使用试剂(干燥处理后,装入称量瓶中,保存于保干器内)
【实验步骤】
【数据记录及处理】
1. 直接法:小纸铲质量m=____________g
2. 增重法:目标质量m=0.2034 g;实际称量m1=___________g;m2=___________g;m3=___________g
3.减重法:目标质量范围m=0.2~0.3g

【思考与讨论】
实验二 食醋中总酸度的测定
学院/专业/班级:______________________________ 姓名:
学号:________________ 实验日期______年__月__日 教师评定:______________
【实验目的】
①学习、掌握滴定分析常用仪器的洗涤方法;
②练习滴定分析基本操作和正确判断终点;
③学习NaOH标准溶液的配制和标定方法;
④学习食醋中总酸度的测定方法。
【实验原理】
食醋的主要成分是醋酸(HAc,其含量约为3% ~ 5%),另外还有少量的其它有机弱酸,例如乳酸等。用NaOH标准溶液进行滴定时,试样中离解常数Kθ³10-7的弱酸都可以被滴定,其滴定反应为: ;
; 。因此,测定的为食醋中的总酸量,分析结果通常用含量最多的 HAc表示。
。因此,测定的为食醋中的总酸量,分析结果通常用含量最多的 HAc表示。
本实验滴定类型属强碱滴定弱酸,滴定突跃在碱性范围,其理论终点的 pH在8.7左右,可选用酚酞作为指示剂。
【实验试剂】
KHC8H4O4 (基准物,105°C烘至恒重于干燥器内保存备用)
NaOH溶液:500 g×L-1
酚酞指示剂:2 g×L-1(乙醇溶液)
食醋试样(待测)
【实验步骤】
(1)0.1 mol×L-1 NaOH标准溶液的配制与标定
①用10 mL量筒量取500 g×L-1 NaOH溶液_____mL,倾入_____mL的聚乙烯试剂瓶中,用水洗涤量筒数次,洗涤液并入试剂瓶中,稀释至_____mL,摇匀后备用。
②用减重法称取_____ ~ _____ g的KHC8H4O4置于三个编好号*的锥形瓶中,分别加入20~30 mL蒸馏水,小心摇动,使其溶解(慎用玻棒!*),然后加入2滴酚酞指示剂,用所配制NaOH溶液滴定至溶液呈微红色且30 s内不褪色为终点,记下所消耗NaOH的体积,计算所配制NaOH溶液的浓度。
(2)食醋试液总酸度的测定
①用移液管移取待测试液_____mL至_____mL容量瓶中,用煮沸并冷却后的水定容。
②用25 mL移液管移取上述试液至250 mL锥形瓶中,滴加2~3滴酚酞指示剂,用NaOH标准溶液滴定至溶液呈微红色并保持30 s内不褪色即为终点,记下所消耗NaOH的体积。根据NaOH标准溶液的浓度和滴定时消耗的体积,求算食醋中的总酸量ρHAC(单位为g·L-1 )。
【数据记录及处理】
表1. NaOH溶液的标定(PP为指示剂)

*表格后应附主要计算公式(平均值、标准差的公式不必列出),用表格中的符号表示即可,此处给出实例,以后请同学自行列出公式。
 (例)
(例)
表2. 食醋试液总酸度的测定


【思考与讨论】
实验三 水的总硬度的测定
学院/专业/班级:______________________________ 姓名:
学号:________________ 实验日期______年__月__日 教师评定:______________
【实验目的】
①掌握EDTA标准溶液的配制与标定;
②掌握 EDTA法测定水的硬度的原理和方法,了解金属指示剂的特点;
③了解水硬度的测定意义和常用硬度的表示方法。
【实验原理】
【实验试剂】
ZnO(基准试剂,900~1000 °C下灼烧至衡重保存于保干器)
EDTA二钠盐(分析纯)
EBT:EBT与NaCl的固体混和物
HCl溶液:6 mol×L-1
氨水溶液:1:1(浓氨水与水等体积混合)
氨性缓冲溶液:pH=10
自来水样
【实验步骤】
(1)0.01 mol×L-1 Zn2+标准溶液的配制
准确称取0.2304 g(偏差可在±10%以内)*于小烧杯,加入 6 mol×L-1 HCl 2~3 mL*,用玻棒搅拌至完全溶解*,转移至250 mL 容量瓶中,用水定容后摇匀。
(2)0.01 mol×L-1 EDTA标准溶液的配制与标定
①称取_____g EDTA二钠盐固体于小烧杯中,加入适量水溶解(可适当加温、搅拌),冷却后转移至试剂瓶中稀释至_____mL,摇匀。
②移取25.00 mL Zn2+标准溶液于250 mL锥形瓶中,加入20~30 mL水,不断摇动下,逐滴*加入1:1的氨水直至白色沉淀产生,继续滴加至白色沉淀恰好完全溶解。加入_____mL pH=10的氨性缓冲溶液和适量EBT指示剂(此时溶液为酒红色),用所配制的EDTA溶液滴定至溶液由酒红色变为纯蓝色为终点,平行滴定三次,计算所配制EDTA溶液的准确浓度。
(3)水样总硬度的测定
移取澄清水样_____mL于锥形瓶中,加入_____mL氨性缓冲溶液及适量铬黑T指示剂,立即用0.01 mol·L -1 EDTA标准溶液滴定,近终点要慢滴多摇,颜色由紫红色变为纯蓝色即为终点。平行滴定三份,所耗EDTA标准溶液体积应不大于0.05 mL。根据EDTA标准溶液的浓度及用量等计算水的总硬度,实验结果以“mg·L-1”表示。
【数据记录及处理】
表1. Zn2+标准溶液的配制


表2. EDTA溶液的配制与标定(EBT为指示剂)
称取EDTA g溶于 水中


表3. 自来水样的总硬度测定(EBT为指示剂)
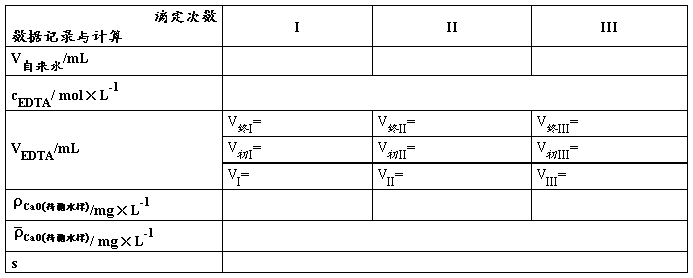
 /mg×L-1=
/mg×L-1=
【思考与讨论】
实验四 双氧水中过氧化氢含量的测定
学院/专业/班级:______________________________ 姓名:
学号:________________ 实验日期______年__月__日 教师评定:______________
【实验目的】
①掌握高锰酸钾标准溶液的配制及标定方法;
②学习高锰酸钾法测定过氧化氢的原理和方法。
【实验原理】
【实验试剂】
Na2C2O4 (基准物,105°C下干燥2小时存于保干器中备用)
KMnO4溶液:_____mol×L-1
H2SO4溶液:3 mol×L-1
市售双氧水(待测样品)
【实验步骤】
(1)0.02 mol×L-1 KMnO4标准溶液的配制与标定
①量取_____mL_____mol×L-1的KMnO4溶液于_____mL烧杯中,稀释至_____mL,摇匀备用。
②准确称取_____ ~ _____g Na2C2O4至于250 mL锥形瓶中,加入30 mL水及10 mL 3 mol×L-1 H2SO4溶液,溶解后加热至70~80°C(刚好冒出蒸气),趁热用KMnO4溶液进行滴定,开始滴定时要慢而摇动均匀,一定等前一滴KMnO4的红色完全褪去后再滴入下一滴,随着滴定过程的进行,滴定速度可适当加快,直至滴定的溶液呈微红色色并保持半分钟中不褪色即为终点。注意整个过程中温度应该保持在60°C以上。平行滴定三份,计算所配制的KMnO4溶液的准确浓度。
(2)市售双氧水中H2O2含量的测定
①用吸量管吸取1.00 mL 市售双氧水(30 %)于250 mL容量瓶中,加水定容后充分摇匀。
②用移液管移取25.00 mL上述稀释过后的双氧水溶液,置于250 mL锥形瓶中,加入10 mL 3 mol·L-1 H2SO4 ,用KMnO4 标准溶液滴定到溶液呈微红色并保持30秒不褪色即为终点。平行测定3次,计算市售双氧水中H2O2的含量。
【数据记录及处理】
表1. KMnO4标准溶液的配制与标定
量取_____mL_____mol×L-1KMnO4溶液稀释至_____mL


表2. 市售双氧水中H2O2含量的测定
移取 mL的双氧水试样至 mL的容量瓶中,用水稀释至刻度。(稀释倍数n= )


【思考与讨论】
