16sRNA PCR 扩增及凝胶电泳分析
微生物学 20092474 王紫枫
一、 实验目的
1.熟悉细菌活化及培养过程
2.掌握PCR扩增技术及方法
3.掌握凝胶电泳分析技术
二、 实验原理
rRNA进化缓慢,具有高度保守性。不同微生物的rRNA的基因序列在某些位点以不同的几率发生突变。同时,小核糖体亚基16sRNA分子量大,携带信息量大,可作为属种鉴定的基础。
通过筛选的细菌,做活化培养后,细菌在缓冲液酶解,通过细胞破壁、裂解、离心得到RNA相关序列,在经过设定PCR相关条件。温度、循环次数,将裂解液加入到体系中进行扩增。在完成循环后进行凝胶电泳、拍照、序列分析。
三、 实验用品
供试菌种53种、编号试管每株两个LB固体和液体培养基、Mg2+、无菌水、EB Buffer、TE离心管、移液枪
四、 实验步骤
1.将供试菌株编号,没人分得3个菌株。
2.将菌株接入固体培养基进行活化,培养24小时。
3.将活化后的菌株挑一环,接入5ml液体培养基内振荡培养16小时得到菌悬液。
4.取1.5ml菌悬液于离心管,10000转5分钟弃上清。
5.用无菌水洗涤一次,沉淀悬浮于150ul TE Bufler。
6.将上述悬液在沸水上煮10分钟,水浴10分钟,10000转5分钟离心后,上清液于-20℃保存。
7.取上述上清液1ul于PCR中。
8.3小时PCR扩增。
9.将扩增后的序列取1ul于EB,并注入电泳槽中。
10. 经过电泳后的凝胶,取出于紫外荧光灯中显色,拍照并分析。
五、 实验结果
经过拍照,仅有2、3、6、9、22、38、39、40号扩增出了新的序列显色明显。其他没有扩增出来的原因可能是提取过程中丢失。另外第三块胶板没有明显变化的主要原因可能是电泳时入缓冲液使用了旧的缓冲液,并未出现预期的结果。
六、 注意事项
1.预制固体培养基琼脂要加够量,否则很难凝固。
2.在转接时,挑取的一环尽量多一些,肉眼可看见的状态为宜,生长期长一些。
3.缓冲液先用现配。
第二篇:PCR扩增产物的电泳分析
PCR扩增产物的电泳分析
凝胶电泳分琼脂糖电泳和聚丙烯酰胺凝胶电泳两种.
一、琼脂糖凝胶电泳:琼脂糖凝胶电泳是一种非常简便、快速、最常用的分离纯化和
鉴定核酸的方法.琼脂糖是从海藻中提取的一种线状高聚物.根据琼脂糖的溶解温度,
把琼脂糖分为一般琼脂糖和低熔点琼脂糖.低熔点琼脂糖熔点为62~65℃,溶解后在
37℃下维持液体状态约数小时,主要用于DNA片段的回收,质粒与外源性DNA的快速连
接等.
(一)凝胶浓度:凝胶浓度的选择依DNA分子的大小而定.
琼脂糖凝胶的浓度与DNA分离范围
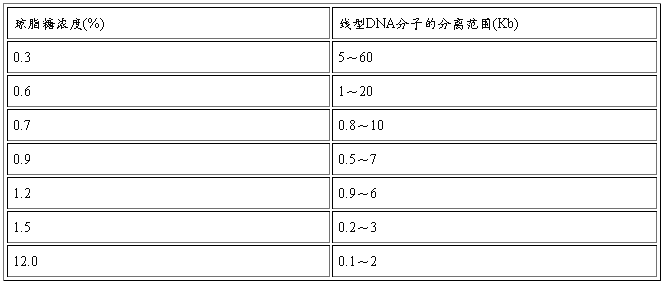
(二)电泳缓冲液
核酸电泳缓冲液有三种,即Tris-硼酸(TBE)、Tris-乙酸(TAE)和Tris-磷酸(TPE).TBE
与TPE缓冲容量高,DNA分离效果好,但TPE在DNA片段回收时含磷酸盐浓度高,容易使
DNA沉淀.TAE缓冲容量低,但价格较便宜,因而推荐选用TBE.缓冲液中的EDTA可螯合
二价阳离子,从而抑制DNA酶的活性,防止PCR扩增产物降解.
10XTBE缓冲液的配制
Tris硷,108克
EDTA,9.3克
硼酸,55克
H2O至,1000ul
(其PH应为8.0~8.2)
临用时用水稀至0.5XTBE(20倍稀释.
(三)核酸电泳的指示剂与染色剂
1.指示剂:核酸电泳常用的指示剂有溴酚兰和二甲苯青及银染色.溴酚兰在碱性液体中
呈紫兰色,在0.6%、1%、1.4%和2%琼脂糖凝胶电泳中,溴酚兰的迁移率分别与1Kb、
0.6Kb、0.2Kb和0.15Kb的双链线性DNA片段大致相同.二甲苯青的水溶液呈兰色,它在
1%和1.4%琼脂糖中电泳时,其迁移速率分别与2Kb和1.6Kb的双链线性DNA大致相似.
指示剂一般与蔗糖、甘油或聚蔗糖400组成载样缓冲液.载样缓冲液的作用有①增加样
品密度,使其比重增加,以确保DNA均匀沉入加样孔内.②在电泳中形成肉眼可见的指
示带,可预测核酸电泳的速度和位置.③使样品呈色,使加样操作更方便.
染色剂:核酸电泳后,需经染色后才能显现出带型,最常用的是溴化乙锭染色法,其
次是银染色.
溴化乙锭(ethidium bromide,EB)是一种荧光染料,EB分子可嵌入核酸双链的碱基对
之间,在紫外线激发下,发出红色荧光.根据情况可在凝胶电泳液中加入终浓度为
0.5ug/ml的EB,有时亦可在电泳后,将凝胶浸入该浓度的溶液中染色10~15min.琼脂
糖凝胶EB染色,肉眼可见核酸电泳带,其DNA量一般>5ng,当溴化乙锭太多,凝胶染
色过深,核酸电泳带看不清时,可将凝胶放入蒸馏水浸泡30min后再观察.
银染色:银染色液中的银离子(Ag+)可与核酸形成稳定的复合物,然后用还原剂如甲醛
使Ag+还原成银颗粒,可把核酸电泳带染色黑褐色.主要用于聚丙烯酰胺凝胶电泳染色.
也用于琼脂糖凝胶染色.其灵敏度比EB高200倍.但银染色后,DNA不宜回收.
(四)电泳
1.电泳装置:
电泳装置主要有电泳仪,电泳槽及灌胶模具等.
2.电泳方法:
(1)用蒸馏水将电泳槽和梳子冲洗干净.放在水平桌面上,并架好梳子.
(2)根据核酸分子量的大小配制不同浓度的琼脂糖凝胶,一般200~400bp的DNA片段,
可配制1.2~1.7%浓度的琼脂糖用于电泳.
3.配制0.5XTBE电泳缓冲液100ml于三角烧瓶中,称取一定量的琼脂糖粉放入后沸水锅
或微波炉内加热熔化.冷却至60℃(需要时可加入溴乙锭),倒入电泳槽中,待凝固.
4.向电泳槽中倒入0.5XTBE,其量以没过胶面2mm为宜,小心移去梳子.如样品孔内有
气泡,应设法除去.
5.在DNA样品中加入0.2体积的载样缓冲液,混匀后,加入样品孔内.
6.接通电源,一般红色为正极黑色为负极,切记DNA样品由负极往正极泳动(靠近加样
孔的一端为负).电压为1-5V/cm(长度以两个电极之间的距离计算).
7.根据指示剂泳动的位置,判断是否终止电泳.一般200~400bp的PCR产物50V电压,
电泳20~40min即可.
(3)溴化乙锭染色后,紫外仪上观察电泳带及其位置,并与核酸分子量标准比较被扩
增产物的大小.
二、聚丙烯酰胺凝胶电泳
聚丙烯酰胺凝胶电泳适宜分离鉴定低分子量蛋白质、小于1Kb的DNA片段和DNA序列分
析.其装载的样品量大,回收DNA纯度高.长度仅相差0.2%(即500bp中的1bp)的核苷酸
分子即能分离.
聚丙烯酰胺凝胶是由丙烯酰胺单体,在催化剂TEMED(N,N,N,N'一四甲基乙二胺)和
过硫酸铵的作用下,丙烯酰胺聚合形成长链,聚丙烯酰胺链在交联剂,N,N'一亚甲
双丙烯酰胺参与下,聚丙烯胺链与链之间交叉联接而形成凝胶.
聚丙烯酰胺凝胶孔径的大小是由丙烯酰胺的浓度决定的,不同浓度丙烯酰胺和DNA的
有效分离范围见表2.
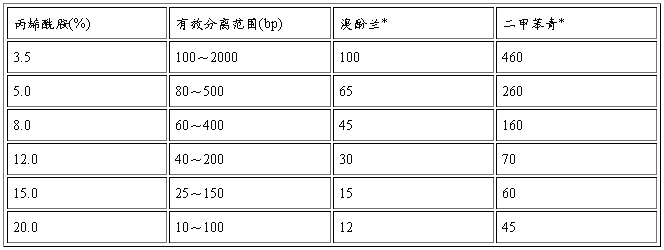
*表中给出的数字为与指示剂迁移率相等的双链DNA分子所含碱基对数目(bp).
(一)材料
1.电泳仪器:电泳仪,垂直电泳槽及其附件.
2.30%丙烯酰胺
丙烯酰胺,29克
N,N'一亚甲基双丙烯酰胺,1克
H2O,加至100ml
装于棕色瓶内,4℃可保存二个月.
3.10%过硫酸铵
过硫酰铵,1克
加水至,10ml
4℃可保存一周,-20℃可保存一个月.
4.1XTBE电泳缓冲液
5.TEMED(四甲基乙烯基二胺)
(二)聚丙烯酰胺凝胶的制备与电泳:
根据分离DNA片段的大小及需凝胶的容积,配制聚丙烯酰胺凝胶.
1.按要求装配好垂直电泳板,两块玻璃板的两侧及底部用1%的琼脂
糖封边,防止封闭不严而使聚丙烯酰胺液漏出.
2.将装好的玻璃电泳板倾斜成45~60℃角.
3.按表3配制所需%浓度凝胶的毫升数.
4.加入TEMED后,立即混匀,缓缓倒入两玻璃板间的胶床中,直到液
体接近溢出时为止.
5.立即插入适当的梳子,密切注意防止梳齿下产生气泡,用一有力
的夹将梳子夹在一边的玻璃板上,然后将玻璃板斜靠在物体上,使
成10°角,可减少液体泄漏的机会.
6.室温聚合一小时后,将玻璃板插入电泳槽中,上紧,倒入0.1XTBE
缓冲液.
7.小心取出梳子,立即用缓冲液冲洗加样孔,因为梳子取出后,梳
子上吸附的及凝胶顶部未聚合的丙烯酰胺会流入加样孔内聚合,产
生不规则的表面,将导致以后DNA电泳带型不规则.
8.将DNA样品与适量的载样缓冲液混匀后,加到样品孔内,加样时不
要产生气泡.
9.接好电极,电压为1-8V/cm,进行电泳.
10.根据指示剂迁移位置来判定是否终止电泳.
11.电泳毕,切断电源,弃去电泳仪,取出胶床板,小心移去一块玻
璃板,让凝胶吸附在另一块玻璃板上.浸入含0.5ug/ml的溴化乙锭溶
液中,15~30min后取出水洗紫外仪下观察结果.
12.聚丙烯酰胺凝胶电泳只能检出>10ng以上量的DNA条带.要求更高
的灵敏度,可用银染.
