质量审核观察项、不符合项汇总表(纺机)
√ 20##年集中审核 □ 日常监督审核 编号: A004.206(1101)

第二篇:GSP质量体系内审
*****医药
有限公司
质量体系内部审核记录
(2008年)
内容
1. 质量体系内部审核计划表
2. 质量体系内部审核计划的通知
3. 质量体系检查记录
4. 质量体系内部审核报告
5. 质量体系内部审核结果的通知
****医药有限公司
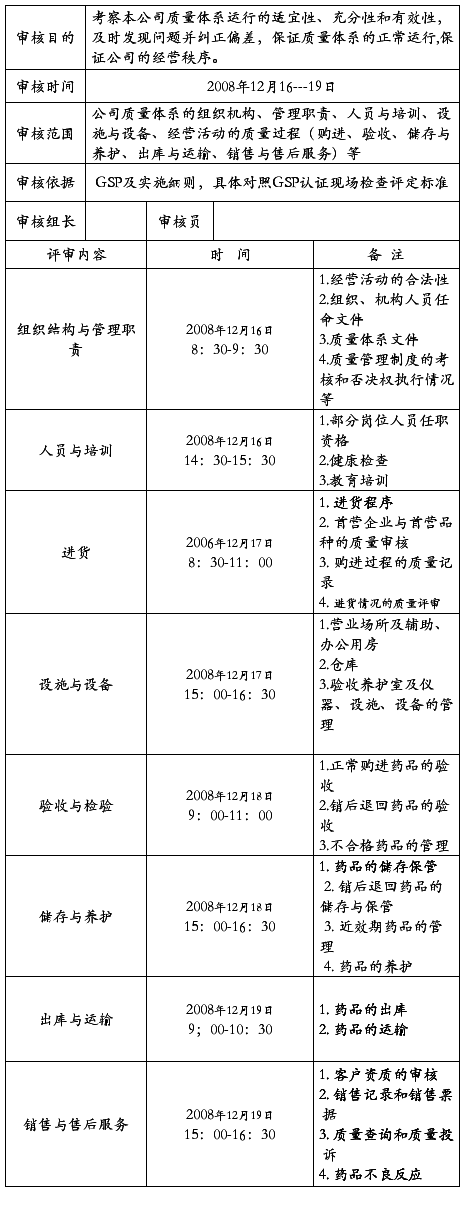
20##年质量体系内部审核计划表
质量管理部: 总经理:
****医药有限公司
20##年质量体系内部审核计划的通知
一、评审目的:
根据GSP要求及公司《质量体系审核制度》的规定,考察本公司质量体系的运行的适宜性、充分性和有效性,及时发现问题并纠正偏差,保证质量体系的正常运行。公司质量管理部根据公司目前业务较繁忙的状况,经与各部门经理协商,决定于20##年12月12日列出本公司《质量体系内部审核计划表》,报总经理同意后,于 20##年12月16---19日对公司质量体系运行情况进行内部审核
二、评审范围:
1. 组织机构与管理职责。
2. 人员与培训。
3. 设施与设备。
4. 经营活动的过程(进货、验收与检验、出库与复核、销售与售后服务)。
三、评审依据:
1.《药品经营质量管理规范》及实施细则。
2. 公司现行质量体系文件。
四:评审组:
组长:***
成员:***************
五、首次会议:
1.会议时间:20##年12月16日上午8:00-8:30。
2.参加人员:各部门负责人和评审组成员。
3.会议主要内容
3.1本次评审的目的、范围、依据等。
3.2本次评审的具体时间安排。
3.3对评审组工作提出的要求。
六、末次会议
1.会议时间:20##年12月20日上午9:30-11:00。
2.参加人员:各部门负责人和评审组成员。
3.会议主要内容
3.1重申本次评审的目的、范围、依据等。
3.2宣读本次评审的缺陷项目。
3.3讨论并提出纠正措施。
3.4评审情况总结。
3.5根据本次评审和质量管理考核落实质量目标的完成情况。
七、评审报告
质量管理部根据评审现场记录和评审过程,编写评审报告,提交评审组审核通过后,报公司总经理一份,质量管理部留档保存一份。
****医药有限公司
20##年12月10日
****医药有限公司
审核报告 SJYY-QR-045
****医药有限公司
关于公司GSP内部评审结果的通知
公司各部门:
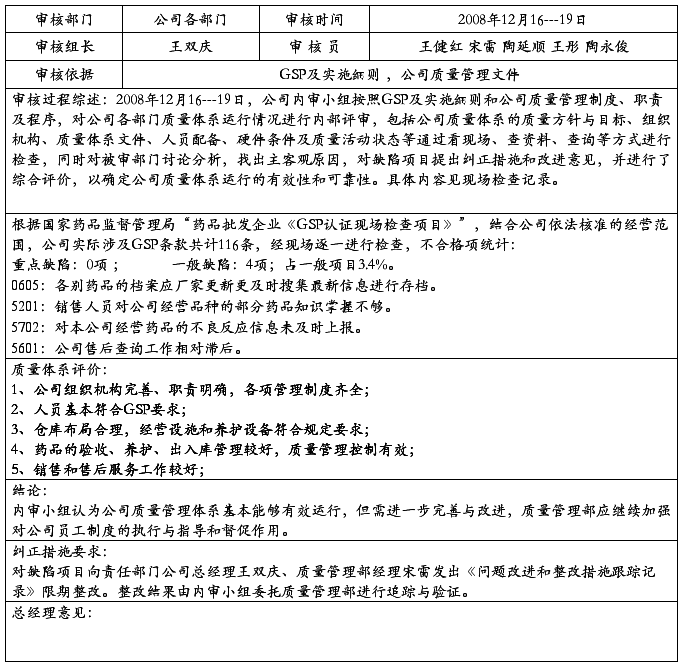
根据GSP要求和公司《质量体系审核制度》,20##年10月4日,公司内审小组按照GSP及实施细则和公司质量管理制度、职责及程序,对公司各部门质量体系运行情况进行内部评审,包括公司质量体系的质量方针与目标、组织机构、质量体系文件、人员配备、硬件条件及质量活动状态等,对工作质量、药品质量、服务质量、环境质量等环节,通过看现场、查资料、查询等方式进行检查,同时对被审部门讨论分析,找出主客观原因,对缺陷项目提出纠正措施和改进意见,并进行了综合评价,以确定公司质量体系运行的有效性和可靠性。根据国家药品监督管理局“药品批发企业《GSP认证现场检查项目》”,结合公司依法核准的经营范围,公司实际涉及GSP条款共计116条,经现场逐一进行检查,不合格项统计:
经现场检查,不合格项统计为:
重点缺陷:0条
一般缺陷:3条 占一般项目3.4%。
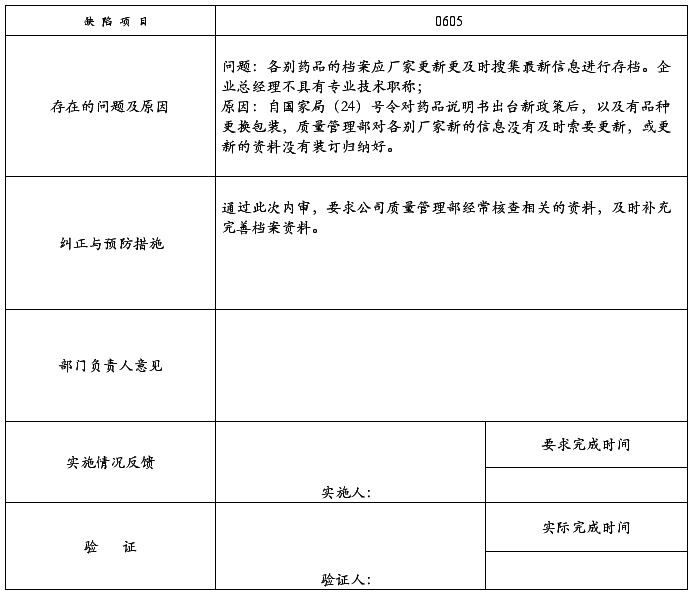
0605:各别药品的档案应厂家更新更及时搜集最新信息进行存档。
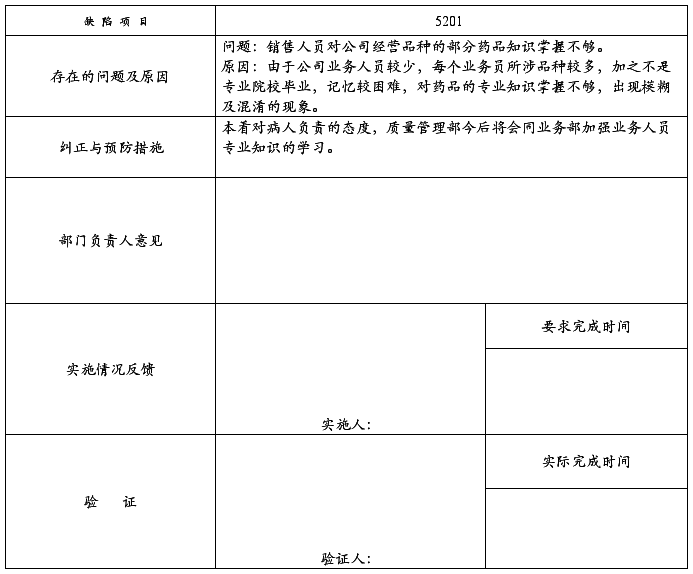
5201:销售人员对公司经营品种的部分药品知识掌握不够。
5702:对本公司经营药品的不良反应信息未及时上报。
5601:公司售后查询工作相对滞后。
综合检查结果,公司内审小组对质量体系的实施评价如下:
1、 公司组织机构完善、职责明确、各项管理制度齐全;
2、 人员符合GSP要求。
3、 仓库布局合理,经营设施和养护设备符合规定要求;
4、 药品的验收、养护和出入库管理较好,质量管理控制有效;
5、 销售和售后服务工作较好;
内审小组认为,质量管理体系在公司运行较好,基本保证了公司的经营秩序能严格按照GSP规定执行。但在检查过程中,也发现存在一些问题,由于受资金的制约,公司经营规模较小,经营时间仅二年,实际经营过程中有些项目还没有充分展开,如退货药品处理、不合格药品管理、质量事故及质量投诉等,因此对这些项目都暂时无法评价,此外对人员的培训和继续教育自上而下首先在思想上应提到重视,不能有应付的想法,实际培训工作也需要进一步加强,同时加强售后服务工作,以确俣公司更加规范地经营,质量管理部在此过程中要严格进行监督和指导;对现有检查缺陷项目向相关责任人发出《问题改进和整改措施跟踪记录》限期整改。整改结果由审核小组委托质量管理部追踪并验证。
通过此次现场内审,由公司质量管理部写出自查报告并存档,公司各部门各岗位人员,严格要求自己,认真履行职责,加强业务知识及专业知识的学习,提高自身素质,使明年的工作业绩更上一层楼。
****医药有限公司
20##年12月23日
20##年质量目标
1. 购进药品100%从质量有保证能力的合法企业取得;
目标实施部门:业务部
分解目标:
1.1 首营企业和首营品种的质量审核率:100%;
1. 2药品购进计划报质量管理部审核率:100%;
1.3购进合同100%注明质量条款,购进药品如无书面合同,应签定质量保证协议书;
1.4药品购进记录准确、完整,对购进药品的合法性和规范性进行有效的监控和追溯率:100%;
1.5购进药品的验收合格率不少于100%;
2.按规定程序验收药品,保证入库药品合格率:100%。
目标实施部门:质量管理部
分解目标:
2.1药品购进入库和销后退回验收率:100%;
2.2验收记录准确,完整,对入库药品的质量能够按照批号进行有效地追溯率:100%;
3.按规定程序储存养护,发现质量缺陷能够及时正确处置,每季度一般缺陷不得超过3次。
目标实施部门:储运部
分解目标:
3.1药品储存正确率:100%;
2. 2各种标牌正确标识率:100%;
3.3每季度库存药品养护检查率:100%,重点养护品种每月养护检查率:100%;
3.4近效期药品报表正确率:100%;
3. 5发现质量问题时,正确处理率:100%;
4. 销售药品100%售给具有合法资格的单位;
目标实施部门:业务部
分解目标:
4.1销售记录准确,完整,对售出的药品准确的跟踪率:100%;
4.2销售退回药品正确处置率:100%;
5. 出库复核和销售质量跟踪记录率:100%。
目标实施部门:储运部
分解目标:
5.1依据出库凭证发货,无白条出库率:100%;
5.2药品出库复核率100%,准确率99.5%;
5.2药品运输完好率:100%;
5.3运输药品差错率小于:0.4%;
6.全年质量查询、质量投诉、质量事故调查、处理、报告率:100%。
目标实施部门:质量管理部
分解目标:
6.1不合格药品处理及时、处理率:100%;
6.2质量查询、投诉或事故处理及时,处理率:100%;
7.全年客户质量投诉不得超过3次;
目标实施部门:质量管理部
分解目标:
7.1售后服务跟踪率:100%;
7.2质量投诉处理及时,处理率:100%;
8.每年直接接触药品人员健康检查率:100%。
目标实施部门:资源部
分解目标:
8.1员工继续教育和培训依据需求及时安排率:100%;
8.2员工继续教育和培训档案建档率:100%;
8.3安排直接接触药品岗位人员参加健康体检,检查率:100%,建档率:100%。
****医药有限公司
问题改进和整改措施跟踪记录
受审部门:质量管理部 (2008)SJYY-QR-012-001
****医药有限公司
问题改进和整改措施跟踪记录
受审部门:质量管理部 (2008)SJYY-QR-012-002
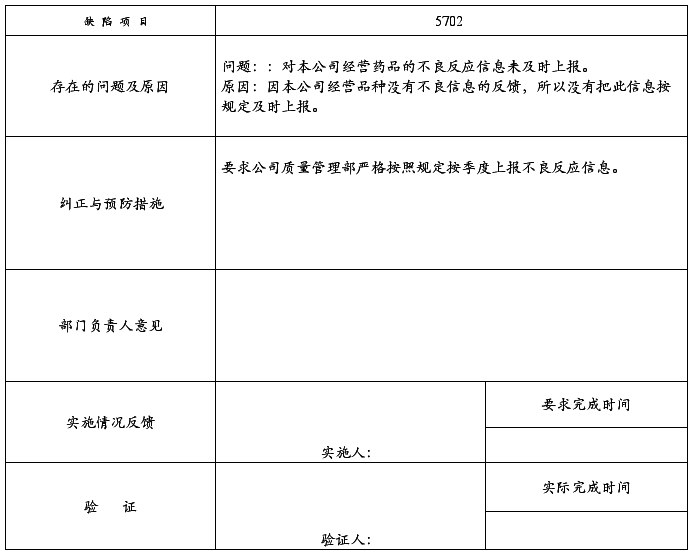
****医药有限公司
问题改进和整改措施跟踪记录
受审部门:质量管理部 (2008)SJYY-QR-012-003
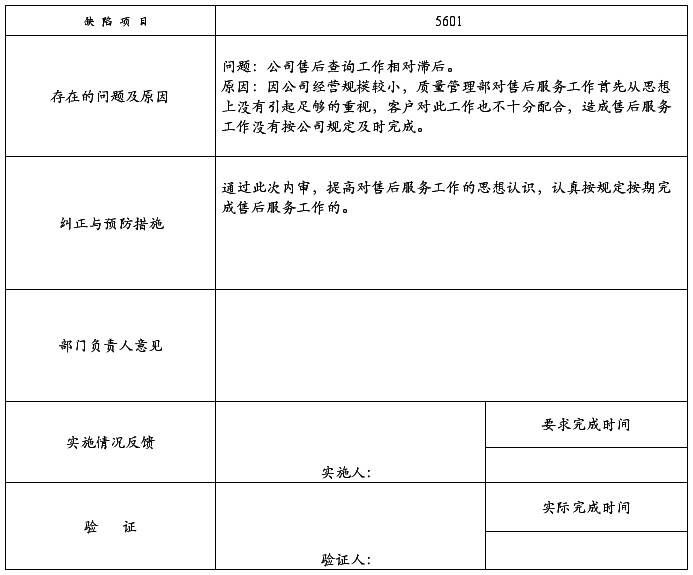
****医药有限公司
问题改进和整改措施跟踪记录
受审部门: 业务部 (2008)SJYY-QR-012-004