****医药有限公司
质量管理体系内审报告
一、内审时间:
审核开始日期:20xx年12月19日
审核结束时间:20xx年12月20日
二、受审部门:
综合办公室、采购部、销售部、储运部、质管部、财务部
三、内审小组成员名单:
组 长:
副组长:
组 员:
四、内部审核目的:
1、检查和评价公司整体搬迁到新的库房、经营场所后公司的质量管理体系对《药品经营质量管理规范》(卫生部令第90号)及其附录的符合程度,验证对体系实施、保持和持续改进的有效性和充分性。
2、检查和评价公司计算机系统升级后,在质量体系运行是否正常有效, 是否具有可持续性.有效性,考核新版 GSP 质量条款实现程度,找出新计算机系统的薄弱环节和改进的机会。
3、检查和评价公司新修订的新版质量管理体系文件的适应性、可操作性,验证对体系实施、保持和持续改进的有效性和充分性。
4、检查公司质量方针和质量目标的贯彻落实情况,质量目标是否在各部门有效开展并得到实施。
五、审核范围:
公司与《药品经营质量管理规范》(卫生部令第90号)及其附录内容相关的工作。
六、审核依据:
1、《中华人民共和国药品管理法》及其实施条例;
2、《药品经营质量管理规范》(卫生部令第90号)及其附录;
3、《湖北省药品批发企业GSP现场检查评定标准》(20xx年3月)。
七、内审方案:
1、依据内审日程安排,由内审组到各职能部门对其应实施的标准章节条款收集实施的内审证据。内审按《药品经营质量管理规范》(卫生部令第90号)中药品批发企业的质量管理的十四个部分,依照《湖北省药品批发企业GSP现场检查评定标准》进行检查的方法。
2、汇总内审结论、分析缺陷原因、提出改进措施、采取预防或追踪管理等方法,防止类似缺陷在其他方面、其他环节重复出现。
八、内审标准:
达到《湖北省药品批发企业GSP现场检查评定标准》(20xx年3月)的要求。
九、内审首、末次会议参加人员:
包括总经理和评审小组成员共9人(杨德柱 肖硕 付前霞 代小红 李厚霞 罗军 赵军宏 李莉 谢宏林 杨丽)。
十、内部审核综述:
1.公司设立了综合办公室、质管部、仓储部、采购部、销售部、财务部,建立了一系列与药品质量相关的组织机构,配备了符合《GSP》(卫生部令第90号)要求的岗位人员,修订了符合《GSP》(卫生部令第90号)及其附录要求的质量管理体系文件,建立和逐步完善了公司的质量管理体系。
2.公司于20xx年1月制订出培训计划。按计划积极进行了相关培训,目的为加强员工GSP
质量意识,规范操作,从而使员工质量管理意识及责任心大为加强。
3.在药品购进方面做到严把药品购进关,按《GSP》(卫生部令第90号)及其附录的要求,对供货单位执行质量信誉、资质及药品合法性的验证审核,特别是对首营企业、首营品种进行严格的审核。对药品入库按GSP规定的条款,逐批进行验收。在库药品的储存设有养护员,每月进行养护质量检查。严把出库质量复核关。药品销售有质量跟踪、售后服务等,做到药品购、存、销各环节严把质量关。
4.内审检查中发现按照《药品经营质量管理规范》(卫生部第90号令)及其附录的要求,我公司尚存在一些问题,问题如下:
1)储运部个别员工对质量方针、目标、操作流程和其岗位职责掌握不到位。
2)没有质量管理部及其人员履行职责的考核记录。
3)冷链专管员现场冷链装箱操作未严格按规范操作。
4)库房未配置冷库作业的防寒服。
5)库房设施设备的档案还在完善中。
6)抽查发现11月以前的冷链品种的收货未能严格按规范操作。
7)验证文件未归入药品质量管理档案管理。
8)常温库整货架上有灰尘。
9)信息管理员未按日进行数据备份。
10)抽查供货企业的资质发现少数供货企业法人委托书和随货同行单不符合新版要求。 希望相关部门人员积极配合公司将《药品经营质量管理规范》(卫生部第90号令)及其附录标准要求实施到位,抓紧时间将存在的问题整改到位,使公司顺利通过20xx年的GSP认证。 十一、下达整改通知书(见附件)
十二、审核报告发放范围:总经理、各部门经理。质管部存档一份。
十三、附件:
1. 红头文件——关于成立20xx年度质量管理体系内审小组的通知一份;
2. 质量管理体系内审会议通知一份;
3. 质量管理体系内审计划一份;
4. 首次会议签到表一张;
5. 质量管理体系内审日程安排表一份;
6. 质量管理体系内审记录表共36页;
7. 末次会议签到表一张;
8. 整改通知书4张;
内审组长:
二O一四年十二月二十日
第二篇:质量体系审核报告
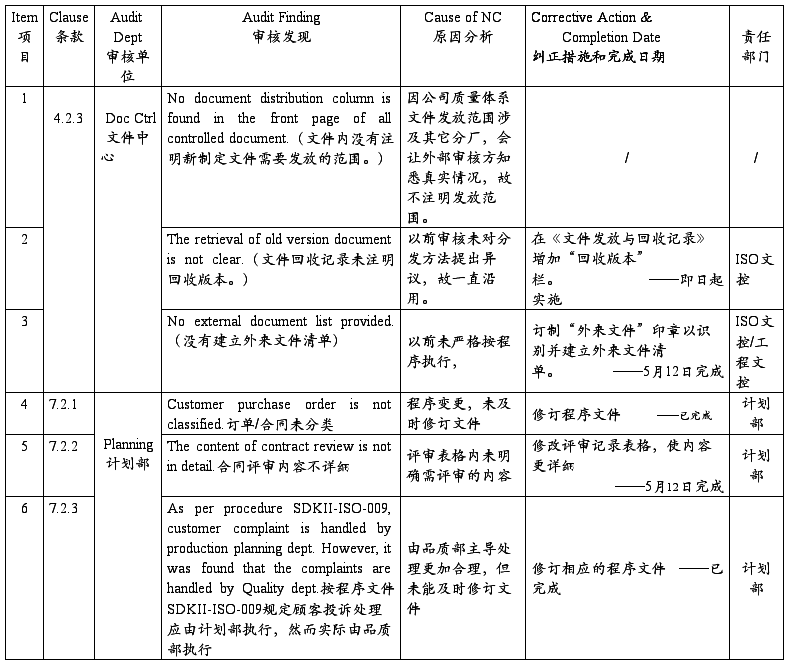
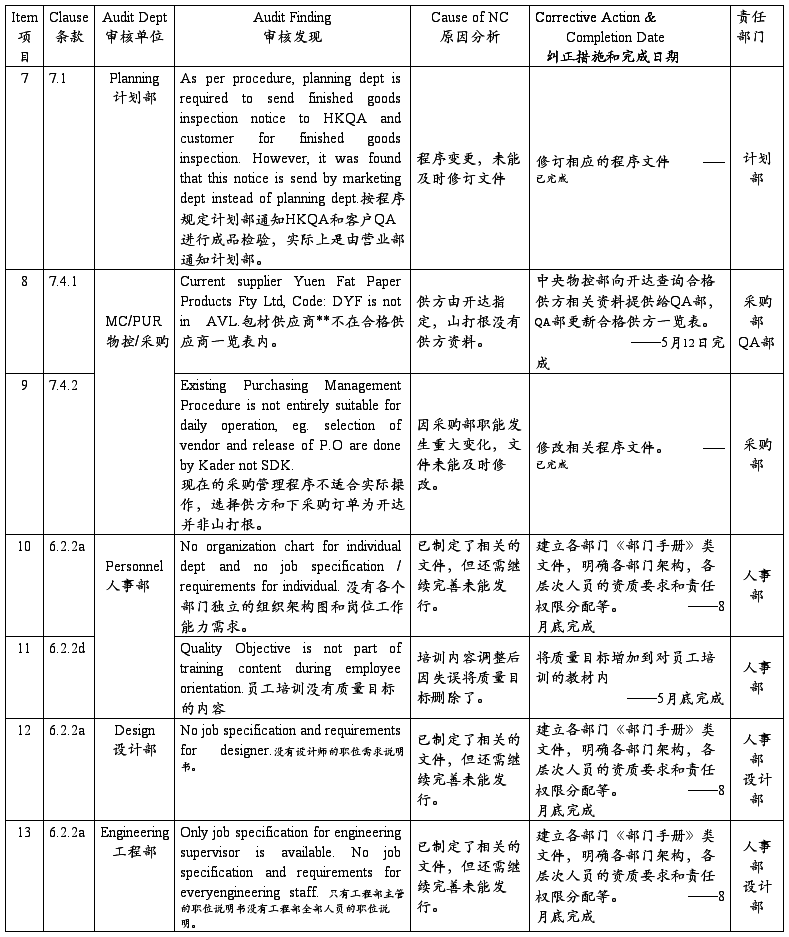
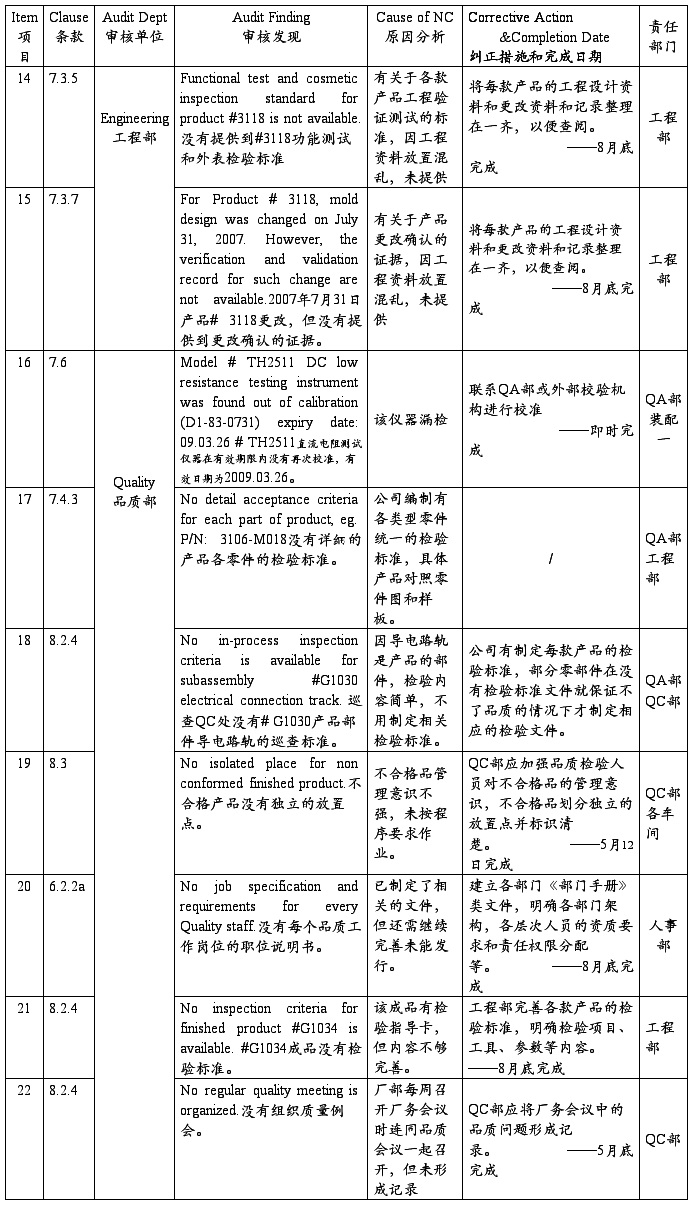
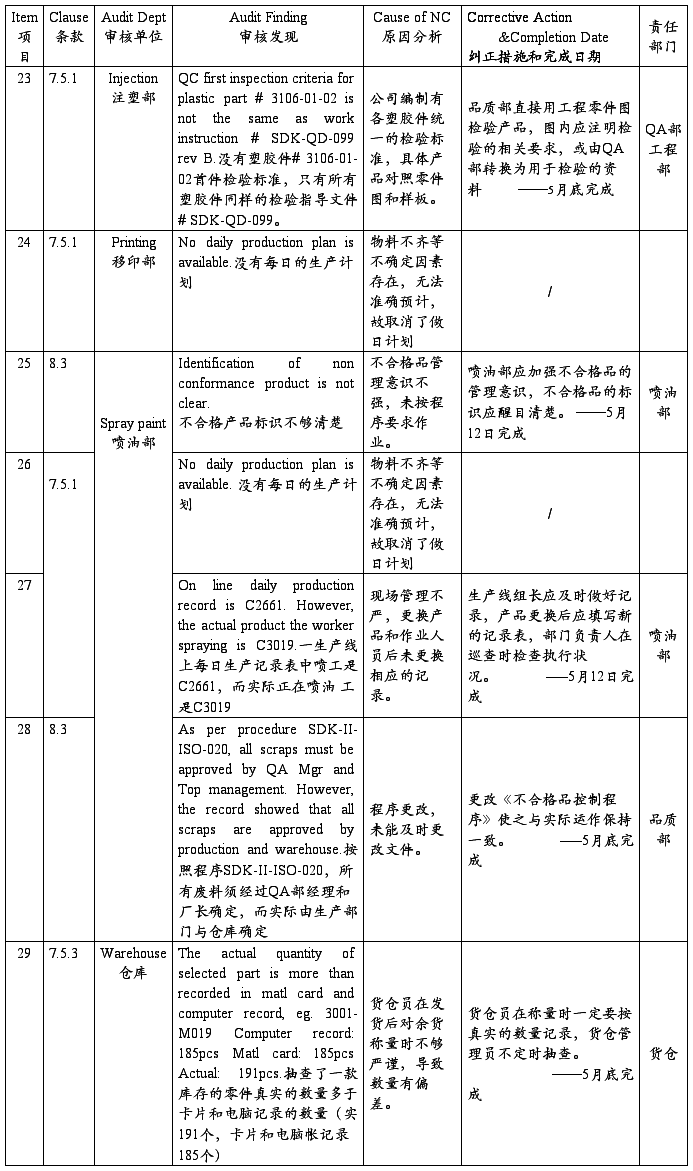
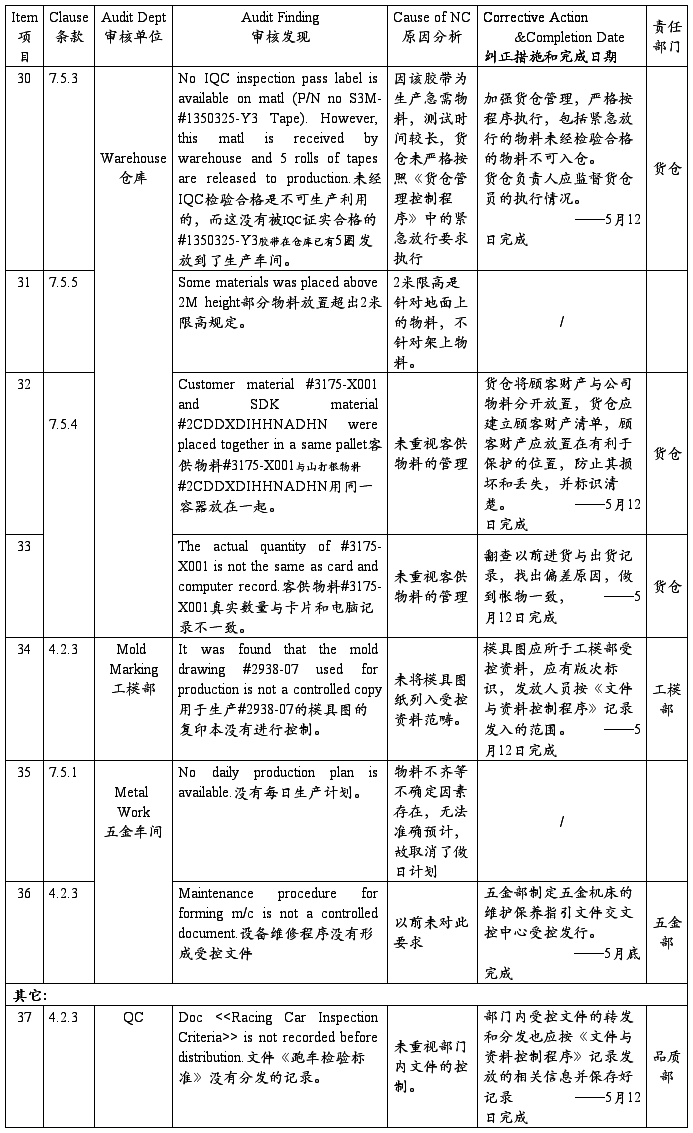
SZ Sanda Kan Quality System Audit NC Report(深圳山打根公司质量体系审核报告)

Page 1 of 6
Page 2 of 6
Page 3 of 6
Page 4 of 6
Page 5of 6
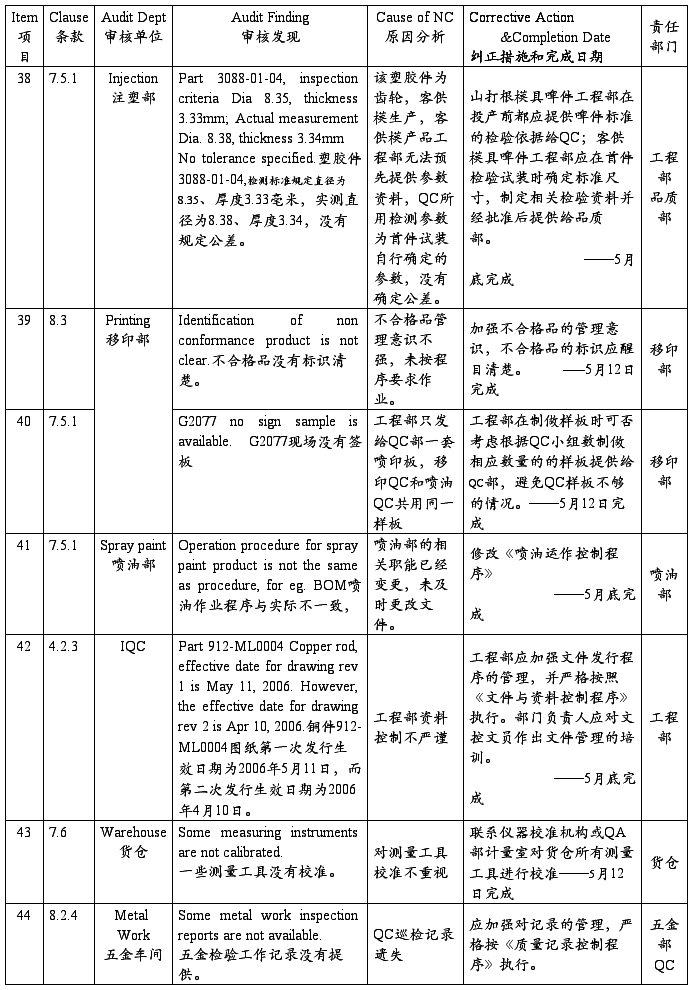
注:以上为开达审核部对公司质量体系审核发现的不符合项,ISO小组按其要求制定了相应的纠正措施和完成日期,并将责任划分到相关部门,相关部门一定按期进行整改。开达审核部会在下次审核时验证这些不符合项的整改落实情况。望各部门配合!
Page 6of 6
