实验八 己二酸的制备
一、实验目的
1、学习环己醇氧化制备己二酸的原理和方法;
2、掌握浓缩、过滤及重结晶等操作技能
二、实验原理
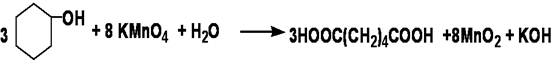
三、实验药品及其物理常数
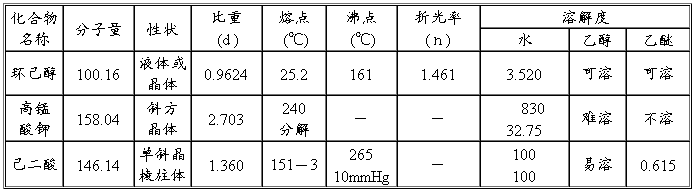
环己醇:2g 2.1ml (0.02mol);高锰酸钾 6g (0.038mol);0.3N氢氧化钠溶液 50ml;亚硫酸氢钠;浓盐酸
四、主要仪器和材料
水浴锅 三口烧瓶(100 mL、19#×3) 恒压滴液漏斗 空心塞(14#) 球形冷凝管(19#) 螺帽接头(19#,2只) 温度计(100℃) 布氏漏斗 吸滤瓶 烧杯 冰 滤纸 水泵等.
氧化剂可用浓硝酸、碱性高锰酸钾或酸性高锰酸钾。本实验采用碱性高锰酸钾作氧化剂
五、实验装置

六、操作步骤
(1)向250ml烧杯内加入50ml 0.3N氢氧化钠溶液,置于磁力搅拌上;
(2)边搅拌边将6g 高锰酸钾溶解到氢氧化钠溶液中;
(3)用滴管滴加2.1ml 环己醇到上述溶液中,维持反应物温度为43~47 ℃。
(4)当醇滴加完毕且反应混合物温度降低至43 ℃左右时,沸水浴将混合物加热,使二氧化锰凝聚。
(5)在一张平整的滤纸上点一小滴混合物以试验反应是否完成,如果观察到试液的紫色存在,那么可以用少量固体亚硫酸氢钠来除掉过量的高锰酸钾。
(6)趁热抽滤,滤渣二氧化锰用少量热水洗涤3次(每次2 mL),每次尽量挤压掉滤渣中的水分;
(7) 合并滤液和洗涤液,用4ml浓盐酸酸化至pH2.0;
(8) 小心地加热蒸发使溶液的体积减少到10ml左右,冷却,分离析出的己二酸。
(9) 抽滤、洗涤、烘干、称重、计算产率。
(10)测量产品的熔点和红外光谱,并与标准光谱比较。
【操作要点及注意事项】
1.KMnO4要研细,以利于KMnO4充分反应。
2. 滴加:本实验为强烈放热反应,所以滴加环己醇的速度不宜过快(1-2滴/秒),否则,因反应强烈放热,使温度急剧升高而引起爆炸。
3.严格控制反应温度,稳定在43~47℃之间。
4.反应终点的判断:
(1)反应温度降至43℃以下。
(2)用玻璃棒蘸一滴混合物点在平铺的滤纸上,若无紫色存在表明已没有KMnO4。
5.用热水洗涤MnO2滤饼时,每次加水量约5~10 ml,不可太多。
6.用浓盐酸酸化时,要慢慢滴加,酸化至pH=1~3。
7.浓缩蒸发时,加热不要过猛,以防液体外溅。浓缩至10 ml左右后停止加热,让其自然冷却、结晶。
8. 环己醇常温下为粘稠液体,可加入适量水搅拌,便于用滴管滴加;
9. 此反应是放热反应,反应开始后会使混合物超过45℃,假如在室温下反应开始5min后,混合物温度还不能上升至45℃,则可小心温热至40℃,使反应开始;
10. 要不断振摇或搅拌,否则极易爆沸冲出容器;
11. 最好是将滤饼移于烧杯中,经搅拌后再抽滤;
12. 为了提高收得率,最好用冰水冷却溶液以降低己二酸在水中的溶解度。
七、实验结果
1、产品性状: ; 2、理论产量:2.08g;
3、实际产量: ; 4、产率: .
四、实验步骤
在装有回流冷凝管、温度计、和滴液漏斗的100 mL三颈烧瓶中,放置18 mL (0.18 mol) 50% HNO3,及少许偏钒酸铵(约0.03g),并在冷凝管上接一气体吸收装置,用稀NaOH吸收反应过程中产生的二氧化氮气体。
滴液漏斗中加入6 mL(约0.06 mol)环己醇。
三颈烧瓶用水浴预热到50 oC左右,移去水浴,先滴入5~6滴环己醇,至反应开始放出二氧化氮气体,然后慢慢加入其余部分的环己醇,调节滴加速度,使瓶内温度维持在50~60oC之间。温度过高时,用冷水浴冷却,温度过低时,则用热水浴加热,滴加完毕约需15min。
加完后继续搅拌,并用80~90 oC的热水浴加热10min,至几乎无棕红色气体放出为止。然后将此热溶液倒入100ml的烧杯中,冷却后析出己二酸,抽滤,用15ml冷水洗涤两次,干燥,粗产物约6克。
粗制的己二酸可以在水中重结晶。纯己二酸为白色棱状晶体,产量约5.1 g,mp为153 oC。
五、实验注意点
1. 环己醇和硝酸切不可用同一量筒量取。
2. 偏钒酸铵不可多加,否则产品发黄。
3. 本实验为强烈放热反应,所以滴加环己醇的速度不宜过快,以免反应过剧,引起爆炸。一般可在环己醇中加1ml水,一是减少环己醇因粘稠带来的损失,二是避免反应过剧。
4. 实验产生的二氧化氮气体有毒,所以装置要求严密不漏气,并要作好尾气吸收。
第二篇:聚己二酸己二酯的制备
实验07
聚己二酸乙二酯的制备
具有双官能团或多官能团的单体通过缩合反应,彼此连在一起,同时消除小分子副产物,生成长链高分子的反应称为缩聚。缩聚反应分为线性缩聚反应和体型缩聚反应,利用缩聚反应能制备很多品种的高分子材料。
一.实验目的
1.本实验将通过改变己二酸乙二酯制备的反应条件,了解其对反应程度的影响;
2.分析副产物的析出情况,进一步了解聚酯类型的缩聚反应的特点。
二.实验原理
线性缩聚反应的特点是单体的双官能团间相互反应,同时析出副产物,在反应初期,由于参加反应的官能团数目较多,反应速度较快,转化率较高,单体间相互形成二聚体、三聚体、最终生成高聚物。
aAa+bBb?aABb+ab
aABb+aAa?aABAa+ab或aABb+bBb?bBABb+ab
a(AB)mb+a(AB)nb?a(AB)m+nb+ab
整个线性缩聚是可逆平衡反应,缩聚物的分子量必然受到平衡常数的影响。利用官能团等活性的假设,可近似的用同一个平衡常数来表示其反应平衡特征。聚酯反应的平衡常数一般较小,K值大约在4~10之间。当反应条件改变时,例如副产物ab从反应体系中蒸除出去,平衡即被破坏。除了单体结构和端基活性的影响外,影响聚酯反应的主要因素有:配料比,反应温度,催化剂,反应程度、反应时间、去除水的程度等。
配料比对反应程度和聚酯的分子量大小的影响很大,体系中任何一种单体过量,都会降低聚合程度;采用催化剂可大大加快反应速度;提高反应温度一般也能加快反应速度,提高反应程度,同时促使反应生成的低分子产物尽快离开反应体系,但反应温度的选择是与单体的沸点、热稳定性有关。反应中低分子副产物将使逆反应进行,阻碍高分子产物的形成,因此去除副产物越彻底,反应进行的程度越大。为了去除水分,本实验可采取提高反应温度,降低系统压力,提高搅拌速度和通入惰性气体等方法。此外,在反应没有达到平衡,链两端未被封锁的情况下,反应时间的增加也可提高反应程度和分子量。
在配料比严格控制在1:1时,产物的平均聚合度Xn与反应程度(P)具有如下关系:Xn=1/(1-P),假如要求Xn=100,则需使P=99%,因此,要获得较高分子量的产品,必须提高反应程度,反应程度可通过析出的副产物的量计算:P=n/n0,其中n为收集到的副产物的量,n0为反应理论产生的副产物的量。
本实验由于实验设备、反应条件和时间的限制,不能获得较高分子量产物,只能通过反应条件的改变,了解缩聚反应的特点以及影响反应的各种因素。
聚酯反应体系中,有羧基官能团存在,因此通过测定反应过程中的酸值的变化,可了解反应进行的程度(或平衡是否达到)。
三.主要仪器和试剂
实验仪器:
实验仪器装置如图7-1、图7-2,其中包括250ml三口瓶一个、搅拌器一个、分水器一个,温度计一个、球形冷凝管一个,100ml和250ml量筒各一个,培养皿。
实验试剂:
己二酸,乙二醇,对甲苯磺酸,十氢萘。
四.实验步骤
实验仪器装置如图7-1、图7-2所示:
在三口瓶中先后加入己二酸36.5克和乙二醇14ml,少量对甲苯磺酸及15ml
十氢萘,分水器内加入15ml十氢萘。用电热锅加热,在搅拌下15min内升温至160?C并保持(160±2)℃1.5小时,每隔15分钟记录一次析出水量。然后将体系升温至(200±2)℃再保持此温度1.5小时,同时每隔15分钟记录一次析出水量。
将反应装置改成减压系统(放出分水器中的水,在(200±2)℃,13.3KPa(100mmHg)压力下反应0.5小时,同时记录在此条件下的析水量。反应
停止,趁热倒出聚合物,冷却后,得白色蜡状固体,称重。
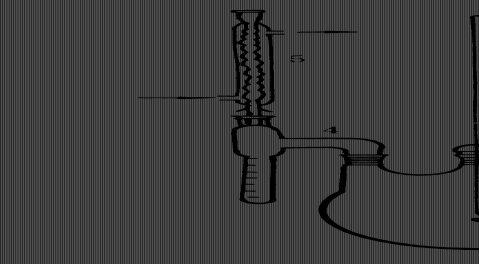
图7-1聚己二酸乙二醇酯制备装置图7-2聚酯减压装置
1.250ml三口烧瓶;2.温度计;3.搅拌器;4.分水器;5.球形冷凝管
实验07
聚己二酸乙二酯的制备
班级:姓名:学号:同组实验者:指导教师签字:实验日期:评分:(实验过程中,认真记录并填写本实验数据,实验结束后,送交指导教师签字)实验数据记录:己二酸用量:
十氢萘用量:
聚合温度:
聚合物重量:
产率:克克℃克%乙二醇用量:聚合时间:毫升小时实验过程记录:
讨论与问题
1.本实验起始条件的选择原则是什么?说明采取实验步骤和装置的原因。
2.根据实验结果画出累积分水量与反应时间的关系图,并讨论反应特点,讨论分水量与反应程度、聚合度的关系。
3.如何保证投料配比的等摩尔数?
