制表单位:
紧急□ 一般√ 编号:□□□□□□□□□□□□□□□
药 品 不 良 反 应 报 告 表(医疗单位使用)
医院名称:解放军第251医院 科别:呼吸科 电话:8785120 报告日期: 20xx年1月18日
患者姓名:高凤荣 性别:男□女√
体重:56
家族药品不良反应:有□无□不详√ 出生日期:19xx年4月2日 民族:汉 (kg)
病历号:235674
(门诊号) 工作单位或地址:张家口市二毛纺厂
反应情况:有√ 无□ 不详□
原患疾病:慢性气管炎急性发作 不良反应
名 称: 速发性哮喘反应 不良反应发生时间:20xx年1月19日 电话:8161684 既往药品不良
不良反应的表现:
(包括临床检验)
因慢性气管炎急性发作,抗感染治疗及雾化吸入后,症状消失,用5%葡萄糖注射液500ml加黄芪注射液30ml静滴,用药2min,出现胸闷、呼吸困难、气喘、张口呼吸,查双肺满布哮鸣音,考虑为黄芪注射液致速发性哮喘反应。
不良反应处理情况:
立即停止静滴黄芪注射液,吸氧,给予地塞米松注射液10mg,3min后,呼吸困难、气喘改善,2h后症状消失,双肺呼吸音清,无哮鸣音。
药品名称
生产厂家 批号 剂型 用药途径 日剂量 用药起止时间 用药原因
怀疑引起不良反应的药品
黄芪注射液 石家庄市神威药业有限公司 30ml 20xx年1月17日
慢性气管炎急性发作 0310621 注射液 静滴 10:00-10:02
并用药品
5%葡萄糖注射液 251医院制剂中心 031107 20xx年1月17日
溶媒 灭菌溶液 静滴 500ml 10:00-10:02
不良反应的结果: 治愈√
间: 年 月 日
对原患疾病的影响:不明显√ 病程延长□
不良反应分 析
1.用药与不良反应的出现有无合理的时间关系? 有√ 无□ 导致死亡□ 病情加重□ 导致后遗症□ 表现: 好转□ 有后遗症□ 表现: 死亡□ 直接原因: 死亡时
2.反应是否符合该药已知的不良反应类型? 是√否□不明□
3.停药或减量后,反应是否消失或减轻? 是√ 否□ 不明□ 未停药或未减量□
4.再次使用可疑药品后是否再次出现同样反应? 是□ 否□ 不明□ 未再使用√
5.反应是否可用并用药的作用、患者病情的进展、其他治疗的影响来解释? 是□ 否√ 不明□
关联性评价
名:
国家药品不良反应监测中心: 肯定□ 很可能□ 可能□ 不太可能□ 未评价□ 无法评价□ 签名:
其它:
报告人职业: 医生√ 药师□ 护士□ 其他□
报告人签名: ****** 省级药品不良反应监测机构: 肯定□ 很可能□ 可能□ 不太可能□ 未评价□ 无法评价□ 签
第二篇:药品不良反应
药品不良反应/事件报告表
报告表的填写方法
《药品不良反应/事件报告表》是药品安全性监测工作的重要档案资料,需要永久保存,务必要用钢笔填写。填写的内容和字迹要清楚、整洁;不用不规范的符号、代号,不用草体签名。报告表中选择项划√,叙述项应准确、简明。
1. 药品不良反应/事件报告表的填写
每一个患者填写一张报告表。个人报告建议由专业人员填写,可以是诊治医务人员、生产企业、经营企业专(兼)职人员及专业监测机构人员。尽可能详细填写所有项目。无法获得的项目,填写“不详”。空间不够时可附页,注明“附件”。所有附件应按顺序表明页码,并指出所描述的项目的名称。
如果报告的是补充报告请填写与原始报告相同的编号并在报告左上方注明“补充报告”与原始报告重复的部分可不必再填写。补充报告也可不填写报告表只需要对补充部分附纸说明即可。
填写详细要求:
(1) 新的□ 严重□ 一般□
“一般”是指新的、严重的药品不良反应以外的所有药品不良反应。“新的”可与“严重”或“一般”复选,而“严重”与“一般”只能二选一。
(2)编码
编码为各级药品不良反应监测机构在网络报告时自动生成。
(3) 单位名称
填写发现并报告药品不良反应的单位名称,要求填写全称,如不可填“人民医院”,应填写“﹡﹡省人民医院”,“﹡﹡省﹡﹡市人民医院”。
(4)部门
部门应填写标准全称或简称,如“普通外科二病房”或“普外二”,“质保部”。
(5)电话
电话号码应填写报告部门电话,注意填写区号,如:010-67164979。
(6)报告日期
报告日期应为填写报告日期,如:20xx年3月3日。
(7)患者姓名
填写患者真实全名。
当新生儿被发现有出生缺陷时,如果报告者认为这种缺陷可能与孕妇在怀孕期间服用药品有关,患者为新生儿。
如药品不良反应涉及胎儿/乳儿或母亲,或者两者均涉及,报告者认为这种缺陷可能与孕妇在怀孕期间服用药品有关时:
如药品不良反应没有影响胎儿/乳儿,患者是母亲;
如药品不良反应的结果是胎儿死亡或自然流产,患者是母亲;
如只有胎儿/孩子出现药品不良反应(除了死亡或自然流产),患者是胎儿/乳儿,将母亲使用的可能引起胎儿/孩子出现药品不良反应的药品列在可疑药品栏目中;
如胎儿/乳儿和母亲都有药品不良反应发生,应填写两张表,并注明两张表的相关性。
(8)出生日期
患者的出生日期,出生年应填写4位如无法获得日期,应填写发生药品不良反应时的年龄。
(9)体重
注意以千克(公斤)为单位,如果不知道准确的体重,请做一个最佳的估计。
(10)联系方式
最好填写患者的联系电话或者移动电话。
如果填写患者的通信地址,请附上邮政编码。
(11)家族药品不良反应/事件
根据实际情况在相应方框填入√。在填写选择项时应规范使用√,不应使用×等其它标志,避免理解偏差。如果需要详细叙述,请另附纸说明。
(12)既往药品不良反应/事件情况
既往药品不良反应/事件情况包括药物过敏史。如果需要详细叙述,请另附纸说明
(13)不良反应/事件名称
不良反应/事件名称应填写不良反应中最主要的表现。例如:不良反应表现:患者从Ⅹ年Ⅹ月Ⅹ日开始使用Ⅹ,1次/日,静滴,两天后患者胸腹部出现斑丘疹,有瘙痒感。继续使用后丘疹面积增大。不良反应名称可填写瘙痒、斑丘疹。对于临床医生来说,不良反应/事件名称相当于病历中的主诉,为病人感受最主要的疾苦或最明显的症状和体征。不良反应/事件名称的选取参考《WH0药品不良反应术语集》
(14)不良反应/事件发生时间
填写不良反应发生的确切时间。
当一个新生儿被发现有出生缺陷,不良反应/事件的发生时间就是孩子的出生日期。
当一个胎儿因为先天缺陷而发生早产或流产时,不良反应/事件的发生时间就是怀孕终止日期。
(15)病历号/门诊号
认真填写患者的病历号(门诊号)以便于对病历详细资料的查找。
企业报告时需填写病例发生医院的名称。
(16)不良反应/事件过程描述(包括症状、体征、临床检验等)及处理情况
在填写不良反应/事件的开始时间和变化过程时,要用具体时间,如X年X月X日,不要用“入院后第X天”,“用药后第X天等”。
在填写不良反应/事件的过程时,要求摘要描述。在填写不良反应/事件的表现时要尽可能明确、具体,如为过敏型皮疹,要填写皮疹的类型、性质、部位、面积大小等;如为心律失常,要填写何种心律失常;如为上消化道出血,有呕血者需估计呕血量的多少等。与不良反应/事件有关的临床检验结果要尽可能明确填写,如怀疑某药引起血小板减少症,应填写病人用药前的血小板计数情况及用药后的变化情况,如怀疑某药引起药物性肝损害,应填写用药前后的转氨酶水平,同时要填写肝炎病毒学检验结果,所有检查要注明检查日期。
此外,应注意填写与不良反应/事件发生有关的患者病史,如:
① 高血压、糖尿病、肝/肾功能障碍等
② 过敏史、怀孕史、吸烟史、饮酒史、药物滥用史等
不良反应的处理情况,填写本次发现的不良反应/事件的处理情况,主要针对不良反应/事件而采取的医疗措施,包括为分析因果关系而采取的措施和相应结果,如补做皮肤实验的情况。
(17)怀疑药品
这一栏主要填写填表人认为可能是引起不良反应/事件的药品,如认为多种药品均可能,可将情况同时填上。如果有四个以上的怀疑药品(含四个),可另附纸说明。如果报告人认为药品和医疗器械都可能与不良反应/事件的发生有关,请将怀疑医疗器械填报《医疗器械不良事件报告表》,并在两张报告表中注明相关性。
商品名称:填写药品的商品名。如果没有或者不知道商品名,填写不详。
通用名称:填写完整的通用名,不可用如“氨苄”,“先V”等简称。监测期内的药品、进口药上市5年内的药品应在通用名称左上角予以注明。
生产厂家:生产厂家要求填写全名(包括所在省、市),不可填“上五”、“白云”等。
批号:填写药品包装上的生产批号,如980324。
用法用量:描述患者如何使用该药品。例如:500mg每天四次口服或者l0mg隔日静脉滴注。如系静脉给药,需注明静脉滴注、静脉推注或者“小壶”给药等。对于规定要缓慢静脉注射的药品应注明是否缓慢注射。
用药起止时间:指使用药品的同一剂量的开始时间和停止时间。如果用药过程中改变剂量应另行填写该剂量的用药起止时间,并予以注明。用药起止时间大于一年时,填写XXXX年X月X日-XXXX年X月X日的格式;用药起止时间小于一年时,填写X月X日-X月X日的格式;如果使用某种药品不足一天,可填写用药持续时间。例如:一次或者静脉滴注一小时。
用药原因:应尽可能具体填写,如原患高血压性心脏病的病人,合并肺部感染而注射氨苄青霉素引起不良反应,此栏应填肺部感染。
(18)并用药品
不良反应/事件发生时,患者同时使用的其他药品或医疗器械(不包括治疗不良事件的药品),而且报告人并不认为这些药品或医疗器械与不良反应/事件发生有关。
并用药品的信息常常能够发现以前不知道的药品之间的相互作用,或者可以提供不良反应的另外的解释,故请列出与怀疑药品相同的其他信息。
如果有四个以上的并用药品(含四个),可另附纸说明。
(19)不良反应/事件的结果
不良反应/事件经采取相应的医疗措施后的结果,不是指原患疾病的后果。例如患者的不良反应/事件已经痊愈,后来又死于原患疾病或与不良反应/事件无关的并发症,此栏仍应填”治愈”。
不良反应经治疗后明显减轻,在填写报告表时没有痊愈,但是经过一段时间可以痊愈时,选择“好转”。 不良反应经治疗后,未能痊愈而留有后遗症时,应注明后遗症的表现。
患者因不良反应导致死亡时,应指出直接死因和死亡时间。
对于不良反应结果为有后遗症或死亡的病例,应附补充报告(病历资料)。
(20)原患疾病
即病历中的诊断,诊断疾病应写标准全称。如急性淋巴细胞白血病,不能写AIL。
(21)对原患疾病的影响
不良反应/事件对原患疾病产生的影响,依据实际情况选择。
(22)国内/国外有无类似不良反应(包括文献报道)
视实际情况填写,如果为文献报道,请附页列出文献名称。
(23)关联性评价
由报告人、报告单位及各级药品不良反应监测机构填写,判断依据是表后所附的不良反应/事件分析。
(24)报告人职业(医疗机构)
依据实际情况做出选择。
(25)报告人职务职称(企业) 依据实际情况填写 (26)报告人签名
报告人签名应字迹清晰,容易辨认。 如果为个人投诉的报告,在此处注明。 (27)不良反应/事件分析
药品与不良反应之间的因果关系评价是很复杂的,国际上也有很多分析方法,我国使用的分析方法主要有以下五条原则:
①用药与不良反应/事件的出现有无合理的时间关系? ②反应是否符合该药已知的不良反应类型? ③停药或减量后,反应/事件是否消失或减轻?
④再次使用可疑药品后是否再次出现同样反应/事件?
⑤反应/事件是否可用并用药的作用、患者病情的进展、其他治疗的影响来解释? 填表人根据实际情况选择。
根据该分析标准,将关联性评价分为肯定、很可能、可能、可能无关、待评价、无法评价五级。
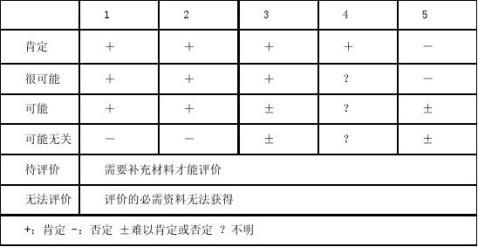
填表人根据实际情况选择。 (29)其它
填写报告者认为有必要说明的情况应附页说明。
(30) 药品生产企业报告新的、严重的药品不良反应/事件病例的要求 ①填报《药品不良反应/事件报告表》; ②产品质量检验报告;
③药品说明书(进口药品还须报送国外药品说明书);
④产品注册、再注册时间,是否在监测期内(进口药是否为首次获准进口5年内);
⑤产品状态(是否是国家基本药物、国家非处方药、国家医疗保险药品、中药保护品种); ⑥国内上年度的销售量和销售范围;
⑦境外使用情况(包括注册国家、注册时间);
⑧变更情况(药品成分或处方、质量标准、生产工艺、说明书变更情况); ⑨国内外临床安全性研究及有关文献报道情况;
⑩除第1、2项以外,其他项目一年之内如无变更,可以免报。 2. 药品群体不良反应/事件报告表的填写 对医疗卫生机构报告要求
医疗卫生机构报告药品群体不良反应/事件时应提供以下信息: (1)事件描述
①发生时间 ②地点
③涉及药品名称
④药品不良反应/事件主要表现 ⑤诊治过程 ⑥转归情况
⑦在该地区是否为计划内免疫药品
(2)典型病例详细填写《药品不良反应/事件报告表》
(3)报告人及联系电话
药品生产企业报告要求
药品生产企业报告药品群体不良反应/事件时应提供以下信息:
(1)事件发生、发展、处理等相关情况
(2)药品说明书(进口药品须提供国外说明书)
(3)质量检验报告
(4)是否在监测期内(进口药是否为首次获准进口五年内)
(5)注册、再注册时间
(6)药品生产批件
(7)执行标准
(8)国内外药品安全性研究情况、国内外药品不良反应发生情况包括文献报道
(9)典型病例详细填写《药品不良反应/事件报告表》
(10)报告人及联系电话
省、自治区、直辖市药品不良反应监测中心报告要求
省、自治区、直辖市药品不良反应监测中心报告药品群体不良反应/事件时应提供以下信息:
(1)组织填写《药品群体不良反应/事件报告表》
(2)整理、分析收到材料
(3)提出关联性评价意见
(4)密切关注事件后续发展
(5)事件过程详细调查报告(事件发生、发展、处理、结果等)
药品群体不良反应/事件报告表的具体填写要求
(1)商品名
填写药品的商品名。如果没有或者不知道商品名,填写“不详”。
(2)通用名
填写完整的通用名,不可用简称,同时填写剂型。
(3)规格
注意要标明单位。
(4)生产单位
药品生产企业,进口药品填写药品的总代理商。
(5)使用单位
将药品用于人体的单位,主要是医疗卫生机构。
(6)使用人数
同一事件中所有使用该药品的人数。
(7)发生人数
出现不良反应/事件的人数。
(8)事件发生地点
出现不良事件的地点,如某市某小学。
其余栏目要求同《药品不良反应/事件报告表》
3. 《药品不良反应/事件定期汇总表》的填写
该汇总表仅要求药品生产企业填写,包括进口药品的国内总代理。一个品种填写一张《药品不良反应/事件定期汇总表》
所生产品种有无不良反应/事件发生,企业均应根据规定提交汇总报告表;
报告的同时要附汇总时间内药品说明书一份,质量标准一份;
栏目如无情况说明请注明“无”,如表格空间不够可另附页说明。
第一部分 生产企业联系方式
应详细填写生产企业联系方式,出现变更需提交说明。
第二部分 产品基本信息
(1)商品名
填写药品的商品名。
(2)通用名
填写完整的通用名,不可用简称,要同时填写剂型。
(3)再注册时间
最近一次再注册时间。
(4)药品成分或处方变更情况
包括变化成分及原辅料名称、剂量、变更依据等。
(5)境外情况
国产药提供出口及国外使用情况,进口药提供国外使用情况。
(6)相关研究
包括文献、综述、研究报告。
只需列明题目、发表论文出处、研究内容论点,对应详细资料另附。 第三部分 药品不良反应/事件发生情况
(1)不良反应/事件名称
要求参照《WH0药品不良反应术语集》填写标准名称。
(2)信息来源
临床——指本企业进行的临床试验中发现的不良反应/事件病例数。
个人——收集的散在的病例报告,包括来自医疗机构和患者投诉的病例报告。 文献——主要指国内文献中的病例报告。
研究——非本企业进行的研究,包括临床试验。
其它——包括国外文献等其他以上为涵盖的来源。
(3)频数
后面栏目例数之和。
(4)出现药品不良反应/事件总人数
总例数,可能小于频数。
