药 品 不 良 反 应 / 事 件 报 告 表
报告类型:新的□ 严重□ 一般□ 首次报告□ 跟踪报告□ 编码:

第二篇:我院20xx年度药品不良反应报告分析(终板)
我院20##年度药品不良反应报告情况汇总分析
截止到20##年10月底,我院共上报药品不良反应510例,其中新的药品不良反应104例(新的严重、新的一般),严重不良反应38例。
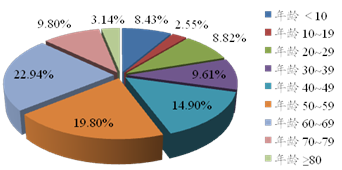
1. 性别及年龄分布情况
在510例药品不良反应中,女性患者为269例,构成比为52.75%,女性多于男性。其中60~69岁为药品不良反应高发年龄,占全部药品不良反应的22.94%;其次为50~59岁,占19.80%。



2. 涉及药品类型分析
本年度上报的药品不良反应涉及的药品种类有18个类别262个品种,引发ADR的药品品种分布(见表1)
肿瘤用药引发的不良反应最多,占全部的18.47%,可能与我院收治肿瘤患者较多,或者使用细胞毒类药物更易引发药物不良反应有关;感染用药次之,占16.90%;需要特别说明的是,今年对比剂引发的不良反应报告较往年有所上升,提醒使用的各相关科室警戒,严格把控适应证并做好使用对比剂的准备工作;另外有14例药品不良反应由临时采购药品引发,需要进一步把控临时采购药品质量、规范临时采购药品的使用。
表1 引发ADR/ADE的药品品种例数及分布

3. 引发ADR给药途径分析
静脉滴注给药引发的不良反应最多,其构成比为64.12%;口服给药为22.55%。

4. ADR迟滞时间的分析
国家药品不良反应上报时限要求:新的、严重的药品不良反应上报时限不超过15日;一般的药品不良反应上报时限不超过30日。
在本次药品不良反应分析中,新的、严重的药品不良反应共计129例,符合规定的85例仅占66%,尚有4例上报时限超过100天,距离规定相去甚远,属回忆性填报;一般不良反应共计380例,符合上报时限的335例占88%;上报时限总合格率为82.6%。建议临床各科室严格按规定时限上报,增强ADR信息的真实性和时效性。
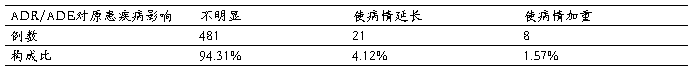
5.510例ADR的转归与药品引发ADR后对原患疾病的影响:
表2 ADR/ADE转归情况

表3 ADR/ADE对原患疾病影响
6.对引发38例严重不良反应的药品种类分析:
在上报《药品不良反应/事件报告》中,评价为“严重”级别的ADR所涉药品种类、转归及对原患疾病的影响见表2
表4 药品种类、引发的严重ADR类型、转归及对原患疾病影响

引发新的ADR药物有:左氧氟沙星注射液、注射用氟脲苷粉针、奥硝唑注射液、碘海醇注射液、注射用七叶皂苷钠、人凝血酶原复合物、曲安奈德注射液、特布他林喷雾剂、地尔硫卓片、美托洛尔片、华法林各1例,血必净注射液2例。
介于中药制剂血必净注射液引发2例严重的速发型ADR,警戒我们在使用时,备好抢救药物和措施;并密切观察患者临床症状、体征变化。1例严重的精神障碍由氨曲南引发,应予注意。
7.不合理用药导致的ADE被认定为ADR的典型病例
①.由药品的未注册用法造成,即“超说明书用药”造成
3例严重ADR需要引起我们特别的警戒!均为外院转来。
上报序列号130502-1-517147-201400441:由于椎管注射曲安奈德和甲钴胺造成截瘫,属于超说明书用法;上报序列号130502-1-517147-201400025由于患者自行增加药物地尔硫卓、美托洛尔两种药物剂量,造成心脏停搏、结性逸搏此例属于药物的超量使用;上报序列号130502-1-517147-201400120是由诊所治疗造成红疹性药疹后入住我院,所用药物不清,原因不明。
建议:临床科室今后在医学实践中一定要详读说明书,做好评估药品非注册用法给患者带来收益/风险,避免纠纷的发生。
②1例ADE,上报序列号130502-1-517147-201400333,患儿因支气管炎,白细胞(WBC):14.32*10^9/L,怀疑合并细菌感染,临床给予头孢甲肟,输液配制按照说明书,输液完毕后输液袋中可见药物颗粒残留。
建议:临床配制时一定要按说明书1g头孢甲肟注入0.9%氯化钠注射液或葡萄糖注射液约5ml溶解液于瓶内溶解,然后转移到不少于100ml溶液中进行滴注。因为注射用盐酸头孢甲肟,为白色至浅橘黄色结晶或结晶性粉末,极微溶于水。辅料无水碳酸钠为助溶剂,在溶解时有二氧化碳产生,1g盐酸头孢甲肟注入约5mL溶液溶解,然后稀释给药。静滴时不可使用注射用水溶解。因溶解后的溶液不等渗。本药溶解后应在12h内使用。
③中药制剂血必净、喜炎平等在使用时进行辩证施治,并输液前后加隔离液,护士输液时在患者身旁观察30分钟再离开。
8.510例ADR所累及的系统-器官及临床表现:
表5 不良反应累及器官-系统情况

注:1.药品分类按《中国国家处方集》划分;
2.累及的器官-系统名称按《药品不良反应术语集》划分
9.总结:
20##年1-6月份上报ADR19例,漏报率太高,主要原因是对ADR认识不足、培训不到位造成。进入7月后,随着医院加强了对医疗安全重视以及对医护人员进行ADR培训,由于对医疗安全认识的深入,我院上报ADR逐月增多,截止10月底上报ADR510例,新的、严重的ADR 129例。通过对我院ADR病例情况分析,说明在药物治疗过程中,一方面要加强用药管理,严格药物的适应证,合理的选择给药剂型;另一方面加强医药护协作,做好用药监护,密切观察患者用药后的病情变化,早发现、早治疗,减少ADR发生,保障患者用药安全。
另外,敬大家注意:一定要本着“怀疑即报”原则,真实、准确、完整填报不良反应。此条款为“三甲评审”核心条款,请大家如实记录在病程或药物使用的分析中,增强真实性、时效性、可追溯性。
