鲁科版化学必修4
第三章第二节弱电解质的电离盐类的水解
第四课时盐类水解的应用
高二化学组王振
2011 12
一、教材分析
在前几节课,学生已经学习了盐类水解的原理以及影响盐类水解平衡移动的因素,本节课在此基础上继续探讨盐类水解的应用。体现化学与实际生活的联系,让学生知道化学是为人类生活而服务的。
二、教学目标
1、知识与技能
利用盐类水解规律解释某些化学现象及其在实验室、工农业生产和实际生活中的应用。
2、过程与方法
培养学生依据客观事实解决问题的逻辑思维能力。
3、情感态度与价值观
引导学生树立“透过现象,抓住本质”的辩证唯物主义观点。培养学生善于观察、勤于思考的科学态度。
三、教学重难点
掌握盐类水解的应用
四、教学方法
引导探究法
五、教学过程
【复习】1、盐类的水解的概念:在溶液中盐电离出来的离子跟水所电离出来的H+或OH-结合生成弱电解质的反应,叫做盐类的水解。
水解的条件:可溶性盐和有弱离子。
水解的实质:促进了水的电离平衡。
水解的结果: 使溶液呈现酸碱性。
水解反应与中和反应的关系:是中和反应的逆反应,是吸热反应。
2、影响盐水解的因素:温度、浓度、外加酸碱。
【导入】学习了这么多基础理论知识以后,有没有考虑过这些理论知识有什么用处?今天我们就来一起探讨一下盐类水解的应用,它包括在实验室、工业、农业以及日常生活中的各种应用。
【板书】盐类水解的应用
【讲述】化学是一门以实验为基础的学科,所以要做大量的实验。在化学实验室里,有很多药品和配制好的溶液。
【展示】实验室药品和溶液的存放的图片。
【讲述】那么这些药品的存放和溶液的配制,有哪些地方需要注意的呢?
【思考】首先来看一个问题:为什么用热水配制CuCl2溶液,溶液会出现浑浊?怎样配制澄清溶液?
【板书】一、化学实验中的盐类水解问题
1、配制和保存易水解的盐溶液
【学生回答】铜离子是弱碱阳离子,发生水解生成氢氧化铜。当温度高时,促进了盐类的水解,氢氧化铜的量增多,于是产生了沉淀。
【讲述】配制CuCl2溶液,为防止出现浑浊,应加少量的稀盐酸。
【思考】用热水配制硫酸铁溶液时,同样会产生混浊?怎样才能用热水配制出澄清的硫酸铁溶液?
【学生回答】配制Fe2(SO4)3溶液,要先加少量的稀H2SO4。
【总结】配制易水解的金属盐溶液时应加少量的阴离子所对应的酸。
【讲述】这是溶液配制需要考虑的问题,配好以后就需要贮存起来。在贮存时需要考虑什么问题呢?先思考一个问题:实验室盛放氢氧化钠溶液的试剂瓶是用的什么瓶塞?
【板书】2、试剂瓶瓶塞的选用
【学生回答】橡胶塞。
【思考】原因是什么?
【学生回答】玻璃中的二氧化硅可以与氢氧化钠溶液反应产生硅酸钠,具有粘性,使瓶口不易打开。
【思考】盛放Na2CO3溶液的试剂瓶为什么也必须用橡胶塞?
【学生回答】Na2CO3溶液水解显碱性,也可以与玻璃中的二氧化硅发生反应。
【板书】实验室贮存碱性溶液的试剂瓶通常使用橡胶塞。
【思考】有时候配制溶液时会引入杂质,例如如何除去MgCl2溶液中少量的Fe3+离子?
【板书】3、除杂问题
【学生回答】Fe3+水解生成Fe(OH)3和H+,当加MgO或Mg(OH)2时,会与H+反应,溶液中有较多的Fe(OH)3,可以沉淀下来,于是可以除去Fe3+。
【板书】溶液中,某些离子的除杂,需考虑盐的水解。
【讲述】这是化学实验时需要考虑的盐类的水解的问题,下面再来看一下在农业生产中的应用。
【展示】两张图片,讨论农作物长势良好的原因。
【总结】需要施肥,打农药等。
【讲述】今天我们主要讨论如何正确施肥。看一个绕口令:灰混肥,肥混灰,灰肥相混损肥分。分析草木灰和铵态氮肥混合使用,为什么会损肥分?
【板书】二、农业生产中的盐类水解问题
【学生回答】草木灰的成分:K2CO3,水解呈碱性;铵态氮肥:铵盐,水解呈酸性。混施后,OH-与H+中和成水,使两种盐的水解平衡向右移动,以至生成较多的NH3·H2O,在光照的情况下, NH3·H2O进一步分解成NH3逸出了,从而降低了肥效。
【讲述】实际上在工业上也会用到水解的原理。首先我们来看一个问题:金属镁与水反应比较困难,若加一些NH4Cl马上产生大量气体?为什么?
【板书】三、工业生产中的盐类水解问题
【学生回答】NH4+水解显酸性,产生H+,可以与镁发生反应。
【讲述】金属焊接时,需要除去金属表面的氧化膜,常用ZnCl2、NH4Cl,而不用盐酸。
【讲述】最后来看一下在日常生活中盐类水解的问题。
【板书】四、日常生活中的盐类水解问题
【思考】你知道为什么能用明矾(KAl(SO4)2·12H2O)来净水吗?
【学生回答】Al3+水解生成Al(OH)3 (胶体),Al(OH)3胶体表面积大,吸附能力强,能吸附水中悬浮杂质生成沉淀而起到净水作用。
【板书】Al3++3H2O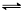 Al(OH)3 +3H+
Al(OH)3 +3H+
【展示】一间非常干净、漂亮的厨房。
【思考】在厨房里面最容易引起脏的原因是什么?
【学生回答】油污。
【思考】先思考油污的主要成分是什么?实验室如何除去油污?
【学生回答】油污的主要成分硬脂酸甘油酯,碱性条件下可以水解生成可溶于水的硬脂酸钠和甘油,所以实验室用氢氧化钠溶液去除油污。
【思考】为什么用纯碱溶液可以洗涤油污? 而且热的效果更好?
【学生回答】CO32-可以产生OH-,使硬脂酸甘油酯水解。
【板书】CO32-+H2O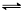 HCO3-+OH-
HCO3-+OH-
【思考】前一段时间,在期中考试时,有消防官兵在消防演习,你知道泡沫灭火器的原理吗?
【学生回答】Al3++3HCO3- = Al(OH)3↓+3CO2↑
【思考】1、为什么把硫酸铝放在玻璃桶内,而碳酸氢钠放在铁桶内?
2、为什么不能用Na2CO3代替NaHCO3?
【学生回答】硫酸铝水解显酸性,可与铁反应。等物质的量的Al2(SO4)3产生的CO2少且生成CO2的速率慢。
【总结】我们今天主要讨论了盐类的水解在实验室、工业、农业以及日常生活中的各种应用。
【课堂练习】1、下列过程或现象与盐类的水解无关的是( )
A.纯碱溶液去油污 B.铁在潮湿的环境下生锈
C.加热氯化铁溶液颜色变深 D.浓硫化钠溶液有臭鸡蛋气味
2、实验室配制硫酸铁溶液时,先把硫酸铁晶体溶解在稀硫酸里,再加水稀释至所需浓度,如此操作的目的是( )
A.防止硫酸铁水解 B.抑制硫酸铁水解
C.提高硫酸铁的溶解度 D.提高溶液的pH值
3、为了同时对某农作物施用分别含有N、P、K三种元素的化肥,对于给定的化肥:①K2CO3 ②KCl ③Ca(H2PO4)2 ④(NH4)2SO4 ⑤氨水,最适合的组合是( )
A.①③④ B.②③④ C.①③⑤ D.②③⑤
【板书设计】
盐类水解的应用
一、化学实验中的盐类水解问题
1、配制和保存易水解的盐溶液
2、试剂瓶瓶塞的选用
3、除杂问题
二、农业生产中的盐类水解问题
1、草木灰不宜与铵态氮肥混合施用,会损失肥分。
原因:CO32-+2NH4++2H2O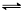 2H2CO3+NH3·H2O
2H2CO3+NH3·H2O
三、工业生产中的盐类水解问题
1、Mg+2NH4Cl=MgCl2+2NH3↑+H2↑
注:工业除锈常用ZnCl2、NH4Cl溶液,而不用盐酸。
四、日常生活中盐类水解问题
1、明矾净水:Al3++3H2O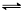 Al(OH)3 +3H+
Al(OH)3 +3H+
2、热碱去油污:CO32-+H2O HCO3-+OH-
HCO3-+OH-
3、泡沫灭火器:Al3++3HCO3- = Al(OH)3↓+3CO2↑
第二篇:盐类的水解教案3
盐类的水解教案
授课:化学组 周祖超
教学目标:
1、使学生初步掌握盐类水解的概念,理解盐类水解的实质,并能够运用盐类水解知识判断盐溶液的酸碱性。
2、通过盐类水解概念的引出、讨论,引导学生总结规律,培养学生运用这些知识来认识问题,解决问题的思维能力,并由此培养学生抽象概括,形成规律,运用规律的能力。
教学重点:盐类水解的实质,
教学难点:盐溶液的酸碱性规律及判断;
设计思路:提出问题——实验研究——理论探索——寻求规律——实验验证——归纳提高 教学方法和教具:实验探究式、分组讨论、科学抽象
教学过程:
【引入】我们知道酸的溶液显酸性、碱的溶液显现碱性,那么反过来,显酸性的溶液一定是
酸的溶液吗?显碱性的溶液一定碱的溶液吗?盐的溶液是否显中性呢?要证明盐的溶液是否真的显中性,最好的办法是什么?
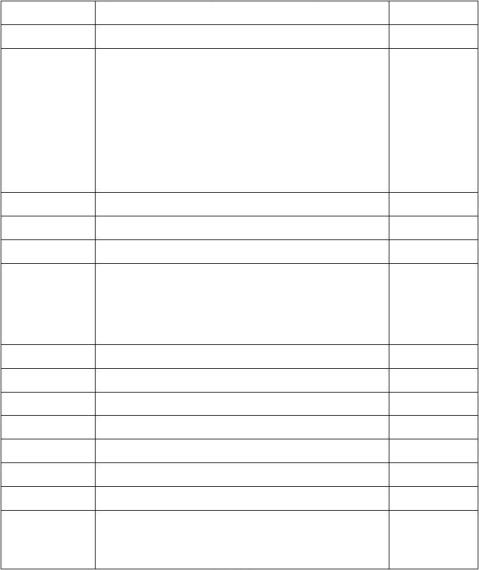
【学生实验】用PH试纸检测CH3COONa、NH4Cl和NaCl溶液的酸碱性。结果:CH3COONa显碱性、NH4Cl显酸性、NaCl显中性
-【提问】这些盐本身是既不能电离出H+,又不能电离出OH的正盐,它们的水溶液为什么
呈现不同的酸碱性?【探究1】三种盐(CH3COONa、NH4Cl、NaCl)溶液的酸碱性? 以CH3COONa为例:
(1)CH3COONa可看作是哪种酸和哪种碱中和而成的产物?
(2)CH3COONa溶液中存在着哪几种离子?哪些离子可以相互结合成弱电解质?
(3)对水的电离平衡有何影响?
CH3COONa溶液为什么显碱性
【板书】 CH3COONa=== CH3COO-+Na+
H2

O H+ + OH-
CH3COOH
CH3COONa + H2O CH3COOH + NaOHCH3COO- + H2O CH3COOH + OH- 观察醋酸根离子水解的彩图及醋酸钠水解的动画:
【小结】在CH3COONa溶液中,醋酸根离子与水电离出来的H+结合,破坏了水的电离衡,使
平衡正向移动,致使溶液中c(H+)<c(OH-),故溶液显碱性同学们根据以上的分析方法分析NH4Cl、NaCl溶液的水解。根据CH3COONa、NH4Cl水解过程给“盐类水解”下定义:
【板书】1、定义:溶液中盐电离出来的离子跟水所电离出来的H+或OH-结合生成弱电解
质的反应。
2、实质:盐电离出的离子与水电离出的H+或OH-结合而破坏了水的电离平衡,
即水的电离平衡正向移动。
3、水解反应与中和反应的关系:
酸+碱
盐+水 【学生练习】:根据以上所学的知识推测下列盐
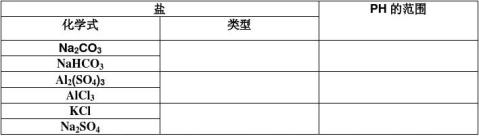
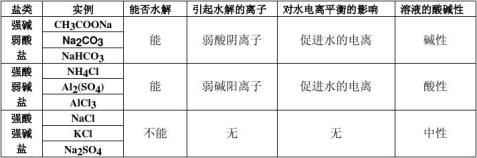
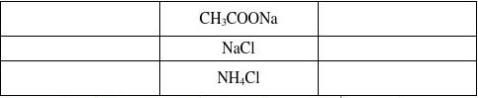
4、小结:有弱才水解、无弱不水解、谁弱谁水解、谁强显谁性 课堂总结:
1、定义:溶液中盐电离出来的离子跟水所电离出来的H+或OH-结合生成弱电解
质的反应。
2、实质:盐电离出的离子与水电离出的H+或OH-结合而破坏了水的电离平衡,
即水的电离平衡正向移动
3、水解反应与中和反应的关系:
酸+碱
谁强显谁性 盐+水4、规律:有弱才水解、无弱不水解、谁弱谁水解、
课堂练习
1、下列离子能发生水解的弱酸根离子有:
弱碱阳离子有: 。
(1)CO32、(2)NO3、 (3)F、 (4)Cl、 (5)CH3COO、
(6)Na、 (7)Al3+、 (8)K、 (9)NH4、 (10)Fe3+2、下列溶液显酸性的是( )
A、溴化钾 B、硫酸铜
C、硫化钠 D、硝酸钡3、下列离子在水溶液中不会发生水解的是( )A、NH4 B、SO42
C、Al D、F4、下列物质的溶液中,由于水解而使pH小于7的是( )
A、NaHCO3 B、NH4Cl
C、CH3COOH D、NaCl
5、25℃时,0.1mol/L某溶液pH=5,则这溶液可能是( )
A、氨水 B、NaCl
C、NH4Cl D、HCl提升:
6、下列物质加入水中,能使水的电离度增大,溶液的pH值减小的是( )
A、HCl B、Al2(SO4)3
C、Na2S D、NH3.H2O
7、比较PH均为11的KOH与CH3COOK溶液中水的电离程度的大小?
3+_+_+++-----
〖板书设计〗

一、 盐类水解
1、盐类水溶液的酸碱性(投影板书)
33 H2O H+ + OH -
CH3COOH
CH3COO- + H2O
2、盐类水解及其本质
① 定义:在溶液中,盐电离出的离子与水离出的H+或OH-生成弱电解质的反应,叫做盐类
的水解。
② 盐 + 水
3、水解的一般规律:
“ 谁弱谁水解,谁强显谁性,都强不水解,溶液显中性,” ..........................
CH3COOH + OH - 酸 + 碱
