五、教学反思
1、本节课设计思路完善,知识点比较全,讲解也到位,学生氛围挺高的!
2、学生互动较少,应该在讲解强酸弱碱盐时,让学生上去写!
第二篇:《盐类的水解》第一课时教学设计
《盐类的水解》第一课时教学设计
山东省平度第一中学 窦君焕
[ 教材依据]
江苏教育出版社高中化学《化学反应原理》专题三,溶液中的离子反应,第三单元,盐类的水解。
[设计思想]
本节课实验较多,规律性强,可以设计多组实验调动学生的兴趣,让学生在积极参与的实验操作和探究中,揭示盐类水解的原理、实质和规律,符合由现象到本质的认知发展规律。盐类水解的原理在生活、生产中应用比较广泛,在学生探究出盐类水解的原理、本质和规律的同时,设置多个问题情境,广泛地联系生产、生活实际,也符合理论联系实际的教学原则。学生进行实验探究的过程中,不仅是培养学生动手操作能力和实验设计能力的过程,也是培养学生学习兴趣,增强学生自信心的过程。整堂课将知识与技能、过程与方法、情感态度与价值观三个方面做到有机的结合。
[教学目标]
1、知识与能力
(1)理解盐类水解的实质,能解释强酸弱碱盐和强碱弱酸盐的水解。
(2)能运用盐类水解规律判断盐溶液酸碱性,会书写盐水解的离子方程式
(3)了解盐类水解在生产生活中的应用。
2、过程与方法
能通过观察、实验、查阅资料等多种手段获取有关盐类水解的信息,并运用比较、分类、归纳、概括等方法得出盐类水解的实质和规律,探究影响盐类水解平衡的因素。
3、情感态度与价值观
实验探究的过程,培养了学生学习化学的兴趣;在实验探究过程中,使学生体验到透过现象揭示事物本质、规律的成功的喜悦,增强学习的信心和动力。
[教学重点]
盐类水解的原理、实质和规律以及盐类水解的应用
[教学难点]
盐类水解的原理、实质和规律;盐类水解离子方程式的书写
[教学准备]
1、药品:NaCl溶液、NH4Cl溶液、Na2S溶液、NaOH溶液、HCl溶液、AlCl3溶液、NaClO溶液、KNO3、PH试纸、酚酞试液、石蕊试液。
2、仪器及用品:试管、烧杯、胶头滴管、玻璃片、玻璃棒
[教学过程]
(一)导入:我们知道,酸溶液显——酸性(学生回答),碱溶液显——碱性(学生回答)。那么,酸碱发生中和反应生成的盐的溶液显酸性、碱性还是中性呢?让我们通过实验来证明。(通过简单的问题切入本节主题)
(二)分组实验:
一组:取NaC l溶液适量放入试管中,然后用胶头滴管滴几滴石蕊试液,观察颜色变化。
二组:取NH4Cl溶液和HCl溶液适量分别放入两支试管中,然后用胶头滴管滴几滴石蕊试液,观察颜色变化。
三组:取Na2S溶液、NaOH溶液适量分别放入两支试管中,然后用胶头滴管滴几滴石蕊试液,观察颜色变化。
四组:取AlCl3溶液、NaClO溶液、KNO3溶液适量分别放入三支试管中,取三片PH试纸放在玻璃片上,用玻璃棒分别蘸取三种溶液滴在PH试纸上,与比色卡对比,读出所测溶液的PH。
(让所有的学生参与到实验中,通过明显的实验现象,激发学生的好奇心和 求知欲,培养学生的探究意识。)
(三)透过实验现象探究盐类水解的本质:
一组和四组实验的结果表明,NaCl溶液、KNO3溶液显中性;二组和四组的实验结果表明,NH4Cl溶液和AlCl3溶液显酸性;三组和四组的实验结果表明,Na2S溶液和NaClO溶液显碱性。为什么不同的盐溶液会呈现不同的酸碱性呢?
下面按实验的分组进行讨论,每一组推选一名代表公布讨论的结果:
 一组:溶液中存在水的电离平衡: H2O H+ + OH- ,当水中加入NaCl,在水溶液中电离出的Na+、Cl-对水的电离平衡无影响,因而,溶液中C(H+)=C(OH-),溶液呈中性。
一组:溶液中存在水的电离平衡: H2O H+ + OH- ,当水中加入NaCl,在水溶液中电离出的Na+、Cl-对水的电离平衡无影响,因而,溶液中C(H+)=C(OH-),溶液呈中性。
 二组:溶液中存在水的电离平衡: H2O H+ + OH- ,当水中加入NH4Cl时,在水溶液中电离出的NH4+结合水电离出的OH-,使水的电离平衡向正方向移动。因而,溶液中C(H+)>C(OH-),溶液呈酸性。
二组:溶液中存在水的电离平衡: H2O H+ + OH- ,当水中加入NH4Cl时,在水溶液中电离出的NH4+结合水电离出的OH-,使水的电离平衡向正方向移动。因而,溶液中C(H+)>C(OH-),溶液呈酸性。
 三组:溶液中存在水的电离平衡: H2O H+ + OH- ,当水中加入Na2S
三组:溶液中存在水的电离平衡: H2O H+ + OH- ,当水中加入Na2S
时,在水溶液中电离出的S2-结合水电离出的H+,使水的电离平衡向正方向移动。因而,溶液中C(H+)<C(OH-),溶液呈碱性。
 四组:溶液中存在水的电离平衡: H2O H+ + OH- ,当水中加入AlCl3或NaClO时,它们在水溶液中电离出的Al3+或ClO-结合水电离出的OH-或H+,使水的电离平衡向正方向移动。因而,溶液中C(H+)>C(OH-)或C(H+)<C(OH-),溶液呈酸性或碱性;在水中加入KNO3时,电离出的K+、NO3-对水的电离平衡无影响,因而,溶液中C(H+)=C(OH-),溶液呈中性。
四组:溶液中存在水的电离平衡: H2O H+ + OH- ,当水中加入AlCl3或NaClO时,它们在水溶液中电离出的Al3+或ClO-结合水电离出的OH-或H+,使水的电离平衡向正方向移动。因而,溶液中C(H+)>C(OH-)或C(H+)<C(OH-),溶液呈酸性或碱性;在水中加入KNO3时,电离出的K+、NO3-对水的电离平衡无影响,因而,溶液中C(H+)=C(OH-),溶液呈中性。
根据各个小组探究的结果,解决下面的问题:
1、什么是盐类的水解?
(学生举手回答)水溶液中,盐的离子结合水电离出的氢离子或氢氧离子生成难电离物质的过程,叫做盐的水解。
2、哪些盐能水解?哪些盐不能水解?
(学生回答)强酸与弱碱反应生成的盐、强碱与弱酸反应生成的盐以及弱酸与弱酸反应生成的盐能水解。强酸与强酸生成的盐不水解。
3、水解的本质是什么?
(学生回答)是对水的电离的促进。
(通过问题的探究与解决,使学生体验到透过现象揭示事物本质和规律的成功与喜悦,增强学习的信心和动力)
4、请二组和三组各推荐一名同学到黑板上写出Na2CO3、FeCl3水解过程:
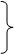 Na2CO3===2Na+ + CO32-
Na2CO3===2Na+ + CO32-

 + + Na2CO3 + H2O Na OH+ NaH CO3
+ + Na2CO3 + H2O Na OH+ NaH CO3
 H2O OH-+ H+
H2O OH-+ H+
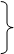 FeCl3===3Cl- + Fe3+
FeCl3===3Cl- + Fe3+

 + + FeCl3 + 3H2O Fe (OH)3 + 3HCl
+ + FeCl3 + 3H2O Fe (OH)3 + 3HCl
 3H2O 3H+ + 3OH-
3H2O 3H+ + 3OH-
5、如何书写水解反应的离子方程式?
 (老师点拨)①判断能否发生水解,确定水解的离子②生成号用 ,产物无↑和↓③多元弱酸根分步书写,阳离子水解一步到位④检查元素及电荷是否守恒。
(老师点拨)①判断能否发生水解,确定水解的离子②生成号用 ,产物无↑和↓③多元弱酸根分步书写,阳离子水解一步到位④检查元素及电荷是否守恒。
6、练习:判断下列盐能否水解,若能水解写出其离子方程式。
①Al2(SO4)3②Na2SO3③KBr④KClO⑤CaCl2⑥NaAlO2
 ① Fe 3++ 3H2O Fe (OH)3 + 3H+
① Fe 3++ 3H2O Fe (OH)3 + 3H+
 ② CO32-+ H2O OH-+ H CO3-
② CO32-+ H2O OH-+ H CO3-
③、⑤不水解
 ④ ClO -+ H2O OH-+ H ClO
④ ClO -+ H2O OH-+ H ClO
 ⑥ AlO2-+ 2H2O OH-+ Al(OH)3
⑥ AlO2-+ 2H2O OH-+ Al(OH)3
(通过练习,使学生加深对盐类水解过程和本质的理解)
7、公布答案,同位之间相互批改,对于写错的进行纠正并探究错因。
(通过交互学习,培养学生的合作意识和精神,并能相互取长补短)
8、四组同学再完成一个实验:用精密PH试纸测出0.1mol/L的Na2SO3和0.1mol/L的Na2S溶液的PH,并将测定结果公布在黑板上。请同学们思考两者PH的不同说明了什么?
9、在学生练习的基础上,与学生一起完成盐类水解规律的探究:
“有弱才水解,越弱越水解;谁强显谁性,都弱不确定。”
(四)课堂小结:
盐类水解的概念、实质、规律;盐类水解的离子方程式的书写。
(可以让一名学生归纳总结,老师进行补充和点评)
(五)布置作业:课本第80页,1、2、3、5、6题;第7题作为课后思考题。
附板书设计:

[教学反思]
1、本节课能根据知识的特点设置多组实验,调动学生的学习积极性和学习兴趣,并培养学生的探究问题的能力,在实际授课中也起到了这样的效果,使一节化学理论课上得生动活泼、有声有色,体现了新课改的基本要求。
2、本节课围绕着盐类水解的概念、本质、规律、和水解反应的离子方程式的书写设置了一系列问题组,通过问题情境再次激发学生的兴趣,使学生透过实验现象探究盐类水解的本质和规律。
3、四个小组实验探究结果的公布,即溶液呈酸碱性原因的分析,让学生回答得正确且全面,要求过高。在实际授课中,学生难以正确全面地回答,此处予设的多,生成的少,且容易造成学生兴奋点降低。今后教学中可以降低问题难度,对学生的回答给予及时地补充,并对学生进行鼓励的方式突破这一教学难点。
