钠及其重要化合物知识点总结
一.金属钠
1.钠的物理性质
金属钠是一种柔软 ,银白色、有金属光泽的金属,是热和电的良导体;它的密度为0.97g/cm3,比水的密度小,比煤油的密度大,熔点为97.81℃、沸点为882.9℃。
2.钠的化学性质
钠原子最外层只有一个电子,在化学反应中钠原子容易失去最外层的一个电子,具有很强的还原性,是一种活泼的金属元素。
(1)跟非金属反应:
①金属钠放置在空气中,会迅速被氧化而生成氧化钠:4Na+O2=2Na2O,(空气中钠的切面变暗)
②在空气(或氧气)中燃烧:2Na+O2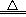 Na2O2(黄色火焰),以上反应说明Na2O2比Na2O稳定。可见,与O2反应时因条件不同而产物不同。
Na2O2(黄色火焰),以上反应说明Na2O2比Na2O稳定。可见,与O2反应时因条件不同而产物不同。
③在氯气中燃烧:2Na+Cl2 NaCl(白烟)
NaCl(白烟)
(2)钠与水反应:2Na+2H2O =2NaOH +H2 ↑
现象: ①浮:钠投入水中并浮在水面上 ②声:钠立即跟水反应,并放出热量,发出嘶嘶响声,产生气体。③游:同时钠熔成一个闪亮的小球并在水面上向各方迅速游动最后消失,④红:反应后的水溶液使酚酞变红。
(3)钠与酸反应:钠与酸的反应比水反应更激烈,极易爆炸。
(4)钠与盐溶液反应:先考虑钠与水反应生成NaOH,再考虑NaOH是否与盐反应。
例如:①钠与CuSO4溶液反应
2Na+2H2O=NaOH+H2↑ (1)
CuSO4+2NaOH=Na2SO4+Cu(OH)2 (2)
合并(1)(2)得:2Na+2H2O+CuSO4=Na2SO4 +Cu(OH)2↓+H2 ↑
②钠与FeCl3溶液反应:6Na+6H2O+2FeCl3=6NaCl+2Fe(OH)3↓+3H2↑
3.钠的存放和取用
由于金属钠的化学性质非常活泼,易与空气中的O2、H2O等反应,所以少量金属钠可保存在煤油里,大量的金属钠则存在铁筒中用石蜡密封。取用时一般先用镊子把钠从煤油中夹出来,并用滤纸把表面的煤油吸干,然后用小刀切下绿豆大小的一块再做有关实验。
4.钠的存在与用途
自然界中钠只能以化合态的形态存在,主要以氯化钠的形式存在。
二.钠的化合物
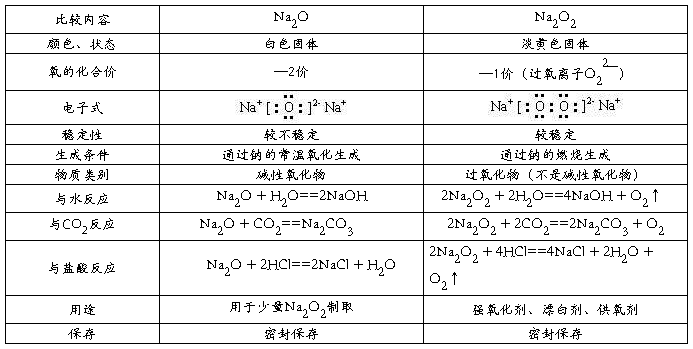
1.氧化钠和过氧化钠的比较
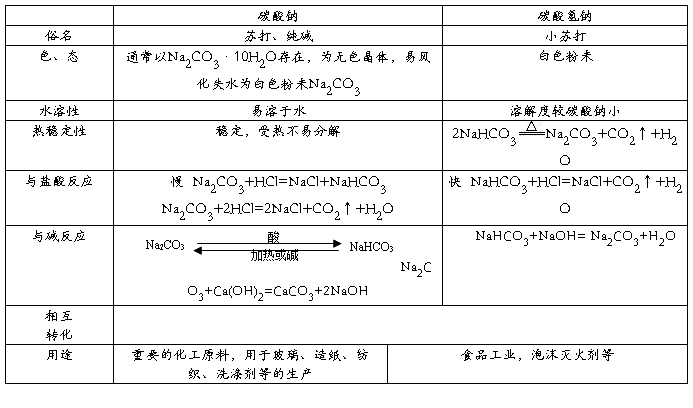
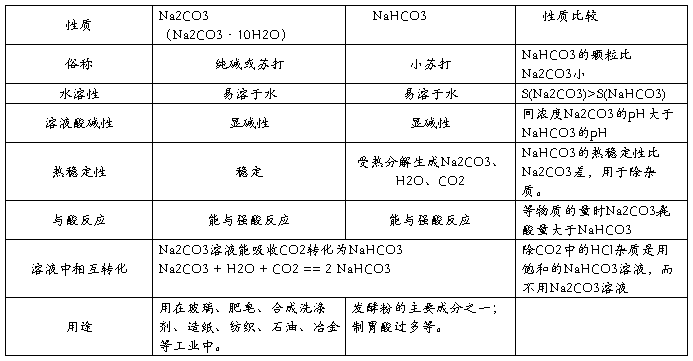
2.碳酸钠与碳酸氢钠
3.钠的其它重要化合物
(1)硫酸钠(Na2SO4·10H2O),俗名:芒硝,为无色晶体。
硫酸钠用途:制玻璃、造纸、染色、纺织、制水玻璃,在医药上用作缓泻剂等。
硫酸钠分布:盐湖、海水及矿物中。
(2)氢氧化钠(NaOH)是中学阶段最为常见的强碱,是一种白色片状晶体,。极易溶于水(并放出大量热),易吸水而发生潮解,在空气中还易变质,反应为:2NaOH+CO2=Na2CO3+H2O。
俗名:苛性钠、烧碱、火碱,氢氧化钠有很强腐蚀性,它是一种重要的碱,具有碱的通性。
工业制法:2NaCl+2H2O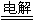 2NaOH+H2↑+Cl2↑,
2NaOH+H2↑+Cl2↑,
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
保存:密封保存。试剂瓶不能用玻璃塞,应用橡皮塞。因为烧碱能与玻璃成分中的SiO2发生反应:SiO2+2NaOH=Na2SiO3+H2O,生成的Na2SiO3使玻璃塞与瓶口粘结。
三.有关钠及其化合物的几个问题
1.金属钠露置在空气中的变化过程:
银白色金属钠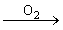

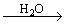

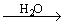

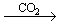

2.Na2CO3与盐酸的互滴反应
(1)向盐酸里逐渐滴加入Na2CO3溶液(开始时酸过量)开始就有气体放出;
(2)向Na2CO3溶液里逐滴加入盐酸(开始时酸不足)开始无气体产生:
HCl+Na2CO3=NaCl+NaHCO3(无气泡)
HCl+NaHCO3=NaCl+CO2↑+H2O
可见不同的滴加顺序产生不同的现象,利用这种现象不用其他试剂就可鉴别Na2CO3溶液和盐酸。
3.碳酸氢钠和碳酸钠的制法
(1)制取NaHCO3的方法
①减压低温蒸干NaHCO3溶液。NaHCO3遇热易分解,其水溶液加热更易分解,所以不可能采用常压下蒸发溶剂的方法制得NaHCO3晶体。
②往饱和Na2CO3溶液中通入CO2,过滤得到晶体。
Na2CO3+C02+H2O=2NaHCO3
(2)制取Na2CO3的方法
往饱和食盐水中依次通人足量的NH3、CO2(氨碱法),利用NaHCO3的溶解性小于NH4HCO3的溶解性原理,使NaHCO3从溶液中析出:
NH3+H2O+CO2=NH4HCO3
NH4HCO3 +NaCl=NaHCO3↓+NH4Cl
2NaHCO3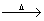 Na2CO3 +CO2↑+H2O(工业方法)
Na2CO3 +CO2↑+H2O(工业方法)
四.碱金属元素 (Li 、Na、K、Rb、Cs)
1.原子结构:
(1)相似性:最外层均为1个电子
(2)递变性:核电荷数依次增多,电子层数依次增多,原子半径依次增大
2.元素性质:
(1)相似性:均为活泼金属元素,最高正价均为+1价
(2)递变性:失电子能力依次增强,金属性依次增强
3.单质性质:
(1)相似性:均具强还原性,均具轻、软、易熔的特点
(2)递变性:还原性依次增强,密度趋向增大,熔沸点依次降低,硬度趋向减小
由锂到铯熔点逐渐降低,与卤素单质等恰恰相反。这是因为碱金属中存在金属键,金属键随原子半径的增大而减弱。卤素单质中存在分子间作用力,分子间作用力随相对分子质量的增大而增强。
4.化合物性质:
(1)相似性:氢氧化物都是强碱
(2)递变性:氢氧化物的碱性依次增强
五.焰色反应
许多金属或它们的化合物在燃烧时火焰呈特殊的颜色,这在化学上叫做焰色反应,是一种物理变化,是元素的性质而不仅属化合物。钠是黄色;钾是紫色(透过蓝色钴玻璃);钙是砖红色。
1.焰色反应
焰色反应指的是元素的性质,相应金属不管是离子还是单质灼烧时都会呈现其焰色。
做焰色反应的实验时应注意:
①火焰本身尽可能无色,
②铂丝要洁净,
③焰色反应鉴定物质的方法,一般是在其他化学方法无效时才采用。
2.焰色反应的操作步骤:
(1)铂丝放在酒精灯上灼烧至与铂的原来颜色相同;
(2)蘸取待测溶液;
(3)在酒精灯上灼烧,观察焰色;
(4)用稀盐酸洗净铂丝,在酒精灯上灼烧。
进行焰色反应之前,灼烧铂丝是为了防止操作之前铂丝上的残留物对实验产生影响。用盐酸洗铂丝灼烧可除去铂丝上的残留物对后面实验的干扰。不用硫酸是由于盐酸盐比硫酸盐更易挥发,对实验的影响小。
焰色反应所用铂丝昂贵,实验室常用光洁的铁丝、铬丝、钨丝等无焰色的金属代替。
六.碱金属中的一般和特殊之处
1.Na、K需保存于煤油中,但Li的密度比煤油小,所以Li必须保存在密度更小的石蜡油中或密封于石蜡
2.碱金属中,从Li至Cs,密度呈增大的趋势,但ρ(K)=0.862g/cm3 < ρ(Na)=0.971e/cm3。
3.酸式盐的溶解度一般大于正盐,但溶解度NaHC03 < Na2C03。
4.氧在化合物中一般显-2价,氢显+1价,但Na2O2 、H202中的氧显-1价,NaH、CaH2中的氢显-1价。
5.试剂瓶中的药品取出后,一般不能放回原瓶,但IA金属Na、K等除外。
6.一般活泼金属能从盐中置换出不活泼金属,但对IA非常活泼的金属Na、K等除外。如:2Na+CuS04+2H20=Cu(OH)2↓+H2↑+Na2S04
第二篇:强烈推荐钠元素单质及其化合物知识点总结
钠元素单质及其化合物

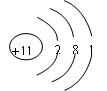 (1)钠的物理性质:钠是银白色金属,密度小(0.97g/cm3),熔点低(97℃),硬度小,质软,可用刀切割。钠通常保存在煤油中。是电和热的良导体。
(1)钠的物理性质:钠是银白色金属,密度小(0.97g/cm3),熔点低(97℃),硬度小,质软,可用刀切割。钠通常保存在煤油中。是电和热的良导体。
(2)钠的化学性质:从原子结构可知钠是活泼的金属单质。
①钠与非金属单质反应:常温:4Na + O2 == 2Na2O,加热:2Na + O2  Na2O2;
Na2O2;
2Na + Cl2  2NaCl; 2Na + S
2NaCl; 2Na + S  Na2S等。
Na2S等。
②钠与水反应:2Na + 2H2O == 2NaOH + H2↑;实验现象:钠浮在水面上,熔成小球,
在水面上游动,有哧哧的声音,最后消失,在反应后的溶液中滴加酚酞,溶液变红
注意:钠在空气中的变化:银白色的钠 变暗(生成了氧化钠)
变暗(生成了氧化钠) 变白(生成氢氧化钠)
变白(生成氢氧化钠) 潮解
潮解 变成白色固体(生成碳酸钠)。常温下金属钠在空气中表面变暗,生成氧化膜,说明钠比Al、Fe活泼得多
变成白色固体(生成碳酸钠)。常温下金属钠在空气中表面变暗,生成氧化膜,说明钠比Al、Fe活泼得多
(应用)钠保存在石蜡油或煤油中,因为钠易与水或者空气中的氧气反应,而钠不与煤油反应,且钠的密度大于煤油的密度,所以保存在煤油中
③钠与酸反应:如2Na + 2HCl == 2NaCl + H2↑,Na放入稀盐酸中,是先与酸反应,酸不足再与水反应。因此Na放入到酸中Na是不可能过量的。同时Na与H2的物质的量比始终是2:1。当然反应要比钠与水的反应剧烈多。
④钠与盐的溶液反应:钠不能置换出溶液中的金属,钠是直接与水反应。反应后的碱再与溶液中的其他物质反应。如钠投入到硫酸铜溶液的反应式:2Na + CuSO4 + 2H2O == Cu(OH)2 ↓+ Na2SO4 + H2 ↑。
⑤钠与氢气的反应:2Na + H2 == 2NaH。NaH + H2O == NaOH + H2 ;NaH是强的还原剂。
(3)工业制钠:电解熔融的NaCl,2NaCl(熔融)  2Na + Cl2↑。
2Na + Cl2↑。
(4)钠的用途:①在熔融的条件下钠可以制取一些金属,如钛、锆、铌、钽等;
②钠钾合金是快中子反应堆的热交换剂;
③钠蒸气可作高压钠灯,发出黄光,射程远,透雾能力强。
2、氧化钠和过氧化钠
(1)Na2O:白色固体,是碱性氧化物,具有碱性氧化物的通性:Na2O + H2O == 2NaOH,Na2O + CO2 == Na2CO3,Na2O + 2HCl == 2NaCl + H2O .另外:加热时,2Na2O + O2 == 2Na2O2.
(2)Na2O2:淡黄色固体是复杂氧化物,易与水和二氧化碳反应。
2Na2O2 + 2H2O == 4NaOH + O2 ,2Na2O2 + 2CO2 == 2Na2CO3 + O2 (作供氧剂)。
因此Na2O2常做生氧剂,同时,Na2O2还具有强氧化性,有漂白作用。如实验:Na2O2和水反应后的溶液中滴加酚酞,变红后又褪色,实验研究表明是有:Na2O2 + H2O == 2NaOH + H2O2,2H2O2 == 2H2O + O2 反应发生。因为H2O2也具有漂白作用。当然过氧化钠也可以直接漂白的。
1、向饱和的Na2CO3溶液中通足量的CO2有晶体NaHCO3析出。
2、Na2CO3溶液与稀HCl的反应①向Na2CO3溶液中滴加稀HCl,先无气体,后有气体,如果n(HCl)小于n(Na2CO3)时反应无气体放出。发生的反应:先①Na2CO3 + HCl == NaCl + NaHCO3,后②NaHCO3 + HCl == NaCl + H2O +CO2 .
②向稀HCl中滴加Na2CO3溶液,先有气体,反应是:Na2CO3 + 2HCl == 2NaCl + H2O + CO2.
如果用2mol的Na2CO3和2.4mol的稀HCl反应,采用①方法放出CO2是0.4mol;采用方法放出CO2为1.2mol。希望同学们在解题时要留意。
3、Na2CO3溶液和NaHCO3溶液的鉴别:取两种试液少量,分别滴加CaCl2或BaCl2溶液,有白色沉淀的原取溶液为Na2CO3,另一无明显现象的原取溶液为NaHCO3.
4、侯氏制碱法
反应式:NaCl + NH3 + CO2 + H2O == NaHCO3 + NH4Cl.
注意:在生产中应先在饱和的NaCl溶液中先通入NH3,后通入CO2,NaHCO3晶体析出过滤,在滤液中加入NaCl细末和通NH3析出NH4Cl晶体为副产品。NH4Cl晶体析出后的母液进行循环试用,提高原料的利用率
一.选择题(共15小题)
1. (2010·西安高一检测)实验室中对于少量金属钠的保存方法,正确的是 ( )
A.保存在水中 B.密封,保存在广口瓶中
C.用铝箔包裹,密封在广口瓶中 D.密封,保存在煤油中
2. (2010·大庆高一检测)在实验室中,用镊子从煤油中取出一小块金属钠,然后用滤纸将煤油吸干,再用小刀切开观察。在这一实验过程中不能得出的钠的物理性质是 ( )
A.钠在常温下是固体 B.钠具有银白色的金属光泽
C.钠的熔点很低 D.金属钠很软
3.(2010·长春高一检测)钠与水反应时产生的各种现象如下:
①钠浮在水面上;②钠沉在水底;③钠熔化成小球;④小球迅速游动逐渐减小,最后消失;⑤发出嘶嘶的声音;⑥滴入酚酞后溶液显红色。其中正确的一组是 ( )
A.①②③④⑤ B.全部 C.①③④⑤⑥ D.①③④⑥
4.(2010·宜春高一检测)下列六种物质:①Na2O ②Na2O2 ③NaCl ④Na2CO3溶液 ⑤NaOH ⑥NaHCO3其中不能与CO2反应的是 ( )
A.①④ B.②③ C.③⑥ D.⑤⑥
5.(2010·广元高一检测)有关焰色反应的实验操作说明错误的是 ( )
A. 先将铂丝灼烧到与原火焰颜色相同,再蘸取被检验的物质
B. 所有金属阳离子的焰色都要透过蓝色钴玻璃观察
C. 实验时,要尽可能选用本身颜色较浅的火焰
D. 每次实验完,均要用盐酸洗净铂丝
6.(2010·广元高一检测)Na2O2晶体和Na2O晶体中阳离子与阴离子的个数比,前者和后者的关系是( )
A. 前者大 B. 前者小
C. 相等 D.不能肯定
7.(2010·大连高一检测)下列关于Na和Na+的叙述中,错误的是 ( )
A.它们相差一个电子层 B.它们的化学性质相似
C.钠原子,钠离子均为同一元素 D.灼烧时,它们的焰色反应都呈黄色
8.(2010·广元高一检测)将金属钠分别投入下列物质的水溶液中,生成白色沉淀的是 ( )
A.HCl B.K2SO4 C.Ca(HCO3)2 D.CuCl2
9.(2010·广元高一检测)不能正确表示下列反应的离子方程式的是 ( )
A.钠与水反应:2Na+2H2O===2Na++2OH-+H2↑
B.钠与CuSO4溶液反应:2Na+Cu2+===Cu↓+2Na+
C.钠与足量的盐酸溶液反应:2Na+2H+===2Na++H2↑
D.钠与KCl溶液反应:2Na+2H2O===2Na++2OH-+H2↑
10.(2010·长春高一检测)下列有关Na2CO3和NaHCO3性质比较中,正确的是 ( )
A.热稳定性:Na2CO3<NaHCO3
B.常温时水溶液中的溶解度:Na2CO3<NaHCO3
C.与稀盐酸反应快慢:Na2CO3<NaHCO3
D.物质的量相同时,消耗盐酸:Na2CO3<NaHCO3
11.(2010·杭州高一检测)下列各组中的两物质反应时,反应条件或反应物用量的改变对生成物没有影响的是 ( )
A、CO2与Ca(ClO)2 B、NaOH与CO2 C、Na与O2 D、Na与H2O
12.(2010·泉州高一检测)有一位学生将一小块钠投入到盛有煤油和水的试管中(煤油和水均足够多),想一想可能观察到的现象是 ( )
A.钠浮在试管中的液面上并四处游动
B.钠沉入试管底部
C.钠与水剧烈反应
D.钠处于煤油和水的交界处并可能作上、下跳动
13.(2010·社旗高一检测)现有NaOH、Na2CO3和Ba(OH)2三种无色溶液,用一种试剂就可将它们鉴别出来,这种试剂是 ( )
A.HCl B.H2SO4 C.Na2SO4 D.CaCl2
14.(2010·大连高一检测)少量的金属钠长期暴露在空气中,它的最终产物是 ( )
A.NaOH B. Na2CO3?10H2O C.Na2CO3 D.NaHCO3
15.(2010·白银高一检测)有关Na2CO3和NaHCO3的性质,下列叙述中错误的是 ( )
A. Na2CO3受热不分解,而NaHCO3受热易分解
B. Na2CO3溶液和 NaHCO3溶液都显碱性
C.等物质的量的Na2CO3和NaHCO3跟同一种盐酸充分反应时,消耗酸的体积之比是2∶1
D.将澄清的石灰水分别加入Na2CO3和NaHCO3溶液时,前者产生沉淀,后者不产生沉淀
 二.非选择题(共2个小题)
二.非选择题(共2个小题)
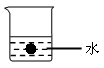
16.(2010·宜春高一检测)如右图所示,在烧杯中盛有100 mL 蒸馏水,水中悬浮着一个表面光滑、耐热、耐碱的小球(此球稳定在水的中央)。将1.0 g 金属钠分多次投入到水中,最后使烧杯内的液体恢复到原来的蒸馏水的温度。
回答下列问题:
(1)1.0 g 钠要分多次投入的主要原因是 。
(2)实验结束时,从烧杯内小球的位置观察到的现象是 ,出现此种现象的主要原因是 。
(3)实验过程中所发生的化学反应方程式是 。
17.(2010·宜春高一检测) A、B、C、D、E、F六种物质的焰色反应均为黄色,A、B、C、D与盐酸反应均生成E,此外B还生成一种可燃气体。而C、D还生成一种无色无味气体H,该气体能使澄清石灰水变浑浊。D和A可反应生成C,F和H也可反应生成C和另一种无色无味气体,该气体能使带火星的木条复燃。请回答下列问题:
(1)写出B、C、F的化学式B ;C ; F
(2)写出F和H反应的化学方程式 。
(3)写出下列反应的离子方程式:
①D+盐酸 。
②D+A 。
18.(2010·白银高一检测)取100 mL的Na2CO3和Na2SO4混合溶液,加入适量Ba(OH)2溶液100 mL后,恰好完全反应,过滤、干燥后得到14.51 g白色沉淀和滤液(溶液体积为200 mL),再用过量稀硝酸处理沉淀,最后减少到4.66 g,并有气体放出。计算:[第(3)问请写出计算过程]
⑴ 原混合液中Na2SO4的物质的量浓度为 mol ·L-1;
⑵ 产生的气体在标准状况下的体积为 L;
⑶ 过滤出沉淀后,计算所得滤液的物质的量浓度为多少?
