硫酸亚铁的制备的实验报告
(温度对实验的影响)
【实验目的】
1、掌握制备试验中实验条件的控制方法。
2、熟悉制备硫酸亚铁的过程并能演示实验基本操作,如水浴加热、过滤、冷却结晶等。
【实验原理】
稀H2SO4与Fe反应生成H2和FeSO4,通过过滤除去铁屑中的不溶物,蒸发浓缩冷却得到硫酸亚铁晶体。
Fe+H2SO4(aq) = H2↑+FeSO4(aq)
【实验内容】
探究:不同温度下所得的硫酸亚铁的产率和反应的最佳适宜温度。
【所用仪器】
铁架台、铁圈、托盘天平、量筒、烧杯、玻璃棒、滴管、酒精灯、温度计、漏斗、石棉网、滤纸等
【实验步骤】
1、进行小组内任务分配,10人分别秤取3.5gFe粉放入100mL烧杯中。量筒取配制好的20mL 3M H2SO4溶液。
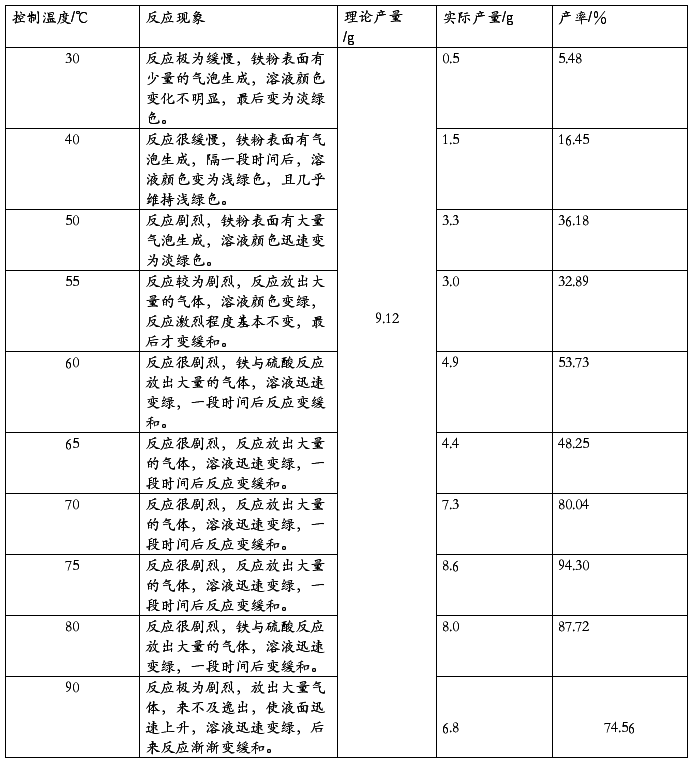
2、小组内各个成员控制反应条件,在相同的条件下控制反应的温度不同。控制反应时间30min,其水浴温度分别为30℃、40℃、50℃、55℃、60℃、65℃、70℃、75℃、80℃、90℃。
3、在反应过程中,观察有关现象(溶液颜色变化、体系反应激烈程度等)。
4、反应结束,趁热过滤,将滤液转移至蒸发皿中(过滤过程中如有很多晶体析出,可加热水使晶体溶解)。
5、蒸发结晶,不断搅拌。当溶液表面出现晶膜时,停止加热,冷却结晶。
6、浅绿色晶体析出,取出晶体,用滤纸吸干水分,称量,计算产率。
【实验记录】
原料:还原性Fe粉:3.5g H2SO4: 20mL 3mol/L 反应时间:30min
个人记录:本人探究的是在温度为80℃下硫酸亚铁的产量。


如图为实验装置和最终得到的产物。产物为蓝绿色晶体,产量为8.0克。
小组记录:
【结果与讨论】
在其他条件相同的情况下,硫酸亚铁的制备反应的速率以及产率与反应的温度有关。
(一)、通过对实验温度和反应现象的分析,可以得出结论:反应温度越高,铁与硫酸的反应越剧烈,实验现象越明显。
30-40℃,反应缓慢,实验现象不明显。
50-75℃,反应剧烈且实验现象很明显,且生成的气体能及时逸出溶液,使得铁与硫酸安静的反应。
80-90℃,反应极为剧烈,大量气体无法及时逸出溶液,使得溶液部分喷出,较为危险。

【实验总结】
综合上述讨论:
1、反应温度控制在45-50 ℃时,产率较高,但是实验现象不明显,故不是反应的适宜温度。
2、反应温度控制在60-75 ℃时,反应的产率较高,且实验现象很明显,是适宜的反应温度。
3、反应温度控制在80-90 ℃时,虽然产率极高,但是反应太剧烈,存在安全问题,所以也不是适宜的反应温度。
因此,通过本次实验,我们可以发现硫酸亚铁的制备实验的最适宜温度为70-80℃。
第二篇:无机混凝剂的制备实验报告
实验4 无机混凝剂的制备
1. 前言
1.1 目的与意义
聚合硫酸铁(PFS)是 2O世纪 80年代发展起来的一种新型无机高分子絮凝剂。相比传统的铝系絮凝剂,具有水解速度快、絮凝体密度大、适用pH值范围宽(4~i0)等特点,且成本低、使用方便、无残留,因而广泛用于工业用水、工业废水及城市污水的净化处理【1】。
通过制备聚硫酸铁的综合实验,了解混凝剂在水处理中的原理及重要作用,掌握合成无机混凝剂的操作技术,并且学会通过金属含量、碱化度、Zata电位的测定,评价混凝剂的水处理产品稳定性和混凝性能。
1.2 文献综述与总结
絮凝净化法具有适应范围广、工艺简单、处理成本低等特点,目前广泛应用于饮用水、生活污水和工业废水的处理中。
聚合硫酸铁PFS是20世纪80年代出现的一种新型无机高分子絮凝剂具有水解速度快、絮凝体密度大、适用pH范围宽等特点 具有很强的中和悬浮颗粒上电荷的能力,有很大的比表面积和很强的吸附能力,能很好地去除水中悬浮物、有机物、硫化物、重金属离子等杂质。 具有脱色、除臭、破乳化及污泥脱水等功能,因而被广泛应用于矿山 印染、造纸等工业废水处理。相比传统的铝系絮凝剂而言PFS在反应过程中无离子水相转移和残留积累使用更方便、价格更便宜、用量更省【2】。
直接氧化法虽然工艺简单、操作简便,但存在氧化剂用量大、成本高、氧化剂引入的离子需分离除去、反应中产生的有害气体需专门设备吸收处理等问题。因而难于在工业化生产中普及和应用,但试验研究中需要少量聚合硫酸铁时,采用此类方法制备简便易行【1】。
2. 实验部分
2.1 实验原理
硫酸铁聚合过程及其复杂,一般认为聚合过程分为三个大步骤。
①氧化过程 即二价铁在氧化剂作用下被氧化为三价铁,这是聚合过程中比较复杂的一步,目前采取的氧化剂种类很多,显然采取不同的氧化剂对氧化过程的影响是不一样的,即使是同样的氧化剂,对过程的机理,不同的研究者也存在不同的看法。以氧化剂H2O2为例,其反应过程如下所示:
4FeSO4+H2O2+2H2SO4==2Fe2(SO4)3+3H2O(4-1)
②水解过程 水解是三价铁离子和氢氧根离子相互结合的过程,这是极其重要的一步,其重要概念是盐基度,盐基度B=[OH-]/(3[Fe3+]),OH-结合越多,则聚合度就越高,絮凝效果也就越好,产品质量越高,水解反应过程如下所示:
Fe3++OH-==Fe(OH)2+ (4-2)
Fe(OH)2++OH-==Fe(OH)2+ (4-3)
Fe(OH)2++OH-==Fe(OH)3 (4-4)
(4-2)、(4-3)两式对盐基度B是有贡献的,但式(4-4)须加以抑制,由于氢氧化铁溶度积非常小,[Fe3+]×[OH-]3==4×10-38(20℃),在溶液中很容易沉淀,在水解过程中应当限制该反应的发生。
③聚合过程 聚合过程的化学方程式如下:
mFe2(OH)n(SO4)3-n/2→[Fe2(OH)n(SO4)3-n/2]m
式中,m表示聚合度的大小,聚合度m在反应过程中是逐渐增加的,该值是个表观值。
综合起来,可以认为整个制备过程的化学反应方程式如下:
4FeSO4 +(2-n)H2SO4+(2n-2)H2O+O2(或氧化剂)→2Fe2(OH)n(SO4)3-n/2
mFe2(OH)n(SO4)3-n/2→[Fe2(OH)n(SO4)3-n/2]m
(2)碱化度
碱化度又称为盐基度,它表示羟基在物质分子中所占的比例,它是关系到产品稳定性和混凝性能的重要技术指标。碱化度测定一般采用酸碱中和滴定,这样核心问题便是如何掩蔽Fe3+。氟化物可与Fe3+生成稳定性很好的六氟合铁络合物沉淀,氟化钾是最合适的掩蔽剂。
碱化度的计算:
X=[(V0-V)C×0.017/(1×10-3CFe)]×100%=[17C(V0-V)/CFe]×100%
式中 C——标准氢氧化钠溶液浓度,mol/L
V0,V——空白试验和水样试验标准氢氧化钠溶液的体积,ml
CFe——聚铁溶液含铁量
2.2 仪器与试剂
2.2.1主要仪器
可调速搅拌器、三口烧瓶250ml、可调速搅拌器、三口烧瓶、锥形瓶、烧杯、恒温槽、酸式滴定管、碱式滴定管、胶头滴管、量筒、移液管
2.2.2主要试剂
七水硫酸亚铁FeSO4?7H2O、硫酸、过氧化氢H2O2(30%)、氯酸钠NaClO3、
酚酞指示剂,重铬酸钾标准溶液0.025mol/L、盐酸溶液:0.1011mol/L、NaOH溶液0.0978mol/L,硫磷混酸15%、二苯胺磺酸钠2g/L、氟化钾
2.3 实验步骤
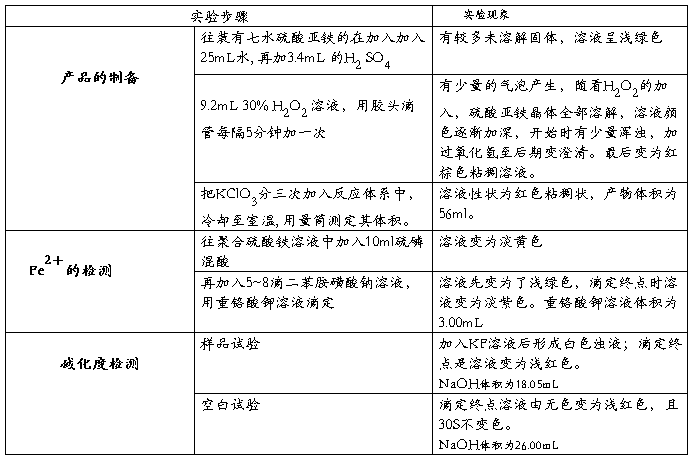
2.3.1 产品制备
称取50g 置于烧瓶中,加入25mL去离子水,按照硫酸与亚铁盐摩尔比例为0.4,实取硫酸3.4ml,然后加入烧瓶中。控制水浴反应温度为50—60°C,取理论反应量的过氧化氢9.2ml和理论量20%的氯酸钾0.74g,快速搅拌混合溶液(800rpm),同时,每隔5min加一次过氧化氢,在1—1.5h内加完。最后将氯酸钠分三次加完,再搅拌15min。
氧化反应完后,溶液完全变为红棕色。用滴管取少量溶液观察,其中应无明显的二价铁离子的颜色,否则,继续加入过氧化氢或氯酸钠。样品分析时,二价铁的转化率应达95%以上。
2.3.2 产物中Fe2+的检测
取5mL聚铁溶液,放入250mL锥形瓶中,稀释至100mL,加入10mL硫磷混酸,冷却后加入5滴二苯胺磺酸钠溶液,用重络酸钾标准溶液滴定至呈稳定的紫色。
2.3.3碱化度检测
用移液管量取1mL聚铁溶液,置于250mL锥形瓶中,用移液管准确移入25.00mL盐酸溶液,再加入20mL去离子水,摇匀,盖上表面皿,在室温下放置10分钟。加入10mL氟化钾溶液,摇匀。再加入5滴酚酞,立即用氢氧化钠溶液滴定至淡红色为终点。
用去离子水做空白实验,重复以上步骤。
2.2 实验现象与结果
Fe2+转化率的计算
M(FeSO4·7H2O)= 278g/mol
Fe+的物质的量:n=m/M=50g÷(278g/mol)=0.1798mol
产品体积:56.0mL
总铁浓度:0.1798mol*56g/mol÷56.0mL=179.80g/L
亚铁浓度:
6Fe2+ + Cr2O72- + 14H+ =6Fe3+ + 2Cr3+ + 7H2O
n(Fe2+)=6n(Cr2O72-)=3.00mL* 0.025mol/L*6=0.45*10-3mol
[Fe2+]=56g/mol*0.45*10-3mol ÷1mL=25.2g/L
产率:(179.80g/L-25.2g/L) ÷179.80g/L×100%=86.0%
碱化度的检测
空白样品滴加氢氧化钠标准液体积:26.00mL
样品溶液滴加氢氧化钠溶液体积:18.05mL
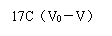
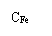
 X = ×100%
X = ×100%
=17*0.1mol/L*(26.00mL-18.05mL) ÷179.80g/L ×100%=7.51 %
 表1 聚合硫酸铁产量与质量指标
表1 聚合硫酸铁产量与质量指标

3. 结果与讨论
1.由表1知合成聚合硫酸铁产品的转化率高,其外观、总铁均符合标准要求
2.产品二价铁含量(25.2g/L)超出了标准(<1g/L),超标量非常大。由于反应开始时的搅拌速度控制不好,太慢,导致溶液中发生水解产生沉淀,溶液为浑浊状态。产品合成还受硫酸影响,亚铁盐在足量的硫酸中被氧化时会生成铁盐;当亚铁盐的硫酸溶液中硫酸量不足,氧化最终将会发生水解,比例过小,产生的氢氧根易生成氢氧化铁沉淀。
4. 由表1可知碱化度偏低,可知聚合硫酸铁的聚合度偏低,凝聚效果不够好。
用碱滴定测碱化度过程难以做到无CO2反应环境,滴定时间快慢也会影响误差的大小,实验可能存在较大误差,由于环境中存在大量CO2滴定终点的浅红色在30s内不变色即可,否则时间长或剧烈震荡都会由于CO2与NaOH反应而浅红色变浅甚至变为无色。
5. 七水合硫酸亚铁在酸性条件下,被双氧水氧化成硫酸铁,经水解、聚合反应制得红棕色聚合硫酸铁(PFS)。在制备过程中,氧化、水解、聚合3个反应同时存在于一个体系当中,相互影响,相互促进。其中氧化反应是3个反应中较慢的一步,控制着整个反应过程。 以下根据文献讨论反应的影响因素:
a.硫酸用量的影响
硫酸在聚合硫酸铁的合成过程中有两个作用:①作为反应的原料参与了聚合反应;②决定体系的酸度,其用量直接影响产品性能。文献显示,硫酸用量适当增加对提高合成反应是有利的。但硫酸用量太大,会导致亚铁离子氧化不完全,且大部分铁离子没有参与聚合,导致盐基度很低,合成失败;硫酸量不足,量越少,生成Fe(OH)3趋势越大,即溶液中[OH-]相对较大。当硫酸与Fe2+的物质的量之比为0.15~0.30时减少硫酸用量可显著提高产品盐基度,但当该比值小于0.15时,会产生大量的Fe(OH)3凝胶沉淀,最终导致产品铁含量大幅度降低,同时因溶液中存在相对较大[OH-],使测得的产品盐基度偏高,但这并非铁离子高度聚合的反映。文献表明:只有当硫酸与Fe2+的物质的量之比介于0.30~0.45之间时,聚合硫酸铁产品性能最好。
b. 过氧化氢用量的影响
H2O2的用量对产品质量指标有很大的影响,当H2O2加入不足时, Fe2+不能够完全氧化Fe3+,此时溶液中仍然含有较多的Fe2+;加入量过多时,固然可以保证氧化完全,但引起氧化剂不必要的浪费。
c.过氧化氢加入速度
为了保证氧化反应的进行,必须控制氧化剂加入的速度,在搅拌作用下使物料之间充分接触反应。但若加入速度过慢,反应所需时间过长,对工业生产是不利的。若加入速度过快,氧化剂有可能来不及与物料充分接触反应就被分解。
d.反应温度的影响
用滴加的方式加入H2O2,由于反应放出大量热,温度对Fe2+的转化率影响不明显。但在温度较低时,七水合硫酸亚铁很难溶解,延长了反应时间,同时Fe2+的转化率稍有降低;在温度较高时,会引起H2O2部分分解,使溶液中含有较多的Fe2+。所以把温度控制在50℃~60℃即可。
e.搅拌速度的影响
此反应在搅拌作用下,使氧化反应均匀快速进行。搅拌速度小,H2O2没有及时分散,会造成局部氧化及H2O2分解,从而导致Fe2+不能够完全氧化;若搅拌速度大,溶液飞溅,不仅增加能耗且氧化不均匀。
PFS的制备受反应温度、氧化剂种类,氧化剂的加入速度和酸度等多种因素的影响,如果条件控制不好,将直接影响产品的性能和质量,其中氧化剂的选择、加入速度以及酸度的控制对其性能的影响尤为显著【4】。
6.聚铁制备实验中,一般硫酸与硫酸亚铁的摩尔比控制在0.25-0.45的范围内,此比值或大或小时,可能会出现什么结果?
答:小于该范围时,会导致Fe3+水解;大于该范围时,会使得溶液中OH-浓度降低,而生成硫酸铁。
7.聚铁制备时要采用很快的搅拌速度,而混凝性能实验时则搅拌速度比较慢,为什么?
答:制备时快速搅拌,是为了使得反应充分进行,促进反应;而后搅拌慢,是为了不破坏混凝实验中生成的聚合物,使得实验顺利进行。
4. 结论
在该实验中,所得产品为红褐色黏稠透明液体,产率可达92% 以上。因此说用H2O2氧化FeSO4 ·7H2O 生产聚合硫酸铁是较经济的, 设备简单。如能找到适当的废酸, 成本将会更低, 而且用过氧化氢生产聚铁具有设备简单、生产周期短、原料廉价易得,能以废治废、产品稳定性高等优点.综上所述, 聚铁制备具有广泛的社会、经济、环境效益。
【参考文献】
[1] 潘碌亭,吴锦峰.聚合硫酸铁制备技术的研究与进展[J].工业水处理,2009,29(9):1-5
[2] 黄珊,李正山,潘科.KClO3氧化法制备PPS的氧化过程研究[J].四川环境,2007,26(3):5-7
[3] 邵维仁,朱传俊.聚合硫酸铁产品的质量检验[J]. 工业水处理,1994,14(1):30-32
[4] 冯西平,李光荣 聚合硫酸铁碱化度的测试与分析 科技创新导报[J].化学工业,2009(30)
