MR.Shen高中理综合精讲 无机化学方程知识点总结 TEL MR.Shen:188xxxxxxxx
Mr.Shen高中理综合精讲
对于高一的新生来说,无机金属以及无机非金属占据高中无机化学的半壁江山,可以说,完全掌握了无机元素,你至少锁定了理综化学的三十分;学习高中化学必修一,重点在于方程式以及对于各个元素的各项反应方程式的记忆。下面我将对无机知识点做以系统归纳以及总结,希望各位认真阅读,认真理解,梦在远方,路在脚下,加油!
无机化学方程式知识点总结
1、熟悉元素周期表和元素周期律(电子排布和周期表的关系,化合价和最外层电子数、元
素所在的族序数的关系(包括数的奇偶性),微粒的半径大小和元素周期表的关系,非金属氢化物的稳定性、酸性和元素周期表的关系)。
熟悉常见的分子或单质、化合物的物质结构(水、氨气、二氧化碳、金刚石、二氧化硅的结构特点,相同电子数的微粒(10电子,18电子,H2O2和H2S,CO、N2、C2H4,O2、CH4))。
2、知道典型的溶解性特征
①加入过量硝酸从溶液中析出的白色沉淀:AgCl,原来溶液是Ag(NH3)2Cl;后者是硅酸沉淀,原来的溶液是可溶解的硅酸盐溶液。生成淡黄的沉淀,原来的溶液中可能含有S2-,或者是S2O32-
②加入过量的硝酸不能观察到沉淀溶解的有AgCl,BaSO4;BaSO3由于转化成为BaSO4而不能观察到沉淀的溶解。AgBr,AgI,也不溶解,但是沉淀的颜色是黄色。
③能够和盐反应生成强酸和沉淀的极有可能是H2S气体和铅、银、铜、汞的盐溶液反应。:
④沉淀先生成后溶解的:CO2和Ca(OH)2,Al3+和氢氧化钠,AlO2-和盐酸,氨水和硝酸银
3、操作不同现象不同的反应: Na2CO3和盐酸;AlCl3和NaOH,NaAlO2和盐酸;AgNO3
和氨水;FeCl3和Na2S;H3PO4和Ca(OH)2反应。
4、先沉淀后澄清的反应:
AlCl3溶液中加入NaOH溶液,生成沉淀,继续滴加沉淀溶解:
AgNO3溶液中滴加稀氨水,先沉淀后澄清:
NaAlO2溶液中滴加盐酸,也是先沉淀后澄清:
澄清石灰水通入二氧化碳,先沉淀后澄
清: ;
次氯酸钙溶液中通入二氧化碳,先沉淀后澄
清:;
KAl(SO4)2与NaOH溶
液: ;
5、通入二氧化碳气体最终能生成沉淀的物质:苯酚钠溶液、硅酸钠溶液、偏铝酸钠溶液
(这三种都可以与少量硝酸反应产生沉淀)、饱和碳酸钠溶液。
1
MR.Shen高中理综合精讲 无机化学方程知识点总结 TEL MR.Shen:188xxxxxxxx
苯酚钠溶液: ;
硅酸钠溶液: ;
饱和碳酸钠溶液: ;
偏铝酸钠溶液: ;
6、能生成两种气体的反应:
HNO3的分解: ;
Mg与NH4Cl溶液的反应:;
电解饱和食盐水: ;
C与浓HNO3加热时反应: ;
C与浓H2SO4加热时反应: ;
7、:

型的反应:


8、两种单质反应生成黑色固体:Fe与O2、Fe与S、Cu与O2
9、同种元素的气态氢化物与气态氧化物可以发生反应生成该元素的单质的是: S、N元
素
H2S+SO2——
NH3+NO—— ;
NH3+NO2——
10、同种元素的气态氢化物与最高价氧化物的水化物可以发生反应生成盐的是:N元素
NH3+HNO3——
11、同时生成沉淀和气体的反应:
Mg3N2+H2O——
CaC2+H2O——
Na2S2O3+H2SO4——
Ba(OH)2+(NH4)2SO4——
Al3+、Fe3+-——S2-、CO32-、HCO3-间的双水解反应:
Al3++S2-——;
Al3++HCO3-——;
Fe3++CO32―——;
12、常见的置换反应:
(1)金属置换金属:
如溶液中金属与盐的反应: ;
铝热反应: ;
(2)非金属置换非金属:
卤素间的置换:;
氟气与水的反应: ;
二氧化硅与碳的反应: ;
硫化氢与氯气反应: ;
(3)金属置换非金属:
2


MR.Shen高中理综合精讲 无机化学方程知识点总结 TEL MR.Shen:188xxxxxxxx
活泼金属与非氧化性酸的反应: ;
钠与水的反应: ;
镁在二氧化碳中燃烧: ;
(4)非金属置换金属:
氢气与氧化铜的反应: ;
碳与氧化铁反应: 。
13、一种物质分解成三种物质:
2KMnO4 ——NH4HCO3 ——(NH4)2CO3 ——NaHCO3 ——Ca(HCO3)2 ——Cu2(OH)2CO3 ——HNO3——
14、三合一的反应:
NH3+H2O+CO2 ——4Fe(OH)3+O2+2H2O ——
4NO2+O2+2H2O ——
4NO+3O2+2H2O ——
CaCO3+CO2+H2O ——
Na2CO3+CO2+H2O ——
AlO2-+Al3++H2O ——
15、能同酸反应的单质:
(1)金属单质(顺序表前的可以同非氧化酸反应,后面的只能与氧化性酸反应)
Zn+H2SO4(稀)——
Zn+H2SO4(浓)——
Cu+HNO3(浓)——
Ag+HNO3(稀)——
(注意:铁、铝遇冷的浓硫酸、硝酸会钝化)
(2)C、S、P可跟氧化性酸(浓H2SO4、HNO3)反应
C+H2SO4(浓)——
C+HNO3(浓)——
S+H2SO4(浓)——
S+HNO3(浓)——
(3)卤素(Cl2、Br2、I2)、O2可与还原性酸(H2S、H2SO3)反应
H2S+X2——
H2S(溶液)+O2——H2SO3+X2——
H2SO3+O2——
(4)Si只与氢氟酸反应: Si+HF——
16、能同碱反应的单质:硫、硅、铝、卤素单质
S+KOH(浓)——
3
MR.Shen高中理综合精讲 无机化学方程知识点总结 TEL MR.Shen:188xxxxxxxx
Si+NaOH+H2O——
Al+NaOH+H2O——
Cl2+NaOH——
Cl2+Ca(OH)2——
[注意]:既能跟酸又有跟碱反应的单质有Al、S、Si、P、卤素单质
17、既能与酸又能与碱反应的无机化合物:
弱酸的酸式盐、两性氧化物和两性氢氧化物、弱酸的铵盐;
NaHCO3+HCl——
NaHCO3+NaOH——
Al2O3+H2SO4——Al2O3+NaOH——
Al(OH)3+NaOH——
Al(OH)3+H2SO4——
18、既能与酸又能与碱反应均有气体放出的有:
NH4HCO3、(NH4)2CO3、NH4HSO3、(NH4)2SO3、NH4HS、(NH4)2S
NH4HCO3+HCl——
NH4HCO3+NaOH——
(NH4)2SO3+H2SO4——(NH4)2SO3+NaOH——
NH4HS+HCl——
NH4HS+NaOH——
19、能生成沉淀和强酸的反应:H2S与Cl2、Br2;CuSO4与H2S
H2S+Cl2——
CuSO4+H2S——
能生成两种强酸的反应:Cl2(Br2、I2)与SO2反应
Cl2+SO2+H2O——
4
MR.Shen高中理综合精讲 无机化学方程知识点总结 TEL MR.Shen:188xxxxxxxx
无机框图题 题眼归纳
一、特征反应
1.与碱反应产生气体
?Al、Si?OH???H2???(1)单质?2Al?2NaOH?2H2O?2NaAlO2?3H2?
?Si?2NaOH?H2O?Na2SiO3?2H2???
碱?(2)铵盐:NH4???NH3??H2O ?
2.与酸反应产生气体
???HCl???H2???浓H2SO4金属??SO2????????HNO3??NO2?、NO?????
?浓HSO4??(1)单质???SO2?、CO2? ???2??C?浓HNO?3???????NO2?、CO2???非金属?浓HSO4??SO2??????2??S??浓HNO3??????SO2?、NO2????
H?CO32?HCO3????CO2???2?H??(2)化合物?SHS???H2S?
?2?H??SOHSO???SO2?3??3???????
3.Na2S2O3与酸反应既产生沉淀又产生气体: S2O32-+2H+=S↓+SO2↑+H2O
4.与水反应产生气体
(1)单质???2Na?2H2O?2NaOH?H2? ??2F2?2H2O?4HF?O2?
?2Na2O2?2H2O?4NaOH?O2???Mg3N2?3H2O?3Mg?OH?2??2NH3?(2)化合物?
?Al2S3?6H2O?2Al?OH?3??3H2S?
?CaC?2HO?Ca?OH??CH?22222?
2O?CO32??HCO3???H???CO2??Al?OH?3??2?H2O3??5.强烈双水解Al与?S?HS??? ??H2S??Al?OH?3?
?H2O???Al?OH?3??AlO2??
6.既能酸反应,又能与碱反应
(1)单质:Al (2)化合物:Al2O3、Al(OH)3、弱酸弱碱盐、弱酸的酸式盐、氨基酸。
CO2??O2??Na2CO3????7.与Na2O2反应?HO 2???O2??NaOH???
5
MR.Shen高中理综合精讲 无机化学方程知识点总结 TEL MR.Shen:188xxxxxxxx
8.2FeCl3+H2S=2FeCl2+S↓+2HCl
?H2O?电解???H2??O2???电解?Al?O2?9.电解?Al2O3?熔融???? 2NaCl2↑
?电解NaCl溶液????NaOH?Cl2??H2???
10.铝热反应:Al+金属氧化物????金属+Al2O3
11
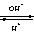
. Al3+ Al(OH)
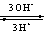
3 AlO2- 高温
12.归中反应:2H2S+SO2=3S+2H2O H2S+H2SO4( 浓)=S+SO2↑+2H2O
H2S+3H2SO4( 浓2↑+4H2O 4NH3+6NO????4N2+6H2O 催化剂
?1.金属?盐?金属?盐13.置换反应:(1)金属→金属?
?2.铝热反应
或H2O??H????H2??活泼金属(Na、Mg、Fe)(2)金属→非金属? 点燃??2MgO?C?2Mg?CO2????
?2F2?2H2O?4HF?O2??高温?Si?2CO?2C?SiO2???(3)非金属→非金属? 高温?CO?H2?C?H2O???
?Cl(Br、I)?HS?S?2HCl(HBr、HI)2?222
高温??金属?H2O?H2?金属氧化物???(4)非金属→金属? 高温
??金属?CO2?C?金属氧化物???
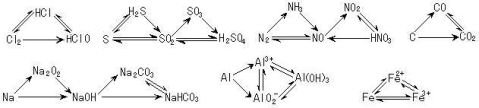
14.三角转化:
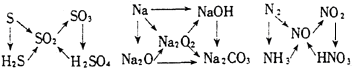
交叉型转化:
15.受热分解产生2种或3种气体的反应:
??NH4HCO3[(NH4)2CO3]???NH3??CO2??H2O??铵盐?NH4HSO3[(NH4)2SO3]???NH3??SO2??H2O
??NHHS[(NH)S]???NH3??H2S?442?
16.特征网络:
222(1)A???B???C????D(酸或碱) OOHO
6
MR.Shen高中理综合精讲 无机化学方程知识点总结 TEL MR.Shen:188xxxxxxxx
222①NH(气体)???NO???NO2????HNO3 3OOHO
222②H2S(气体)???SO2???SO3????H2SO4 OOHO
222③C(固体)???CO???CO2????H2CO3 OOHO
222④Na(固体)???Na2O???Na2O2????NaOH OOHO
强酸???气体B???(2)A—? 强碱???气体C???
A为弱酸的铵盐:(NH4)2CO3或NH4HCO3;(NH4)2S或NH4HS;(NH4)2SO3或NH4HSO3
(3)无机框图中常用到催化剂的反应:
2,?2KClO3?MnO????2KCl?3O2?
22H2O2?MnO???2H2O?O2?
?2SO2?O2?催化剂,????2SO3
4NH3?5O2?????4NO?6H2O
?N2?3H2?催化剂,????2NH3催化剂,?
17.关于反应形式的联想:
①热分解反应:典型的特征是一种物质加热(1变2或1变3)。

B+C :不溶性酸和碱受热分解成为相应的酸性氧化物(碱性氧化物)和水。
举例:H4SiO4;Mg(OH)2,Al(OH)3,Cu(OH)2,Fe(OH)3
不溶性碳酸盐受热分解:CaCO3,MgCO3(典型前途是和CO2的性质联系),
NaNO3,KNO3,KClO3受热分解(典型特征是生成单质气体)。
B+C+D:属于盐的热稳定性问题。NH4HCO3,MgCl2·6H2O,AlCl3·6H2O
硝酸盐的热稳定性:Mg(NO3)2,Cu(NO3)2,AgNO3
KMnO4。FeSO4
NH4I,NH4HS(分解的典型特征是生成两种单质。
H2O2也有稳定性,当浓度低时,主要和催化剂有关系。温度高时
受热也会使它分解。A
含有电解熔融的Al2O3来制备金属铝、电解熔融的NaCl来制备金属钠。
2.两种物质的加热反应:
C:固体和固体反应:SiO2和CaO反应;固体和气体C和CO2
A+
BC+D:固体和固体反应的:Al和不活泼的金属氧化物反应。SiO2和C的反应(但是生成气体)SiO2和碳酸钙以及碳酸钠的反应。C还原金属氧化物。
固体和液体反应:C和水蒸气的反应:Fe和水蒸气的反应。
气体和液体:CO和水蒸气。
C+D+E:浓烟酸和MnO2反应制备氯气:浓硫酸和C,Cu,Fe的反应,
浓硝酸和C的反应。实验室制备氨气。
3.三种物质之间的反应:
7
MR.Shen高中理综合精讲 无机化学方程知识点总结 TEL MR.Shen:188xxxxxxxx
加热:重要有制备氯气:MnO2+NaCl+H2SO4制备氯气。
A+B+C
气体不加热:KClO3+KCl+H2SO4制备氯气。
Si+NaOH+H2O生成氢气
Al+NaOH+H2O生成氢气
Cu + H2SO4 + HNO3二、物质的重要特征:
1、性质特征:
(1)物质的颜色:
有色气体单质:F2、Cl2、O3
其它有色单质:Br2(深棕红色液体)、I2(紫黑色固体)、S(淡黄色固体)、Cu(红色固体)、Au
(金黄色固体)、P(白磷是白色固体,红磷是赤红色固体)、Si(灰黑色晶体)、
C(黑色粉未)
无色气体单质:N2、O2、H2 有色气体化合物:NO2
黄色固体:S、Na2O2、AgBr、AgI、FeS2
黑色固体:FeO、Fe3O4、MnO2、C、CuS、PbS、CuO
红色固体:Fe(OH)3、Fe2O3、Cu2O、Cu
蓝色固体:五水硫酸铜(胆矾或蓝矾) ;
绿色固体:七水硫酸亚铁(绿矾) ;
紫黑色固体:KMnO4、碘单质。
白色[Fe(0H)2、CaCO3、BaSO4、AgCl、BaSO3]
-有色离子(溶液)Cu2+、Fe2+、Fe3+、MnO4
不溶于稀酸的白色沉淀:AgCl、BaSO4
不溶于稀酸的黄色沉淀:S、AgBr、AgI

3红棕色;Fe(OH)3红褐色;[Fe(SCN)]2+红色(或血红色);Cu2O红色(或砖红色);被氧化
的苯酚(即苯醌)粉红色;石蕊在pH<5的溶液中呈红色;酚酞在pH8~10的溶液中呈浅红色;
NO2红棕色;红磷暗红色;Br2深棕红色;品红溶液红色;充氦气、氖气的灯管红色; Cu紫
红色;甲基橙在pH<3.1的溶液中显红色。

4-紫红色;[Fe(C6H5O)6]3—紫色;I2紫黑色;I2蒸汽紫色;I2的CCl4或苯或汽油等溶液紫
红色(碘酒褐色);石蕊在pH5~8的溶液中呈紫色。

pH3.1~4.4的溶液中呈橙色。
3溶液溶液棕黄色。
、AgI、Fe
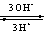
3+、Na2O2、AgBr、F2;甲基橙在pH>4.4的溶液中呈黄色。
2+、Cu(OH)2、CuSO4·

5H2O;石蕊在pH>8的溶液中呈蓝色;I2
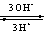
遇淀粉变蓝色;液态、固态
的氧气淡蓝色;
MnO2、CuO、CuS、Cu2S、PbS、Ag2S、FeS、FeO、Fe3O4黑色;
Si灰黑色。绿色:Fe2+浅绿色;Cl2黄绿色;CuCl2浓溶液绿色(很浓黄绿色、稀则蓝色);碱
式碳酸铜绿色。
2O褐色。
重要的反应:铝热反应、过氧化钠性质、Mg+CO2→、Fe3+→Fe2+、漂白粉性质、常见气体的实验室制
法、电解熔融氧化铝、电解饱和食盐水、化工上的反应(硅酸盐工业、硫酸工业、硝酸工
业、皂化反应)。
(2)物质的状态:
常温下为液体的单质:Br2、Hg 常温下的常见的无色液体:H2O H2O2
8
MR.Shen高中理综合精讲 无机化学方程知识点总结 TEL MR.Shen:188xxxxxxxx 常见的气体:H2、N2、O2、F2、Cl2 、NH3、HF、HCl(HX)、H2S、CO、CO2、NO、NO2、SO2)[注:
有机物中的气态烃CxHy(x≤4);有机化学中有许多液态物质,但是含氧有机化合物中
只有HCHO常温下是气态]
常见的固体单质:I2、S、P、C、Si、金属单质。 白色胶状沉淀(Al(OH)3、H4SiO4)
(3)物质的气味:
有臭鸡蛋气味的气体:H2S 有刺激性气味的气体:Cl2、SO2、NO2、HX、NH3
有刺激性气味的液体:浓盐酸、浓硝酸、浓氨水、氯水、溴水
(4)物质的毒性:
非金属单质有毒的:Cl2、Br2、I2、F2、S、P4
常见的有毒气体化合物:CO、NO、NO2、SO2、H2S
能与血红蛋白结合的是CO和NO
(5)物质的溶解性:
极易溶于水的气体:HX、NH3
常见的难溶于水的气体:H2、N2、NO、CO、CH4、C2H4、C2H2
S和P4不溶于水,微溶于酒精,易溶于二硫化碳。
2、组成特征:
(1)不含金属元素的离子化合物:铵盐
---(2)含有金属元素的阴离子:MnO4、AlO2、Cr2O72
(3)AB2型的化合物:CO2、NO2、SO2、SiO2、CS2、ClO2、CaC2、MgX2、CaX2、BeCl2、KO2等
(4)A2B2型的化合物:H2O2、Na2O2、C2H2等
(5)A2B型的化合物:H2O、H2S、Na2O、Na2S等
(6)AB型的化合物:CO、NO、HX、NaX、MgO、CaO、MgS、CaS等
(7)能形成A2B和A2B2型化合物的元素:H、Na与O
3、结构特征:
(1)具有正四面体结构的物质:甲烷、白磷、NH4+、金刚石等
(2)属于线型分子的是:CO2、CS2、C2H2等
(3)属于平面分子的有:C2H4、苯等
4、分子的极性:
(1)常见的非极性分子:CO2、CS2、CH4、CCl4、C2H4、C2H2、C6H6等
(2)常见的极性分子:双原子化合物分子、H2O、H2S、NH3、H2O2等
5.特征反应现象:白色沉淀[Fe(OH)2]????红褐色[Fe(OH)3] 空气
三、重要的实验现象:
1、燃烧时火焰的颜色:
(1)火焰为蓝色或淡蓝色的是:H2、CO、CH4、H2S、C2H5OH;
(2)火焰为苍白色的为H2与Cl2;
(3)Na燃烧时火焰呈黄色。
2、沉淀现象:
---(1)溶液中反应有黄色沉淀生成的有:AgNO3与Br、I;S2O32与H+、H2S溶液与一些氧化性物质(Cl2、
O2、SO2等);
(2)向一溶液中滴入碱液,先生成白色沉淀,进而变为灰绿色,最后变为红褐色沉淀,则溶液中一定
含有Fe2+;
(3)与碱产生红褐色沉淀的必是Fe3+;
-(4)产生黑色沉淀的有Fe2+、Cu2+、Pb2+与S2;
(5)与碱反应生成白色沉淀的一般是Mg2+和Al3+,若加过量NaOH沉淀不溶解,则是Mg2+,溶解则是 9
MR.Shen高中理综合精讲 无机化学方程知识点总结 TEL MR.Shen:188xxxxxxxx
Al3+;
-(6)加过量酸产生白色胶状沉淀者是SiO32。
3、放气现象:
(1)与稀盐酸反应生成刺激性气味的气体,且此气体可使品红溶液褪色,该气体一般是二氧化硫,
--原溶液中含有SO32或HSO3。
(2)与稀盐酸反应生成无色气体,且此气体可使澄清的石灰水变浑浊,此气体可能是CO2或SO2;
(3)与碱溶液反应且加热时产生刺激性气味的气体,此气体可使湿润的红色石蕊试纸变红,此气体
中氨气,原溶液中一定含有NH4+离子;
4、变色现象:
-(1)Fe3+与SCN、苯酚溶液、Fe、Cu反应时颜色的变化;
(2)遇空气迅速由无色变为红棕色的气体必为NO;
(3)Fe2+与Cl2、Br2等氧化性物质反应
(4)酸碱性溶液与指示剂的变化;
(5)品红溶液与Cl2、SO2等漂白剂的作用;
(6)碘遇淀粉变蓝。
(7)卤素单质在水中和在有机溶剂中的颜色变化。
5、放热现象:
(1)强酸和强碱溶于水时一般放热,盐溶于水时一般吸热,NaCl溶于水时热量变化不大。
(2)氢氧化钡晶体与氯化铵晶体混合反应吸热、二氧化碳与碳的反应也是吸热;
(3)酸碱中和、金属与酸、物质与氧气的反应都是放热反应 6、与水能发生爆炸性反应的有F2、K、Cs等。
四、重要的反应条件:
1、需催化剂的无机反应:
(1)氯酸钾的分解: ;
(2)过氧化氢的分解: ;
(3)合成氨反应: ;
(4)氨的催化氧化: ;
(5)二氧化硫的催化氧化: ;
2、必须控制170℃才能发生的反应,必是制取乙烯的反应;
3、需放电才能进行的反应:N2与O2的反应: ; 4、需光照的反应:HNO3、HClO、AgX的分解;H2与Cl2混合见光爆炸;
五、重要的化工生产反应:
1;
(注意于谦的《石灰吟》:“千锤万凿出深山,烈火焚烧若等闲。粉身碎骨浑不怕,要留清白在人间。”中包含的三个化学方程式。以及成语“滴水穿石”、“钟乳石的形成”中包含的化学方程式)
2、水煤汽的生产:;
3、盐酸的生产:氢气在氯气中燃烧 ;
4、漂白粉的生产:将氯气通入石灰乳中粉
漂白粉的成分是: ,其中有效成分是次氯酸钙,真正起漂白作用的则是次氯酸。
5、硫酸的生产(接触法):
;
6、玻璃的生产:工业上用纯碱、石灰石和石英为原料来生产普通玻璃。
;
7、合成氨生产:
8、工业生产硝酸(氨氧化法):
10
MR.Shen高中理综合精讲 无机化学方程知识点总结 TEL MR.Shen:188xxxxxxxx
9、电解饱和食盐水:;
10、金属的冶炼:(1)钠的冶炼:;
(2)镁的冶炼: ;(3)铝的冶炼: ;
(4)铁的冶炼: ;(5)铝热反应: ;
11
