《无机化学》各章小结
第一章 绪论
 平衡理论 :四大平衡
平衡理论 :四大平衡

 理论部分 原子结构
理论部分 原子结构
1.无机化学 结构理论:, 分子结构,
晶体结构
元素化合物
2.基本概念:体系,环境,焓变,热化学方程式,标准态
 古代化学
古代化学
3.化学发展史: 近代化学
现代化学
第二章 化学反应速率和化学平衡
1. 化学反应速率
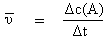
2. 质量作用定律
 元反应 aA + Bb Yy + Zz
元反应 aA + Bb Yy + Zz
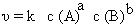
3. 影响化学反应速率的因素: 温度, 浓度, 催化剂, 其它.
温度是影响反应速率的重要因素之一。温度升高会加速反应的进行;温度降低又会减慢反应的进行。
浓度对反应速率的影响是增加反应物浓度或减少生成物浓度,都会影响反应速率。
催化剂可以改变反应速率。
其他因素, 如相接触面等。在非均匀系统中进行的反应,如固体和液体,固体和气体或液体和气体的反应等,除了上述的几种因素外,还与反应物的接触面的大小和接触机会有关。超声波、紫外线、激光和高能射线等会对某些反应的速率产生影响
4. 化学反应理论: 碰撞理论, 过渡态理论
碰撞理论有两个要点:恰当取向,足够的能量。
过渡态理论主要应用于有机化学。
5. 化学平衡: 标准平衡常数, 多重平衡规则, 化学平衡移动及其影响因素
(1)平衡常数为一可逆反应的特征常数,是一定条件下可逆反应进行程度的标度。对同类反应而言,K值越大,反应朝正向进行的程度越大,反应进行的越完全
(2)书写和应用平衡常数须注意以下几点
a. 写入平衡常数表达式中各物质的浓度或分压,必须是在系统达到平衡状态时相应的值。生成物为分子项,反应物为分母项,式中各物质浓度或分压的指数,就是反应方程式中相应的化学计量数。气体只可以用分压表示,而不能用浓度表示,这与气体规定的标准状态有关。
b.平衡常数表达式必须与计量方程式相对应,同一化学反应以不同计量方程式表示时,平衡常数表达式不同,其数值也不同。
c.反应式中若有纯故态、纯液态,他们的浓度在平衡常数表达式中不必列出。在稀溶液中进行的反应,如反应有水参加,由于作用掉的水分子数与总的水分子数相比微不足道,故水的浓度可视为常数,合并入平衡常数,不必出现在平衡关系式中。
由于化学反应平衡常数随温度而改变,使用是须注意相应的温度
(3)平衡移动原理 如以某种形式改变一个平衡系统的条件(如浓度、压力、温度),平衡就会向着减弱这个改变的方向移动。
a 浓度对化学平衡的影响
增大反应物的浓度或减小生成物的浓度,平衡向右移动,减小反应物的浓度或增大生成物的浓度,平衡逆向移动。
b 压力对化学平衡的影响
压力变化只对反应前后气体分子数有变化的反应平衡系统有影响
在恒温下增大压力,平衡向气体分子数减少的方向移动;减小压力,平衡向气体分子数的方向移动
c 温度对化学平衡的影响
温度变化时,主要改变了平衡常数,从而导致平衡的移动。
对于放热反应,升高温度,会使平衡常数变小。此时,反应商大于平衡常数,平衡将向左移动。反之,对于吸热反应,升高温度,平衡常数增大。此时,反应商小于平衡常数,平衡将向右移动。
d 催化剂能够降低反应的活化能,加快反应速率,缩短达到平衡的时间。由于它以同样倍数加快正、逆反应速率,平衡常数K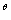 并不改变,因此不会使平衡发生移动。
并不改变,因此不会使平衡发生移动。
6. 化学平衡的综合利用。
第三章电解质溶液和离子平衡
1.强电解质溶液 表观电离度
2.水的离解
H2O  H+ +OH-
H+ +OH-
Kw = 1014
3. 酸碱指示剂
4.弱酸弱碱的电离平衡
Ka 弱酸电离常数
Kb 弱碱电离常数
5.稀释定律,一元弱酸碱与多元弱酸碱的电离平衡
6.同离子效应,缓冲溶液
同离子效应:在若电解质的溶液中,加入含有相同离子的易溶强电解质,使弱电解质离解度降低的现象。
缓冲溶液:能保持pH相对稳定的溶液,缓冲溶液通常由弱酸及其盐或弱碱及其盐所组成。
7.盐类水解
强酸弱碱盐,强碱弱酸,弱酸弱碱盐,强酸强碱盐
8.水解平衡及影响因素
温度,溶液酸碱性等。
9.酸碱质子理论
质子理论认为凡是能给出质子的物质都是酸,凡能接受质子的物质都是碱。
质子酸可以是分子、阳离子或阴离子。
质子碱也可以是分子、阳离子或阴离子。
酸碱共轭关系
根据质子理论,酸给出质子后剩余的部分就称为碱,因为它具有接受质子的能力;碱接受质子后就变成了酸。此所谓“酸中有碱,碱能变酸”。相互依存
10.沉淀和溶解平衡 容度积,容度积规则,盐效应
(1) Q>K ,溶液呈过饱和状态,有沉淀从溶液中析出,直到溶液呈饱和状态.
,溶液呈过饱和状态,有沉淀从溶液中析出,直到溶液呈饱和状态.
(2) Q<K ,溶液是不饱和状态,无沉淀析出.若系统中原来有沉淀,则沉淀开始溶解,直到溶液饱和.
,溶液是不饱和状态,无沉淀析出.若系统中原来有沉淀,则沉淀开始溶解,直到溶液饱和.
(3) Q=K ,溶液为饱和状态,沉淀和溶解处于动态平衡.
,溶液为饱和状态,沉淀和溶解处于动态平衡.
此即溶度积规则,它是判断沉淀的生成和溶解的重要依据.
11. 沉淀的溶解,转化
第四章氧化和还原
1.氧化还原的基本概念
氧化值 (形式电荷),单质中元素的氧化值为零,中性分子分子中,各元素氧化值的代数和为零,离子中,元素或多元素的氧化值之和等于离子所带的电荷。
氧化还原电对,如Cu2+/Cu ,Fe3+/Fe2+
2. 离子电子法配平
原则:电子总数相等;原子总数相等
适用于溶液体系。
3.原电池
原电池的组成:至少两个电对,有象盐桥那样能连起来的装置。电极可以是金属,也可以是非金属。
Cu-Zn原电池符号,电极反应,电池反应。作为本章的重点必须掌握。
4.电极电势
标准电极电势,标准氢电极电势,电池符号Eθ
本教材使用的电极电势是还原电极电势,一定要注意和其它教材区别,尤其一些老教材。注意: Cu2+ + 2e- = Cu 与 Cu –2e- =Cu2+ 的区别。
5.Nerst方程
6.电极电势的应用
判断氧化剂和还原剂的相对强弱, 判断氧化还原反应进行的程度和方向。
7.元素电势图及其应用
元素电势图:元素不同的氧化值,按照有高到低的顺序排成一行,在相邻两个物种之间用直线相连,表示一个电对,并在直线上标明此电对的标准电极电势值。
应用元素电势图可以进行歧化反应的能否发生的判断。左电对电极电势大于右电对电极电势,则会发生歧化反应,反之,发生逆歧化反应。
另外,应用元素电势图,可以综合评价元素及其化合物的氧化还原性质的判断。如教材对氯及其氧化物在酸性条件和碱性条件下的性质进行的评价。
第五章原子结构与元素周期律。
1.原子核外电子的运动状态
原子轨道,电子云,四个量子数,Pauling 能级图
量子数,电子层,电子亚层之间的关系,每个电子层最多容纳的电子数
主量子数 1 2 3 4
电子层 K L M N
角量子数 0 1 2 3
电子亚层 s p d f
每个亚层电子数 2 6 10 14
每层最多容纳电子数 2 8 18 32
2.原子核外电子排布
原子核外电子排布三原理,核外电子排布式,轨道排布式
3.原子核外电子排布式与元素周期律
周期与能级组,族与价电子构型,周期表元素分区。
4.元素性质的周期性
有效核电荷,原子半径,电离能,电子亲和能
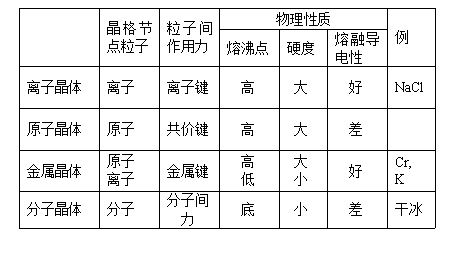
第六章分子结构与晶体结构
1. 化学键 分子或晶体中相邻原子间强烈的相互作用
 共价键:共用电子对
共价键:共用电子对
分类 离子键:阴阳离子间吸引作用
金属键:金属原子、金属离子与电子之间的结合力
3.共价键理论要点:配对原则和最大重叠原则
键参数: 键长,键角,键能
4.杂化理论与分子构型
等性杂化和非等性杂化,等性杂化分为是sp,sp2,sp3
5.分子间作用力与分子晶体
分子间作用力分为色散力,诱导力,取向力。

6.离子键与离子晶体
离子的电子构型
2电子型: Li+. Be2 +.
8电子型:Na +,Ba2 +.
18电子型:Ag +,Zn2 +.
18+2电子型:Sn2 +,Bi2 +
9 -- 17电子型:Fe2 +,Cu2+
离子化合物无方向性和饱和性
7.离子极化
离子极化对物质的熔点、溶解度的影响。
8.其他类型晶体
第七章配位化合物
1.配位化合物的基本概念
配位化合物的组成:内界和外界,内外界之间属于离子键,当然也有的配合物无外界,如Fe(CO)4。
形成体与配位体,形成体主要是金属原子或金属离子。配位体主要是能提供孤电子对的原子或分子。配位数是配位原子数。
命名原则遵循无机化合物的命名原则。
如:[Cu(H2O)4]·SO4 硫酸四水合铜(II)
2.配位化合物的结构
配位化合物中化学键,包括离子键,共价键,配位键。
杂化轨道与配位化合物的空间构型。
内轨配合物与外轨配合物的异同。内轨配合物是参与杂化的原子的次外层的电子参与杂化,形成化学键,外轨配合物是指原子的外层电子参与了杂化。内轨配合物能量低,稳定性高。
3. 配位平衡
平衡常数,平衡常数的应用,配位平衡的移动
配位平衡常数用K表示或β表示。β值越大表示配离子越稳定。可以应用β来判断相同类型的配合物的稳定性强与弱。也可以进行溶液中某离子浓度的计算。
影响配位平衡的因素有溶液的酸碱性、氧化还原反应、及是否可以生成更稳定的配合物。
4. 鳌合物 概念与特性
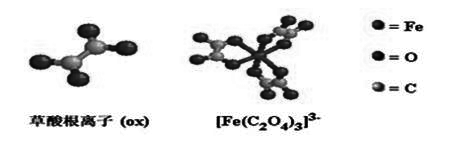
a) 配合物形成体在周期表中的分布
第八章主族元素(一)碱金属与碱土金属
1.碱金属(IA ): ns1
Li, Na, K, Rb, Cs, Fr
2.碱土金属(IIA ): ns2
Be, Mg, Ca, Sr, Ba, Ra
3.碱金属元素概述
碱金属的物理性质,钠钾的制备,碱金属氧化物,硫化物,氢氧化物的性质,
生产氢氧化钠的新工艺,重要的钠钾盐。
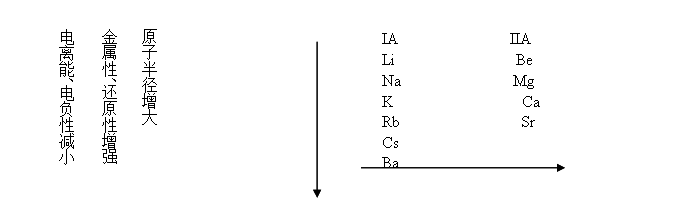
原子半径减小
金属性、还原性减弱
电离能、电负性增大
4.碱土金属元素概述
碱土金属元素的物理性质,氧化物、氢氧化物的性质,盐类的通性,硬水软化和纯水的制备。
5.对角线规则



 Li Be B C
Li Be B C
Na Mg Al Si
6.氢氧化物的性质
 M- O- H M+ + OH-
M- O- H M+ + OH-
 M- O- H MO- + H+
M- O- H MO- + H+
?= z/r (z: M离子的电荷;:r:离子半径)
? 1/2 < 0.22 MOH显碱性
? 1/2 在0.22---0.32间 MOH显两性
? 1/2 > 0.32 MOH显酸性
第九章主族元素(二)铝、锡、铅、砷、锑、铋
1.元素的概述
1).p区元素分为金属和非金属元素。只有砷分族3种As, Sb,Bi属常见元素。
2.)价电子构型:ns2np1-6
3)同一族自上而下,原子半径逐渐增大,金属性逐渐增强,非金属减弱。
4)同周期元素自右而左,形成负氧化态的能力减弱。
5)一般都有多种氧化态。最高氧化态等于价层电子数。
2.铝的典型性质缺电子性、亲氧性及两性,氧化物两性。
3.锡、铅单质的性质
锡、铅氧化物的氧化还原性。
2HgCl2 + Sn2+ → Hg2Cl2↓ + Sn4+ + 2Cl_
Hg2Cl2 + Sn2+ → 2Hg↓ + Sn4+ + 2Cl_
锡、铅的氧化物有SnO,SnO2,PbO,PbO2
4.砷、锑、铋的单质及其化合物的性质,含砷、含铅废水的处理。
第十章 非金属元素(-) 氢 稀有气体 卤素
1.氢的制备、性质、应用。
氢在自然界中的分布 三种同位素:11H;12H; 13H
氢的成键特征: 离子键、共价键、独特的键形
氢可以与金属、非金属反应生成相应的氧化物,如水,二氧化碳等。
、 实验室制备 Zn + H2SO4 →ZnSO4 + H2↑
电解法 阴极 2H2O +2e- → H2 ↑ + 2OH-
阳极 4OH- → O2 ↑ + 2H2O +4e-
工业生产 C(赤热) + H2O(g) → H2(g) + CO(g)
2.稀有气体简介
稀有气体 He Ne Ar Kr Xe Rn
价电子构型 ns2np6
稀有气体电离能,熔沸点,溶解度,气体密度有如下变化规律。
He Ne Ar Kr Xe Rn
第一电离能 大 小
mp. bp. 小 大
水中溶解度 小 大
气体密度 小 大
3.卤素单质的制备,氢化物的性质,熟悉氯的含氧酸及其盐的性质应用。
卤素单质 F2 Cl2 Br2 I2
氢化物 HF HCl HBr HI
卤素单质可以发生氧化反应,是很强的氧化剂;单质还可以发生歧化反应。
2.4. 拟卤素与氰的几种重要化合物。
第十一章 非金属元素(二) 氧 硫、氮、磷、碳、硅、硼
1.氧及其化合物
氧单质、臭氧、过氧化氢。过氧化氢的结构及性质。
氧分子表现出顺磁性,是因为分子中含有2个3电子π键,也就是含有两个未成对电子,自旋平行。
臭氧浅兰色气体,在距地面20-40km的高空处存在较多,形成臭氧层,可以吸收紫外线。现在由于氟利昂等影响了臭氧层。臭氧的氧化性比氧的氧化性强。
双氧水市售有30%和3%,分子中存在一个过氧键,四个原子不在一个平面内,即可作氧化剂又可以做还原剂。如双氧水与高锰酸钾和二氧化锰分别反应,与高锰酸钾反应表现出还原性,与二氧化锰反应表现出氧化性。
2.硫及其化合物
硫单质及其氧化物和含氧酸盐。硫化氢及硫化物
硫单质有3种同素异形体,主要氧化物有SO2,SO3,形成相应的酸H2SO3,H2SO4.还有H2S2O3,H2S2O4,H2SO3,H2S2O5,H2S2O7,H2S2O8.硫酸是二元强酸,具有吸水性、氧化性和脱水性。H2S2O8形成的盐具有强氧化性,如(NH4)2S2O8.
硫化氢是无色有臭鸡蛋气味的气体。其水溶液为二元弱酸。和许多重金属形成难溶盐。
3.氮及其氢化物、硝酸盐
氮气工业上主要是由液态空气经分馏制得。氨,硝酸是氮的两种重要化合物。硝酸是强酸,具有氧化性。硝酸盐分解产物主要有,生成亚硝酸盐,氧化物,金属单质。
亚硝酸盐有毒。
汽车尾气中主要成份有NOX 。
4.磷及其化合物。
磷主要的同素异形体有白磷和红磷。氧化物主要有P2O5,P2O3.含氧酸主要有偏磷酸、焦磷酸、磷酸。磷酸可以形成一种正盐和两种酸式盐,只有磷酸二氢盐的水溶液呈酸性,其它两种呈碱性。
5.碳、硅、硼几种单质及其化合物的性质、应用。
碳的同素异形体有三种,即金刚石、石墨和球烯。其中球烯中C60 最稳定。
硅是地壳中含量最高的元素。石英是常见的二氧化硅的天然晶体。水玻璃是硅酸钠的水溶液。
第十二章 过渡元素(一)
1.

过渡元素的通性。
过渡元素原子半径不如主族元素半径变化,但呈现多种氧化态(如上图),具有很强的配位能力,具有催化性能和磁性,水合离子有颜色。
2.铜副族元素的通性,单质及其化合物的性质。
铜副族元素包括Cu、Ag、Au。第一副族与主族的区别与联系。第一主族元素活泼。
铜的一价化合物主要有:Cu2O, Cu2S, CuCl
铜的二价化合物主要有:CuO, CuS CuCl2
银常见的化合物是AgNO3,不同银的化合物具有感光性,银可以和许多配体形成配合物。银能溶于稀或浓的硝酸中,一般含银的废水废渣需要处理,处理的原则是产生沉淀,与液体分开。
3.锌副族元素的通性,锌、汞及其化合物的性质
IIB族包括锌、镉、汞三种元素,都是银白色金属,它们与元素周期表中的Sn,Pb,Bi等一起合称低熔点金属。通常所说的铅管,铅丝都是镀锌的铁管或铁丝。
镉主要用作耐腐蚀和高温的材料。
汞齐是汞能溶解许多金属形成液态或固态的合金,如钠汞齐。
锌的主要化合物有:ZnO, ZnCl2, ZnS, ZnSO4
铬的主要化合物有:CdS, Cd(NO3)2, 含镉废水需要处理。
汞的化合物有:Hg(NO3)2, HgCl2, HgO,HgCl, 含汞废水需要处理。
第十三章过渡金属元素(二)
1.铬及其化合物。
铬是周期表中VIB族第一种元素,在地壳中的丰度,居21位,主要矿物。铬铁矿(FeO·Cr2O3)。不锈钢是指含Cr在2%以上的钢。
铬的氧化物和氢氧化物有:
CrO Cr2O3
Cr(0H)2 Cr(OH)3
具有强氧化性的有CrO3,H2Cr2O7
Na2Cr2O7 K2Cr2O7 是两种重要的重铬酸盐,都是黄色晶体,分别称做红矾钠和红矾钾。
铬的各种物质之间转化关系见下表。
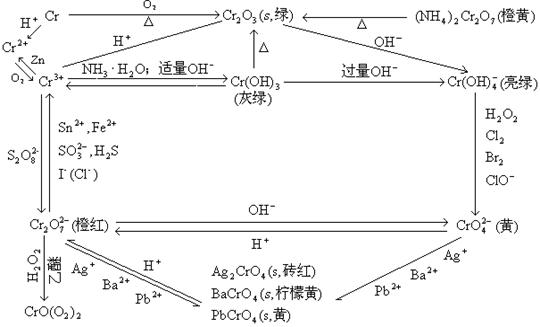
2.锰及其化合物。
锰是VIIB第一种元素,地壳中的丰度为14位,主要以软锰矿(MnO2.xH2O)形式存在。
主要化合物有MnO, Mn2O3 ,MnO2, MnO3, Mn2O7
主要氢氧化物有Mn(OH)2, Mn(OH)3, Mn(OH)4,H2MnO4,HMnO4
应该掌握的是KMnO4 的氧化性质及应用。
3.铁、钴、镍的单质、氧化物、氢氧化物的性质。
铁、钴、镍位于元素周期表VIIIB,性质相似,合称铁系元素。它们属于中等活泼金属,高温下能与O,S,Cl等非金属反应。
铁系元素氧化物都有颜色,其中钴二价盐因所含结晶水数目不同而呈现多种颜色。
铁系元素氢氧化物低价有还原性,高价具有氧化性。
实验室配置二价铁盐常用的是铁的复盐,FeSO4·(NH4)2SO4·6H2O
