转载自free kao yan
首先说明一下,我是复习考有机专业的,因为接触无机比较早,也看过一些无机的教材,对无机的知识点略有了解,同时应版主要求,把版中无机的讨论带动起来,故介绍一下个人学的无机的心得,供大家参考,仅代表个人观点.
无机的东西比较杂,并且比较松散,主要可以分为理论部分和元素化合物部分
理论部分主要分为四大结构和四大平衡,以及化学热力学,动力学初步和溶液
四大结构:原子结构,分子结构,配合物结构,晶体结构
四大平衡:酸碱平衡,沉淀溶解平衡,配位离解平衡,氧化还原平衡
如果你考物化的话化学热力学和动力学基础就不用看了,物化讲的比这个透彻得多,平衡的总纲以及溶液部分在物化里面也是讲的很详细;
如果你分析化学学得好的话,四大平衡也可以少看很多,因为分析化学就是建立在四大平衡的基础上的(仪器分析不算,呵呵);
而结构化学里面所涉及到的结构问题又比无机的四大结构深多了,同样如果你在这方面比较强,那四大结构又省了很多事.
但是如果每门掌握的都不透彻怎么办呢?不要担心,无机的理论部分仅仅是是一个大纲性质的东西,也就是总结性的概括.所以每种理论都有,但是每种理论要求都比较简单,按照四大结构-四大平衡-化学热力学初步-化学动力学初步-溶液的顺序自己仔细地过一遍也不是很难的事情,起码我感觉比自学有机容易多了,呵呵
如果你的化学基础比较扎实,也不要在旁边偷偷笑,正所谓"结构决定性质",无机尽管理论比较简单,但是其精髓在于用简单的理论解释大量的现象和物质性质,在你掌握相关理论的基础上要能够灵活地把它们运用到平时见到的单质和化合物的性质解释.这样才算真正掌握了无机的理论.
总的来说无机的理论部分重点在运用.
而无机化学的重点则元素部分,这个也是无机主要讲的东西以及无机的特点.
首先建议周期表最好是背过,认识并且会写除f区以外的元素,镧系最好能背过,一些重要的比如说La Ce也要知道的.
个人感觉主族元素里面比较重要的是B,P,S,Sn,Pb,As,Bi,
副族里Hg,Co,Cr,Mn,Ti,V,Cu等比较重要,下面分主族和副族元素分开介绍:
第一主族里面要注意过氧化物,超氧化物,臭氧化物的结构和生成条件,焰色反应的火焰颜色(包括碱土金属和少量过渡金属的都要知道),以及碱金属的不溶盐;
第二主族Mg,Ba最常见,同时也要注意焰色反应,对角线规则(主要是三对元素Li-Mg Be-Al,B-Si)首次在这里出现;
第三主族注意B和Al, 铝热反应,Al的冶炼要注意K3AlF6的作用;B绝对是基础无机的重点元素之一,要注意它的多中心缺电子桥键的结构;
第四主族里面C,Si,Ge,Sn,Pb都要比较熟悉.碳氢化合物主要是放在有机里面了,无机主要是看它的氧化物和碳酸盐,这个比较简单.
Si的考点的比较少,但是可以和元素有机结合起来,同时Si和Ge作为半导体材料应该和材料方面联系起来,并且这个地方要顺便复习一下晶体结构中的导带理论.Sn,Pb应该是重点考察的,二价Sn的还原性以及其在反应中价态变化导致颜色变化要很清楚,四价铅具有强氧化性也是要知道的.
第五主族N,P,As,Bi重点,N的氧化物结构及合成,HNO3的还原产物都是比较烦人的东西的
三种同素异形体的性质和相互转化(主要是白磷和红磷的相互转化条件)以及磷的氢化物和含氧酸的性质也要知道.As的氧化物和硫化物小心识记,马氏试砷法和古氏试砷法要熟悉,Bi要关注正五价的强氧化性
第六主族S是重点,硫化物的不溶盐及其颜色绝对可以烦死你,硫的含氧酸结构及性质也很多,带"矾"的硫酸盐要知道
卤素属于高中元素,都比较熟悉,就不多说了.但是要小心卤素互化物和拟卤素的性质
氢和稀有气体看看就好了
这些是主族的主要内容,下面是副族
第一过渡系绝对是重点中的重点,而里面又以Cr,Mn,Cu最重要,Ti,V,Co,Ni,Fe也是常考的,Sc我的印象里面貌似从来没有考过.... Cr,Mn颜色丰富多彩,价态变化多端,够看一段时间了,Fe和Cu
可以说差不多重要,要注意不同价态元素的存在条件以及转化,Co和 Ni的性质可以和铁类比,但是注意Fe,Co三价态稳定,Ni二价态稳定,
同时Fe可以有六价,Ti和V注意下反应和颜色就好了,东西比较少
第二过渡系和第三过渡系重点元素应该是Hg,Cd,Mo,W,Re,Ag,Pt,Au,Pt.Mo和W同多酸及杂多酸要知道,[Re2Cl8]2- 中存在δ键,其成键特点和对称性要知道.
其它还需要关注的是俗名和化合物的对应关系,元素及其化合物的定性鉴定(起码常见的,我上面提到的物质的定性鉴定要知道),特殊反应要记牢,顺便提醒一下,一些关于"第一","最","唯一","特殊"的东西要知道
关于教材方面我看过三个版本,个人感觉北师大版的教材的分析得很透彻,讲解比较细致,语言通俗易懂,适合初学者学;武大的无机很全面,东西比较多,每章后面有总结和专题小节,适合提高用;而大连理工的教材感觉平平,除非是指定教材,否则没有必要参考. 同时听枫版主推荐申泮文的无机也很有水平,适合提高用,感谢他的热心.
以上只是个人学习无机的几点小心得,必定存在很多疏漏之处,在这里仅起到一个抛砖引玉的作用,还请广大研友以及化学爱好者们批评指正,把它补充完整,大家共同进步,如有疑问或者好的建议,欢迎回帖或者另开主体大家共同讨论
再次感谢版主的支持和好的建议
第二篇:无机合成化学考点总结
1无机合成化学的内容:1)无机合成化学与反应规律问题2)实验技术与方法问题3)分离问题
4)机构鉴定与问题
2无机材料合成的思想方法:1开拓新的合成方法2元素的掺杂和置换3突破原有体系4体系杂化5学科交叉
3无机合成化学的热点领域:1极端条件合成(模拟宇宙空间条件下高纯度晶体的合成);2软化学合成和绿色化学合成(温和条件下的合成);3特种结构无机材料的制备(特殊聚集态,凝聚态,形貌和尺寸控制);4功能材料的制备(材料的多相复合);5特殊材料集态材料的制备(溶胶—凝胶路线)6特种功能材料的分子设计(新化合物的制备和发现);7生物合成(生物体对血红素的合成)8米粉体材料的制备(纳米级半导体材料Cds)
4其他的工业制备N2(低温下的分级冷凝)O2(深度冷凝法)Cl20(电解)CO2(热分解)NH3(化学合成)
5气体除杂净化的方法:a化学除杂法-最常用的方法,分离提纯反应必须具有特效性,灵敏性,高选择性b气体的分级分离净化(不能用化学除杂的)—该法是基于气体的沸点,蒸汽压等性能不同对气体进行提纯的一种方法:1)低温下的分级冷凝2)低温下的分级蒸发3)应用分馏柱进行分级蒸发4)气体色谱法c吸附分离和净化—性质极其相似而又缺乏特征化学分离方法的混合气体的分离
6气体除杂净化的主要对象:a出去液雾和固体颗粒:b干燥1)低温冷阱2)干燥剂c除氧:通常先初除后细除。初除方法1)让气体通过铜屑,氨水和氨化铵饱和溶液,2)让气体通过灼热的300——400度的铜3)让气体通过焦性没食子酸溶液4)让气体通过蒽醒- -磺酸钠溶液。细除方法—最好让气体通过活性铜。d:除氨:各种碱金属,碱土金属及其合金可直接用作N2的吸收剂,Ca和K,Na.Ba或Si的合金在比较低得温度下就能吸收N2,在高温下用钛粉除N2也是有效的方法。
7、溶剂的主要类型:1、按化学基团—水系(水醇,醛酮)、氨系(氨分子、阱),质子溶剂:包括液氨、液态氟化氢、硫酸、“超酸”溶剂);2:按亲质子性—酸性(卤化氢、发烟硫酸),碱性,两性(水、醇),质子惰性—苯、酚、乙基、环己烷。CH4(惰性溶剂、偶极质子惰性溶剂、两性溶剂、无水分子溶剂);3::按溶质在溶剂中所表现的性质—区分溶剂、拉平溶剂;4:按液态时的结构—分子、离子(导电性好、离解性强)。
8:拉平效应:将各种不同强度的酸或碱拉平到溶剂质子化(在这里是水化质子H3o+)水平的效应。
9:溶剂选择的原则:反应物充分溶解;反应物不与溶剂作用;使副产物最少;易于使产物分离。
溶剂选择应考虑:反应物的性质;生成物的性质;溶剂的性质。
10:纯水制备:1.纯水标准:软化水、脱盐水、纯水、高纯水
2.纯水的制备方法:蒸馏、离子交换法、电渗析、反渗透i
11:化学气象沉淀法(CVD):利用气态或蒸汽态的物质在气相或气固界面上发生化学反应,生成固态沉积物。其有热解反应、化学合成反应、化学输送反应三种类型。、
12:CVD的基本要求:1.反应原料是气体或易于挥发成蒸汽的液态或固态物质。2.反应易于生产所需要的沉淀物而其他副产物保留在气相排除或易于分离,(产物致密、形态完美,生成多组分涂层)3.装置简单,操作较易于控制。
习题:1.化学气相积淀法,在热解反应中,用金属烷基化学物和金属烷氧基化物做源物质时,得到沉淀层分别为什么物质?如何解释?答:近视烷基化合物,其M—C键能小区C—C键,可广泛用于沉积高附着性金属膜;金属烷氧基化物,有趣M—O键能大于C—O键能,所以用于沉积氧化物。
12.什么情况下用低温化学分离法?一两种化合物通过它们的挥发性的差别进行分离不太容
易时,用该方法,要点是:通过加入过量的第三种化合物使之同第一种化合物形成不挥发的化合物,这样把挥发性的组分除去后再在不挥发性产物中加入过量第四种化合物,使第四种化合物从不挥发性物质中将源组分置换出来,进而同加入的第三种化合物形成不挥发的化合物,最终达到目的。
用何方法分离O2和CO?低温吸附分离,O2的吸附量随温度下降而增加。
在分级冷凝中如何选择冷阱?对要分离的两种化合物来说,可根据它们的沸点或在0.1MPa下的升华点来选择冷阱。
简述液氨中的合成反应:1)金属在液氨中的反应:碱金属,碱土金属;2)化合物在液氨中如AlCl3等;3)非金属与液氨反应;4)Na+NH3=NaNH2+1/2/H2。
13,化学输运反应:有一些物质本身在高温下会气化分解然后在沉积反应器稍冷的地方反应沉积生成薄膜、晶体或粉末等形式的产物。也有的时候原料物质本身不容易发生分解,而需添加另一物质(称为输运剂)来促进输运中间气态产物的生成。这类输运反应中通常是T2>T1,即生成气态化合物的反应温度T 2往往比重新反应沉积时的温度T1要高一些。但是这不是固定不变的。有时候沉积反应反而发生在较高温度的地方。(实例要记)
14,实验室中常用的几种获得高温的方法:a电阻炉(1)石墨发热体,碳素材料发热体(2)金属发热体(3) 氧化物发热体,碳化硅发热体;b感应炉;c电弧炉。
15,高温测量的主要类型:测量仪表:a接触式:1.膨胀式温度计(液体式,固体式)2.压力表式温度计—(充液体气体蒸汽型)3.热电阻式温度计(铂铜特殊半导体热敏电阻)4.热电偶温度计(铂铑——铂热,镍铬)b非接触式:1.光学高温计2.辐射高温计3.比色高温计。
16.热电偶高温计具有下列优点: 1.体积小,重量轻,结构简单,易于装配维护,使用方便。2.主要作用点是两根线连成的很小的热接点,两根线较细,热惰性很小,有良好的热感度。3.能直接与被测物体相接触,不受环境介质如烟雾、尘埃、二氧化碳、蒸气等影响而引起误差,具有较高的准确度,可保证在预期的误差以内。4.测温范围较广,一般可在室温至20xx℃左右之间应用,某些情况其至可达3000℃。5.测量讯号可远距离传送,并由仪表迅速显示或自动记录,便于集中管理。
17.很多合成反应需要在高温条件进行。主要的合成反应如下:
1.高温下的固相合成反应。(制陶反应)2.高温下的气—固合成反应。3.高温下的化学转移反应4.高温熔炼和合金制备。 5.高温下的相变合成。 6.高温熔盐电解。 7.等离子体激光、聚焦等作用下的超高温合成。 8.高温下的单晶生长和区域熔融提纯。
18.低温的获得:通常获得低温的途径有相变制冷,热电制冷,等焓与等熵绝热膨胀等,用绝热去磁等可获得极低温的状态:-100C普冷;<-100C深冷,<4.2K极冷。
19.制冷原理:a等熵冷却是压缩空气通过膨胀机进行绝热膨胀,同时做外功,如果过程可逆,则必为等熵过程;b等焓冷却就是焦耳——汤姆逊节流效应引起的制冷过程c磁冷却。20.低温分离方法:a低温下的分级冷凝是让一个气体混合物通过不同低温的冷阱,由于气体的沸点不同,就分别冷凝在不同低温的冷阱内,从而达到其分离目的。(看例子);b低温下的分级减压蒸发,沸点之差大于80℃;c低温吸附分离,O2吸附量随温度下降增加;d低温化学分离;e低温的冷冻干燥,水去除盐干燥留下。
21,高压的产生方法:a,气压机,气体液化合成(1000atm);b汽化,水热溶剂热生成(30atm); C等静压,超硬材料的合成d冲击波,超硬材料的合成;e热分解,类似水热汽化。
22,高压下的相变原因:a结构中阳离子配位数的变化;b阳离子配位数不变而排列变化;c结构中电子结构的变化和电荷的转移。
23.软化学:在温和条件下进行反应
绿色化学:从根本上减少或消除传统工业对环境造成的污染,低排放或零排放。
24.软化学特点:条件温和、易于控制;合成结果是介稳结构或在高温高压下需合成转变的化合物;用于材料复合,纳米材料或聚合物;适用于低熵低焓、低对称性化合物或材料。
25.绿色化学的原则:a防止污染优于污染治理;b源于经济性,设计合成方法应使生产过程中所采用的原料最大限度进入产品;c绿色合成,原料、中间产物、终产物均对人对环境无毒无害,d设计安全化学品,设计时高效少毒,e选用无毒无害的溶剂和助剂;f合理使用和节约能源。
26.低热固相化学反应的规律:1.潜伏期,随时间增长潜伏期变短;2.不存在化学平衡,一旦发生,便可完全进行。3.拓扑化学控制原理,晶体的形貌控制若反应的惊醒;4.分布反应,制定特定配比的化合物,配位化合物的配位数;5.嵌入平衡。
27. 固相反应与液相反应的差别;1.反应物溶解度的影响;2.常务溶解度的影响;3.热力学状态函数的差别。4.控制反应的因素的不同。5.化学平衡的影响。
28.高温高压下水的变化;蒸汽压变高,离子积变高,介电常数升高,便面张丽,粘度降低,密度下降;高温高压下电解质的变化:离子活性增加,又重新结合的趋势。.
29. 高温高压下水热反应具有三个特征:1.使复杂离子间的反应加速;2.使水解反应加剧;
3.使其氧化还原电势发生明显变化
30. 流变相反应法特点:1.组成负载 2.似液非液,似同非同;3.液固并存,有流动性;4.宏观均匀。例如:C6H4(CO2)2Zn的制备用流变相法容易得到单一晶体的产物;Zn(OC6H4CO2)的制备用流变相法直接得到具有不同结构和良好发光特性的,Zn(OC6H4CO2)的内盐。
课后习题:低温固相反应机理?——扩散——反应——成核——生长。
低温固相反应应用? 1.合成化学中应用 2.生产中的应用—颜料制造业,制药业,其他应用(如制三聚氰胺)
水热合成法的定义?--密闭体系中,在一定温度下,在水的自生压强下,反应混合物进行反应的一种办法,分为低温,低温,高温高压三种。
水热法优点及其应用前景?——a.由于在反应条件下反应物反应性能的改变,火星的提高,水热法有可能替代固相反应以及难以进行的合成反应,并产生一系列的合成方法。b.由于在水热中间态,介稳态以及特殊物相易于生成,因此能开发合成一系列特种介稳结构,特种凝聚态的新合成产物。C.能使低熔点化合物,高蒸汽化合物,高温分解相在水热和溶剂热。D.水热的低温,等压,溶液条件,有利于生成取向好,完美的晶体,且合成产物的结晶度高,易于控制产物晶体力度。E.由于易于调节水热条件下的环境气氛,孤儿有利于低价态,中价态,特种化合态的生成,并能进行特殊混合。
水热法合成水晶的必然性?一从各种SiO2原料想要得到水晶,有三种方法:一是从水溶液中声场水晶,而SiO2不溶于水,此法不通;二是从熔体中生长晶体,SiO2熔体冷却后一段生成非晶固体—玻璃,故此法也不通。所以只有采用第三种方法—水热法,刺猬水热法合成水晶的必然性。
水热法基本反应类型?--转晶反应,单晶培养,分解反应,脱水反应。
31 晶体的定义:1.具有规则几何形态多面体的固体。2.(新定义)具有阵结构的固体,它们的组成点(原子,分子,离子)或基元在空间规则排列,并无限的周期性的重复。
32.晶体的通性:基本性质—自范性,均一性,各向异性。1.自范性:指晶体在适当条件下可以自发的形成几何多面体的性质;2,各向异性:同意格子构造中,在不同方向上指点排列一般是不一样的,因此晶体的性质也随方向的不同而有所差异;3.对称性:在晶体的外型上也常有相等的晶面,晶棱和?顶重复出现;4.最小内能:在相同热力学条件下。晶体与各种
物质的非晶质体、液体、气体相比较,其内能最小;5稳定性:晶体由于有最小内能,因而晶体状态是一个相对稳定的状态。
33、晶体驱动相:气象—△P 、△T;溶液生成—△C;熔体生成—△T=T-TC。
34、晶体生长理论:浓厚环境相法相生长;稀薄环境相切向生长。
35、工业晶体生长方法:1从溶液中生长晶体:降温法、流动法、蒸发法、凝胶法、电解溶剂法,从溶液中生长晶体的基本原理是将原料溶解在溶剂中,采用适当的措施造成溶液的过饱和,是晶体在其中生长,过程中的关键因素是控制溶液的过饱和度。2水热法生长晶体:水热法是一种在高温高压下从过饱和水溶液中进行结晶的方法。如石英中NaOH中的溶解反应。3从溶液中生长晶体:特点:1)生长快,结晶完整性好。2)只涉及到定向凝固过程。3)界面过程—固液界面。4)多种平衡存在,熔体生长方法:a提拉法—是被普遍采用的晶体生长方法。,此法能顺利生长某些易挥发的化合物(如GaP)和特定形状的晶体。b坩埚移动法—凝固过程通过固液界面来完成。C、助溶剂法——般称高温溶液生长法,适用性强,几乎适用于所有材料。d熔焰法—生长宝石的主要方法,最简单的无坩埚生长法。e区熔法—1)基座法—具有拉着法和浮区法的特点,但不使用坩埚,融区T/S有晶体和多晶原料来支持,无坩埚生长方法。2)浮区法—不需坩埚,避免坩埚污染。
36、无机膜:把两个物相之间隔开而使之关联,能进行质量和能量的传递的中间介入相。
37、无机膜的分类:按照材质:金属膜、陶瓷膜;按外形分:管状、板状:按断面结构分:对称膜、非对称膜;按孔径分:过滤膜(1~15um)、微滤膜(0.1~0.5um)、纳滤膜(<2nm)、超滤膜(2~100nm);
38、无机膜应用领域:a 食品工业,如果汁、蔬菜汁,乳品工业;b.制药工业,如生物发酵液、蛋白、酶;c.环保领域,如含油废水的处理、脱脂废水处理。
39、无机膜、陶瓷膜常用成型方法:a.挤压成型:1.工艺流程:有机、高聚物添加剂.陶瓷粉体的混合→加溶剂、水的炼泥→陈化→挤压成型→干燥→烧结→产品。2.控制因素:陶瓷粉体粒径/膜孔径=2.5:1。混合均匀、湿度、温度、成型快慢、干燥速率控制、烧结温度。b 流延成型:1.工艺流程:粉体、溶剂、分散剂、增塑剂的混合→浆料→流延成型→干燥→烧结→产品。2.控制因素:溶剂、分散剂、搅拌形式、平整性膜厚。
40、纳米效应:1.表面与界面效应;2.小尺寸效应;3.量子尺寸效应;4.宏观粒子磁道效应;
5.久保效应
41、纳米粉体材料的合成方法:物理法、化学法及其他方法(如球磨法)。物理法包括粉式法(干式、湿式)、构筑法(气体冷凝、溅射、氢电弧等离子体)。化学法包括气相法、气相分解、气相合成、气相—固相、液相法(沉淀、共沉淀、均相沉淀、水解沉淀、水盐、溶液—凝胶、冷冻干燥、喷雾法)。
42、纳米粒子性质变化:A 物理性质:a.热性质变化—纳米粒子的熔点、开始烧结温度和晶化温度可以在较低温度时发生。(例如:块状铅的熔点为600k,而粒径20nm的球形铅熔点降到200k。)b.磁性变化:纳米粒子的小尺寸效应、量子尺寸效应、表面效应等使它具有常规粗晶粒材料所不具备的磁特征。(例如:金属sb通常为抗磁性,而纳米sb表现出磁性)。c 离子导电性增加。(例如:纳米CaF2的离子导电率比多晶粉末CaF2高1—0.8个数量级。 级,比单晶CaF2高约两个数量级。)d.光学性质变化:半导体的纳米粒子的尺寸小于激子态的波尔半径时,它的光吸收就发生各种蓝移,改变纳米颗粒尺寸可以改变吸收光谱波长。(例如:金属纳米粉末一般呈黑色,且粒径越小,颜色越深。)e.力学性能变化:常规情况下的软金属,当其颗粒尺寸小于50mm时,位错源在通常应力下难以起作用,使得金属强度增大。(氧化钛纳米陶瓷在810℃下经过15h加压,从最初高度为35mm的圆筒变为小于2mm的小圆环。)B.化学性能:a.化学反应性能提高,纳米粒子随粒径的减小,反应活性显著增加。(粒子为45mm的TiN,在空气中加热,即燃烧成为白色的TiO2纳米粒子。)b.吸附性强,
纳米粒子由于大的比表面面积和表面原子配位不足,与相同材质的大块相比,有较强的吸附性。C.催化效率高,纳米粒子比表面积大,表面活化心多,催化效率大大提高,(利用纳米镍粉作为火箭固体燃料反应催化剂,燃烧效率可提高100倍。)
43、非晶材料结构特征:长程无序性、亚稳定性。
44、非晶体的通行:各向同性、无固定熔点、可任意切割、机械性能、化学性能
45、非晶体材料的制备:A.熔体冷却法:a.传统玻璃冷却法;b.超速冷却法;c.激光自旋融化和自由落下冷却法。B.气相凝聚法。C.晶体能泵入法。D.化学反应法:a.溶液化学反应;b.溶胶—凝胶法;c.微溶液法;d.先驱物法;e.流变相法。
46、沸石分子筛的骨架结构:基本单元结构→次级单元结构→三位骨架结构。
47、沸石分子筛合成方法及影响因素:合成方法,水热晶化法、非水体系合成、高温晶化、转晶。大致过程—成胶—成核—生长。影响因素:配比、陈化晶化温度、PH值、时间、无极阳离子影响、搅拌、水量。
课后习题:精细陶瓷的制备工序?各工序的方法?—工序:精细陶瓷原粉的化学合成1.固相法—a.化合法,b.自蔓延高温合成法,c.热分解法,d.爆炸法:2.液相法—a.沉淀法,b.溶胶—凝胶法,c.溶剂蒸发法,d.微乳液法;3.气相法—a.气象热分解,b.化学气相积淀法。→精细陶瓷成型 1.原粉的预处理;2.粉料的成型—a.干压成型,b.浆料成型c.可塑成型,d.注射成型。→精细陶瓷的烧结 1.无压烧结;2.热压烧结—a.一般热压法,b.高温等静压法;3.其他烧结方法—a.电场烧结,b.超高压烧结,c.活化烧结,d.放电等离子烧结,e.爆炸烧结。 何谓纳米科技与纳米材料?物理效应和特点?—纳米科技是研究由尺寸在0.1~100nm之间的物质所组成的体系的运动规律和相互作用、及其实用技术问题的科学技术。纳米材料可分为两个层次:纳米微粒和纳米固体,前者指单个纳米尺寸的超微粒子、纳米微粒的集合体称谓零位超微粉末或纳米粉。纳米固体是由纳米微粒聚集而成,它包括三维纳米块体、而为纳米薄膜和一维纳米线。四大效应+物理化学特性。
非晶体材料的定义?—非晶体材料是由非晶态半导体、非晶态超导体、非晶态电解质等非晶态组成的材料。
沸石分子筛为何物?—沸石分子筛是硅氧四面体和铝氧四面体通过公用氧原子连接而成的多孔性晶体硅铝酸盐,统称为TO4四面体。
第三篇:无机化学总结笔记
《无机化学》各章小结
第一章 绪论
 平衡理论 :四大平衡
平衡理论 :四大平衡

 理论部分 原子结构
理论部分 原子结构
1.无机化学 结构理论:, 分子结构,
晶体结构
元素化合物
2.基本概念:体系,环境,焓变,热化学方程式,标准态
 古代化学
古代化学
3.化学发展史: 近代化学
现代化学
第二章 化学反应速率和化学平衡
1. 化学反应速率

2. 质量作用定律
 元反应 aA + Bb Yy + Zz
元反应 aA + Bb Yy + Zz

3. 影响化学反应速率的因素: 温度, 浓度, 催化剂, 其它.
温度是影响反应速率的重要因素之一。温度升高会加速反应的进行;温度降低又会减慢反应的进行。
浓度对反应速率的影响是增加反应物浓度或减少生成物浓度,都会影响反应速率。
催化剂可以改变反应速率。
其他因素, 如相接触面等。在非均匀系统中进行的反应,如固体和液体,固体和气体或液体和气体的反应等,除了上述的几种因素外,还与反应物的接触面的大小和接触机会有关。超声波、紫外线、激光和高能射线等会对某些反应的速率产生影响
4. 化学反应理论: 碰撞理论, 过渡态理论
碰撞理论有两个要点:恰当取向,足够的能量。
过渡态理论主要应用于有机化学。
5. 化学平衡: 标准平衡常数, 多重平衡规则, 化学平衡移动及其影响因素
(1)平衡常数为一可逆反应的特征常数,是一定条件下可逆反应进行程度的标度。对同类反应而言,K值越大,反应朝正向进行的程度越大,反应进行的越完全
(2)书写和应用平衡常数须注意以下几点
a. 写入平衡常数表达式中各物质的浓度或分压,必须是在系统达到平衡状态时相应的值。生成物为分子项,反应物为分母项,式中各物质浓度或分压的指数,就是反应方程式中相应的化学计量数。气体只可以用分压表示,而不能用浓度表示,这与气体规定的标准状态有关。
b.平衡常数表达式必须与计量方程式相对应,同一化学反应以不同计量方程式表示时,平衡常数表达式不同,其数值也不同。
c.反应式中若有纯故态、纯液态,他们的浓度在平衡常数表达式中不必列出。在稀溶液中进行的反应,如反应有水参加,由于作用掉的水分子数与总的水分子数相比微不足道,故水的浓度可视为常数,合并入平衡常数,不必出现在平衡关系式中。
由于化学反应平衡常数随温度而改变,使用是须注意相应的温度
(3)平衡移动原理 如以某种形式改变一个平衡系统的条件(如浓度、压力、温度),平衡就会向着减弱这个改变的方向移动。
a 浓度对化学平衡的影响
增大反应物的浓度或减小生成物的浓度,平衡向右移动,减小反应物的浓度或增大生成物的浓度,平衡逆向移动。
b 压力对化学平衡的影响
压力变化只对反应前后气体分子数有变化的反应平衡系统有影响
在恒温下增大压力,平衡向气体分子数减少的方向移动;减小压力,平衡向气体分子数的方向移动
c 温度对化学平衡的影响
温度变化时,主要改变了平衡常数,从而导致平衡的移动。
对于放热反应,升高温度,会使平衡常数变小。此时,反应商大于平衡常数,平衡将向左移动。反之,对于吸热反应,升高温度,平衡常数增大。此时,反应商小于平衡常数,平衡将向右移动。
d 催化剂能够降低反应的活化能,加快反应速率,缩短达到平衡的时间。由于它以同样倍数加快正、逆反应速率,平衡常数K 并不改变,因此不会使平衡发生移动。
并不改变,因此不会使平衡发生移动。
6. 化学平衡的综合利用。
第三章电解质溶液和离子平衡
1.强电解质溶液 表观电离度
2.水的离解
H2O  H+ +OH-
H+ +OH-
Kw = 1014
3. 酸碱指示剂
4.弱酸弱碱的电离平衡
Ka 弱酸电离常数
Kb 弱碱电离常数
5.稀释定律,一元弱酸碱与多元弱酸碱的电离平衡
6.同离子效应,缓冲溶液
同离子效应:在若电解质的溶液中,加入含有相同离子的易溶强电解质,使弱电解质离解度降低的现象。
缓冲溶液:能保持pH相对稳定的溶液,缓冲溶液通常由弱酸及其盐或弱碱及其盐所组成。
7.盐类水解
强酸弱碱盐,强碱弱酸,弱酸弱碱盐,强酸强碱盐
8.水解平衡及影响因素
温度,溶液酸碱性等。
9.酸碱质子理论
质子理论认为凡是能给出质子的物质都是酸,凡能接受质子的物质都是碱。
质子酸可以是分子、阳离子或阴离子。
质子碱也可以是分子、阳离子或阴离子。
酸碱共轭关系
根据质子理论,酸给出质子后剩余的部分就称为碱,因为它具有接受质子的能力;碱接受质子后就变成了酸。此所谓“酸中有碱,碱能变酸”。相互依存
10.沉淀和溶解平衡 容度积,容度积规则,盐效应
(1) Q>K ,溶液呈过饱和状态,有沉淀从溶液中析出,直到溶液呈饱和状态.
,溶液呈过饱和状态,有沉淀从溶液中析出,直到溶液呈饱和状态.
(2) Q<K ,溶液是不饱和状态,无沉淀析出.若系统中原来有沉淀,则沉淀开始溶解,直到溶液饱和.
,溶液是不饱和状态,无沉淀析出.若系统中原来有沉淀,则沉淀开始溶解,直到溶液饱和.
(3) Q=K ,溶液为饱和状态,沉淀和溶解处于动态平衡.
,溶液为饱和状态,沉淀和溶解处于动态平衡.
此即溶度积规则,它是判断沉淀的生成和溶解的重要依据.
11. 沉淀的溶解,转化
第四章氧化和还原
1.氧化还原的基本概念
氧化值 (形式电荷),单质中元素的氧化值为零,中性分子分子中,各元素氧化值的代数和为零,离子中,元素或多元素的氧化值之和等于离子所带的电荷。
氧化还原电对,如Cu2+/Cu ,Fe3+/Fe2+
2. 离子电子法配平
原则:电子总数相等;原子总数相等
适用于溶液体系。
3.原电池
原电池的组成:至少两个电对,有象盐桥那样能连起来的装置。电极可以是金属,也可以是非金属。
Cu-Zn原电池符号,电极反应,电池反应。作为本章的重点必须掌握。
4.电极电势
标准电极电势,标准氢电极电势,电池符号Eθ
本教材使用的电极电势是还原电极电势,一定要注意和其它教材区别,尤其一些老教材。注意: Cu2+ + 2e- = Cu 与 Cu –2e- =Cu2+ 的区别。
5.Nerst方程
6.电极电势的应用
判断氧化剂和还原剂的相对强弱, 判断氧化还原反应进行的程度和方向。
7.元素电势图及其应用
元素电势图:元素不同的氧化值,按照有高到低的顺序排成一行,在相邻两个物种之间用直线相连,表示一个电对,并在直线上标明此电对的标准电极电势值。
应用元素电势图可以进行歧化反应的能否发生的判断。左电对电极电势大于右电对电极电势,则会发生歧化反应,反之,发生逆歧化反应。
另外,应用元素电势图,可以综合评价元素及其化合物的氧化还原性质的判断。如教材对氯及其氧化物在酸性条件和碱性条件下的性质进行的评价。
第五章原子结构与元素周期律。
1.原子核外电子的运动状态
原子轨道,电子云,四个量子数,Pauling 能级图
量子数,电子层,电子亚层之间的关系,每个电子层最多容纳的电子数
主量子数 1 2 3 4
电子层 K L M N
角量子数 0 1 2 3
电子亚层 s p d f
每个亚层电子数 2 6 10 14
每层最多容纳电子数 2 8 18 32
2.原子核外电子排布
原子核外电子排布三原理,核外电子排布式,轨道排布式

3.原子核外电子排布式与元素周期律
周期与能级组,族与价电子构型,周期表元素分区。
4.元素性质的周期性
有效核电荷,原子半径,电离能,电子亲和能
第六章分子结构与晶体结构
1. 化学键 分子或晶体中相邻原子间强烈的相互作用
 共价键:共用电子对
共价键:共用电子对
分类 离子键:阴阳离子间吸引作用
金属键:金属原子、金属离子与电子之间的结合力
3.共价键理论要点:配对原则和最大重叠原则
键参数: 键长,键角,键能
4.杂化理论与分子构型
等性杂化和非等性杂化,等性杂化分为是sp,sp2,sp3
5.分子间作用力与分子晶体
分子间作用力分为色散力,诱导力,取向力。

6.离子键与离子晶体
离子的电子构型
2电子型: Li+. Be2 +.
8电子型:Na +,Ba2 +.
18电子型:Ag +,Zn2 +.
18+2电子型:Sn2 +,Bi2 +
9 -- 17电子型:Fe2 +,Cu2+
离子化合物无方向性和饱和性
7.离子极化
离子极化对物质的熔点、溶解度的影响。
8.其他类型晶体

第七章配位化合物
1.配位化合物的基本概念
配位化合物的组成:内界和外界,内外界之间属于离子键,当然也有的配合物无外界,如Fe(CO)4。
形成体与配位体,形成体主要是金属原子或金属离子。配位体主要是能提供孤电子对的原子或分子。配位数是配位原子数。
命名原则遵循无机化合物的命名原则。
如:[Cu(H2O)4]·SO4 硫酸四水合铜(II)
2.配位化合物的结构
配位化合物中化学键,包括离子键,共价键,配位键。
杂化轨道与配位化合物的空间构型。
内轨配合物与外轨配合物的异同。内轨配合物是参与杂化的原子的次外层的电子参与杂化,形成化学键,外轨配合物是指原子的外层电子参与了杂化。内轨配合物能量低,稳定性高。
3. 配位平衡
平衡常数,平衡常数的应用,配位平衡的移动
配位平衡常数用K表示或β表示。β值越大表示配离子越稳定。可以应用β来判断相同类型的配合物的稳定性强与弱。也可以进行溶液中某离子浓度的计算。
影响配位平衡的因素有溶液的酸碱性、氧化还原反应、及是否可以生成更稳定的配合物。
4. 鳌合物 概念与特性
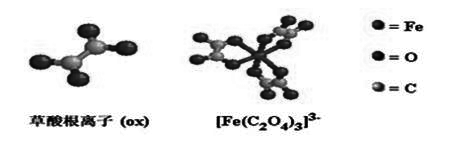
a) 配合物形成体在周期表中的分布
第八章主族元素(一)碱金属与碱土金属
1.碱金属(IA ): ns1
Li, Na, K, Rb, Cs, Fr
2.碱土金属(IIA ): ns2
Be, Mg, Ca, Sr, Ba, Ra
3.碱金属元素概述
碱金属的物理性质,钠钾的制备,碱金属氧化物,硫化物,氢氧化物的性质,
生产氢氧化钠的新工艺,重要的钠钾盐。

原子半径减小
金属性、还原性减弱
电离能、电负性增大
4.碱土金属元素概述
碱土金属元素的物理性质,氧化物、氢氧化物的性质,盐类的通性,硬水软化和纯水的制备。
5.对角线规则



 Li Be B C
Li Be B C
Na Mg Al Si
6.氢氧化物的性质
 M- O- H M+ + OH-
M- O- H M+ + OH-
 M- O- H MO- + H+
M- O- H MO- + H+
?= z/r (z: M离子的电荷;:r:离子半径)
? 1/2 < 0.22 MOH显碱性
? 1/2 在0.22---0.32间 MOH显两性
? 1/2 > 0.32 MOH显酸性
第九章主族元素(二)铝、锡、铅、砷、锑、铋
1.元素的概述
1).p区元素分为金属和非金属元素。只有砷分族3种As, Sb,Bi属常见元素。
2.)价电子构型:ns2np1-6
3)同一族自上而下,原子半径逐渐增大,金属性逐渐增强,非金属减弱。
4)同周期元素自右而左,形成负氧化态的能力减弱。
5)一般都有多种氧化态。最高氧化态等于价层电子数。
2.铝的典型性质缺电子性、亲氧性及两性,氧化物两性。

3.锡、铅单质的性质
锡、铅氧化物的氧化还原性。
2HgCl2 + Sn2+ → Hg2Cl2↓ + Sn4+ + 2Cl_
Hg2Cl2 + Sn2+ → 2Hg↓ + Sn4+ + 2Cl_
锡、铅的氧化物有SnO,SnO2,PbO,PbO2
4.砷、锑、铋的单质及其化合物的性质,含砷、含铅废水的处理。
第十章 非金属元素(-) 氢 稀有气体 卤素
1.氢的制备、性质、应用。
氢在自然界中的分布 三种同位素:11H;12H; 13H
氢的成键特征: 离子键、共价键、独特的键形
氢可以与金属、非金属反应生成相应的氧化物,如水,二氧化碳等。
、 实验室制备 Zn + H2SO4 →ZnSO4 + H2↑
电解法 阴极 2H2O +2e- → H2 ↑ + 2OH-
阳极 4OH- → O2 ↑ + 2H2O +4e-
工业生产 C(赤热) + H2O(g) → H2(g) + CO(g)
2.稀有气体简介
稀有气体 He Ne Ar Kr Xe Rn
价电子构型 ns2np6
稀有气体电离能,熔沸点,溶解度,气体密度有如下变化规律。
He Ne Ar Kr Xe Rn
第一电离能 大 小
mp. bp. 小 大
水中溶解度 小 大
气体密度 小 大
3.卤素单质的制备,氢化物的性质,熟悉氯的含氧酸及其盐的性质应用。
卤素单质 F2 Cl2 Br2 I2
氢化物 HF HCl HBr HI
卤素单质可以发生氧化反应,是很强的氧化剂;单质还可以发生歧化反应。
2.4. 拟卤素与氰的几种重要化合物。
第十一章 非金属元素(二) 氧 硫、氮、磷、碳、硅、硼
1.氧及其化合物
氧单质、臭氧、过氧化氢。过氧化氢的结构及性质。
氧分子表现出顺磁性,是因为分子中含有2个3电子π键,也就是含有两个未成对电子,自旋平行。
臭氧浅兰色气体,在距地面20-40km的高空处存在较多,形成臭氧层,可以吸收紫外线。现在由于氟利昂等影响了臭氧层。臭氧的氧化性比氧的氧化性强。
双氧水市售有30%和3%,分子中存在一个过氧键,四个原子不在一个平面内,即可作氧化剂又可以做还原剂。如双氧水与高锰酸钾和二氧化锰分别反应,与高锰酸钾反应表现出还原性,与二氧化锰反应表现出氧化性。
2.硫及其化合物
硫单质及其氧化物和含氧酸盐。硫化氢及硫化物
硫单质有3种同素异形体,主要氧化物有SO2,SO3,形成相应的酸H2SO3,H2SO4.还有H2S2O3,H2S2O4,H2SO3,H2S2O5,H2S2O7,H2S2O8.硫酸是二元强酸,具有吸水性、氧化性和脱水性。H2S2O8形成的盐具有强氧化性,如(NH4)2S2O8.
硫化氢是无色有臭鸡蛋气味的气体。其水溶液为二元弱酸。和许多重金属形成难溶盐。
3.氮及其氢化物、硝酸盐
氮气工业上主要是由液态空气经分馏制得。氨,硝酸是氮的两种重要化合物。硝酸是强酸,具有氧化性。硝酸盐分解产物主要有,生成亚硝酸盐,氧化物,金属单质。
亚硝酸盐有毒。
汽车尾气中主要成份有NOX 。
4.磷及其化合物。
磷主要的同素异形体有白磷和红磷。氧化物主要有P2O5,P2O3.含氧酸主要有偏磷酸、焦磷酸、磷酸。磷酸可以形成一种正盐和两种酸式盐,只有磷酸二氢盐的水溶液呈酸性,其它两种呈碱性。
5.碳、硅、硼几种单质及其化合物的性质、应用。
碳的同素异形体有三种,即金刚石、石墨和球烯。其中球烯中C60 最稳定。
硅是地壳中含量最高的元素。石英是常见的二氧化硅的天然晶体。水玻璃是硅酸钠的水溶液。
第十二章 过渡元素(一)
1.

过渡元素的通性。
过渡元素原子半径不如主族元素半径变化,但呈现多种氧化态(如上图),具有很强的配位能力,具有催化性能和磁性,水合离子有颜色。
2.铜副族元素的通性,单质及其化合物的性质。
铜副族元素包括Cu、Ag、Au。第一副族与主族的区别与联系。第一主族元素活泼。
铜的一价化合物主要有:Cu2O, Cu2S, CuCl
铜的二价化合物主要有:CuO, CuS CuCl2
银常见的化合物是AgNO3,不同银的化合物具有感光性,银可以和许多配体形成配合物。银能溶于稀或浓的硝酸中,一般含银的废水废渣需要处理,处理的原则是产生沉淀,与液体分开。
3.锌副族元素的通性,锌、汞及其化合物的性质
IIB族包括锌、镉、汞三种元素,都是银白色金属,它们与元素周期表中的Sn,Pb,Bi等一起合称低熔点金属。通常所说的铅管,铅丝都是镀锌的铁管或铁丝。
镉主要用作耐腐蚀和高温的材料。
汞齐是汞能溶解许多金属形成液态或固态的合金,如钠汞齐。
锌的主要化合物有:ZnO, ZnCl2, ZnS, ZnSO4
铬的主要化合物有:CdS, Cd(NO3)2, 含镉废水需要处理。
汞的化合物有:Hg(NO3)2, HgCl2, HgO,HgCl, 含汞废水需要处理。
第十三章过渡金属元素(二)
1.铬及其化合物。
铬是周期表中VIB族第一种元素,在地壳中的丰度,居21位,主要矿物。铬铁矿(FeO·Cr2O3)。不锈钢是指含Cr在2%以上的钢。
铬的氧化物和氢氧化物有:
CrO Cr2O3
Cr(0H)2 Cr(OH)3
具有强氧化性的有CrO3,H2Cr2O7
Na2Cr2O7 K2Cr2O7 是两种重要的重铬酸盐,都是黄色晶体,分别称做红矾钠和红矾钾。
铬的各种物质之间转化关系见下表。

2.锰及其化合物。
锰是VIIB第一种元素,地壳中的丰度为14位,主要以软锰矿(MnO2.xH2O)形式存在。
主要化合物有MnO, Mn2O3 ,MnO2, MnO3, Mn2O7
主要氢氧化物有Mn(OH)2, Mn(OH)3, Mn(OH)4,H2MnO4,HMnO4
应该掌握的是KMnO4 的氧化性质及应用。
3.铁、钴、镍的单质、氧化物、氢氧化物的性质。
铁、钴、镍位于元素周期表VIIIB,性质相似,合称铁系元素。它们属于中等活泼金属,高温下能与O,S,Cl等非金属反应。
铁系元素氧化物都有颜色,其中钴二价盐因所含结晶水数目不同而呈现多种颜色。
铁系元素氢氧化物低价有还原性,高价具有氧化性。
实验室配置二价铁盐常用的是铁的复盐,FeSO4·(NH4)2SO4·6H2O
