转载自free kao yan
首先说明一下,我是复习考有机专业的,因为接触无机比较早,也看过一些无机的教材,对无机的知识点略有了解,同时应版主要求,把版中无机的讨论带动起来,故介绍一下个人学的无机的心得,供大家参考,仅代表个人观点.
无机的东西比较杂,并且比较松散,主要可以分为理论部分和元素化合物部分
理论部分主要分为四大结构和四大平衡,以及化学热力学,动力学初步和溶液
四大结构:原子结构,分子结构,配合物结构,晶体结构
四大平衡:酸碱平衡,沉淀溶解平衡,配位离解平衡,氧化还原平衡
如果你考物化的话化学热力学和动力学基础就不用看了,物化讲的比这个透彻得多,平衡的总纲以及溶液部分在物化里面也是讲的很详细;
如果你分析化学学得好的话,四大平衡也可以少看很多,因为分析化学就是建立在四大平衡的基础上的(仪器分析不算,呵呵);
而结构化学里面所涉及到的结构问题又比无机的四大结构深多了,同样如果你在这方面比较强,那四大结构又省了很多事.
但是如果每门掌握的都不透彻怎么办呢?不要担心,无机的理论部分仅仅是是一个大纲性质的东西,也就是总结性的概括.所以每种理论都有,但是每种理论要求都比较简单,按照四大结构-四大平衡-化学热力学初步-化学动力学初步-溶液的顺序自己仔细地过一遍也不是很难的事情,起码我感觉比自学有机容易多了,呵呵
如果你的化学基础比较扎实,也不要在旁边偷偷笑,正所谓"结构决定性质",无机尽管理论比较简单,但是其精髓在于用简单的理论解释大量的现象和物质性质,在你掌握相关理论的基础上要能够灵活地把它们运用到平时见到的单质和化合物的性质解释.这样才算真正掌握了无机的理论.
总的来说无机的理论部分重点在运用.
而无机化学的重点则元素部分,这个也是无机主要讲的东西以及无机的特点.
首先建议周期表最好是背过,认识并且会写除f区以外的元素,镧系最好能背过,一些重要的比如说La Ce也要知道的.
个人感觉主族元素里面比较重要的是B,P,S,Sn,Pb,As,Bi,
副族里Hg,Co,Cr,Mn,Ti,V,Cu等比较重要,下面分主族和副族元素分开介绍:
第一主族里面要注意过氧化物,超氧化物,臭氧化物的结构和生成条件,焰色反应的火焰颜色(包括碱土金属和少量过渡金属的都要知道),以及碱金属的不溶盐;
第二主族Mg,Ba最常见,同时也要注意焰色反应,对角线规则(主要是三对元素Li-Mg Be-Al,B-Si)首次在这里出现;
第三主族注意B和Al, 铝热反应,Al的冶炼要注意K3AlF6的作用;B绝对是基础无机的重点元素之一,要注意它的多中心缺电子桥键的结构;
第四主族里面C,Si,Ge,Sn,Pb都要比较熟悉.碳氢化合物主要是放在有机里面了,无机主要是看它的氧化物和碳酸盐,这个比较简单.
Si的考点的比较少,但是可以和元素有机结合起来,同时Si和Ge作为半导体材料应该和材料方面联系起来,并且这个地方要顺便复习一下晶体结构中的导带理论.Sn,Pb应该是重点考察的,二价Sn的还原性以及其在反应中价态变化导致颜色变化要很清楚,四价铅具有强氧化性
也是要知道的.
第五主族N,P,As,Bi重点,N的氧化物结构及合成,HNO3的还原产物都是比较烦人的东西的三种同素异形体的性质和相互转化(主要是白磷和红磷的相互转化条件)以及磷的氢化物和含氧酸的性质也要知道.As的氧化物和硫化物小心识记,马氏试砷法和古氏试砷法要熟悉,Bi要关注正五价的强氧化性
第六主族S是重点,硫化物的不溶盐及其颜色绝对可以烦死你,硫的含氧酸结构及性质也很多,带"矾"的硫酸盐要知道
卤素属于高中元素,都比较熟悉,就不多说了.但是要小心卤素互化物和拟卤素的性质
氢和稀有气体看看就好了
这些是主族的主要内容,下面是副族
第一过渡系绝对是重点中的重点,而里面又以Cr,Mn,Cu最重要,Ti,V,Co,Ni,Fe也是常考的,Sc我的印象里面貌似从来没有考过.... Cr,Mn颜色丰富多彩,价态变化多端,够看一段时间了,Fe和Cu
可以说差不多重要,要注意不同价态元素的存在条件以及转化,Co和 Ni的性质可以和铁类比,但是注意Fe,Co三价态稳定,Ni二价态稳定,
同时Fe可以有六价,Ti和V注意下反应和颜色就好了,东西比较少
第二过渡系和第三过渡系重点元素应该是Hg,Cd,Mo,W,Re,Ag,Pt,Au,Pt.Mo和W同多酸及杂多酸要知道,[Re2Cl8]2- 中存在δ键,其成键特点和对称性要知道.
其它还需要关注的是俗名和化合物的对应关系,元素及其化合物的定性鉴定(起码常见的,我上面提到的物质的定性鉴定要知道),特殊反应要记牢,顺便提醒一下,一些关于"第一","最","唯一","特殊"的东西要知道
关于教材方面我看过三个版本,个人感觉北师大版的教材的分析得很透彻,讲解比较细致,语言通俗易懂,适合初学者学;武大的无机很全面,东西比较多,每章后面有总结和专题小节,适合提高用;而大连理工的教材感觉平平,除非是指定教材,否则没有必要参考. 同时听枫版主推荐申泮文的无机也很有水平,适合提高用,感谢他的热心.
以上只是个人学习无机的几点小心得,必定存在很多疏漏之处,在这里仅起到一个抛砖引玉的作用,还请广大研友以及化学爱好者们批评指正,把它补充完整,大家共同进步,如有疑问或者好的建议,欢迎回帖或者另开主体大家共同讨论
再次感谢版主的支持和好的建议
第二篇:无机化学考研辅导(上)
无机化学考研辅导讲座(上)
一.无机化学(理论部分)知识点应用归纳
1、无机物(分子或离子)构型:
(1)简单分子(或离子):
(2)配合物:
2、物质的熔、沸点(包括硬度):
(1)晶体类型:原子晶体,离子晶体,金属晶体,分子晶体
(2)离子晶体:
(3)分子晶体
(4)金属晶体:金属键(与价电子、价轨道有关)
3、物质的稳定性:
(1)无机小分子:
(2)配合物:
4、物质的磁性:
(1)无机小分子:MO (掌握双原子分子轨道能级图)
(共价双原子分子)
(2)配合物:
5、物质的颜色:
(1)无机小分子:极化理论
(2)配合物:
6、无机物溶解度:
(1)离子晶体:
(2)共价化合物:
7、物质的氧化还原性:影响因素
(1)溶液酸、碱度
(2)物质的聚集状态
8、化学反应方向:
(1)热力学数据:
(2)软硬酸碱理论
9、分子极性、键的极性、键角、键长等:
10、推导元素在周期表中的位置:能级组取值,
选择—组合理量子数:四个量子数取值规则
11、溶液中有关质点浓度计算:
化学平衡,电离平衡,沉淀—溶解平衡,氧化—还原平衡,配合解离平衡: 利用多重平衡规则,K是关键
12、常见的基本概念:
对角线规则;惰性电子对效应;Lewis酸、碱;质子酸、碱;缓冲溶液;屏蔽效应;钻穿效应;同离子效应;盐效应;镧系收缩;电负性;电离势;电子亲合势;晶格能;键能;有效核电荷及求法等。
二.无机化学(元素部分)
(1)结构
(2)性质:
重点是化学性质
第一讲 分子结构(molecular structure)
1-1 离子键理论
一、基本要点
活泼金属和活泼非金属的原子反应时,生成的化合物如NaCl等都是离子型化合物,它们具有一些固有的特征,如它们都以晶体的形式存在,具有较高的熔、沸点,在熔融态或水溶液中可导电等。
这种由于原子间发生电子转移,生成正负离子,并通过静电库仑作用而形成的化学键称为离子键。通常,生成离子键的条件是两原子的电负性差大于1.7以上,由离子键形成的化合物叫做离子键化合物。
二、离子特征
1、离子电荷:
是指原子在形成离子化合物过程中失去或获得的电子数。正离子电荷通常是+1、+2、+3或+4;阴离子:-1、-2,而-3、-4的负离子一般都是含氧酸根离子或配阴离子。
2、离子的电子构型:
2+2+(1)2e构型:1s,如Li,Be
26+2+2+(2)8e构型:(n-1)ns(n-1)p:Na,Mg,Ba等
(3)9~17e构型:(n-1)ns2(n-1)p6(n-1)d1~9:Fe2+,Mn2+等
(4)18e构型:(n-1)ns2(n-1)p6(n-1)d10:Cu+,Ag+,Zn2+等
261022+2+(5)18+2e构型:(n-1)ns(n-1)p(n-1)dns:Sn,Pb等
3、离子半径:(变化规律):
同一元素:负离子>原子>低价正离子>高价正离子
同族元素同价离子:从上→下,半径增大
同一周期:从左→右,半径r↓
三、晶格能(U)
1、定义:指相互远离的气态正离子和负离子结合成1mol离子晶体时所释放的能量绝对值,或1mol离子晶体解离成自由气态离子所吸收的能量的绝对值。
2、计算:晶格能不能用实验直接测量,通常有两种方法计算:
(1)库仑作用能模型理论计算:
A为马德隆(Madelung)常数,与晶格类型有关;n是与原子的电子构型有关的因子;Z1Z2为正负离子的电荷数。上式看出,U与离子的带电荷数成正比,与正负离子核间距r0成反比,与配位数有关,配位数增加,A增大,U增大。
(2)玻恩—哈伯(Born—Haber)循环间接计算:
例:已知NaF(s)的生成焓,金属Na的升华热,Na的电离热,F2的离解热, F的电子亲合
能,试计算NaF的晶格能U。
四、离子极化
1、基本概念
离子间除了库仑力外,诱导力起着重要作用,因为阳离子具有多余的正电荷,半径较小,它对相邻的阴离子会起诱导作用;阴离子半径较大,在外壳上有较多的电子,容易变形,在被诱导过程中能产生瞬时的诱导偶极。阴离子中产生的诱导偶极又会反过来诱导阳离子,阳
---离子如果易变形(18e,18+2e or 9~17e构型半径大的离子),阳离子中也会产生偶极,使阳
离子和阴离子之间发生了额外的吸引力。当两个离子接近时,可能使两个离子的电子云重叠,趋向于生成极性较小的键。由离子键向共价键过渡。
2、极化力(极化作用):
(1)电荷: 阳离子电荷越高,极化力越强
(2)半径: 外壳相似电荷相等时,半径小,极化力强。
(3)离子构型(阳离子):
18e-,2e-,18+2e-,(Ag+、Li+、Pb2+等)>9~17e-(Fe2+、Ni2+、Cr3+)>8e-(Na+、Mg2+等)
(4)电荷高的复杂阴离子也具有一定极化作用,如SO42-、PO43- 等
3、离子的变形性
(1)结构相同的阳离子,正电荷高变形性小
2--+2+3+4+O>F>Ne>Na>Mg>Al>Si
(2)对于外壳结构相同的离子,电子层数越多,变形性越大
+++++----Li<Na<K<Rb<Cs;F<Cl<Br<I
(3)电荷和半径相近时;18e-,18+2e-;9~17e->>8e-
++2+2+变形性:Ag>K;Hg>Ca等
(4)对于相同或类似的结构的离子,半径越大,变形性越大
(5)复杂阴离子变形性通常不大,中心离子氧化数越高,变形性越小
-------ClO4<F<NO3<CN<Cl<Br<I
小结:最易变形是体积大阴离子和18e-,18+2e-,9~17e-的少电荷阳离子,如:Ag+、Pb2+、Hg2+等; 最不易变形是小半径高电荷稀有气体外壳阳离子,如Be2+、Al3+、Si4+等
4、相互极化(附加极化)作用
实际上,每一个离子一方面作为带电体,会使其他异号离子发生变形,另一方面,在周围离子作用下,本身也会产生变形,这种阴阳离子相互极化作用结果,使产生的诱导偶极矩加大,从而进一步加强了它们相互作用,这就是附加极化作用。
显然,,每个离子的总极化作用应是它原有极化作用与附加极化作用之和。
5、离子极化理论的应用:
(1)晶体类型转变:离子晶体→分子晶体; 如AgF→AgI;NaF→SiF4→PCl5
(2)键型转变:离子型→共价型
(3)结构转变:共价性增强,配位数减小。如AgF(NaCl型)→AgI(ZnS型)
(4)熔、沸点变化:降低
(5)溶解性变化: 减小
(6)颜色变化: 颜色加深
例题1:解释现象(1)MgO的熔点高于Mn2O7;(2)AgCl,AgBr,AgI颜色依次加深;
(3)HgS在水中溶解度很小
1—2 价键理论(VB法)
一、价键理论的基本要点:
1、共价键的本质:
价键理论认为共价键的本质是由于原子相互接近时,由于原子轨道的重叠,原子间通过共用自旋方向相反的电子对结合,使体系能量降低而成键。共价键的本质也是电性的。
2、共价键形成原理
(1)电子配对原理:根据成单电子数配对,共价单键、双键等
(2)能量最低原理:
(3)原子轨道最大重叠原理:
3、共价键的特点
(1)共价键结合力的本质是电性的,但不能认为纯粹是静电作用,一般用键能表示共价键强度。
(2)共价键形成是由于原子轨道重叠,两核间电子云几率密度最大。不意味着仅在两核之间。
(3)共价键具有饱和性。
(4)共价键具有方向性。
(5)共价键的键型:
1σ键。2π键。 3配位键。4δ键:由两个原子的dxy—dxy;dxz—dxz,dyz—dyz,or dx2-y2—dx2-y2,轨道面对面的重叠而成。如在Re2Cl82-中δ键是dxy—dxy面对面(沿z轴)重叠:
二、杂化轨道理论
1、杂化轨道的概念:在形成分子时,由于原子间的相互作用,若干不同类型的、能量相近的原子轨道混合起来,重新组成一组新的轨道,重新组合过程叫做杂化,所形成的轨道叫杂化轨道。
2、杂化轨道理论的基本要点:
(1)原子间的微扰作用,使某一原子内能量相近的原子轨道重新组合构成新的轨道,其能量、形状和空间伸展方向皆发生了变化。
(2)形成杂化轨道数,等于参加杂化的原子轨道数。
(3)杂化轨道满足―最大重叠原理‖,成键能力更强,构成分子更稳定。
(4)杂化轨道空间构型决定形成分子或离子的空间构型:
如sp(直线);sp2(平面三角);sp3(正四面体);dsp2(sp2d平面方形);dsp3(sp3d三角双锥);d2sp3(sp3 d2八面体)
(5)杂化轨道有等性和不等性杂化轨道之分
原子轨道杂化后,如果每个杂化轨道所含的成分完全相同,则称为等性杂化,等性杂化轨道空间构型与分子的空间构型是一致的,如CH4分子
原子轨道杂化后,杂化轨道所含的成分不完全相同,称为不等性杂化,在有孤对电子占据时,杂化轨道空间取向与分子的空间构型就不相同了,如NH3,H2O等
3、杂化轨道理论的应用
例1:试用杂化轨道理论推断下列分子的空间构型:(1)SnCl2;(2)CF2Cl2;(3)NF3;(4)SF6.
1—3.价电子对互斥模型(VSEPR)
一、基本要点:
1、概念:在共价分子中,中心原子价电子层电子对的排布方式,总是尽可能使它们之间静电斥力最小,分子(或离子)的几何构型总是采取电子对相互排斥力最小的那种结构。
2、价电子对之间的斥力大小
(1)电子对之间的夹角越小,排斥力越大;
(2)孤对~孤对>孤对~键对>键对~键对
(3)三键>双键>单键,如HCHO中,CHCH(118?)<CHCO(121?)
(4)中心原子相同时,价层电子对之间斥力随配位原子的电负性增大而减小,生成键角也较小,如:NF3和NH3<FNF(121.1?)<HNH(107.3?)
配位原子相同时,电子对间的斥力,随着中心原子电负性减小而减小,键角也减小。如:键角:OH2>SH2>SeH2>TeH2
3.价电子对数的计算:
价层电子对数=1/2(中心原子价电子数+配位原子提供的电子数)
--(1)H和X作为配体提供一个e,X为中心原子提供7个e
--(2)氧族元素作为配体,不提供e,作为中心原子提供6个e,
(3)对于离子,加上或减去所带电荷数
(4)含有奇数电子时,电子数加1
(5)N作为配体-1,中心原子为5
4、价电子对数与分子构型
(1)价电子构型:2对直线,3对平面三角,4对正四面体,5对三角双锥,6对正八面体
(2)分子构型:
1若价电子对全部是键对,分子构型与其相同
2若价电子对中有键对有孤对,分子构型与价电子对构型不同,要画出所有可能构型,根据电子对斥力大小,选择稳定构型。
二、价层电子对互斥模型应用
1、判断分子或离子构型
例1:判断ClF3分子构型
练习:
1、用价层电子对互斥模型预测下列分子或离子的空间构型:OF2;SF4;XeF4;SCN-;NOCl;SO2Cl2;
2、判断中心原子杂化轨道类型及可能空间构型:SnCl2;SnCl3-;CF2Cl2;NF3;SF6;BCl3;ClF3;OF2;SF4;XeF4
1—4 双原子分子轨道理论(MO)
一、基本要点:
1、作为一种近似处理,认为MO是由AO线性组合而成,MO的数目等于组成分子的各原子轨道之和。
2、原子轨道要有效地线性组合成MO,必须遵守以下三条原则:(1)对称性原理(2)能量相近(3)最大重叠
3、若MO由两个符号相同的原子轨道叠加而成,其能量低于原子轨道的能量,称为成键MO,若由两个符号相反的AO叠加而成,其能量高于AO能量,称为反键分子轨道,处于它们之间的还有非键轨道,根据MO的对称性不同,将其分为σ—MO轨道和π—MO。
4、电子在MO上排布也遵循原子轨道电子轨道排布三原则——不相容原理、能量最低原理和洪特规则
二、能级图
适用于O2、F2、Ne2 第一、二周期其他双原子分子
(a)NF、CF (b)CO、BN、BO、CN、NO
第二周期不同原子双原子分子的能级图类似于上面两图,,一般可根据价电子数判断属于哪种,如 1价电子为10的CO是N2的等电子体,用b图; 2BN、BO、CN等价电子数都少于10,也常用b; 3价电子数为12的NF是O2的等电子体,与a相同; 4NO、CF价电子数为11,恰好介于N2和O2之间,NO类似于b;CF类似于a。
三、MO的应用
1、判断化合物稳定性、磁性
例1:写出下列分子的分子轨道电子排布式,并指出哪些分子不能存在?哪些是顺磁性?
B2;C2;O2;Ne2
例2:写出CN;CN+;CN-的分子轨道电子排布式,并比较它们的键能、键长和磁性。
1—5 离域π键
一、 概念
离域π键也叫大π键,是由三个或三个以上的原子形成的π键,不同于两原子间的π键
二、生成离域π键条件
1、原子都在同一平面上
2、每一原子有一互相平行的p轨道
3、p电子的数目小于p轨道总数目的两倍.
三、应用:
1. 增加化合物的稳定性
44362-62. 例:O3(π3)CO2(2个π3)NO2(π3)NO3-(π4)CO3(π4)等
1—6 分子间力及氢键
一、分子间力概念:
分子间力——范德华力,包括取向力、诱导力、色散力。取向力发生在极性分子之间;诱导力存在于极性分子与非极性分子以及极性分子与极性分子之间。色散力存在于任何分子之间。三种力中除了少数极性很大的分子(如H2O,HF等)以取向力为主外,绝大多数分子却以色散力为主,分子色散力大小与分子变形性有关,一般来说,分子的体积越大,其变形性越大,则色散力也越大。
二、分子间力特点:
1、较弱(几个至几十个kJ·mol-1,比化学键小1~2个数量级)
2、近程力,在几个?,无方向性和饱和性
3、取向力与温度有关,诱导力和色散力与温度无关.
三.氢键:
是指氢原子与电负性大,半径小,且具有孤对电子的原子X(F、O、N等)键合的,还能同另一电负性较大的原子Y结合成新的键,叫氢键。
四、氢键特点及类型:
1、特点:有方向性和饱和性,比分子间力强,比化学键弱
2、类型:分子间氢键,分子内氢键
五、分子间力及氢键对物质性质的影响
主要对物质的熔沸点;汽化热;熔化热;溶解度和粘度有较大的影响。但分子间氢键和分子内氢键对物质的影响不同,分子间氢键使物质的熔沸点等升高,而分子内氢键使熔沸点等降低。
例1 判断下列各对分子间存在何种类型的分子间作用力?
(1)C2H6 和 CCl4 (2)NH3 和 C6H6 (3)CH3COOH 和 H2O
(4)CO2 和 H2O (5)CHCl3 和 CH2Cl2 (6) HCHO 和 H2O
例2 下列化合物哪些化合物自身分子间能形成氢键?
(1)CH3Cl (2)H2O2 (3)CH3CHO (4)H3BO3
(5)H3PO4 (6)(CH3)2O (7)CH3COCH3 (8)C6H5NH2
1—7键参数
一、键能
它是 衡量化学键牢固程度的键参数,键能越大,键越牢固。对双原子分子而言,键能是在标准大气压P?和298K下,将1mol气态分子AB的化学键断开,成为气态的中性原子A和B所需的能量。双原子分子的键能和键离解能量是不同的。
二、键长
分子中成键原子和核间的平均距离称为键长(也称为核间距)。在两个确定原子之间,键长越短,则越强越牢固。
三、键角
1、分子中相邻两键之间的夹角称为键角。键角是决定分子空间构型的主要因素。
2、影响键角因素
(1)中心原子杂化类型: sp;sp2;sp3;sp3d2 等之间:180?;120?;129.5?; 90?
(2)中心原子孤对电子数:孤对越多,键角越小
如sp3杂化CH4;NH3; H2 O 键角依次为:109.5? ;107.3? ; 104.5?
(3)多重键 多重键所包含的电子越多,斥力比单键大,使得分子内含多重键的键角变大,单键间的键角变小,例如sp2杂化的COF2:
(4)电负性 在中心原子具有孤对电子的ABn型分子中,当A相同,B不同时,随B的电负性增大,A-B成键电子对偏向B,从而减少成键电子对之间的斥力,使其键角减小,例如:PI3 PBr3 PCl3 PF3的键角依次为:102?;101?;100.1?;97.8?
如B相同而A不同,则随着A电负性增大,A-B间成键电子对偏向A,从而增大成键电子间的斥力,使其键角增大。如:SbH3;AsH3;PH3;NH3为91.3?;91.8?;93.3?;107.3?
例1:在下列多对分子中,哪个分子键角大?说明原因:
(1)HgCl2和BCl3 (2)CF4和PF3 (3)SiF4和SF6
(4)SnCl2和SCl2 (5)OF2和Cl2O (6)PF3和NF3
四、键的极性
成键两原子正负电荷中心不重合则化学键就有极性。引起化学键极性的主要原因是成键两原子电负性的差异,电负性差越大,键的极性越大。
另外,双原子分子键的极性与分子的极性是一致的,但对多原子分子来说,分子是否有极性不仅要看键是否有极性,还与分子的空间构型有关。
例2:比较下列多对偶极矩μ的大小,并简要说明理由
(1)PH3和NH3 (2)BF3和NF3
(3)NH3和NF3 (4)CH3-O-CH3和C6H6
习题:
1.选择题:
(1).叠氮酸的结构式是H-N1 –N2-N3 ,1.2.3.号氮原子采用的杂化类型依次是:( )
A.sp3 sp sp B. sp2 sp sp C. sp3sp sp2 D. sp2 sp sp2 (B)
(2).ClO3F的构型属于( )
A.直线 B.平面四方 C.平面三角 D.四面体 (D)
(3).下列各组物质中,具有顺磁性的是;( )
A.NO NO2 B.NO CO C.NO2 CO D.NO2 SO2 (A)
(4).下列化合物中,哪些存在氢键 ( )
(1)硼酸;(2)对硝基苯酚;(3)邻硝基苯酚;(4)碳酸氢钠
A. 1 2 3 4 B. 2 C. 2 3 D. 1 2 3 (A)
(5).下列分子中,偶极距不为零的分子是:( )
A.BeCl2 B.BF3 C. NF3 D.C6H6 (C)
(6). 下列化合物中既存在离子键,共价键,又存在配位键的是:( )
A.NH4F B.NaOH C.H2S D.BaCl2 (A)
2.填空题:
(1).由原子轨道组合成分子轨道必须要遵守的三个原则是____, _____, ______,HF中的H的1s轨道与F的一个_____ 轨道组合成MO。
(2).写出符合下列条件的相应的分子或离子的化学式。 1氧原子用sp3杂化轨道形成两个σ键_____.(H2O)
2氧原子形成一个π键_____.一个三电子π键_____.两个三电子π键_____.(O2- O2+ O2)
3
3硼原子用sp杂化轨道形成4个σ键_____. ( BF4-) 4硫原子形成6个σ键_____. (SF6)
3.根据键级的大小,判断N2+与N2 ,以及O2与O2-的键长大小_____.( N2+ < N2; O2 > O2-) 4.下列各对分子间,存在的相互作用力分别为: (1)CH3Cl 和CH3Cl之间存在_____. (2) CH3Cl和CCl4之间存在_____. (3)H2O和C2H5OH之间存在_____.
5、根据电子配对法,讨论一氧化碳分子的结构和有关性质。 6、用杂化理论讨论BF3分子的结构及特点。 7、讨论H3PO4分子中各原子之间的键合情况。 8、判断下列键能大小顺序并说明理由。 (1) C-H, Si-H, Ge-H, Sn-H (2) C-Cl, Si-Cl, Ge-Cl, Sn-Cl (3) Si-F, Si-Cl, Si-Br, Si-I
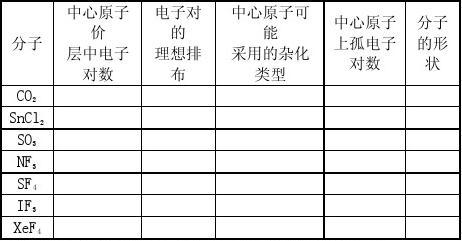
11、大π键形成的条件是什么? 12、讨论NO3-的结构。
13、从结构上讨论为什么SOCl2能表现为路易斯酸,又能表现为路易斯碱? 14、什么是奇电子化合物?它有哪些特征? 15、什么叫等电子体?什么叫等电子原理? 16、将卤素单质沸点由低到高的顺序排列。 17、试析二氯乙烯顺反异构体沸点的差异。
18、氢氟酸随浓度的增大酸性增强。试解释原因。 19、用氢键形成说明NH3(aq)为什么表示弱碱性?
20、比较NaCl、MgO、CuO、BaO,哪一种离子晶体的熔点最高? 21、分析Na2O、CaO、Y2O3、ThO2中哪种氧化物的熔点最高?
22、试确定Sc(OH)3、Y(OH)3、La(OH)3、Eu(OH)3碱性相对强弱顺序。
3+3+3+3+
23、在Sc、Y、La、Eu中,哪种离子最易水解?
24、填空:阳离子的极化能与-------------有关,电荷越高,极化作用越--------------,半径越大,极化作用越-----------------。半径越大,阳离子的变形性越---------------------,阳离子电子构型以-------------和
最差的为-------------------。阴离子极化和变形性对简单离子----------------变形性最大,-------------------次之,
来说和阳离子类似,复杂阴离子的变形性在电荷相等时,半径越大则变形性越------------------,相对复杂的阴离子变形性较-----------------,中心原子氧化数越高,则整个阴离子变形性越----------------。 25.试根据晶体的构型与半径比的关系,判断下列AB型离子化合物的晶体构型。 MgO,BeO, NaBr,CaS,RbI,CsBr,AgCl, CsI。 26.BF3是平面三角形的几何构型,但NF3却是三角锥形的几何构型,试用杂化轨道理论加以说明。
27.试用价层电子对互斥理论讨论COCl2分子的构型与键角。 28.试用价层电子对互斥理论判断下列分子或离子的空间构型:
+---3-2--HgCl2,I3,I3,SO2Cl2,IO2F2,ClF3,IF5,ICl4,PO4,SO3,ClO2,
SF6,PCl5,O3。
29.已知NO2,CO2,SO2分子中键角分别为132°,180°,120°,判断它们的中心原子轨道的杂化类型,说明成键情况。
30.在下列各对化合物中,哪一种化合物的键角大?说明原因。 ⑴CH4和NH3 ⑵OF2和Cl2O ⑶NH3和NF3 ⑷PH3和NH3 31.判断下列各对化合物中键的极性大小。
⑴ZnO和ZnS ⑵HI和HCl ⑶H2S和H2Se ⑷H2O和OF2
32.已知:ΔfHmO(N,g)=472.20 KJ· mol-1,ΔfHmO(H,g)=217.97 KJ· mol-1,ΔfHmO(NH3,g)=-46.11 KJ· mol-1。试计算NH3分子中N—H键的键能。 33.根据分子轨道理论判断各组物质中稳定性和磁性大小。
⑴ NO+,NO,NO-;
+-2-⑵ O2,O2,O2,O2 。
34. 已知CO2,NO2-,BF3分别为直线形,V形和平面三角形。试用等电子原理说明下列
---2-分子或离子的成键情况和几何构型。O3; NO2; NO3; N3; CO3
35.比较化合物的熔沸点高低,并说明原因。(1)CH3CH2OH和CH3OCH3;(2)O3和SO2;(3)HgCl2和HgI2;(4)邻羧基苯酚和对羧基苯酚。
36.判断下列各组分子之间存在什么形式的分子间作用力。(1)苯和四氯化碳;(2)氦和水;(3)二氧化碳气体和溴化氢气体;(5)甲醇和水。
37.比较下列各组物质的热稳定性,并说明原因。(1)Na2CO3和NaHCO3 (2)CaCO3和MnCO3;(3)Li2CO3和K2CO3;(4)NaNO2和NaNO3
第二讲 原子结构
2—1 核外电子运动状态 一、玻尔(Bohr)理论要点
1、氢原子核外电子运动取一定轨道,电子不放出也不吸收能量,离核越远,能量E越高,正常情况下,e-尽可能处于最低轨道上,处于稳定状态,称基态。
2、在一定轨道上运动的电子有一定的能量E,由某些量子化(指某一物理学的变化是不连续的<跳跃式的>;原子中电子的能级是量子化的,所以原子光谱呈线状)的条件决定(E整数值)。
在玻尔(Bohr)原子结构理论基础上,推得类氢原子(单电子原子或离子)多原子轨道半径r和能量E。
3、*电荷数(氢原子Z=1);B=52.9pm;A=2.179×10-18J n为正整数,成为量子数。 3、玻尔(Bohr)理论及存在的问题
(1)解释氢光谱(2)提出能级概念(3)提出量子化特征
(4)未考虑波粒二象性(5)无法解释多电子原子光谱和在磁场中分裂
二、核外电子运动的特点 1、波粒二象性。量子化
——爱因斯坦方程
19xx年德布罗依(de Broglie L)提出:微观粒子也是有波粒二象性 ——德布罗依关系式,此关系式19xx年戴维逊电子衍射实验证实。 2、测不准原理
由于电子有波动性,不可能像宏观物体那样可以精确测定它们在原子核外运动的位置和动量。19xx年,海森堡(Heisonberg W)推导出如下测不准关系式:或(普朗克常数)
三、核外电子运动状态的描述
1、波函数和原子轨道:
由于电子运动具有波动性,量子力学用波函数ψ来描述它的运动状态。Ψ是求解薛定谔(Schr?dinger)方程所得的函数式,它是包含三个常数项(n,l,m)和空间坐标(r,θ,φ)的函数,记为:Ψ(r,θ,φ)。
2、四个量子数及取值。
(1)主量子数(n):决定原子中电子云出现概率最大区域、离核的远近。n越大,e-里核平均距离越远,能量越高。所以n是决定能量高低的主要因素。氢原子多*电子层能量为:
取值:n= 1,2,3,4,5……
电子层符号:K,L,M,N,O……
(2)角量子数(l):决定电子在空间不同角度的分布情况,即决定了原子轨道或电子云的角度分布图的形状;对多电子原子来说,电子的能量除与n有关外,与l也有关,当n相同时,l越大,能量越高。
在同一电子层中,L相同的电子归并为一―亚层‖
取值l=0 1 2 3 4……,(n-1)
S p d f g……
球型 哑铃型,花瓣型……
(3)磁量子数(m):决定了原子轨道或电子云在空间的取向(伸展方向)
取值:m=0,±1,±2,±3……±l 取(2l+1)个值。
(4)自旋量子数(ms):代表电子两种―自旋‖状态。(自旋方向)
取值:+1/2和-1/2
四个量子数取值规则:
相互制约关系:
每个n,l可取0到(n-1)个值,共n个值,且n>l
每个l,m可取+l到-l,共(2l+1)个值,且l≥m
每一套(n,l,m),ms可取±1/2两个值。
例题1:
在下列n套量子数中,试指出(1)哪些是不可能存在的?为什么?(2)用轨道符号表示可能存在多套量子数。
1(2,1,0,0) 2(2,2,-1,-1/2) 3(3,0,0,+1/2)
4(7,1,+1,-1/2) 5(4,0,-1,+1/2) 6(2,3,+2,-1/2)
7(3,2,+3,-1/2) 8(2,-1,0,+1/2) 9(6,5,+4,+1/2)
例题2:写出氖原子中多电子的四个量子数表达式
四、屏蔽效应和穿透效应
1、屏蔽效应
(1)概念:在多电子原子中,对于某一指定的电子来说,它除了受到核的吸引外,还要受到其余电子对它的排斥作用。利用中心力场模型的近似处理,把其余电子对其指定电子的排斥作用近似地看作抵消一部分核电荷对该指定电子的吸引,而核电荷由原来的Z变为
**(Z-σ)。σ称为屏蔽常数,(Z-σ)称为有效核电荷,用Z表示。Z=(Z-σ) 这种由核外其余电子抵消部分核电荷对指定电子吸引的作用,称为屏蔽效应。因此,多电子原子某指定电子的能量公式变成:
电子越靠近核,它对外层电子屏蔽作用越大,σ值由可斯莱特(Slater)规则进行近似的计算。
(2)σ的计算:将原子电子按内外次序分组:
1s;2s2p;3s3p3d;4s4p4d4f;……
1外层电子对内层电子,没有屏蔽作用,多组的σ=0
2同一组,σ=0.35(但1s, σ=0.30)
3如果被屏电子为ns或np,(n-1)组对ns、np, σ=0.85,至内组σ=1.0
4如果被屏电子为nd或nfe-,位于它左边多轨道电子对它的σ=1.0
例:求锂原子(Z=3)的第一电离能。
2、钻穿效应:
由电子云径向分布图可以看出,n值较大的电子在离核较远的区域出现几率大,但在离核较近的区域也有出现的几率。这种外层电子向内层穿透的效应称为钻穿效应。
钻穿效应主要表现在穿入内层的小峰上,峰是数目越多,穿透效应越大,因峰的数目为n-l,所以n相同,l越小的电子穿透效应越大。穿透效应大的电子可回避部分内层对它的屏蔽效应,使σ值变小,所以该电子的能量便下降。对多电子原子来说,n相同l不同的电子亚层,其能量高低:Ens<Enp<End<Enf(能级分裂)。当n和l都不相同,出现了n值小l值大的轨道反而比n值大l值小的轨道能量大。如E3d>E4s,发生能级交错现象,当n≥6时,Ens<E(n-2)f<E(n-1)d<Enp。
例:计算Pt原子4s及3d电子的有效核电荷。
五、原子核外电子排布: (遵循三个原则)
1.保里(Pauli)不相容原理: 在同一原子中,不可能存在所处状态完全相同的电子。或在同一原子中不可能存在四个量子数完全相同的电子。
2.能量最低原理: 电子在各轨道上的排布方式应使整个原子能量处于最低状态。
1Pauling能级图
2宪:(n+0.7l)
3.洪特(Hund)规则: 在能量相同的轨道(自旋轨道)上排布电子时,总是优先分占不同的轨道,且自旋平行。作为洪特规则的特例,简并轨道处于全满或半满状态,能量较低稳定。
例1:写出下列原子的核外电子排布和价电子构型
24Cr 47Ag 82Pb
注: 1核外电子排布按电子层由内到外逐层书写,先由Pauling图写好,再重排 2原子失电子先后顺序np,ns,(n-1)d,(n-2)f
六、原子结构和元素周期表
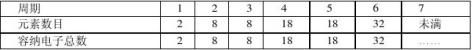
1、各周期元素数目
各周期元素数目等于ns1~np6结束多能级组所能容纳的电子数目。由于能级交错的存在,
(1)周期数=电子层数
(2)主族元素的族数=最外层电子数
副族元素的族数=最外层电子数+次外层d电子数
注: 1稀有气体过去称为零族,现在为ⅧA族;
2副族ⅠB、ⅡB和ⅧB例外,ⅠB和ⅡB算得电子分别为11和12,ⅧB族为8,9,10
3、元素分区
s区:价电子构型ns1~2 ⅠA→ⅡA
p区:价电子构型ns2np1~6 ⅢA→ⅧA
d区:价电子构型(n-1)d1~8ns2(少数例外) ⅡB→ⅧB
101~2ds区:价电子构型(n-1)dns ⅠB→ⅡB
1~141~2f区:价电子构型:(n-2)fns(有例外) La系、Ac系
例1:具有下列价电子的元素是属于哪一类或哪一种元素?
(1)具有3个p电子;(2)3d全满,4s有2个e-(3)有2个n=4和l=0的电子,8个n=3和l=2的电子。
七、原子结构和元素基本性质
1、原子半径:由相邻原子核间距测出的,同种元素的两个原子以共价单键连接时,其核间距的一半为该原子的(单键)共价半径。
原子半径在周期表中变化规律:
(1)同一族:主族元素由上到下半径增大,副族元素由上到下半径增大,但不明显。第五、六周期受到La系收缩的影响。
(2)同一周期:由左到右半径减小,主族比副族减小幅度大。因为主族元素有效核电荷增加幅度大;另外ⅠB、ⅡB原子半径比左边相邻元素大,这是因为d轨道电子填满屏蔽效应增大的缘故。
2、电离能
-(1)概念:气态原子失去一个e成为+1价气态离子所需的能量,称为该元素的(单一)
电离能(I1)。气态+1价离子再失去一个e-所需的能量称为第二电离能(I2)……一般I1<I2<I3<……
(2)在周期表中变化规律(主要指主族元素)
1同一族比较:从上到下,I↓,原子半径增大的缘故。
2同一周期比较:从左到右,I↑,原子半径减小的缘故,有效核电荷渐增。但在ⅢA和ⅥA出现两个转折。即电离能ⅡA>ⅢA,ⅤA>ⅥA。前者是因为ⅡA失去的se-,ⅢA失去pe-,pe-能量比se-高,易失去,后者是由于ⅤA族p轨道已半满,较稳定,而ⅥA的最后一个e-要填入p轨道,必然受到原来已占据轨道的那个电子排斥,要额外消耗电子的成对能,故较易失去。
3、电子亲合能
(1)概念:气态原子获得一个e-成为气态-1价离子所释放的能量称为该元素(单一)电子亲合能(E)
(2)周期表中变化规律:与电离势变化规律基本相同。
1电子亲合能数据难以测准,多类书中出入较大。
2ⅤA、ⅥA、ⅦA电子亲合能最大不是在第二周期,而是在第三周期。如:
3同一周期电子亲合能在 ⅡA、ⅤA出现反复。
4、电负性
(1)概念:电负性是指分子内原子吸引电子的能力。元素电负性越大,原子在分子内吸引成键电子的能力越强。
(2)变化规律:类同电离能和电子亲合能
对主族元素:同一族上→下减小(ⅢA有些例外);同以周期从左→右增加。
例1.试用原子结构理论解释。
(1)稀有气体在每周期元素中具有最高的电离能
(2)电离能Mg>Al;P>S
(3)电子亲合能 S>O;C>N
例2:利用适用于单电子的玻尔理论计算:
1B4+离子的电子处于n=3时轨道半径和能量。 21mol处于该状态下B4+的电离能,是多少? 4+3 B电子从n=3跃迁到n=2放出的光波长和频率。
例3:为什么原子的最外层,次外层和外数第三层依次最高只能有8,18和32个电子? 例4:试依据原子结构理论预测:
1原子核外出现第一个电子(l=4)电子的元素的原子序数是多少?
2第七周期为未满周期,若填满后应有多少种元素?第八周期有多少种元素?
3有人经过理论研究发现,第114号元素应该有一定的稳定性。试指出它属于哪一周期?哪一族?
习题:
1、玻尔理论的要点是什么?这一理论对原子结构的发展有什么贡献?存在什么缺陷?
2、几率和几率密度有何区别?
3、说明四个量子数的物理意义和取值要求。
4、电子云图和电子云角度分布图两者有何区别?
5、什么叫做中心势场模型?
6、在元素周期表中,元素按外围(亦称价壳层)电子构型可分为几个区域?各区域价电子构型有何特征?什么叫过渡元素?
7、元素的电离能的变化有何变化规律?
8、为什么电离能都是正值?而电子亲合能却有正有负?电子亲合能的大小与哪些因素有关?在周期表中元素的电子亲合能有何变化趋势?
9、鲍林是如何标度电负性的?电负性有何递变规律?试计算氢原子的电负性(已知:H-H
-1-1-1键的键能为436kJ·mol;F-F键的键能为155kJ·mol;H-F键的键能为565kJ·mol)。
10、质量为10克的子弹运动,若它的位置准确测定到0.01cm,其速度的测不准情况如何?
*11、计算铁(Z=26)原子中和3d电子相关联的σ、Z和E3d
12、求锂原子(Z=3)的第一电离能。
13.计算波长为401.4nm(相当于钾的紫光)的光子所具有的质量和能量。
7-114.假如电子在一万伏特加速电压下的运动速度是5.9×10m·s。计算电子的波长,并与可
见光波长进行比较。
16.设子弹的质量为0.01kg,速度为1.0×103m·s-1。试通过计算说明宏观物体主要表现为粒子性,其运动服从经典力学规律(设子弹速度的不确定程度为10-3m·s-1)。
17.什么是屏蔽效应和钻穿效应?怎样解释同一主层中能级分裂及不同主层中的能级交错现象?
18.请写出原子序数为24的元素的名称,符号及其基态原子的电子结构式,并用四个量子数分别表示每个价电子的运动状态。
19.通过计算说明,原子序数为12,16,25的元素原子中,4s和3d轨道哪个能量高?
20.请解释原因:
++⑴ He中3s和3p轨道的能量相等,而在Ar中3s和3p轨道的能量不相等。
⑵ 第一电子亲和能为Cl>F,S>O;而不是F>Cl,O>S。
2+21.已知M离子3d轨道中有5个电子,试推出:
⑴ M原子的核外电子排布;
⑵ M原子的最外层和最高能级组中电子数各为多少;
⑶ M元素在周期表中的位置。
22.判断下列各对元素中哪一种元素的第一电离能大,并说明原因。
S与P Al与Mg Sn与Sb Cu与Zn Cs与Au
23.判断半径大小并说明原因:
⑴Sr与Ba ; ⑵Ca与Sc; ⑶Ni与Cu; ⑷Zr与Hf; ⑸S2-与S ; ⑹Na+与Al3+ ; ⑺Sn2+与Pb2+ ; ⑻Fe2+与Fe3+
24.为什么原子的最外,次外层,和外数第三层依次最多只能有8,18和32个电子?
25.某元素原子M层电子比最外层的N层电子多8个,它为何周期何族元素,用四个量子数表明每个价电子的状态.
26.原子结构理论预测:(1)原子核外出现第一个g(l=4)电子的元素的原子序数是多少?(2)第七周期为未满周期,若添满后应有多少种元素? 第八周到期有多少种元素?(3)有人通过理论研究发现,第114号元素应该有一定的稳定性,试指出它属于哪一周期?哪一族?
27.比较下列各对原子或离子半径的大小,并申述理由.
(1) 原子半径:Ca和Sc;Ni和Cu;Zr和Hf;Cs和Sr;K和Ag
(2) 离子半径:Mg2+和Al3+;La3+和Ce3+;F-和Na+;S2-和Cl-;K+和Cu+
28.将下列原子按指定性质大小的顺序排列, 并申述理由.
(1)电离能:Mg Al P S
(2)电子亲合能:F Cl N C
(3)电负性:P S Ge As
第三讲 配位化合物
3-1配位化合物的命名
一般服从于无机化合物的命名原则,内界与外界之间叫―某化某‖;―某酸某‖;―氢氧化某‖等。
一、内界命名:
1、次序:配位体数→配位体名称→合→中心离子或原子(氧化数<罗马数字>)
2、配位名称顺序:
无机简单离子→复杂离子→有机离子→NH3-H2O→有机分子。如:[Co(NH3)3H2OCl2]+
(1)多类配体如果不只一个时,按配位原子元素符号的英文字母顺序命名,如:
[CoClNO2(NH3)4]+:一氯·一硝基·四氯合钴(Ⅲ)离子
+[Co(CO)4(NH3)2]:四羰基·二氨合钴(Ⅲ)离子
(2)配位原子相同,配体中原子数目也相同,则按结构式中与配位原子相连的原子的元素符号字母顺序排列,如:[Pt(NH2)(NO2)(NH3)2]:氨基·硝基·二氨合钵(Ⅱ)
(3)多核配合物命名:在桥联基前冠以希腊字母μ-,桥基多于一个时,用二(μ-),三(μ-)。如:
[(NH3)5Cr-OH-Cr(NH3)5]Cl5
五氯化·μ-羟·十氨合二铬(Ⅲ)
五氯化·μ-羟·二(五氨合二铬(Ⅲ))
3、电中性配体:一般保留原来命名,而CO、NO、O2和N2作为配体时,为羰基、亚硝基、
双氧、双氮。
4、同一配体若配位原子不同,则名称不同,如-NO2硝基、-ONO亚硝酸根、-SCN硫氰酸根、-NCS异硫氰酸根
5、常见配体缩写:
乙二胺(en)、吡啶(py)、硫脲(tu)、草酸根(ox-)、乙酰丙酮根离子(acac-)、乙二胺四乙酸根离子(edta-)
例
1、[CrCl2(NH3)4] Cl·2H2O
2、[Pt(NO2)(NH3)(NH2OH)(py)]Cl
3-2 配合物的异构现象
1、构造异构:配合物的实验式相同,但中心原子于配体间连接的方式不同而引起的异构。
主要有:
(1)离解异构:如[Co(NH3)5Br]SO4和[Co(NH3)5SO4]Br
(2)水合异构:如[CrCl(H2O)5]Cl·H2O和[CrCl2(H2O)4]Cl·2H2O
(3)配位异构:如[Co(en)3][Cr(CN)6]和[Cr(en)3][Co(CN)6]
(4)键合异构:如[Co(ONO)2(NH3)4]Cl和[Co(NO2)2(NH3)4]Cl
(5)聚合异构:如[Co(NH3)6][Co(NO2)6]和[Co(NH3)4(NO2)2][Co(NH3)2(NO2)4]
2、立体异构: 配合物的实验式和成键原子连结方式都相同,但配体在空间排列方式不同而引起的异构。又分为:
(1)几何异构:配体在空间相对位置不同而产生的异构现象。如:[Pt(NH3)2Cl]有两种异构体——顺式和反式
橙黄色,μ>0,溶解度大 亮黄色,μ<0,溶解度小
[CrCl2(NH3)4]+也有2种异构体,顺式和反式八面体Ma3b3存在面式、径式,如:
[Co(CN)3(NH3)3].
常见化合物类型与几何异构体数关系
MX3Y MX2Y2 MX2Y2 MXY2K 平四方形 MX4
1 2 2 3 异构体数 1
MX6 MX5Y MX4Y2 MX3Y3 MX4YZ MX3Y2Z MX2Y2Z2 八面体
1 2 2 2 3 5 异构体数 1
(2)旋转异构:若一个与其镜像不能叠合,则该分子与其镜像像互为旋光异构,如
[Pt(NH3)2(NO2)2Cl]的旋光异构体为:
例:画出下列配合物可能存在的立体异构体。
(1)[PtClBrNH3Py] (2)[PtCl2(NO2)(NH3)2]
3—3 配合物价键理论
一、基本要点
1、中心原子M和配体之间的结合是由M提供空轨道,L提供孤电子对而形成的配位键。有σ配键、π配键。
2、中心原子(或离子)提供的空轨道,必须进行杂化,杂化轨道的类型决定了配离子的空间构型和稳定性。如:
sp(直线)、sp2(平面三角)、sp3(正四面体)、dsp2(平面正方)、dsp3(三角双锥)、d2sp2(d4s,四方锥)、d2sp3(sp3d2,八面体)
3、中心原子由(n-1)dnsnp轨道杂化而形成的配合物称内轨型配合物;而由nsnpnd轨道杂化而形成的配合物称外轨型化合物,内轨型配合物稳定性大于外轨型化合物。
4、高自旋和低自旋配合物
1与自由离子比较,形成配合物后,体系成单电子数未变,而磁矩(μ配合物,一般为外轨型配合物,而主量子数相同的价轨道杂化成键。
2与自由离子比较,形成配合物后,成单电子数减小,磁矩(μ)变小,称为低自旋配合物,即(n-1)d轨道参与杂化成键。
判断高自旋和低自旋配合物方法:
1实验测定:
2经验方法
a、电负性大,高自旋,如F-,O2-等。(F-;H2O等)
b、电负性小:低自旋:C、N等。(CN-;NO2-;CO等)
例:指出下列配离子(1)中心离子的电子排布情况。(2)杂化类型,配合物类型(内轨型还是外轨型)、空间构型及磁矩。
2-3+3-1 Ni(CN)4 2 Ni(CO)4 3 Cr(H2O)6 4 CoF6
5 Co(NH3)62+(μ=3.8μB) 6 Co(NO)64-(μ=1.8μB)
3—4 配合物的晶体场理论
一、基本要点:
1、中心离子与配体之间看作纯粹的静电作用
2、中心离子d轨道在配体(场)作用下,发生能级分裂。
3、d电子在分裂后的d轨道上重排,改变了d电子的能量。
二、d轨道能级分裂
1、八面体场中d轨道能级分裂
2、四面体(场)中d轨道能级分裂
三、分裂能(?)
1、概念:
分裂后最高能量d轨道的能量与最低能量d轨道能量之差。叫做d轨道分裂能(?)
2、不同配体场中,d轨道分裂能值不同(上图)
3、影响分裂能大小因素
(1)对于同一M离子,?随配位体不同而变化,如八面体中,
I-<Br-<Cl-<SCN-<OH-<C2O42-<H2O<NH3……<NO2-<CN-;这一序列称为光谱化学序列。按配位原子来说,?大小为:卤素<氧<氮<碳
(2)相同配体,同一M元素,高价离子比低价?大。
(3)相同配体,同一族,第三过渡系>第二过渡系>第一过渡系
四、晶体场稳定化能(CFSE)
1、概念:在配体场作用下,d轨道发生分裂,d电子在分裂后d轨道总能量,叫做晶体场稳定化能。
在其他条件相同时,CFSE越大,配合物越稳定。
2、应用
例1:计算Fe2+(d6)在强场和弱场中的CFSE。
五、晶体场理论的应用
1、配合物的磁性
(1)当p>?,高自旋,所有F-的配合物p>?,高自旋
(2)当p<?,低自旋,CN-配合物p<?,低自旋。
(3)正四面体配合物一般是高自旋?<p
1238910(4)对于d、d、d、d、d、d金属离子配合物不论弱场强场,只有1种排布,无高低
自旋,只有d4~d7才分高低自旋。
2、解释配离子的空间构型:用CFSE判断。
3、解释配合物可见光谱(颜色):d-d跃迁
4、配离子的稳定性:
用CFSE,其值越大,配合物越稳定。
例:已知Co3+的p=17800cm-1,Co3+与下列配体形成配合物的?为:
F- H2O NH3
?/cm-1 13000 18600 23000
试回答:
3+(1)Co的d电子在这些配合物中排布情况以及这些配合物的类型和磁矩。
(2)计算这些配合物的晶体场稳定化能。
3—5 软硬酸碱理论简介
一、比较重要的几种酸碱理论概念:
1、电离论(水—离子论):亦称阿仑尼乌斯酸碱理论。
+-在水溶液中离解出的正离子全部三H的化合物为酸;在水溶液中离解出的负离子全部是OH
的化合物是碱。
2、酸碱质子论:凡能给出H+的分子或离子为酸,凡能接受H+的分子或离子为碱。酸碱关系式为:
酸=碱+H+
3、酸碱电子论:由路易斯(Lewis G N)提出:凡能接受电子对的物质为酸批;凡能给出电子对的物质为碱。酸碱反应的实质是形成了配位键。
4、软硬酸碱理论
是在Lewis酸碱电子对理论基础上提出的。该理论是根据金属离子对多种配体的亲和性不同,把金属离子分为两类。一类是―硬‖的金属离子,称为硬酸;另一类是软的金属离子,称为软酸。硬的金属离子一般是半径小,电荷高。在与半径小,变形性小的阴离子(硬碱)相互作用时,又较大的亲和力,这是以库仑力为主的作用力。软的金属离子由于半径达,本身又较大的变形性,在与半径大,变形性大的阴离子(软碱)相互作用时,发生相互间的极化作用(*软酸软碱作用),这是一种以共价键力为主的相互作用力。
二、软硬酸碱的特征
1、硬酸:金属离子和其他Lewis酸的受体原子体积小,正电荷高,极化性低,对外层电子抓得紧。
如:H+;Li+;Na+;K+;Be2+;Fe3+;Ti4+;Cr3+
2、软酸:金属离子及其他Lewis酸的受体原子体积大,正电荷低或等于零,极化性高,变形性大,也就是对外层电子抓得松。如:Cu+;Ag+;Au+;Cd2+;Hg2+;Pd2+和Pt2+;Hg22+及M0等。
3、交界酸:处于硬酸和软酸之间称为交界酸。
如:Fe2+;Co2+;Ni2+;Cu2+;Zn2+;Pb2+;Sn2+;Sb3+;Cr2+;Bi3+等
4、硬碱:与硬酸能形成稳定的配合物的配体,即给予体原子电负性高,难极化,难氧化,也就是外层电子抓得紧,难失去,称为硬碱。
如:NH3;F-;H2O;OH-;O2-;CH3COO-;PO43-;SO42-;CO32-;ClO4-;NO3-;ROH等
5、软碱:与软酸形成稳定配合物的配体,即配体原子具有低的电负性,容易极化和氧化,外层电子抓得松,称为软碱。如:I-;S2-;CN-;SCN-;CO;H-;S2O32-;C2H4;RS-等
6、交界碱:处于硬碱软碱之间称为交界碱。如:N3-;Br-;NO2-;SO32-;N2等
三、软硬酸碱规则及其应用
1、软硬酸碱(SHAB)规则 硬亲硬,软亲软,软硬交界就不管(处中间)
2、应用:
2-2+(1)化合物的稳定性:K稳[Cd(CN)4]>K稳[Cd(NH3)4] 107 5.8×10 1.70×10
热稳定性:HF>HI
(2)判断反应方向:
-1 1Li+CsF=LiF+CsI △H=-63kJ·mol
2HgF2+BeI2=BeF2+HgI2 △H=-397kJ·mol-1
3AlI3+3NaF=AlF3+3NaI △H=496kJ·mol-1
4BeI2+ZnF2=BeF2+ZnI2 △H=-277kJ·mol-1
(3)自然界元素存在形式
矿物中Mg;Ca;Sr;Ba;Al等金属离子为硬酸,大都以氯化物、氟化物、碳酸盐、硫酸盐等形式存在,而Cu;Ag;Au;Zn;Pb;Hg;Ni;Co等低价金属为软酸,则以硫化物的形式存在。
(4)类聚现象:
键合在简单酸是的碱会影响酸的软硬度,如:
----BH3F+BF3H→BF4+BH4 向右进行
CF3H+CH3F→CF4+CH4 向右进行
由于在定界酸B(Ⅲ)上键合了三个软碱H-,增加了B(Ⅲ)的软度,使之更易接受软碱H-形成BH4-,而BF3H-更多被硬碱F-取代形成BF4-。这种软-软和硬-硬相聚和的趋势就称为类聚效应(Simbiosis Effect)
(5)溶解性
在水溶液中,H2O含有电负性高的氧原子,是一种硬碱,但介于F-与其它卤素离子之间,Li+是典型硬酸,与F-键合强。LiF水肿溶解度小,而LiCl、LiBr、LiI易溶,易被H2O取代。而卤化银中重,Ag+是硬酸,与Cl-、Br-、I-键合较水强,这些盐溶解度就小,但Ag+ 与F-键合较水弱,AgF溶解度就大。
(6)反应速度:SHAB规则可预测反应速度,通常H-H结合或S-S结合化学反应速度就很迅速。
练习题:
1、下列反应向何方向进行?为什么?
(1)CuI2+2CuF=CuF2+2CuI
(2)CH3F+CF3H=CH4+CF4
(3)TiF4+2TiI2=TiI4+2TiF2
(4)F-+HSO3-=SO32-+HF
2、解释下列现象
(1) AgI2-和I3-是稳定的,而AgF2-和I2F-不存在?
(2)BH3CO稳定存在而BF3CO不能形成?
3—6 有效原子序数(EAN)规则(Effective atomic number)
一、概念
19xx年英国化学家西奇维克提出,是指中心原子的电子数和配体给予中心原子的电子数之和。即中心原子形成稳定配合物的EAN应等于紧跟它后面的惰性原子的序数。主要用于羰基及其它非经典配合物结构中。如:
[Cr(CO)6]→24e-+12e-=36e-
[Fe(CO)5] →26e-+10e-=36e- →Kr(氪) -36e-
[Co(NH3)6]3+→24e-+12e-=36e-
对于中心原子三偶数电子的,可直接形成羰基配合物,而一般中心原子为奇数电子的羰基配合物多不稳定,(不能满足EAN),所以它们容易氧化,还原或聚和成多核配合物,以符合EAN要求,如V为23e-,在形成V(CO)6的总电子数为35,它不稳定,易被还原成
-+-[V(CO)6]。而V(CO)6+Na→Na+[V(CO)6]
又如具有奇电子数的Mn(0),Co(0),它们的羰基配合物以二聚体Mn2(CO)10,Co2(CO)8或混合形式[Mn(CO)5Cl]和[HCo(CO)4]存在,它们的结构,有效原子序数计算如下图:
二、常见配体提供电子数的计算
+1、NO:一氧化氮分子虽不是有机配体,但与CO十分类似。能理解成NO,与CO有相当
数目的电子(等电子体)。NO参加配体是以三电子成键,因而许多有亚硝酰作配体的配合物能符合EAN法则。如:
[Co(CO)3NO]→27+6+3=36e- [Fe(CO)2(NO)2] →26e-+4e-+6e-=36e-
[Mn(CO)(NO)3] →25+2+9=36e- [Cr(NO)4] →24+12=36e-
2、烷基与金属形成σ键,按单电子计算。对不饱和的碳氢分子或离子可按参加配位双键的π电子数目计算。
如:[Mn(CO)5(C2H4)]+=25e-+2e-+10e--e-=36e-
[Cr(C6H4)2]=24e-+2×6e-=36e-
[Fe(C4H6)(CO)3]=26e-+4e-+6e-=6e-
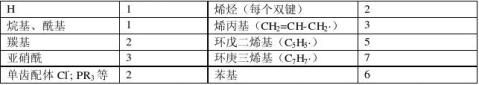
3、环戊二烯基和羰基的混合配合物:环戊二烯基作为5个e-,如:
[Mn(CO)3(C5H5)]=25+6+5=36e-
[Co(CO)2(C5H5)]=27+4+5=36e-
[V(CO)4(C5H5)]=23+8+5=36e-
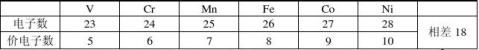
EAN法则的另一种说法是18e-规则。而中心原子内层电子不予考虑,只考虑外层和次外层的电子
(即价电子),中心原子价电子数加上配体给予的电子数目总和等于18e-时,则形成稳定的配合物。一些过渡元素不成键的内层电子数也是18。
形成外层总电子数为16的配合物。
三、应用:
练习1: 运用EAN规则判断下列金属羰基配合物是否存在?若存在,计算n值,并画出空间结构示意图。
ACr(CO)n BMn(CO)n CNi(CO)n DFe2(CO)n
练习2:利用EAN规则完成下列反应:
1Re2O7+CO→ 2Fe(CO)5+NO→
练习3:填空
(1)根据EAN,下列化学式中正确的是
A Fe(CO)3 B Fe(CO)4 C Fe(CO)5 D Fe(CO)6
(2)在[HxCo(CO)4]中,x值为
A 1 B 2 C 3 D 4
(3)按照18e-规则,下列各配合物中,主要以双聚体存在的是
A Mn(CO)4NO B Fe(CO)5 C Cr(CO)6 D Co(CO)4
(4)下列配合物中,有顺磁性的是
A ZnF42- B Ni(CO)4 C Fe(CN)63- D Fe(CN)64-
3—7 配位离解平衡
一、稳定常数(K稳)和逐级稳定常数(K稳i)
配离子在水溶液中存在着生成和离解平衡,如:
Ag++2NH3=Ag(NH3)2+
其实配离子在溶液中是逐级形成的,如Ag(NH3)2+是分两步:
Ag++NH3=Ag(NH3)+ k1=…………
Ag(NH3)++NH3=Ag(NH3)2+ k2=…………
k1,k2称为Ag(NH3)2+逐级稳定常数,显然K稳=k1·k2
另外,也有使用不稳定常数和逐级不稳定常数,即:K不稳=1/K稳 二、配离子溶液中有关离子浓度的计算:
在利用稳定常数进行有关配位理解计算,要注意: 1各逐级稳定常数都很大,(K稳很大), 2配体大大过量
例1:在10ml 0.20 mol·L-1AgNO3溶液中,加入10ml 1.0mol·L-1 NaCN,计算平衡溶液中Ag+
-21
浓度,已知K稳(Ag(CN)2)=1.3×10。 三、配位理解平衡的移动 在配位离解的系统中,若加入某些试剂,使溶液中同时存在沉淀平衡或氧化还原平衡或酸碱平衡,则溶液中各组分的浓度应同时满足多重平衡。
练习1:(1)欲用100ml氨水溶解1.0g AgCl,求氨水的最低浓度。(2)在上述溶液中加入0.6g KBr(s),是否有AgBr沉淀产生?(3)若要使AgBr沉淀完全溶解,这是氨水的最低浓度是多少?
-10-13+7
已知:Ksp(AgCl)=1.6×10;Ksp(AgBr)=7.7×10;K稳(Ag(NH3)2)=1.6×10 练习2:已知K稳(Zn(CN)42-)=5.75×1016;φ(Zn2+/Zn)=-0.763V,求算Zn(CN)42-+2e=Zn2++4CN-的φ。 练习3:为什么在水溶液中,Co3+能氧化水,而在氨水中形成[Co(NH3)6]3+却不能氧化水? 已知K稳[Co(NH3)6]3+=1.58×1035;K稳[Co(NH3)6]2+=1.38×105;Kb(NH3·H2O)=1.8×10-5,
3+2+-φ(Co/Co)=1.81V, φ(O2/OH)=0.42V, φ(O2/H2O)=1.23V。
习题4:水中铁盐会导致红棕色Fe(OH)3在瓷水槽里沉淀,通常用草酸H2C2O4溶液去洗涤,以除去这种沉淀物,试通过计算证明所列下列两个方程式中哪一个更能表达Fe(OH)3的溶解机理。
3+2-(1)酸碱机理:2Fe(OH)3(s)+3H2C2O4(aq)=3Fe(aq)+6H2O+3C2O4(aq)
3-+
(2)配离子生成机理:Fe(OH)3(s)+3H2C2O4(aq)=Fe(C2O4)3(aq)+3H2O+3H(aq)
3-2036
已知:K稳Fe(C2O4)3=1.0×10,KspFe(OH)3=1×10, H2C2O4:K1=6×10-2,K2=6×10-5,Kw=1.0×10-14
习题5:试求AgI在下列溶液中的溶解度:(1)1.0mol/L氨水;(2)0.10mol/LKCN溶液。已知Ksp(AgI)=1.5x10-16, β2(Ag(NH3)2+)=1.6x107; β2(Ag(CN)2)=1.3x1021
习题6:已知Au3+ + Au; AuCl4- 2- 求:(1)AuCl4- 和AuCl2-的累积稳定常数; (2)3Au+ ? Au3+ +2Au的平衡常数;
(3)3AuCl2- ? AuCl4-+2Au +2Cl- 的平衡常数。 习题
1.命名下列配合物和配离子
(1)(NH4)3[SbCl6];(2)[Cr(H2O)4Br2]Br.2H2O; (3)[Cr(Py)2(H2O)Cl3]。
2.根据下列配合物和配离子名称写出其化学式。
(1)四氯合铂(Ⅱ)酸六氨合铂(Ⅱ);(2)氯化二氯.四水合钴(Ⅲ);(3)氯.硝基.四氨合钴(Ⅲ)配阳离子(4)二氨.草酸根合镍(Ⅱ)。
3.指出下列配合物中配离子、中心离子、配位体、配位数及配位原子: (1)[Co(NH3)(en)2Cl]Cl2; (2)K2Na[Co(ONO)6].
4.指出下列配合物的空间构型,并画出可能存在的几何异构体: (1) [Pt(NH3)2(NO2)Cl];(2)[Pt(Py)(NH3)ClBr];(3)[Pt(NH3)2(OH)2Cl2]; (4)NH4[Co(NH3)2(NO2)4] 5.根据实验测定的有效磁矩,判断下列各配离子是低自旋还是高自旋,是内轨型还是外轨型,中心离子杂化类型,配离子的空间构型。(1)
2+2-4-3-[Fe(en)3], 5.5B.M;(2)[Co(SCN)4],4.3B.M;(3)[Mn(CN)6],1.8B.M;(4)[FeF6],5.9B
.M
6.给出下列离子在八面体强场,弱场时d电子在t2g和eg轨道上排布的图示,并计算晶体场稳定化能CFSE(以Dq和p表示):
Cr3+;Cr2+;Mn2+;Fe2+;Co2+;Ni2+
7.测下列各对配离子稳定性相对高低,并简要说明原因:(1)Co(NH3)63+与Co(NH3)62+;(2)Zn(EDTA)2-与Ca(EDTA)2-;(3)Cu(CN)43-与Zn(CN)42-;(4)AlF63-与AlCl63-;(5)Cu(NH2CH2COO)2与 Cu(NH2CH2CH2NH2)22+ 8.在0.1mol/LK[Ag(CN)2]溶液中加入KCl固体,使Cl-的浓度为0.1mol/L,会有何现象发生?
-10-21
已知Ksp(AgCl)=1.8x10;K稳[Ag(CN)2]=1.25x10
9.若在1L水中溶解0.1molZn(OH)2,需要加入多少克固体NaOH?已知
-172-17
Ksp[Zn(OH)2]=1.2x10; K稳[Zn(OH)4]=4.6x10
2+
10.一个铜电极浸在含有1.0mol/L氨和1.0mol/LCu(NH3)4的溶液里,以标准氢电极为正极,
2+
测得它与铜电极之间的电势差为0.03V,试计算Cu(NH3)4配离子的稳定常数。已知 E0(Cu2+/Cu)=0.34V.
11.向一含有0.2mol/L自由氨和0.20mol/LNH4Cl的缓冲溶液中加入等体积的0.03mol/L[Cu(NH3)4]Cl2的溶液,问混合后溶液中能否有Cu(OH)2沉淀生成?已知:Ksp Cu(OH)2=1.6x10-19,K[Cu(NH3)4]2+=4.8x1012,KNH3=1.8x10-5
第四讲 元素化学通论
一、含氧酸的强度 1、R-O-H规则
含氧酸在水溶液中的强度决定于酸分子中质子转移倾向的强弱: 质子转移的倾向越大,酸性越强,反之则越弱。 而质子转移倾向的难易程度,又取决于酸分子中R吸引羟基氧原子的电子的能力。当R的半径较小,电负性越大,氧化数较高时,R吸引羟基氧原子的能力强,能够有效地降低氧原子上的电子密度,供O-H键变弱,容易释放出质子,而表现出较强的酸性。这一经验规则称为R-O-H规则。其规律:
(1)同一周期,同种类型的含氧酸(如HnRO4),其酸性自左向右依次增强,如:
HClO4>H2SO4>H3PO4>H4SiO4 HNO3>H2CO3>H3BO3…
(2)同一族中同种类型的含氧酸强度自上而下依次减弱:HClO>HBrO>HIO
(3)同一元素不同氧化态的含氧酸,高氧化态含氧酸的酸性较强;低氧化态含氧酸的酸性较弱。如:HClO4>HClO3>HClO2>HClO 2、Pauling规则:
1、多元酸的逐级电离常数有如下关系:
K1:K2:K3=1:10-5:10-10
如H3PO4 K1=7.52×10-3 k2=6.23×10-8 k3=4.4×10-13
2、含氧酸的通式是ROn(0H)m , n为非氢键合的氧原子数(非羟基氧),n值越大酸性越强,
并根据n值把含氧酸分为四类: (1)n=0,为弱酸,ka=10-8—10-11
如:HClO: Ka=3.2×10-8 H3BO3:Ka=6.0×10-10 (2)n=1,为中强酸,Ka1=10-2—10-4
如:H3PO4: Ka1=7.5×10-3 H5IO6:Ka1=5.1×10-4 (3)n=2,为强酸,Ka1>10-1
如:HIO3: Ka=1.7×10-1 H2CrO4:Ka1=9.5 (4)n=3,为极强酸,Ka>>1 如:HClO4: Ka=1010
应当指出:用Pauling规则时,只能用结构式,不能用最简式来判断,若能知道某含氧酸的分子结构,便能推断酸的近似强度。反之,若已知酸的近似强度,根据分子式也能推测其分子结构。
如:亚磷酸(H3PO3)是二元酸 , 次磷酸(H3PO2)是一元酸
-2
K1=1.0×10,
K2=2.6×10-7 K1=1.0×10-2
另外,含氧酸脱水“缩合”后,酸分子内的非氢键合的氧原子数会增加,导致其酸性增强,多酸的酸性比原来酸的酸性强,如:H3P04的Ka1=7.5×10-3<H4P2O7的Ka1=1.4×10-1。
其原因:(1)随着电离的进行,酸根的电荷越来越大,和质子间的作用力增强,电离作用相形成分子方向进行,因此酸性按K1>K2>K3>……依次减小。
(2)因为酸分子中非羟基氧原子数越大,表示分子中R→O配键越多,R的还原性越强,多羟基中氧原子的电子吸引作用越大,使氧原子上的电子密度减小得越多,O-H越弱,酸性也就越强。
3.超酸(Superacid)
(1)概念: 19xx年圣诞节,美国Case Western Keserve大学,G.A.Olah教授实验室一位**研究人员J.Lukas无意中将圣诞节晚会上用过的蜡烛扔进一个酸性溶液(SbF5·HSO3F)中,结果发现蜡烛很快的熔解了,促使他进一步研究,*此实验溶液去做’Hnmr研究,令人惊奇的是’Hnmr谱图上竟出现了一个尖锐的特丁基阳离子(正碳离子)峰。这种酸能溶解饱和烃,**“魔力”无穷。从那时起,Olah实验室人员就给SbF5·HSO3F起个绰号叫“魔酸”(Magic acid)。现在人们习惯地将酸强度超过100% H2SO4的一个酸或酸性介质叫做超酸(或超强酸),把SbF5·HSO3F称作魔酸。
超酸具有极强的质子化能力,极高的酸度,比一般的无机酸强106~1010倍。 (2) 超酸的主要类型:
a. 布朗斯特超酸,如HF、HClO4、HSO3Cl、HSO3F和HSO3CF3等,室温下为液体,本身为酸性极强的溶剂。
b. 路易斯超酸:SbF5、AsF5、TaF5和NbF5等,其中SbF5是目前已知最强的路易斯酸,可用于制备正碳离子和魔酸等共轭超酸。
c. 共轭布朗斯特——路易斯超酸:包括一些由布朗斯特和路易斯酸组成的体系。如:H2SO4·SO3(H2S2O7);H2SO4·B(OH)3;HSO3F·SbF5;HSO3F等。
d. 固体超酸:硫酸处理的氧化物TiO2·H2SO4;ZrO2·H2SO4;路易斯酸处理的TiO2·SiO2
等。
(3) 超酸用途:
a. 非电解质成为电解质,能使很弱的碱质子化(正碳离子) b. 超酸中,解离出多卤素阳离子I2+、I3+、Br2+等 c. 良好的催化剂 二、含氧酸的稳定性
1、不同的含氧酸的稳定性相差很大,同一元素的含氧酸,高氧化态的酸比低氧化态的酸稳定。如:
HClO4> HClO3> HClO2> HClO H2SO4>H2SO3 ; HNO3>HNO2
2、氧化还原性:
(1)同一周期主族元素和过渡元素最高价含氧酸氧化性随原子序数递增而增强。如: H4SiO4<H3PO4<H2SO4<HClO4 V2O5<Cr2O72-<MnO4-
(2)相应价态,同一周期的主族元素的含氧酸氧化性大于副族元素。
如: BrO4->MnO4-; SeO42->Cr2O72-
(3)同一元素不同氧化态的含氧酸中,低氧化态的氧化性较强。
如: HClO>HClO2;HNO2>HNO3(稀)
(4)在同一主族中,各元素的最高氧化态含氧酸的氧化性,大多是随原子序数增加呈锯齿形升高;
如
HNO3 >H3PO4 <H3AsO4 ;H2SO4< H2SeO4>H6TeO6 ;HClO4<HBrO4>H5IO6 低氧化态则自上而下有规律递减. HClO>HBrO>HIO
(5) 浓酸的含氧酸氧化性比稀酸强;含氧酸的氧化性一般比相应盐的氧化性强;同一种含氧酸盐
在酸性介质中比在碱性介质中氧化性强. 3. 影响含氧酸(盐)氧化能力的因素:
(1) 中心原子结合电子的能力: 含氧酸(盐)的氧化能力系指处于高氧化态的中心原子在它转变为低氧化态的过程中获得电子的能力,这种能力与它的电负性、原子半径及氧化态等因素有
关。若中心原子半径小,电负性大,获得电子的能力强,其含氧酸(盐)的氧化性也就强,反之,氧化性则弱。
同一周期的元素,自左往右,电负性增大,半径减小,所以它们的最高氧化态含氧酸的氧化性依次递增。
同一族元素,从上至下,电负性减小,原子半径增大,所以低氧化态含氧酸(盐)的氧化性依次递减。高氧化态氧化性锯齿形变化,则是由于次级周期性引起的。
(2) 含氧酸分子的稳定性: 含氧酸的氧化性和分子的稳定性有关,一般来说,如果含氧酸分子中的中心原子R多变价,分子又不稳定,其氧化性越强。含氧酸分子的稳定性与分子中R-O键的强度和键的数目有关。键的数目越多,R-O键强度越大,要断裂这些键,使高氧化态的含氧酸还原为低氧化态甚至为单质,就比较困难,所以,稳定的多变价元素的含氧酸氧化性很弱,甚至没有氧化性。
R-O键的强度和数目与R的电子构型、氧化态、原子半径、成键情况以及分子中带正电性的H原子对R的反极化作用等因素有关。
例如:在HClO、HClO2、HClO3、HClO4系列中,由于酸分子中R-O键数目依次增加,R-O键键长减小,稳定性依次增加,因而,氧化性随氯的氧化态增加而依次减弱。HClO>HClO2>HClO3>HClO4
低氧化态含氧酸氧化性强还和它的酸性弱有关,因为在弱酸分子中存在着带正电性的氢原子,对酸分子中的R原子有反极化作用,使R-O键易于断裂,同理可以解释:①为什么浓酸的氧化性比稀酸强?因为在浓酸溶液中存在着自由的酸分子,有反极化作用。②为什么
n++含氧酸的氧化性比含氧酸强?因为含氧酸盐中M反极化作用比H弱,含氧酸盐比含氧酸
稳定。
(3) 其他外界因素的影响: 溶液的酸碱性、温度以及伴随氧化还原反应同时进行的其他非氧化还原过程(如水的生成、溶剂化和反溶剂化作用、沉淀生成、缔合等)对含氧酸的氧化性有影响。
三、含氧酸盐的热稳定性规律
1、同一盐及其酸稳定性次序是:
正盐 > 酸式盐 > 酸
Na2CO3 > NaHCO3 > H2CO3
o 分解温度C~1800 270 室温以下
2、同一酸根不同金属的含氧酸盐,热稳定性次序是:
碱金属 > 碱土金属 > 过渡金属 > 铵盐
K2CO3 CaCO3 ZnCO3 (NH4)CO3
分解温度Co 1800 825 300 58
3、同一酸根同族金属离子盐,热稳定性从上到下依次递增:
BeCO3 MgCO3 CaCO3 SrCO3 BaCO3
o分解温度C 100 350 825 1350 1450
4、同一成酸元素其高氧化态含氧酸盐比低价态稳定
KClO4> KClO3> KClO2> KClO
5、不同价态的同一金属离子的含氧酸盐,其低价比高价稳定:
Hg2(NO3)2>Hg(NO3)2
6、酸不稳定其盐也不稳定,酸越稳定,其盐也较稳定,碳酸盐,硝酸盐,亚硫酸盐,卤酸盐的稳定性都较差,较易分解,而硫酸盐,磷酸盐较稳定。其酸也较稳定,难分解。
如:盐 Na3PO4 > Na2SO4 > Na2CO3 > NaNO3
分解温度Co 不分解 不分解 1800 380
用离子极化理论可以对上述规律做出定性解释,金属离子的反极化作用越大,该盐的热稳定性就越差。
四、含氧酸的热分解产物
热分解产物,不仅与酸有关,与其正离子的性质也有关,多数情况下分解为酸酐和金属氧化物或其他产物:CaCO3=CaO+CO2↑
(一)对于硝酸盐的热分解有三种情况:
1、碱金属,碱土金属的硝酸盐分解,产生亚硝酸盐和O2, 如:
2KNO3=2KNO2+O2↑
2、电化学序在Mg-Cu之间的金属,因亚硝酸盐不稳定,其分解产物为M氧化物,NO2和O2,如:
2Pb(NO3)=2PbO+4NO2↑+O2↑
3、电位顺序Cu以后的M,因其M氧化物不稳定,分解产生M单质,如:
2AgNO3=2Ag+2NO2+O2↑
(二)对于铵盐的热分解产物与含氧酸根是否具有氧化性密切相关,若无氧化性,分解成酸酐
和其他产物,有氧化性要进一步分解为低价产物。
2(NH4)2CO3=2NH3↑+CO2↑+H2O
4NH4ClO4=2N2↑+6H2O+4HCl+6O2↑
2NH4NO3=N2↑+4H2O+O2
(三)对于稳定酸的酸式盐,热分解失水,形成偏酸盐或焦酸盐。如:
NaH2PO4=NaPO3+H2O
2Na2HPO4=Na4P2O7+H2O
五.P区元素的次级周期性
次级周期性是指元素周期表中,每族元素的物理化学性质,从上向下并非单调的直线式递变,而是呈现起伏的”锯齿形”变化.对于P区元素,主要是指第二.第四.第六周期元素的正氧化态,尤其是最高氧化态的化合物所表现的特殊性.
1.第二周期P区元素的特殊性
(1)N.O.F的含氢化合物容易形成氢键,离子性较强。
(2)它们的最高配位数为4,而第3周期和以后几个周期的元素可以超过4。
(3)多数有生成重键的特性。
与同族元素相比,除稀有气体外,B、C、N、O、F内层电子少,只有1s2,原子半径特别小(同一族中,从第二周期到第三周期原子半径增加幅度最大),价轨道没有d轨道等特点,所以第二周期元素的电子亲和能(EA)反常地比第三周期同族元素的小。在形成化合键时,在键型、键数和键能等方面也有不同于同族元素的特殊性,影响到这些元素的单质和化合物的结构和性质。
2.第四周期P区元素的不规则性
最突出的反常性质是这些元素最高氧化态化合物(如氧化物;含氧酸及其盐)的稳定性小,而氧化性则很强.
第四周期p区元素,经过d区长周期中的元素,此外成增加了10个d电子,次外层结2610构是3s3p3d,由于d电子屏蔽核电荷能力比同层的s、p电子的要小,这就使从Ga→Br,最外层电子感受到有效核电荷Z*比不插入10个d电子时要大,导致这些元素的原子半径和第三周期同族元素相比,增加幅度不大。由原子半径引起的这些元素的金属性(非金属性)、电负性、氢氧化物酸碱性、最高氧化态含氧酸(盐)的氧化性等性质都出现反常现象,即所谓“不规则性”。最突出反常性质是这些元素最高氧化态化合物(如氯化物、含氧酸及其盐)的稳定性小,而氧化性则很强。如ⅦA高溴酸(盐)氧化性比高氯酸(盐)、高碘酸(盐)强得多。ⅥAH2SeO4的氧化性比H2SO4(稀)强,中等浓度的H2SeO4就能氧化Cl-→Cl2,而浓H2SO4和NaCl反应→HCl;ⅤAH2AsO4有氧化性,在酸性介质中能将I-氧化为I2,而H3PO4
-基本上没有氧化性,浓H3PO4和I反应只生成HI。
导致第四周期p区元素性质不规则性的本质因素是因为第三周期过渡到第四周期,次外
262610层电子从2s2p变为3s3p3d,第一次出现了d电子,导致有效核电荷Z*增加得多,使最
外层的4s电子能级变低,比较稳定。
3.P区金属6S2电子的稳定性
周期表中P区下方的金属元素,即第六周期的Tl;Pb;Bi;Po在化合物中的特征氧化态应依次为+Ⅲ;+ Ⅳ;+Ⅴ和+Ⅵ,但这四种元素的氧化态表现反常,它们的低氧化态化合物,既Tl(Ⅰ);Pb(Ⅱ);Bi(Ⅲ);Po(Ⅳ)的化合物最稳定.长期以来,学者们认为这是由于这四种元素存在6S2惰性电子对之故,这种现象为西奇威克最先注意到,并称之为”惰性电子对效应”.
产生惰性电子对效应,原因是多方面的,仅从结构上考虑主要有:从第四周期过渡到第五周期,原子的次外层结构相同,所以同族元素相应的化合物性质改变较有规律。从第五到第六周期,次外电子层虽相同,但倒数第三层电子结构发生改变,第一次出现了4f电子,
由于f电子对核电荷的屏蔽作用比d电子更小,以使有效电荷Z*也增加得多,6s2也变得稳定,所以第六周期p区元素和第五周期元素相比,又表现出一些特殊性。
六.无机化合物的水解性
无机物的水解是一类常见且十分重要的化学性质。在实践中我们有时利用他的水解性质(如制备氢氧化铁溶胶等),有时却又必须避免它的水解性质(如配置SnCl2溶液等)。
无机化合物中除强酸强碱盐外一般都存在着水解的可能性。众所周知,一些典型盐类溶于水可发生如下的电离过程:
+-+-MA+(x+y)H2O≒[M(OH2)x]+[A(H2O)Y]
+-+
上式中[M(OH2)x]和[A(H2O)Y]表示相应的水合离子,这个过程显然是可逆的,如果M离子夺
—+—+—
取水分子中的OH离子而释放出H,.或者A离子夺取水分子中的H而释放出OH离子。那将破坏水的电离平衡,从而产生一种弱酸或弱碱,这种过程即盐的水解过程。 1.影响水解的因素 (1)电荷和半径
+-从水解的本质可见:MA溶于水后是否发生水解作用,主要决定于M和A离子对配位水分子
影响(极化作用)的大小,显然金属离子或阴离子具有高电荷和较小的离子半径时,他们对水分子有较强的极化作用,因此容易发生水解,反之低电荷和较大离子半径的离子在水中不易发生水解,如:AlCl3,SiCl4遇水都极易水解:
AlCl3 +3H2O=Al(OH)3+3HCl SiCl4+4H2O=H4SiO4+4HCl
相反,NaCl, BaCl2在水中基本不发生水解。 (2)电子层结构
我们知道Ca2+,Sr2+和Ba2+ 等盐一般不发生水解,但是电荷相同的Zn2+,Cd2+ Hg2+ 等离
2+2+2+-子在水中却会水解,这种差异主要是电子层结构不同而引起的。Zn,Cd,Hg等离子是18e
2+2+2
离子,他们有较高的有效核电荷,因而极化作用强,容易使配位水发生水解。而Ca,Sr和Ba+-等离子是8e离子,它们具有较低有效核电荷和较大的离子半径,极化作用较弱,不易使配位水发生分解作用,即不易水解。
总之,离子的极化作用越强该离子在水中就越容易水解。有人找到了水解常数的负对数PKh
2+2
同表示离子的极化能力的Z/R之间的关系, Na的Z/R=2.2×1028C2.M_,PKh=14.48,它基本上不
3+2282_
水解,Al的Z/R=43.6×10C.M,PKh=5.14它显著水解,其水解反应式如下:
Al3++6 H2O→[Al(H2O)6] 3+→H3O++[Al(H2O)5OH] 2+
2+-生成的配离子[Al(H2O)5OH]还可以逐级水解。此外还可以看到非稀有气体构型(18e,9
—17e-,18+2e-)的金属离子,他们的盐都容易发生水解。 (3)空轨道
我们知道碳的卤化物如CF4和CCl4遇水不发生水解,但是比碳的原子半径大的硅其卤化物却易水解,如:
SiX4+4H2O= H4SiO4+4HX
对于四氟化硅来讲,水解后所产生的HF与部分四氟化硅生产氟硅酸: 3SiF4+4 H2O= H4SiO4+4H++2SiF62—
这种区别是因为碳原子只能利用2S和2P轨道成键,这就使其最大共价数限制在4,并阻碍水分子中氧原子将电子对给予碳原子,所以碳的卤化物不水解。然而硅不仅有可利用的3S和3P轨道形成共价键,而且还有空的3d轨道,这样,当遇到水分子时,具有空的3d轨道的Si4+
接受水分子中氧原子的孤电子对,而形成配位键,同时使原有的键削弱,断裂。这就是卤化硅水解的实质,由于相同的理由,硅也容易形成包含SP3d2杂化轨道的SiF62—配离子。
NF3不易水解,PF3却易水解也可以用同样的理由解释。 硼原子虽然利用2S和2P轨道成键,但是因为成键后在2P轨道中还有空轨道存在,所以硼原子还有接受电子对形成配位键的可能,这就是硼的卤化物为什么会强烈水解的原因。如:BCl3的水解反应可认为是从氧原子的孤电子对给予硼原子开始的;
H2O+BCl3→[H2O→BCl3] →HOBCl2+HCl
↓2 H2O
B(OH)3+2HCl
除结构因素影响水解反应以外,增高温度往往使水解加强,例如,
MgCl2.6 H2O→Mg(OH)Cl+HCl↑+5H2O
Mg(OH)Cl→MgO+HCl↑
再如,FeCl3在水中有部分水解,可以写成为:
[Fe(H2O)6]3++H2O→[Fe(OH)(H2O)5]2++H3O+
或简写为:
Fe3++H2O→Fe(OH)2++H+
但加热后,会进一步水解,最后得到红棕色凝胶状的[Fe(OH)3(H2O)3]沉淀。
由于水解反应是一个可逆平衡,所以溶液的酸度也会影响水解反应的进行。
2.水解产物的类型
一种化合物的水解情况主要决定于正负两种离子水解情况。负离子的水解一般比较简单,下面主要讨论正离子水解的情况。水解产物的类型大致可分为以下几种:
(1)碱式盐
多数无机盐水解后生成碱式盐,这是一种最常见的水解类型。如:
SnCl2+H2O=Sn(OH)Cl↓+3HCl
BiCl3+3H2O=BiOCl↓+3HCl
(2)氢氧化物
有些金属盐类水解后最终产物是氢氧化物,这些水解反应常需要加热以促进水解的完成,如:
AlCl3 +3H2O=Al(OH)3↓+3HCl
FeCl3+3H2O=Fe(OH)3↓+3HCl
(3)含氧酸
许多非金属卤化物和高价金属盐类水解后生成相应的含氧酸,如:
BCl3+H2O=H3BO3+3HCl
PCl5+4H2O=H3PO4+5HCl
SnCl4+3H2O=H2SnO3+4HCl
水解后所产生的含氧酸,有些可以认为是相应氧化物的水合物,如H2SnO3,可以认为是
SnO2.H2O,TiCl4的水解产物H2TiO3也可以认为是TiO2. H2O。
无机物水解产物类型上的差别,主要是化合物中正离子和负离子对配位水分子的极化引起的。现将离子极化作用和水解产物关系对比如下:
Ⅰ Ⅱ 极
2+2-(1)[H2O·M·OH2] (1)[H2O·A·H2O] 化
(2)[H2O·M·OH]+ 作
-(3)[HO·M·OH] (2)[H2O·A·H] 用
-(4)[HO·M·O] 增
2-(5)[O·M·O] (3)[H·A·H] 强
水解反应有时伴有其他反应而使产物复杂化,这些反应有聚合,配合,脱水和氧化还原等。
(4)聚合和配合
有些盐发生水解时首先生成碱式盐,接着这些碱式盐聚合成多核阳离子,如:
Fe3++H2O = [Fe(OH)]2++H+
2Fe3++2H2O
[Fe2(OH)2]4++ 2H+
[Fe2(OH)2]4+多聚配阳离子有如下的结构:
当Fe3+离子的水解作用再进一步进行时,将通过羟桥出现更高的聚合度,以至逐渐形成胶体溶液,并最后析出水合氧化铁沉淀。这类沉淀从溶液中析出时均呈絮状,十分疏松。这就是因为沉淀中包含着大量的水分,其来源首先就是水合离子内部所含有的那些水分。
有时水解产物还可以同未水解的无机物发生配合作用,如: 3SnCl4+3H2O=SnO2·H2O+2H2SnCl6
综上所述,就无机物的水解反应,可归纳出几条规律:
a. 随正,负离子极化作用的增强,水解反应加剧,这包括水解度的增大和水解反应的深化。离子电荷,电子壳结构(或统一为有效核电荷),离子半径是影响离子极化作用强弱的主要内在因素,
+ 2+2+3+
电荷高,半径小的离子,其极化作用强。由18电子(如CuHg等),18+2电子(如Sn Bi)
+2+3+2+
以及2电子(Li ,Be)的构型过度到9——17电子(如Fe ,Co)构型,8电子构型时,离子极化作用依次减弱。共价型化合物水解的必要条件是电正性原子要有空轨道。 b. 温度对水解反应的影响较大,是主要的外因,温度升高时水解加剧。
c. 水解产物不外乎碱式盐,氢氧化物,含水氧化物和酸四种,这个产物顺序与正离子的极化作用增强顺序是一致的。低价金属离子水解的产物一般为碱式盐,高价金属离子水解的产物一般为氢氧化物或含水氧化物。在估计共价型化合物的水解产物时,首先要判断清楚元素的正负氧化态,判断依据就是它们的电负性。在P, S , Br ,Cl, N ,F这系列中,元素在相互化合时,处于右位的为负性。负氧化态的非金属的水解产物一般为氢化物,正氧化态的非金属元素的水解产物一般为含氧酸。
d. 水解反应常伴有其他反应,氧化还原和聚合反应等。
七.无机物的酸分解反应:
1. SO32-+2H+=SO2↑+H2O 3NO2-+2H+=NO3-+2NO↑+H2O
2-+
2. S2O3+2H=SO2↑+S↓+H2O
2-+2-+
3. S2+2H=S↓+H2S↑ Sx+2H=H2S↑+(X-1)S↓
2-+3-+
4. SnS3+2H=SnS2↓+H2S↑ 2AsS3+6H=As2S3↓+3H2S↑ 2AsS43-+6H+=As2S5↓+3H2S↑ 2SbS43-+6H+=Sb2S5↓+3H2S↑
+2+
5. Mg2Si+4H=2Mg+SiH4(g)
6. MgB2+12H+=6Mg2++B4H10+8B+H2(g)↑ Fe2S3+4H+=2Fe2++S↓+H2S↑
八.非金属单质的碱歧化反应:
---X2+2KOH=KX+KXO+H2O Cl2+2OH=Cl+ClO+H2O 2F2+2OH-=OF2+H2O+2F- 3I2+6OH-=5I-+IO3-+3H2O
3S+6NaOH=2Na2S+Na2SO3+3H2O 4P+3NaOH+3H2O=3NaH2PO2+PH3↑
Si+2OH-+H2O=SiO32-+2H2↑(与金属铝、锌等类似) 2B+2NaOH+3KNO3(氧化剂)=2NaBO2+3KNO2+H2O
九.含氧酸盐热分解的自身氧化还原规律
含氧酸盐受热分解,如果有电子转移,而且这种转移是在含氧酸盐内部进行的话,就发生自身氧化还原反应,如:
2AgNO3=2Ag+2NO2↑+O2↑ 1.阴离子氧化阳离子反应
阴离子具有较强氧化性而阳离子又有较强还原性,如NH4NO3,(NH4)2Cr2O7等. NH4NO2=N2+2H2O(实验室制N2) NH4NO3=N2O+2H2O
(NH4)2Cr2O7 =Cr2O3+ N2+4H2O 2NH4ClO4= N2+Cl2+2O2+4H2O Mn(NO3)2=MnO2+2NO Hg2(NO3)2=2HgO+2NO2
这几个反应都是酸根将NH4+氧化成N2或将低价的具有还原性的Mn2+,Hg22+氧化成MnO2和HgO
2.阳离子氧化阴离子的反应
如果含氧酸盐中阳离子具有强氧化性,而阴离子具有强的还原性,则受热后可能在阴阳离子之间发生氧化还原反应。
AgNO2=Ag+NO2↑
Ag2SO3=2Ag+SO3↑
Ag2C2O4=2Ag+2CO2↑
+-2-2-这里是Ag将NO2、SO3、C2O4等离子氧化。又如
Ag2SO4=2Ag+SO2+O2↑
HgSO4=Hg+O2↑+SO2↑
在盐热分解较多见主要是Ag和Hg的含氧酸盐易发生这种反应。
3.阴离子自身氧化还原反应:
如果含氧酸盐中阳离子稳定,阴离子不稳定(ClO4-、NO3-、MnO4-),而且相应的酸性氧化物(Cl2O7、N2O5、Mn2O7)也不稳定时,则它们受热时,只能在阴离子内部不同元素之间发生电子的转移
而使化合物分解,通常为阴离子自身氧化还原反应,分解时,通常有氧气放出
KClO4=KCl+2O2↑
KNO3=2KNO2+O2↑
4KMnO4=2K2MnO4+2MnO2+2O2↑
4Na2Cr2O7=4Na2CrO4+2Cr2O3+3O2↑
碱金属的第五、七族的最高价含氧酸盐特别是多数卤素含氧酸盐,加热时通常按这种方式分解,由于CO2、SiO2、P2O5、O3等分子比较稳定,所以碳酸盐、硅酸盐、磷酸盐、硫酸盐
等热分解时一般不放出氧气。
十.含氧酸盐热分解的歧化反应规律
这种类型热分解虽也属氧化还原反应,但其氧化还原反应是发生在同一元素上,结果使该元素的氧化数一部分变高,另一部分则变低,如NaClO、Na2SO3、Cu2SO4等。
1.阴离子的歧化反应: 具备三个条件
(1) 成酸元素的氧化态处于中间价态;
(2) 酸根阴离子必须是不稳定的,而且歧化后元素的价态是稳定的,例如ClO3-可歧化为
--Cl和ClO4;
(3) 含氧酸盐中阳离子必须稳定,它们都是碱金属和少数活泼的碱土金属离子等,如
3NaClO=2NaCl+NaClO3
4KClO3=KCl+3KClO4
4Na2SO3=Na2S+3Na2SO4
其中Cl和S发生了歧化
应注意这三个条件必须同时具备,否则不发生这类反应,如亚硝酸钾和亚硝酸银中,氮原子处中间价态,但由于硝酸根不如亚硝酸根稳定,因此受热时不会发生这种类型的反应.
2.阳离子歧化反应
含氧酸盐中,若阳离子不稳定时,加热也可能发生歧化分解,如:
Hg2CO3=HgO+Hg+CO2
Mn2(SO4)3=MnO2+MnSO4+2SO3
有的在水溶液中进行:
2Cu+(aq)=Cu2+(aq)+Cu
综上所述:在常见的含氧酸盐中磷酸盐、硼酸盐、硅酸盐都比较稳定,它们在加热时不分解,但易脱水缩合为多酸盐;硝酸盐及卤酸盐不稳定,由于它们的酸根离子具有氧化性,因此加热这类盐会发生不同形式的氧化还原反应,随金属阳离子的不同产物各异,如硝酸盐的几种类型;碳酸盐和硫酸盐等居中,且硫酸盐的分解温度高于碳酸盐,一般含氧酸盐的酸式盐不如正盐稳定。
十一.金属元素高低价转化的规律
元素周期表中,除少数金属元素无变价外,其余均有变价。同一金属的多种不同价态在溶液中存在的形式不同,它们都以各自的最稳定状态而存在于溶液中。①处于低价态的金属
离子一般以简单的阳离子形式存在于溶液中,如Pb2+、Mn2+、Fe2+、Bi3+、Cr3+等;②处于中间价态的金属元素大都以氧化物、氧酰离子或相应价态的酸根离子形式存在于溶液中,如MnO2、+--PbO、CrO2等;③处于高价态的金属元素常以复杂的含氧酸根形式存在,如MnO4、BiO3-、CrO42-、FeO42-等。这主要是因为同一金属元素离子价态越高,半径就越小,离子电荷与半径
的比值越大的离子,对水分子的极化力大。由于极化,使O-H键电子密度减少,易断键,结果,由水配位的金属离子转化为羟基配位的金属离子,进一步转化为氧配位的配合阴离子如MnO4-。如Mn7+←
金属元素高低价态离子间的相互转化过程,实际上就是氧化还原的过程。有些氧化还原过程常伴有介质参加,而且介质可影响氧化还原产物。因此水溶液中金属元素的高低价相互转化过程与介质的酸碱性有关,而且存在普遍规律:
1.由低价态化合物转化到高价态化合物,需在碱性介质中用氧化剂氧化低价态的离子,如:
Pb2+--PbO22------PbO2
Bi3+---Bi(OH)3--------NaBiO3
Cr3+----CrO2------CrO42-
Mn2+---Mn(OH)2-----MnO2-----MnO42-
Fe2+--Fe(OH)2----Fe(OH)3----FeO42-
Co2+--Co(OH)2----Co2O3
Ni2+--Ni(OH)2----Ni2O3
在碱性介质中能完成这种转化过程,有几点原因:其一是从电极电势来看在碱性介质中金属的电对较低,其还原态不稳定,还原性较强,易找合适的氧化剂将低价态氧化成高价态.
4+其二是这些元素的高价态在酸性介质中极不稳定,只能在碱性中存在.如Pb在酸性介质中3+3+23334碱性条件是形成高价态化合物本身的要求。当然也有一些高价态在酸中稳定,不一定用碱,如
Sn2+-----Sn4+
Fe2+----Fe3+
Ce3+----Ce4+
但只是少数,再如Mn2+转化成MnO4-在碱性介质较易转化,而在酸性溶液中则需很强的氧
化剂(BiO3-;PbO2;S2O82-;IO4-等)才能进行.绝大多数金属由低价态转化到高价态需在碱性介质
中进行,是主要的制备原则(碱性介质加上强氧化剂是制备高价态的一个原则)
2.由高价态向低价态转化需在酸性介质条件下,用强还原剂将高价化合物还原
2+如 PbO2----Pb
NaBiO3----Bi3+
2-3+CrO4-----Cr
在酸性介质中,电对的值增大,其高价态的氧化性增强,在强还原剂的作用下可以转化为低价态的金属离子。
