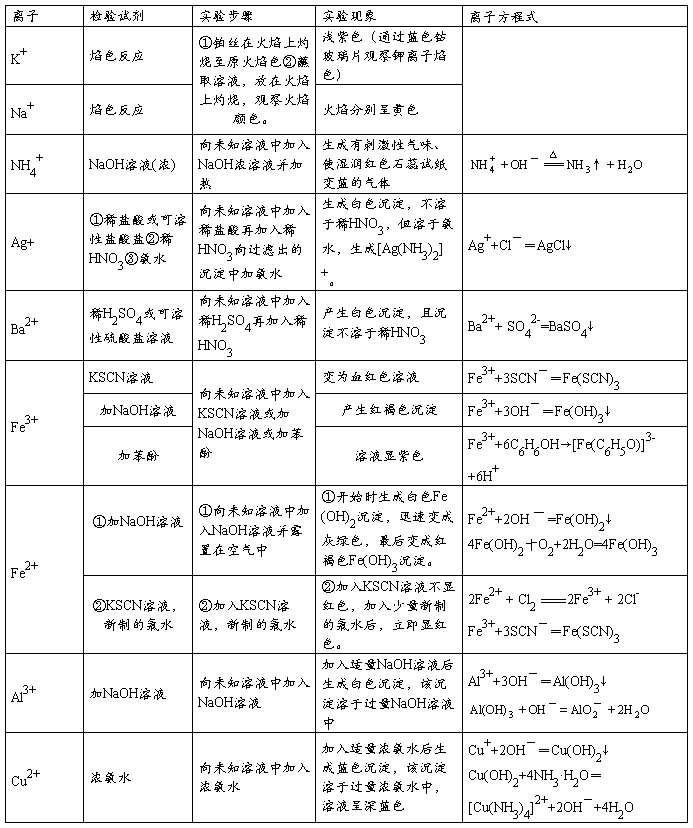
一、常见离子的检验
(一)常见阳离子的检验方法
(二)常见阴离子的检验方法
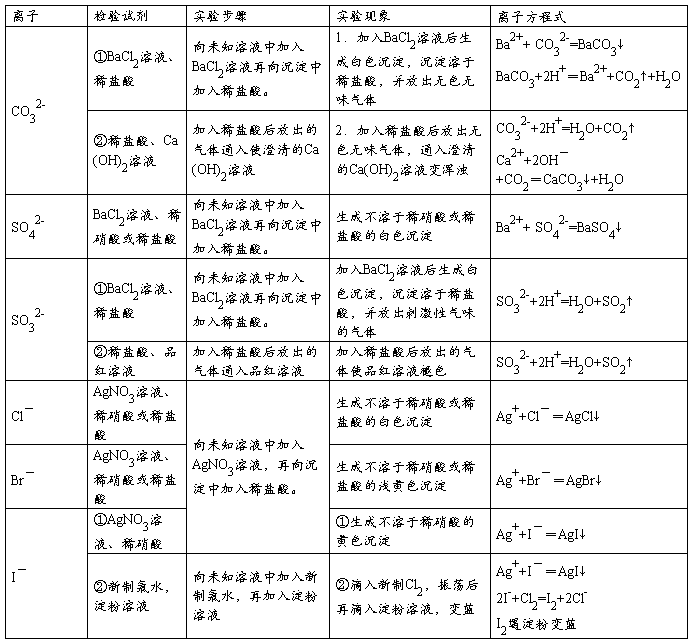
注意:
1.若SO42-与Cl-同时检验,需注意检验顺序。应先用Ba(NO3)2溶液将SO42-检出,并滤去BaSO4,然后再用AgNO3检验Cl-。
2.检验SO32-的试剂中,只能用盐酸,不能用稀硝酸。因为稀硝酸能把SO32-氧化成SO42-。
3.若Ag+和Ba2+同时检验,也需注意检验顺序,应先用盐酸将Ag+检验出并滤去沉淀,然后再用稀硫酸检验Ba2+。
二、按俗称分:
无机部分:
纯碱、苏打、天然碱 、口碱:Na2CO3 小苏打:NaHCO3 大苏打:Na2S2O3 石膏(生石膏):CaSO4.2H2O 石灰石、大理石:CaCO3 生石灰:CaO 熟石灰、消石灰:Ca(OH)2 芒硝:Na2SO4·7H2O (缓泻剂) 烧碱、火碱、苛性钠:NaOH 绿矾:FaSO4·7H2O 干冰:CO2 明矾:KAl (SO4)2·12H2O 漂白粉:Ca (ClO)2 、CaCl2(混和物) 胆矾、蓝矾:CuSO4·5H2O 双氧水:H2O2 硅石、石英:SiO2 刚玉:Al2O3 水玻璃、泡花碱、矿物胶:Na2SiO3 铁红、铁矿:Fe2O3 磁铁矿:Fe3O4 黄铁矿、硫铁矿:FeS2 铜绿、孔雀石:Cu2 (OH)2CO3 玻璃的主要成分:Na2SiO3、CaSiO3、SiO2 天然气、沼气、坑气(主要成分):CH4 水煤气:CO和H2 光化学烟雾:NO2在光照下产生的一种有毒气体 王水:浓HNO3与浓HCl按体积比1:3混合而成。
有机部分:
氯仿:CHCl3 电石:CaC2 电石气:C2H2 (乙炔) TNT:三硝基甲苯 酒精、乙醇:C2H5OH氟氯烃:是良好的制冷剂,有毒,但破坏O3层。 醋酸:冰醋酸、食醋 CH3COOH 石炭酸:苯酚 蚁醛:甲醛 HCHO 福尔马林:35%—40%的甲醛水溶液 蚁酸:甲酸 HCOOH葡萄糖:C6H12O6 果糖:C6H12O6 蔗糖:C12H22O11 麦芽糖:C12H22O11 淀粉:(C6H10O5)n 硬脂酸:C17H35COOH 油酸:C17H33COOH 软脂酸:C15H31COOH 草酸:乙二酸 HOOC—COOH 使蓝墨水褪色,强酸性,受热分解成CO2和水,使KMnO4酸性溶液褪色。
三、 颜色
1、铁:铁粉是黑色的;一整块的固体铁是银白色的。 Fe2+——浅绿色 Fe3O4——黑色晶体 Fe(OH)2——白色沉淀 Fe3+——黄色 Fe (OH)3——红褐色沉淀 Fe (SCN)3——血红色溶液 FeO——黑色的粉末 Fe2O3——红棕色粉末 FeS——黑色固体
2、铜:单质是紫红色 Cu2+——蓝色 CuO——黑色 Cu2O——红色 CuSO4·5H2O——蓝色 Cu2 (OH)2CO3 —绿色 Cu(OH)2——蓝色
3、BaSO4 、BaCO3 、Ag2CO3 、CaCO3 、AgCl 、 Mg (OH)2 、三溴苯酚均是白色沉淀 Al(OH)3 白色絮状沉淀 H4SiO4(原硅酸)白色胶状沉淀
4、Cl2、氯水——黄绿色 F2——淡黄绿色气体 Br2——深红棕色液体 I2——紫黑色固体
5、HF、HCl、HBr、HI均为无色气体,在空气中均形成白雾
6、CCl4——无色的液体,密度大于水,与水不互溶 KMnO4--——紫色 MnO4-——紫色
7、Na2O2—淡黄色固体 Ag3PO4—黄色沉淀 S—黄色固体 AgBr—浅黄色沉淀
8、AgI—黄色沉淀 O3—淡蓝色气体 SO2—无色,有剌激性气味、有毒的气体
9、SO3—无色固体(沸点44.8 0C) 品红溶液——红色 氢氟酸:HF——腐蚀玻璃
10、N2O4、NO——无色气体 NO2——红棕色气体 NH3——无色、有剌激性气味气体
四、高中重点化学方程式小结
(是离子反应的自己改写出离子方程式)
1. 钠在氧气中燃烧 2Na + O2 点燃 Na2O2 2. 钠与氧气在常温下反应 4Na + O2 = 2Na2O
3. 钠与水反应 2Na + 2H2O = 2NaOH + H2↑ 4. 氧化钠与水反应 2Na2O + 2H2O = 4NaOH
5. 过氧化钠与水反应 2Na2O2 + 2H2O = 4NaOH + O2↑
6. 过氧化钠与二氧化碳反应 2Na2O2 + 2CO2 = 2Na2CO3 + O2↑
7. 碳酸氢钠与氢氧化钠反应 NaHCO3 + NaOH = Na2CO3 + H2O
8. 碳酸氢钠加热分解 2NaHCO3 △ Na2CO3 + H2O + CO2↑
9. 氢氧化钠通入少量二氧化碳气体 2NaOH + CO2 = Na2CO3 + H2O
10.二氧化碳通入碳酸钠溶液 Na2CO3 + CO2 + H2O = 2NaHCO3
11. 氢氧化钙溶液中通入过量的二氧化碳气体 Ca(OH)2 + 2CO2 = Ca(HCO3)2
12.碳酸氢钠加过量氢氧化钙 NaHCO3 + Ca(OH)2 = NaOH + CaCO3↓+ H2O
13.碳酸氢钠加少量氢氧化钙 2NaHCO3 + Ca(OH)2 = Na2CO3 + CaCO3↓+ 2H2O
14 碳酸氢钙加过量氢氧化钠 Ca(HCO3)2 + 2NaOH = Na2CO3 + CaCO3↓+2H2O
15. 碳酸氢钙加少量氢氧化钠 Ca(HCO3)2 + NaOH = NaHCO3 + CaCO3↓+H2O
16. 氯气与水反应 Cl2 + H2O = HClO + HCl 17. 氟气与水反应 2F2 + 2H2O = 4HF + O2
18. 氯气与氢氧化钠反应 2NaOH + Cl2 = NaClO + NaCl + H2O
19.工业上制漂白精(或漂白粉) Ca(OH)2 + 2Cl2 = Ca(ClO)2 + CaCl2 + 2H2O
20. 氯气与溴化钠反应 Cl2 + 2NaBr = 2NaCl + Br2 21. 氯气与碘化氢反应 Cl2 + 2HI = 2HCl + I2
22. 溴与碘化钾反应 Br2 + 2KI = 2KBr + I2
23. 在高温下氧化铁与一氧化碳气体反应 Fe2O3 + 3CO 高温 2Fe + 3CO2
24. 硫与铁加热反应 Fe + S △ FeS 25. 过氧化氢于二氧化锰制氧气 2H2O2 催化剂 2H2O + O2↑
26. 二氧化硫与硫化氢反应 SO2 + 2H2S = 3S + 2H2O
27. 卤素单质溶液X2(X=Cl Br I)中通入SO2 SO2 + X2 + 2H2O = H2SO4 + 2HX
28. 氯气与亚硫酸钠溶液反应 Cl2 + Na2SO3 + H2O = Na2SO4 + 2HCl
29. 铜与浓硫酸反应 Cu + 2H2SO4 (浓)△ CuSO4 + SO2↑+ 2H2O
30. 碳与浓硫酸反应 C + 2H2SO4 △ CO2↑+ 2SO2↑+ 2H2O
31. 工业上用黄铁矿石(主要成分是FeS2)来制取硫酸,主要的反应为
4FeS2 +11O2高温2Fe2O3+8SO2 2SO2 + O2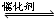 2SO3 再用98﹪硫酸吸收
2SO3 再用98﹪硫酸吸收
32. 硫化氢与浓硫酸反应 33. 硅与氢氧化钠溶液反应 Si + 2NaOH + H2O = Na2SiO3 + 2H2↑
34. 二氧化硅与碳反应 SiO2 + 2C 高温 Si + 2CO↑
35. 二氧化硅与氢氧化钠反应 SiO2 + 2NaOH = Na2SiO3 + H2O
36. 二氧化硅与碳酸钙反应 SiO2 + CaCO3高温 CaSiO3 + CO2↑
37. 二氧化硅与氢氟酸反应 SiO2 + 4HF = SiF4 + 2H2O
38. 工业上制取氨气的方法 N2 + 3H2高温 高压 催化剂 2NH3
39. 在放电条件下氮气与氧气反应 N2 + O2 = 2NO
40. 一氧化碳遇空气变成红棕色气体 2NO + O2 = 2NO2
41 二氧化氮、氧气与水混合 __NO2+__O2+__H2O = __HNO3
42.一氧化氮、氧气与水混合 __NO+__O2+__H2O = __HNO3
43. 氨溶于水显碱性的原因 NH3 + H2O  NH3·H2O
NH3·H2O  NH4+ + OH-
NH4+ + OH-
44. NH3 ·H2O不稳定,受热易分解 NH3·H2O △ NH3↑+ H2O
45. 沾有浓氨水的玻璃棒与沾有浓盐酸的玻璃棒相互靠近产生大量的白烟 NH3 + HCl = NH4Cl

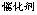

 46. 氨的催化氧化 4NH3 + 5O2 4NO + 6H2O
46. 氨的催化氧化 4NH3 + 5O2 4NO + 6H2O
47. NH4HCO3受热分解时的反应 NH4HCO3 △ NH3↑+ CO2↑+ H2O
48. 实验室制取氨气的反应原理 49. 浓硝酸呈黄色的原因是
50. 铜和稀硝酸反应时,放出的无色气体,当接触空气后,气体变成了红棕色,写出上述过程中发生的反应 3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑+ 4H2O 2NO + O2 = 2NO2
51. 木炭与浓硝酸的反应 52. 将NO2气体压缩加压,发现气体颜色变浅 2NO2 N2O4
N2O4
53. 过量的铁和不足的铁分别与稀硝酸反应的离子方程式
铁过量 3Fe + 8H+ + 2NO3- = 3Fe2+ + 2NO↑+ 4H2O
铁不足 Fe + 4H+ + NO3- = Fe3+ + NO↑+ 2H2O
54. 实验室制取Fe(OH)2,观察到有白色沉淀生成,但沉淀马上变为灰绿色,最后变为红褐色,写出此过程的有关化学方程式 Fe2+ + 2OH- = Fe(OH)2 ↓ 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
55. 红热的铁丝申到盛氯气的集气瓶中,生成棕黄色的烟,加水震荡后生橙黄色溶液 2Fe + 3Cl2 点燃 2FeCl3
56. 红热的铁与水蒸气反应 3Fe + 4H2O 高温 Fe3O4 + 4H2↑
57. 往FeCl2溶液中加入氯水,溶液变为黄色,写出相关离子方程式: 2Fe2+ + Cl2 = 2Fe3+ + 2Cl-
58. 将铁粉加入FeCl3溶液中,溶液变为绿色,写出相应离子方程式 2Fe3+ + Fe = 3Fe2+
59. 将铜粉与氯化铁溶液混合,写出相关离子方程式 2Fe3+ + Cu = 2Fe2+ + Cu2+
60. 如何检验FeSO4溶液中的Fe2+部分被氧化?
61. 铝与氢氧化钠反应的离子方程式 2Al + 2OH- + 2H2O = 2AlO2- + 3H2↑
62.铝粉与氧化铁 2Al + Fe2O3 高温 2Fe + Al2O3
63. Al(OH)3 制取 Al3+ + 3NH3·H2O = Al(OH)3 ↓+ 3NH4+
AlO2-+CO2+2H20= Al(OH)3↓+HCO3-
64. Al(OH)3既可以与酸反应又可以与碱反应的原因(即Al(OH)3的电离方程式)是
Al3+ + 3OH- Al(OH)3
Al(OH)3 AlO2- + H+
AlO2- + H+
65. 氯化铝溶液中滴加过量的氢氧化钠溶液的化学和离子方程式
Al3+ + 3OH- = Al(OH)3↓ Al(OH)3 + OH- = AlO2- + 2H2O
66. 偏铝酸钠溶液中滴加盐酸直到过量的现象、离子方程式
AlO2- + H+ + H2O = Al(OH)3↓ Al(OH)3 + 3H+ = Al3+ + 3H2O
67. 将氯化铝与偏铝酸钠混合后的现象、离子方程式 AlO2- + Al3+ + 2H2O = 4Al(OH)3↓
68. 把AlCl3溶液滴入NaOH溶液中的离子反应方程式
Al(OH)3 + 4OH- = AlO2- + 2H2O AlO2- + Al3+ + 2H2O = 4Al(OH)3↓
69. 把NaOH溶液逐滴滴入AlCl3溶液中至过量(用离子方程式表示)
Al3+ + 3OH- = Al(OH)3↓ Al(OH)3 + OH- = AlO2- + 2H2O
70. Al2O3溶于NaOH溶液中(用离子方程式表示) Al2O3 + 2OH- = 2AlO2- + H2O
71. 把过量的CO2通入偏铝酸钠溶液中(用离子方程式表示)
AlO2- + CO2 + 2H2O = Al(OH)3↓+ HCO3-
72. 把CO2通入过量的偏铝酸钠溶液中(用离子方程式表示)
2AlO2- + CO2 + 3H2O = 2Al(OH)3 + CO32-
73. 把盐酸滴入偏铝酸钠溶液中至过量(用离子方程式表示)
AlO2- + H+ H2O = Al(OH)3↓ Al(OH)3 + 3H+ = Al3+ + 3H2O
75.明矾和FeCl3可用作净水剂的原因(用离子方程式表示)
Al3+ + 3H2O  Al(OH)3 + 3H+ Fe3+ + 3H2O
Al(OH)3 + 3H+ Fe3+ + 3H2O  Fe(OH)3 + 3H+
Fe(OH)3 + 3H+
76. 泡沫灭火器含Al2(SO4)3和NaHCO3溶液,使用时的离子方程式
Al3+ + 3HCO3- = Al(OH)3↓+ 3CO2↑
77. 镁与CO2反应的化学方程式 2Mg + CO2 点燃 2MgO + C
78. 在NH4Cl溶液中加入镁条产生气泡(用离子方程式表示)
NH4+ + H2O = NH3·H2O + H+ Mg + 2H+ = Mg2+ + H2↑
79. 工业上常用电解熔融氧化铝和熔融氯化钠的方法来制取金属铝与金属钠,写出相应的化学方程式 2Al2O3(熔融) = 4Al + 3O2↑ 2NaCl(熔融)= 2Na + Cl2↑
80.氯化铵、醋酸钠、碳酸钠、碳酸氢钠、硫化钠溶液中三个守恒
氯化铵溶液:电荷守恒:
物料守恒:
质子守恒:
醋酸钠溶液:电荷守恒:
物料守恒:
质子守恒:
碳酸钠溶液:电荷守恒:
物料守恒:
质子守恒:
碳酸氢钠溶液:电荷守恒:
物料守恒:
质子守恒:
硫化钠溶液:电荷守恒:
物料守恒:
质子守恒:
81. 写出铜—锌—稀硫酸所组成原电池的的电极反应和原电池反应
负极 Zn-2e- = Zn2+ 正极 2H+ + 2e- = H2↑ 原电池反应 Zn + 2H+ = Zn2+ + H2↑
82. 写出钢铁析氢腐蚀所发生的电极反应
负极 Fe-2e- =Fe2+ 正极 2H+ + 2e- = H2↑
83. 写出钢铁吸氧腐蚀所发生的电极反应
负极 2Fe-4e- =2Fe2+ 正极 2H2O + O2 + 4e- = 4OH-
84. 以碱溶液为电解质的氢氧燃料电池中发生的电极反应和原电池反应
负极 2H2-4e- + 4OH- = 4H2O、 正极 O2 + 4e- + 2H2O = 4OH- 、原电池反应 2H2 + O2 = 2H2O
85. 以酸溶液为电解质的氢氧燃料电池中发生的电极反应和原电池反应
负极 2H2-4e- = 4H+ 正极 O2 + 4e- + 4H+ = 2H2O 原电池反应 2H2 + O2 = 2H2O
86. 以碱溶液为电解质的甲烷燃料电池中发生的电极反应和原电池反应
负极 CH4 - 8e- + 10OH- = CO32- + 7H2O 正极 2O2 + 8e- + 4H2O = 8OH-
原电池反应 CH4 + 2O2 + 2OH- 点燃 CO32- + 3H2O
87. 电解氯化钠溶液
阳极 2Cl—2e- = Cl2↑ 阴极 2H+ + 2e- = H2↑ 总反应 2NaCl + 2H2O = 2NaOH + H2↑+ Cl2↑
88.粗铜的精炼;粗铜做阳极,纯铜做阴极,电解质溶液为硫酸铜
阳极 Zn-2e-= Zn2+ Fe -2e-= Fe2+ Cu-2e-=Cu2+ 阴极 Cu2++2e-=Cu
粗铜中比铜活泼的先进入溶液,没铜活泼的沉下来形成阳极泥
89.电镀: 镀层金属做阳极,待镀金属做阴极,电解质溶液含镀层金属的阳离子。
90. 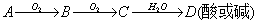
①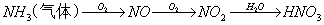
②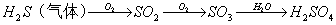
③
④

 五、常见气体的制取和检验
五、常见气体的制取和检验
⑴氧气
制取原理——含氧化合物自身分解
制取方程式——2KClO3= 2KCl+3O2↑ 或KMnO4 == 或H2O2 MnO2

 装置——略微向下倾斜的大试管,加热 检验——带火星木条,复燃 收集——排水法或向上排气法
装置——略微向下倾斜的大试管,加热 检验——带火星木条,复燃 收集——排水法或向上排气法
⑵氢气
制取原理——活泼金属与弱氧化性酸的置换
制取方程式——Zn+H2SO4 === H2SO4+H2↑
装置——启普发生器 检验——点燃,淡蓝色火焰,在容器壁上有水珠 收集——排水法或向下排气法
⑶氯气
制取原理——强氧化剂氧化含氧化合物
制取方程式——MnO2+4HCl(浓)==MnCl2+Cl2↑+2H2O
装置——分液漏斗,圆底烧瓶,加热 检验——能使湿润的蓝色石蕊试纸先变红后褪色;
除杂质——先通入饱和食盐水(除HCl),再通入浓H2SO4(除水蒸气)
收集——排饱和食盐水法或向上排气法 尾气回收——Cl2+2NaOH=== NaCl+NaClO+H2O
⑺氨气
①制取原理——固体铵盐与固体强碱的复分解
②制取方程式——Ca(OH)2+2NH4Cl=CaCl2+NH3↑+2H2O
③装置——略微向下倾斜的大试管,加热
④检验——湿润的红色石蕊试纸,变蓝 或玻璃棒蘸取浓盐酸产生大量的白烟
⑤除杂质——通入碱石灰(除水蒸气) ⑥收集——向下排气法
⑷硫化氢
①制取原理——强酸与强碱的复分解反应 ②制取方程式——FeS+2HCl=== FeCl2+H2S↑
③装置——启普发生器 ④检验——能使湿润的醋酸铅试纸变黑
⑤除杂质——先通入饱和NaHS溶液(除HCl),再通入固体CaCl2(或P2O5)(除水蒸气)
⑥收集——向上排气法 ⑦尾气回收——H2S+2NaOH=== Na2S+H2O或H2S+NaOH=== NaHS+H2O
⑸二氧化硫
①制取原理——稳定性强酸与不稳定性弱酸盐的复分解
②制取方程式——Na2SO3+H2SO4=== Na2SO4+SO2↑+H2O
③装置——分液漏斗,圆底烧瓶 ④检验——先通入品红试液,褪色,后加热又恢复原红色;
⑤除杂质——通入浓H2SO4(除水蒸气) ⑥收集——向上排气法
⑦尾气回收——SO2+2NaOH=== Na2SO3+H2O
⑿甲烷
①制取方程式——CH3COONa+NaOH→ CH4↑+Na2CO3
②装置——略微向下倾斜的大试管,加热 ③收集——排水法或向下排空气法
⒀乙烯
①制取原理——浓硫酸对有机物的脱水作用
②制取方程式——CH3CH2OH →(浓硫酸,170℃)CH2=CH2↑+H2O ③装置——分液漏斗,圆底烧瓶,加热
④除杂质——通入NaOH溶液(除SO2,CO2),通入浓硫酸(除水蒸气) ⑤收集——排水法
⒁乙炔
①制取原理——电石强烈吸水作用 ②制取方程式——CaC2+2H2O=Ca(OH)2+CH≡ CH↑
③装置——分液漏斗,圆底烧瓶(或用大试管,锥形瓶)
④检验——无色气体,能燃烧,产生明亮的火焰,并冒出浓的黑烟
⑤除杂质——通入硫酸铜溶液(除H2S,PH3),通入浓硫酸(除水蒸气) ⑥收集——排水法或向下排气法
六、“10电子”、“18电子”的微粒小结
1.“10电子”的微粒:Ne、N3?、O2?、F?、Na+、Mg2+、Al3+、HF、H2O、NH3、CH4、OH?、NH2?、H3O+、NH4+
2.“18电子”的微粒:Ar、Cl?、S2?、K+、Ca2+、HCl、H2S、PH3、SiH4、H2O2、F2、CH3F、N2H4、CH3OH、HS?
注:其它诸如C2H6、N2H5+、N2H62+等亦为18电子的微粒。
七、特殊试剂的存放和取用10例
1.Na、K:隔绝空气;防氧化,保存在煤油中(或液态烷烃中),(Li用石蜡密封保存)。用镊子取,玻片上切,滤纸吸煤油,剩余部分随即放人煤油中。
2.白磷:保存在水中,防氧化,放冷暗处。镊子取,并立即放入水中用长柄小刀切取,滤纸吸干水分。
3.液Br2:有毒易挥发,盛于磨口的细口瓶中,并用水封。瓶盖严密。
4.I2:易升华,且具有强烈刺激性气味,应保存在用蜡封好的瓶中,放置低温处。
5.浓HNO3,AgNO3:见光易分解,应保存在棕色瓶中,放在低温避光处。
6.固体烧碱:易潮解,应用易于密封的干燥大口瓶保存。瓶口用橡胶塞塞严或用塑料盖盖紧。
7.NH3?H2O:易挥发,应密封放低温处。
8.C6H6、、C6H5—CH3、CH3CH2OH、CH3CH2OCH2CH3:易挥发、易燃,应密封存放低温处,并远离火源。
9.Fe2+盐溶液、H2SO3及其盐溶液、氢硫酸及其盐溶液:因易被空气氧化,不宜长期放置,应现用现配。
10.卤水、石灰水、银氨溶液、Cu(OH)2悬浊液等,都要随配随用,不能长时间放置。
八、电子式
