高中化学基础知识总结——《无机化学》部分
一、物质的颜色
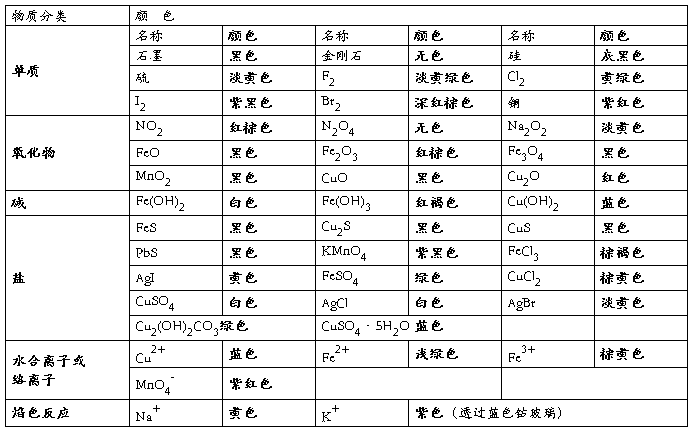
附表1 卤素单质及其溶液(由稀到浓)颜色

其它:1.久置的浓硝酸(溶有NO2)呈黄色,工业盐酸(含杂质Fe3+)呈黄色。
2.I2与淀粉溶液作用呈蓝色。
3.蓝色石蕊试纸遇酸变红;红色石蕊试纸遇碱变蓝。
4.pH试纸(黄色)遇酸变红,遇碱变蓝。
二、俗名总结
序号 物质 俗名 序号 物质 俗名
1 NaCl 食盐 7 Na2CO3 纯碱、苏打
2 NaOH 烧碱、火碱、苛性钠 8 NaHCO3 小苏打
3 CaO 生石灰 9 CuSO4?5H2O 胆矾、蓝矾
4 Ca(OH)2 熟石灰、消石灰 10 SiO2 石英、硅石
5 CaCO3 石灰石、大理石 11 Na2SiO3 水溶液(水玻璃)
6 KAl(SO4)2?12H2O 明矾 12 CO2 固体 干冰
三、《金属及其化合物部分》考点揭秘
钠及其化合物:
1、 钠单质(1)Na与水反应的离子方程式: 。
(2)Na的保存:放于煤油中
(3)Na、K失火的处理:不能用水灭火,必须用干燥的沙土灭火。
2、过氧化钠(1)物质分类:过氧化物;
(2)过氧化钠中微粒的组成:1mol过氧化钠中所含有离子的数目为3NA,或说它们的微粒个数之比为2:1,命题角度为阿伏加德罗常数。
(3)过氧化钠与水、CO2的反应: ;
。
(4)强氧化性:加入过氧化钠后溶液离子共存的问题。
3、碳酸钠与碳酸氢钠
(1)除杂:CO2(HCl):通入饱和的NaHCO3溶液而不是饱和Na2CO3溶液。
(2)NaHCO3(少量与过量)与石灰水的反应:命题角度为离子方程式的书写正误
(3)NaHCO3溶液中离子浓度大小的顺序问题:因HCO3-水解程度大于电离程度,顺序为c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-),也有c(CO32-) <c(H2CO3)。
铝及其化合物
1、铝单质
(1)铝与NaOH溶液的反应: 。
(2)铝、铁钝化:常温下,与浓硫酸、浓硝酸发生钝化。
(3)铝热反应(Fe2O3): ;
(4)离子共存:与铝反应放出氢气时溶液的酸碱性问题。
2、氧化铝
(1)两性氧化物:与酸反应离子方程式: ;
与碱反应离子方程式: 。(2)工业制备铝:2Al2O3(熔融) 4Al+3O2↑
4Al+3O2↑
3、氢氧化铝
1.制备(氯化铝溶液中加入过量氨水): ;
2.两性氢氧化物:与酸反应: ;
与碱反应: 。
3.治疗胃酸过多:
4.明矾净水原理:
。(离子方程式和必要的文字说明)
铁及其化合物:
1、铁
(1)铁与水蒸气的反应: 。
(2)铁与氯气、盐酸反应: 、 。
2、氧化物
(1)铁的氧化物成分:废铁屑的主要成分Fe2O3;铁锈的主要成分为Fe2O3. nH2O;黑色晶体、磁性氧化铁为Fe3O4;红棕色粉未,俗称铁红,作红色油漆和涂料的为Fe2O3,赤铁矿的主要成分为Fe2O3,它是炼铁的原料。铁在氧气燃烧与铁与水蒸气反应的产物都是Fe3O4。
3、氢氧化物
(1) Fe(OH)2→Fe(OH)3:方程式: ;
现象: 。
(2)Fe(OH)3的受热分解: 。
(3)氢氧化铁胶体的制备操作方法:
。
4、铁盐与亚铁盐
(1)Fe2+、Fe3+的检验:Fe2+: ;
Fe3+: 。
(2)硫酸亚铁溶液的配制需注意: ;
氯化铁溶液的配制需注意: 。
(3)铜电路板常用FeCl3作腐蚀液: 。
(4)离子共存:不能与Fe2+共存的离子:(H+、NO3-)、(MnO4-)、(ClO-);不能与Fe3+共存的离子有:I-、SO32-、SCN-。
(5)Na2FeO4(高铁酸钠)作新型净水剂的优点:
。
(6)Cu2+ (Fe3+)的除杂: 。
铜及其化合物
(1)电解硫酸铜溶液: ;
(2)铜与浓硫酸反应: 。
四、非金属及其化合物知识考点归纳
硅及其化合物
1、硅
(1)在自然界中没有游离态的硅,
(2)用途:太阳能电池、计算机芯片以及良好的半导体材料等。
(3)Si与O2的反应: 。
2、二氧化硅(SiO2):
(1)SiO2与NaOH的反应: ;
(2)SiO2与HF的反应: ;
3、硅酸(H2SiO3):
(1)物理性质:不溶于水的白色胶状物,能形成硅胶,吸附水分能力强。
(2)H2SiO3制备:向硅酸钠溶液中通入CO2气体: 。
4、硅酸盐
Na2SiO3的水溶液俗称 ,又称泡花碱,是一种无色粘稠的液体,可以作黏胶剂和木材防火剂。
氯及其化合物
1、氯气(Cl2):
(1)物理性质:黄绿色的有毒气体,液氯为纯净物
(2)化学性质:
①与Fe、Cu反应: 、 。
②与氢气反应: 。
③Cl2与水反应: 。氯水含七种微粒,其中有 。
④Cl2与NaOH反应: ;
与Ca(OH)2溶液反应: ;
此反应用来制漂白粉,漂白粉的主要成分为 ,有效成分为 。
漂白粉久置空气会失效(涉及两个反应): 。
2、Cl-的检验:
方法: 。
硫及其化合物
1、硫单质:
(1)物质性质: ;
(2)硫和氧气的反应: 。
2、二氧化硫(SO2)
(1)化学性质:
①SO2能与水反应: ;
②SO2与NaOH溶液反应: (SO2少量);
(SO2过量)。
③SO2具有强还原性,能与强氧化剂(如酸性高锰酸钾溶液、氯气、氧气等)反应。
SO2与O2的反应: 。
SO2和Cl2的反应: 。
④SO2的弱氧化性(与H2S反应): 。
⑤SO2的漂白性:SO2能使品红溶液褪色,加热恢复原来的颜色。用此检验SO2的存在。
3、硫酸(H2SO4)
(1)浓硫酸三大性质:
①吸水性:可作干燥剂,可干燥H2、O2、SO2、CO2等气体,但不可以用来干燥NH3、H2S气体。
②脱水性:能将有机物(蔗糖、棉花等)以H和O原子个数比2︰1脱去,炭化变黑。
③强氧化性:浓硫酸在加热条件下显示强氧化性(+6价硫体现了强氧化性),能与大多数金属反应,也能与非金属反应。
(ⅰ)与铜反应: ;
(ⅱ)与C反应: 。
常温下,Fe、Al遇浓H2SO4或浓HNO3发生钝化,而不是不反应。
氮及其化合物
1、氮的氧化物:NO2和NO
N2与O2的反应: ;
NO与O2反应: ;
NO2与H2O反应: 。
2、硝酸(HNO3):
(1)与铜反应:①Cu+4HNO3(浓)= ;
②3Cu+8HNO3(稀)= 。
常温下,Fe、Al遇浓H2SO4或浓HNO3发生钝化。
(2)与C反应: 。
3、氨气(NH3)
(1)氨气与水的反应: ;
氨水中的微粒: (六种微粒)。
b.氨气与盐酸反应: ;
(2)氨气的实验室制法:(课本图)
1)原理:
2)装置特点:固+固 气体,与制O2相同。
气体,与制O2相同。
3)收集:向下排空气法。
4)验满:a.
b.
5) 干燥:用碱石灰(NaOH与CaO的混合物)或生石灰在干燥管或U型管中干燥。不能用CaCl2、硫酸作干燥剂。
4、铵盐
(1)受热易分解,放出氨气:NH4Cl ;
;
NH4HCO3 。
。
(2)与NaOH反应: 。
(3)NH4+的检验: 。
五、《化学反应原理》基础内容
1、能源
关于能源问题,应了解下面的几个问题:
(1)能源的分类:常规能源(可再生能源,如水等,非再生能源,如煤、石油、天然气等);新能源(可再生能源,如太阳能、风能、生物能;非再生能源,如核聚变燃料)
(2)能源的开发;①太阳能:每年辐射到地球表面的能量为5×1019kJ,相当于目前全世界能量消耗的1.3万倍。②生物能:将生物转化为可燃性的液态或气态化合物,再利用燃烧放热。③风能:利用风力进行发电、提水、扬帆助航等技术,风能是一种可再生的干净能源。④地球能、海洋能。
2、热化学方程式的书写及盖斯定律的应用:
3、化学反应速率及其简单计算
(1)化学反应速率:单位一般为mol/(L·min)或mol.·L-1·min-1
(2)结论:对于一般反应 aA + bB =cC + dD来说有:VA :VB :VC :VD =△CA :△CB :△CC :△CD =△nA :△nB :△nC :△nD = a :b :c :d
(3)影响化学反应速率的因素
1.内因(主要因素): ;
2.外因(次要因素):浓度、温度、压强、催化剂等。
4、化学平衡状态的标志和判断
(1)V正=V逆,它是化学平衡的本质特征
(2)化学平衡的状态的判断:总压强、总体积、总物质的量、平均相对分子质量、温度、密度等。
5、影响化学平衡的因素
(1)浓度: ;
(2)温度: ;
(3)压强: ;
(4)催化剂: 。
6、化学平衡常数
(1)利用K值可判断某状态是否处于平衡状态。例如,在某温度下,可逆反应mA(g)+nB(g) pC(g)+qD(g),平衡常数为K。若某时刻时,反应物和生成物的浓度关系如下:
pC(g)+qD(g),平衡常数为K。若某时刻时,反应物和生成物的浓度关系如下: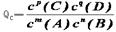 ,则有以下结论:
,则有以下结论:
①Qc=K ,V(正)=V(逆),可逆反应处于化学平衡状态;
②Qc<K ,V(正)>V(逆),可逆反应向正反应方向进行;
③Qc>K ,V(正)<V(逆),可逆反应向逆反应方向进行。
水溶液中的离子平衡
1、电解质、非电解质,强弱电解质的比较
电解质、非电解质的概念;强电解质与弱电解质的概念
2、强弱电解质通过实验进行判断的方法(以醋酸HAc为例):
(1)溶液导电性对比实验:相同条件下,HAc溶液的导电性明显弱于强酸(盐酸、硝酸)
(2)测0.01mol/LHAc溶液的pH>2
(3)测NaAc溶液的pH值: 常温下,PH>7
(4)测pH= a的HAc稀释100倍后所得溶液pH<a +2
(5)将物质的量浓度相同的HAc溶液和NaOH溶液等体积混合后溶液呈碱性
(6)中和10mLpH=1的HAc溶液消耗pH=13的NaOH溶液的体积大于10mL
(7)将pH=1的HAc溶液与pH=13的NaOH溶液等体积混合后溶液呈酸性
(8)比较物质的量浓度相同的HAc溶液与盐酸,分别与同样的锌粒反应产生气体的速率,后者快。
3、弱电解质电离平衡及电离平衡常数
要点一:影响水电离平衡的因素
1.温度:升温,促进水电离,c(H+)、c(OH-)同时增大,但溶液仍呈中性。
2.加入酸碱:向纯水中加入酸或碱溶液,酸电离出H+或碱电离出的OH-均使水的电离平衡受到抑制。
3.加入可水解的离子(弱酸根或弱碱阳离子):破坏了水的电离平衡,使水的电离平衡右移,促进了水的电离。
4.其他因素:向水中加入活泼金属、电解时有H+、OH-放电时均可促进水的电离平衡正向移动。
要点二:水的离子积常数
1.水的离子积表示为KW = c(H+) c(OH-) ,水的离子积只与温度有关,如不指明,则是在25℃;升高温度,Kw增大,降低温度,Kw减小。
c(OH-) ,水的离子积只与温度有关,如不指明,则是在25℃;升高温度,Kw增大,降低温度,Kw减小。
2.不仅适用于纯水,还适用于以水为溶剂的稀酸、稀碱溶液。
3.当水中加入酸或碱时,水的电离平衡都受到抑制,但Kw不变,改变的只是c(H+)、c(OH-)相对大小。
要点三:溶液的酸碱性及PH值计算
要点四:电离方程式的书写
1.由于弱电解质在溶液中部分电离,故写电离方程式时用“ ”符号,
”符号,
如CH3COOH H++CH3COO-
H++CH3COO-
2.多元弱酸分步电离,以第一步电离为主:
如H2CO3电离: H2CO3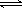 HCO3-+H+ ,HCO3-
HCO3-+H+ ,HCO3- CO32-+H+
CO32-+H+
3.多元弱碱的电离与多元弱酸的电离情况相似,但常用一步表示:Fe(OH)3 Fe3++3OH-
Fe3++3OH-
要点五:水解方程式的书写
1.因单个离子水解程度较弱,故水解反应方程式用“ ”,生成的产物少,生成物一般不标“↓”或“↑”。
”,生成的产物少,生成物一般不标“↓”或“↑”。
2.多元弱酸对应的盐水解方程式与多元弱酸的电离方程式一样也是分步进行,不能合并。
3.多元弱碱阳离子的水解方程式一步完成。例如FeCl3水解:FeCl3+3H2O  Fe(OH)3+3H+
Fe(OH)3+3H+
4.双水解是指阴阳离子均水解,且水解程度较大,一般能进行到底,此类水解用“=”表示,生成物中的沉淀、气体要用“↓”或“↑”标出,如Al3+与[Al(OH)4]-、HCO3-、HS-、S2-之间均发生双水解反应,如Al3++ 3HS-+3H2O=Al(OH)3↓+3H2S↑
六、盐类的水解
要点六:盐类水解规律
1.有弱才水解,无弱不水解,越弱越水解;谁强显谁性,两弱相促进,两强不水解。
要点七:影响盐类的水解的因素
1.内在因素:组成盐的弱离子对应的酸或碱越弱,盐的水解程度越大.
2.外在因素:
①温度:升高温度,能促进盐的水解(因盐的水解是吸热的);
②冲稀:用水稀释,盐的浓度减小,水解所呈现的酸碱性减弱,但盐的水解程度增大;
③加入酸或碱:能促进或抑制盐的水解,加入水解呈现的酸碱性相反的盐也能促进盐的水解。
要点八:盐类水解的应用
1.易水解盐溶液的配制:配制FeCl3、SnCl2等溶液时,常将它们溶于较浓的盐酸中,然后再用水稀释到所需浓度。
2.较活泼的金属与盐溶液作用产生氢气:如将Mg放入NH4Cl溶液中,会有氢气产生。
3.化肥的合理使用,如铵态氮肥不能与草木灰(主要成分K2CO3)混用
4.泡沫灭火器中药剂的使用: ;
5.明矾净水: 。
4、溶液中离子浓度大小的比较
(1)多元弱酸、多元弱酸盐溶液
如H2S溶液: ;
如Na2CO3溶液: 。
(2)混合溶液中离子浓度的比较:
(3)掌握三个守恒关系:
(1)电荷守恒:如在Na2CO3溶液中有: ;
(2)物料守恒:如在Na2 CO3溶液中有: ;
(3)质子守恒:如在Na2 CO3溶液中有: 。
5、溶沉淀解平衡及沉淀溶解平衡常数
(1)溶度积的应用:
通过比较溶度积和溶液中有关离子浓度幂的乘积—离子积QC的相对大小,可以判断难溶电解质在给定条件下沉淀能否生成或溶解。
QC >Ksp 溶液过饱和,有沉淀析出,直至溶液饱和达到新的平衡状态
QC= Ksp 溶液饱和,沉淀与溶解处于平衡状态
QC <Ksp溶液未饱和,无沉淀析出,若加入过量难溶电解质,难溶电解质溶解直至溶液饱和。
电化学
1 、原电池的工作原理
(1)将化学能转变为电能的装置叫做原电池,
(2)原电池的形成条件:(如下图所示)


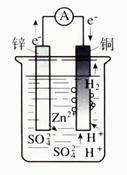
(3)判断原电池正负极常用的方法
负极:一般为较活泼金属,发生氧化反应;是电子流出的一极,电流流入的一极;或阴离子定向移动极;往往表现溶解。
正极:一般为较不活泼金属,发生还原反应;电子流入一极,电流流出一极;或阳离子定向移向极;往往表现为有气泡冒出或固体析出。
2、化学电源
甲烷燃料电池电极反应式及总式: 。
3、电解原理及规律
(1)阳极:与电源正极相连的电极,是发生氧化反应;
阴极:是与电源负极相连的电极,发生还原反应。
(2) 离子的放电顺序:
(3)酸、碱、盐溶液电解规律(惰性电极)
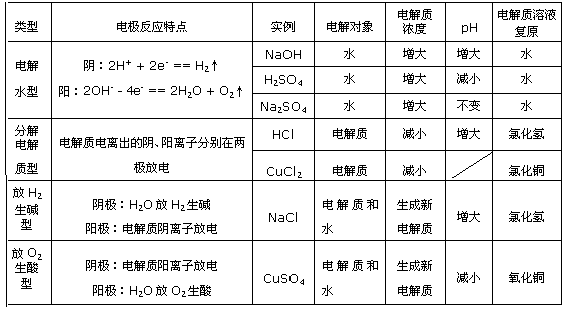 4、电解原理的应用
4、电解原理的应用
(1)氯碱工业(电解饱和食盐水):2NaCl + 2H2O == 2NaOH + H2↑ + Cl2↑
(2)电镀:待镀金属制品作阴极,镀层金属作阳极,含有镀层金属离子的溶液作电镀液,阳极反应:M – ne- =Mn+(进入溶液),阴极反应Mn+ + ne- =M(在镀件上沉积金属)
(3)电解精炼铜:以粗铜为阳极,精铜为阴极,含铜离子的溶液作电解质溶液。电解时发生如下反应:阳极(粗铜):Cu -2e- = Cu2+;阴极(纯铜):Cu2+ + 2e- = Cu。
5、钢铁的腐蚀与防护(以钢铁铁腐蚀为例)
1.钢铁的析氢腐蚀和吸氧腐蚀: ;
。
特别提醒:
1.金属腐蚀的快慢:在相同的电解质溶液中,金属腐蚀的快慢一般为:电解池的阳极>原电池负极>化学腐蚀>电解池阴极、原电池正极。
