第一章 绪论... 2
第三章 化学热力学初步... 3
基本概念... 3
rHqm的计算... 3
反应的方向... 3
ΔrGqm的计算... 4
第四章 化学反应速率和化学平衡化学反应速率... 4
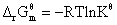 ...................................... 4
...................................... 4
非标态下化学反应方向的判据为:当 Q<Kθ ΔrGm <0 反应正向自发;当 Q=Kθ ΔrGm=0 处于平衡状态;当 Q>Kθ ΔrGm >0 反应正向非自发... 5
多重平衡规则... 5
化学平衡的移动(吕.查德里原理) 5
有关化学平衡的计算... 5
第五章 物质结构基础... 5
原子轨道(波函数)的角度分布图... 6
电子云的角度分布图... 6
电子云的径向分布图... 6
四个量子数的取值及物理意义... 6
核外电子分布的一般原则... 7
电子层结构与元素周期律(通过电子排布式能知道元素在周期表中的位置,反之亦然)... 7
价键理论... 8
杂化轨道理论... 8
NaCl,KCl 9
第六章 酸碱平衡与酸碱滴定法... 10
酸碱质子理论... 10
各种溶液pH值的计算... 10
滴定分析概述... 11
第七章 沉淀溶解平衡及在分析化学中的应用... 13
第八章 氧化还原平衡与氧化还原滴定法... 13
电动势和吉布斯函数变的关系△G =-nFε. 13
氧化还原反应的平衡常数的计算... 14
氧化还原滴定法... 14
第九章 配位平衡与配位滴定... 14
配离子在溶液中的解离平衡... 14
乙二胺四乙酸:简称EDTA ,通常用H4Y表示,由于乙二胺四乙酸溶解度小,所以滴定时用的是乙二胺四乙酸二钠,还是称为EDTA ................................................................................. 15
................................................................................. 15
稳定常数:... 15
配位滴定法... 16
无机化学及分析化学总结
第一章 绪论
l 系统误差:由固定因素引起的误差,具有单向性、重现性、可校正
l 偶然误差:随机的偶然因素引起的误差, 大小正负难以确定,不可校正,无法避免,服从统计规律
(1)绝对值相同的正负误差出现的概率相等
(2)大误差出现的概率小,小误差出现的概率大。
l 准确度: 在一定测量精度的条件下分析结果与真值的接近程度,用误差衡量
l 精密度(precision):多次重复测定某一量时所得测量 值的离散程度。用偏差衡量
l 准确度与精密度的关系:精密度好是准确度好的前提;精密度好不一定准确度高
l 测定结果的数据处理
(1)对于偏差较大的可疑数据按Q检验法进行检验,决定其取舍;
(2) 计算出数据的平均值、平均偏差与标准偏差等;复习p12例题
l 有效数字及其计算规则
有效数字:实际能测得的数据,其最后一位是可疑的。对于可疑数字一般认为有±1的误差
例: 滴定管读数 21.09 mL 分析天平读数 0.2080 g 最后一位为可疑值
注意: (1) “0”的作用:有效数字(在数字的中间或后面)定位作用(在数字的前面)
(2)对数值(pH、pOH、pM、pK等)有效数字的位数取决于小数部分的位数。
计算规则:(1) 加减法:计算结果小数点后的位数与小数点后位数最少的数据一样。
(2)乘除法(乘方、开方、对数)计算结果的有效位数与有效位数最少的数据一样。
第三章 化学热力学初步
基本概念:化学反应进度、体系与环境、状态与状态函数(状态函数的特征)、热与功(热与功的符号、体积功的计算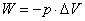 )、内能和热力学第一定律(热力学定律第一定律数学表达式ΔU = Q + W)
)、内能和热力学第一定律(热力学定律第一定律数学表达式ΔU = Q + W)
DrHqm的计算
△rHm:摩尔反应焓变,对于给定的化学反应,反应进度为1mol时的反应热
DrHqm:化学反应中,任何物质均处于标准状态下,该反应的摩尔反应焓变
DfHqm:在温度T及标准态下,由参考状态单质生成1mol物质B的标准摩尔反应焓变即为物质B在T温度下的标准摩尔生成焓。参考状态单质的标准生成焓为零。
1.利用DfHqm计算DrHqm
 , DrHqm≈DrHqm (298.15K);
, DrHqm≈DrHqm (298.15K);
2.盖斯定律:在恒容或恒压同时只做体积功的情况下,任一化学反应,不论是一步完成的,还是分几步完成的,其化学反应的热效应总是相同的,即化学反应热效应只与始、终状态有关而与具体途径无关。根据盖斯定律若化学反应可以加和,则其反应热也可以加和。
反应的方向
热力学中,有两条重要的自然规律控制着所有物质系统的变化方向
(1)从过程的能量变化来看,物质系统倾向于取得最低能量状态;(2)从系统中质点分布和运动状态来分析,物质系统倾向于取得最大混乱度。
热力学中,体系的混乱度用熵来量度的。符号:S
对于物理或化学变化而论,几乎没有例外:一个导致气体分子数增加的过程或反应总伴随着熵值增大,即: DS > 0;如果气体分子数减少,DS < 0。
标准摩尔反应熵变的计算: ,
,
DrSqm≈DrSqm (298.15K)
l 用熵变判断反应自发性的标准是,对于孤立系统:
ΔS(孤) >0 自发过程;ΔS(孤) =0 平衡状态;ΔS(孤)<0 非自发过程
l 判断反应方向的判据是ΔG(适用条件:恒温恒压只做体积功):
ΔG < 0 自发过程;ΔG > 0 非自发过程;ΔG = 0 平衡状态
l ΔH、ΔS对反应自发性的影响(ΔG =ΔH- TΔS)
ΔH<0, ΔS>0,则ΔG<0,任意温度下均自发
ΔH>0, ΔS<0,则ΔG>0,任意温度下均非自发
ΔH>0, ΔS>0,则高温下ΔG<0, 低温下ΔG>0,即高温自发,低温非自发
ΔH<0, ΔS>0,则高温下ΔG>0, 低温下ΔG<0,即高温自发,低温非自发
ΔrGqm的计算
(1)利用标准摩尔生成吉布斯函数计算
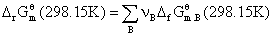 (只有298.15K时的ΔfGqm,B 数据,该方法只能计算298.15K时的ΔrGqm)
(只有298.15K时的ΔfGqm,B 数据,该方法只能计算298.15K时的ΔrGqm)
(2)任意温度下的ΔrGqm可按吉布斯——亥姆霍兹公式近似计算
ΔrGqm(T)≈ΔrHqm (298.15K)-TΔrSqm(298.15K) (ΔrHqm—KJ·mol-1, ΔrSqm—J·mol-1·K-1注意单位换算)
l 反应自发进行的温度范围的计算
ΔrGqm(T)≈ΔrHqm (298.15K)-TΔrSqm(298.15K)
ΔrHqm (298.15K)-TΔrSqm(298.15K)<0 (反应自发)
ΔrHqm (298.15K)和ΔrHqm (298.15K)可以通过热力学数据算出,从而可求出自发进行的温度范围。(p58例3-7)
第四章 化学反应速率和化学平衡化学反应速率
l 化学反应速率的表示方法(浓度随时间的变化)瞬时速率、平均速率
l 化学反应速率理论(碰撞理论、过渡状态理论)
活化分子、活化能(能用化学反应速率理论解释浓度、温度、催化剂对反应速率的影响)
l 质量作用定律(只适用于基元反应)、速率方程、反应级数
l 影响反应速率的因素
(1)内因:反应的活化能大小;(2)外因:浓度、温度、催化剂(不要求计算)
l 标准平衡常数 Kθ
(1) Kθ表达式的书写
溶液用相对平衡浓度表示, 即平衡浓度除以cθ (1 mol×L-1)
即平衡浓度除以cθ (1 mol×L-1)
气体用相对平衡分压表示, 即平衡分压除以pθ (100 kPa),标准平衡常数是量纲为1的量。复相反应中,固体、纯液体和溶剂不写入式中,即用“1”表示
即平衡分压除以pθ (100 kPa),标准平衡常数是量纲为1的量。复相反应中,固体、纯液体和溶剂不写入式中,即用“1”表示
(2)Kθ的求算:a通过表达式求得;b由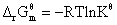 求得
求得
(1)此式把动力学与热力学联系起来,只要知道了某温度下反应的标准摩尔吉布斯函数变  ,就可以求出反应的标准平衡常数Kθ。
,就可以求出反应的标准平衡常数Kθ。
(2)  值愈小(越负),则Kθ值愈大,反应达到平衡时进行得愈完全。
值愈小(越负),则Kθ值愈大,反应达到平衡时进行得愈完全。
非标态下化学反应方向的判据为:当 Q<Kθ ΔrGm<0 反应正向自发;当 Q=Kθ ΔrGm=0 处于平衡状态;当 Q>Kθ ΔrGm>0 反应正向非自发
多重平衡规则
若干反应方程式相加(减)所得到的反应的平衡常数为这些反应的平衡常数之积(商)。
反应1=反应2+反应3 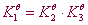 ;反应1=反应2-反应3
;反应1=反应2-反应3 
反应1=m×反应2 
化学平衡的移动(吕.查德里原理)
1.浓度(分压) 、总压力对化学平衡的影响(此时温度不变,因而Kθ为定值)
2.温度对化学平衡的影响(影响Kθ)
升高温度,平衡向吸热反应方向移动,降低温度,平衡向放热反应方向移动,
有关化学平衡的计算
1.写出反应方程式;2.找出各物质的初始浓度(分压);3.设定未知数表示出各物质的平衡浓度(分压)4.表示出平衡常数(标准平衡常数或实验平衡常数) →得到方程5.求解方程解出未知数(p87例4-10)
第五章 物质结构基础
l 微观粒子运动的特征是波粒二象性,具体体现为量子化(能量不连续)和统计性
l 微观粒子质量小,运动速度大,如电子在原子核为10-10m 的范围内以106~108m/s的速度运动(没有固定的轨迹,不服从牛顿定律)→微观粒子的位置与动量不能同时准确测定
l 微观粒子运动的统计性
单个电子的位置和动量不能同时准确测定,但是一个电子的多次运动,或大量电子的运动是有规律的。即电子在原子核外任何空间都能出现,只是在某些空间范围出现的概率大,某些空间范围出现的概率小
l 波函数
(1)波函数y(r, q , f)和其对应的能量E代表了核外电子的一种运动状态,所以波函数又称为原子轨道(函), 原子轨道不再是经典力学中描述的某种确定的几何轨迹。
(2)波函数y(r, q , f)没有明确的物理意义,只是电子的运动状态满足波函数的函数式。
|y|2表示空间某处体积内电子出现的概率(即概率密度)
原子轨道(波函数)的角度分布图
将波函数角度部分U (q , f)随θ,φ的变化作图,即得波函数的角度分布图,即原子轨道的角度分布图。
作图方法是:从原点(原子核)引出不同(q , f )的直线,直线的长度为|Y |,将所有直线的端点连接起来,在空间则形成一个封闭的曲面,并给曲面标上Y值的正、负号。
则曲面上任意一点到原点的距离就是此时(q , f )对应的U (q , f)函数值的绝对值
(1)s原子轨道的角度分布图——球面形,即S轨道角度部分函数值在在r一定时,每个方向上取值相同
(2)p原子轨道的角度分布图——双球面形,d原子轨道的角度分布图——四橄榄形
即p、d、f原子轨道角度部分函数值在r一定时,在各个方向上有大小、正负不同的分布
电子云的角度分布图
电子云角度分布图是波函数角度部分函数Y(q , f)的平方|Y|2随q、f 角度变化的图形
作图方法与波函数角度分布图一样,只是线段的长度为|Y|2
与原子轨道角度分布图的区别在于:
(1)原子轨道角度分布图中Y有正、负之分,而电子云角度分布图中|Y |2全为正
(2)由于Y < 1,|Y |2<|Y|,电子云角度分布图要比原子轨道角度分布图稍“瘦”些。
|y|2表示电子在核外空间某处出现的概率密度,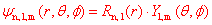
则|Y|2表示r一定时电子在核外空间某方向上出现的概率(密度)(方向一定,体积为单位体积)
s轨道上电子在离核的距离一定时,在每个方向上出现的概率相同
p,d,f轨道上电子在离核的距离一定时,在不同方向上出现的概率有一定大小分布,某些方向上(对称轴)出现的概率最大。
电子云的径向分布图
|R|2表示方向(q , f)一定时电子,电子离核远近不同时出现的概率密度,离核越远,电子出现的体积空间越大,则 概率=概率密度× 体积;即概率=R2(r)×4pr2
R2(r)×4pr2对r作图即可得电子云径向分布图 ,电子云的径向分布图反映电子在核外空间出现的概率离核远近的变化
(1)当l相同时,n越大,主峰(具有最大值的吸收峰)距核越远,即电子出现的最大概率区域离核的距离越远
(2) 当n 相同时,l不同时,主峰离核的距离相近,即电子出现的最大概率区域离核的距离相近。→电子(最大概率区域)分层分布
四个量子数的取值及物理意义
(1)主量子数n:取值:1,2,3,…n等正整数。描述原子中电子(出现概率最大区域)离核的远近,n越大,电子(出现概率最大区域)离核的距离越远, 能量越高,同时n决定电子层
(2)角量子数l:0 1 2 3… n-1
物理意义1:决定波函数角度分布图和电子云角度分布图的形状
物理意义2:在多电子原子中与主量子数n一起决定电子的能量n相同,l越大能级越高 Ens<Enp<End…
(3)磁量子数 m m=0,±1,±2,…± l
物理意义:波函数和电子云角度分布图在空间的伸展方向,即取向数目
n,l相同,m不同的轨道叫等价轨道(简并轨道)
(4)自旋量子数ms,电子有两种自旋方向;
ms= +1/2或ms= -1/2;图示用箭头、¯符号表示
l n、l、m三个量子数决定一个原子轨道(波函数);n、l、m、 ms四个量子数决定一个电子的运动状态
l 能级组1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
核外电子分布的一般原则
能量最低原理、泡利不相容原理、洪特(Hund)规则
注意洪特规则(不容易理解):当电子在n, l 相同的数个等价轨道上分布时,每个电子尽可能占据磁量子数不同的轨道且自旋平行。
洪德规则的补充:简并轨道全充满、半充满或全空的状态比较稳定,全充满: p6, d10,f14 半充满: p3, d5, f7 全空: p0, d0, f0
能级交错时(4s3d,5s4d, 6s4f5d,7s5f6d),可以s轨道未填满,而让简并轨道半满,全满,这时能量更低更稳定,如24Cr 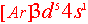 ,29Cu
,29Cu 
电子层结构与元素周期律(通过电子排布式能知道元素在周期表中的位置,反之亦然)
1.能级组与元素周期(行)
(1)各周期元素数目=对应能级组中原子轨道的电子最大容量
(2)原子的电子层数=原子所在的周期数(钯Pd除外)
2.价电子构型与元素周期表中族的划分(列)
价电子:原子发生化学反应时参与形成化学键的电子价电子构型:价电子层的电子排布
主族元素(A): 最后一个电子填入ns或np轨道的元素
主族元素的价电子:最外层电子 (nsnp) IA~VIIIA(VIIIA也称零族)
副族元素(B): 最后一个电子填入(n-1)d或(n-2)f 轨道的元素
副族元素的价电子:最外层s电子,及(n-1)d电子(甚至(n-2)f电子)
IIIB~ VIIIB, ⅠB ,IIB ,其中VIIIB元素有3列
族号数=价电子总数
(VIIIA为8或2,ⅠB,ⅡB d10不计入,Ⅷ 8~10)
3. 价电子构型与元素的分区
s 区 :最后一个电子填入s轨道的元素
p 区:最后一个电子填入p轨道的元素
d 区:最后一个电子填入d轨道且d轨道未满的元素
ds 区:最后一个电子填入d轨道且d轨道填满的元素
f 区:最后一个电子填入f轨道的元素
l 元素基本性质的周期性
掌握主族元素原子半径、电离势、电负性的递变规律
l 离子键
离子键——当活泼金属原子和活泼非金属元素原子互相接近时,前者失去电子形成正离子,后者得到电子形成负离子。正、负离子通过静电相互作用结合成离子型化合物
离子键的本质是静电作用力
生成离子键的条件: 原子间电负性相差足够大,一般要大于1.8左右
离子键的特征:没有方向性、没有饱和性
离子化合物的熔点和沸点:离子的电荷越高、半径越小,静电作用力就越强,
熔点和沸点就越高
价键理论
共价键的本质:原子轨道发生重叠,两核间电子出现概率增大,降低了两核间的正电排斥,又增强了两核对电子云密度大的区域的吸引,系统能量降低, 形成稳定的共价键
价键理论要点:
? 成键原子的未成对电子自旋相反;
? 最大重叠原理:成键原子的原子轨道重叠程度(面积)越大,键越牢。
? 对称性匹配原理:原子轨道的重叠必须发生在角度分布图中正负号相同的轨道之间
l 共价键的特征
饱和性——电子配对后不再与第三个电子成键
方向性——共价键具有方向性的原因是因为原子轨道(p, d, f)有一定的方向性,所以必须沿着特定的方向重叠,它和相邻原子的轨道重叠才能达到最大重叠。
l 共价键的类型
σ键:原子轨道沿键轴方 向“头碰头”式重叠; π键:原子轨道沿键轴 方向“肩并肩”式重叠
l σ键与p键的识别
共价单键为σ键; 共价双键(及三键)中:有一个σ键,其余为p键。
σ键,重叠程度大,较稳定;π键,重叠程度小,较活泼。
杂化轨道理论
杂化轨道理论的要点
(1)同一原子中若干不同类型、能量相近的原子轨道混合起来,重新组成数目相同、能量完全相同的新轨道→杂化轨道
(2)杂化轨道(一头大,一头小)在某些方向上的角度分布更集中,因而杂化轨道比未杂化的原子轨道成键能力强
注意只有在形成分子的过程中,中心原子的能量相近的原子轨道才能进行杂化
杂化形式 中心原子的孤电子对 分子 空间构型 示例 键角
sp等性 0 AX2 直线形 CO2, BeCl2 ,炔烃 180°
sp2等性 0 AX3 平面三角形 BF3, SO3,炔烃 120°
sp3等性 0 AX4 正四面体 CH4, NH4+烷烃 109°28′
sp3不等性 1 :AX3 三角锥 NH3,PCl3 <109°28′
2 :AX2 V字形 H2O, SF2 <109°28′
l 极性分子与非极性分子(能区分分子的极性和键的极性;能判断分子的极性)
l 分子间力
(1)取向力:极性分子中永久偶极间的相互作用力
(2)诱导力:诱导偶极与永久偶极间的作用力。
(3)色散力:瞬间偶极间的作用力。
v 极性分子与极性分子间存在:取向力、诱导力、色散力
v 极性分子与非极性分子间存在:诱导力、色散力
v 非极性分子与非极性分子间存在:色散力
l 分子间力的特征:弱作用力、近距离力、无方向性和饱和性。
l 分子间力对物质物理性质的影响: 结构相似的同系列物质(如:卤素、稀有气体等),分子量越大,瞬间偶极越频繁,分子间作用力越强,物质的熔沸点越高;分子量相等或相近,体积大的变形性大,熔沸点高。
l 氢键 X-H┄Y (有方向的分子间力)
l X、Y代表F、O、N等电负性大而且原子半径较小的原子,可相同,也可不同。
l 形成条件:
(1)分子中有与电负性大,半径小的元素(X)成强极性共价键的H
(2)分子中有电负性大,半径小,含孤电子对的Y。
l 氢键的特点
方向性:X-H┄Y,尽量在同一直线上。除非其它外力有较大影响时,才改变方向。
饱和性:一个H只能与一个Y结合。
l 氢键对化合物性质的影响
同系列物质中, 分子间存在氢键时, 大大地影响了分子间的结合力, 故物质的熔点、沸点将升高。形成分子内氢键相反。

第六章 酸碱平衡与酸碱滴定法
酸碱质子理论
质子酸、质子碱、两性物质;共轭酸碱对
酸碱反应的实质:两对共轭酸碱对间的质子的传递。
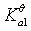 共轭酸碱对解离平衡常数的关系:共轭酸碱对的解离平衡常数乘积为Kqw
共轭酸碱对解离平衡常数的关系:共轭酸碱对的解离平衡常数乘积为Kqw

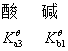

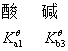
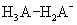
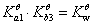
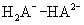

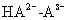

l 同离子效应、盐效应
各种溶液pH值的计算
1.一元弱酸(碱)
浓度为ca mol/L 的 HA溶液
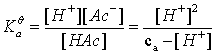

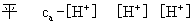
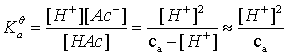

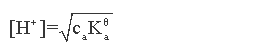
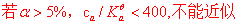

一元弱碱完全一样,只是把H+换成OH-, 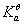 换成
换成
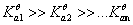 2.多元弱酸(碱)
2.多元弱酸(碱)
对于多元弱酸(碱)一般 ,则可忽略第二级及其以后的解离,多元弱酸可近似当做一元弱酸处理,多元弱碱也可以同样处理。
3.两性物质

NaHCO3溶液;NaH2PO4溶液: Na2HPO4溶液:
(多元弱酸失去一个质子变成的两性物质) (多元弱酸失去两个质子变成的两性物质)
4.缓冲溶液(能够抵抗加入少量强酸或强碱或稀释而能保持溶液pH值基本不变的溶液)
组成:弱电解质的共轭酸碱对
原理:同时存在抗酸组分和抗碱组分
由Ca mol/L HB 和Cb mol/L B- 构成的缓冲溶液

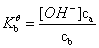
由Cb mol/L 弱碱和Ca mol/L 共轭酸 构成的缓冲溶液
影响缓冲溶液缓冲能力的因素:共轭酸碱对的总浓度、共轭酸碱对的浓度比
总浓度一定时,浓度比等于1时,缓冲能力最强
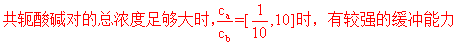
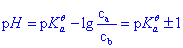
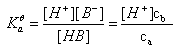 此时对应的pH范围称为缓冲溶液的缓冲范围:
此时对应的pH范围称为缓冲溶液的缓冲范围:

缓冲溶液的选择:
那么配制一定pH值的缓冲溶液时,为了使共轭酸碱对的浓度比接近于1,所以要选择pKaθ接近pH值的缓冲溶液(p167 例子6-17,6-18)
滴定分析概述
定量分析的任务:定性分析、定量分析、结构分析
定量分析方法的分类 :重点掌握按测定原理、组分在试样中的相对含量分类
按测定原理分类:化学分析法(主要有重量分析法和滴定分析法)、仪器分析法
按组分在试样中的相对含量分类:
常量组分分析(>1%);微量组分分析(0.01%~1%);痕量组分分析(<0.01%)
l 定量分析的一般程序:采样 → 前处理 → 测定 ( 消除干扰 ) → 数据处理
l 滴定分析的方法和滴定方式
标准溶液、化学计量点(sp)、滴定终点(ep)、
终点误差(计量点和滴定终点不相吻合而造成的分析误差)
滴定分析的方法: 酸碱滴定法、沉淀滴定法、氧化还原滴定法、配位滴定法
滴定分析对滴定反应的要求:
反应必须定量进行、反应必须速进行、有简便可靠的确定终点的方法
滴定方式:直接滴定法、返滴定法、间接滴定法、置换滴定法
标准溶液的配置:直接配制法、标定法
滴定分析结果的计算:物质的量的比等于反应式中系数比
l 酸碱滴定法
1.指示剂变色原理、变色范围
 示剂的理论变色点
示剂的理论变色点
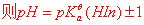 变色范围:
变色范围:
注意:人眼对不同颜色的敏感程度不同所以理论变色范围与实际变色范围有一定差别
l 酸碱滴定曲线
强酸(强碱)的滴定:化学计量时产物为H2O,则pH=7.00
弱酸的滴定:化学计量时产物为该弱酸的共轭碱,,则pH>7.00
弱碱的滴定:化学计量时产物为该弱碱的共轭酸,,则pH<7.00
多元弱酸(碱):会判断有几个滴定突跃,化学计量点时生成什么物质
酸碱滴定突跃:化学计量点前后±0.1%范围内pH值的急剧变化
指示剂选择原则:
(1)指示剂的变色范围全部 或部分处于滴定突跃范围之内。
(2)变色点与化学计量点尽量接近
指示剂在滴定突跃范围内变色,则滴定的相对误差小于±0.1%
弱酸弱碱滴定突跃的影响因素:浓度、解离常数
浓度越大、解离常数越大,滴定突跃范围越宽
弱酸(碱)准确滴定的条件: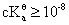 (
(  )
)
对多元弱酸滴定:
(1)判断能否准确滴定,根据: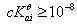 ;
;
(2)判断能否准确分步滴定,根据: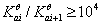
若条件(2)成立,相邻两步解离相互不影响,则滴定时分别与NaOH中和反应,即可以分别滴定
例:滴定下列多元弱酸或弱碱溶液时,有几个滴定突跃
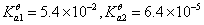 1. 0.1mol/LH2C2O4
1. 0.1mol/LH2C2O4
1个 化学计量点时生成Na2C2O4
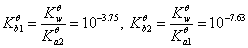 2. 0.1mol/LNa2CO3
2. 0.1mol/LNa2CO3
1个 化学计量点时生成Na2SO4和H3BO3
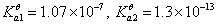 3. 0.1mol/LH2S
3. 0.1mol/LH2S
1个 化学计量点时生成NaHS
l 酸碱标准溶液配制与标定
盐酸标准溶液:基准物质:无水碳酸钠和硼砂(Na2B4O7·10H2O)
氢氧化钠标准溶液:基准物质有草酸、邻苯二甲酸氢钾
l 双指示剂法(酚酞、甲基橙)滴定混合碱(能根据V1和V2的大小关系判断混合碱的组成,并计算各成分的百分含量)
混合碱的组成:纯Na2CO3、Na2CO3 + NaOH、Na2CO3 + NaHCO3
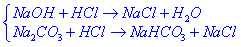 (1)酚酞变色(pH=9.1) 时发生的反应:
(1)酚酞变色(pH=9.1) 时发生的反应:
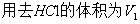
(2)甲基橙变色时(pH=3.8)发生的反应:NaHCO3+HCl→NaCl+H2CO3,用去HCl的体积为 V2
V1= V2 组成为Na2CO3;V1> V2 组成为NaOH + Na2CO3;V1 < V2组成为Na2CO3 + NaHCO3(p193,17, 20题)
第七章 沉淀溶解平衡及在分析化学中的应用
l 溶度积常数KqSP
l  溶度积和溶解度的相互换算(纯水中)
溶度积和溶解度的相互换算(纯水中)
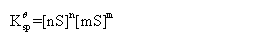
初: 0 0
平衡: nS mS
对同类型的难溶电解质,可用溶度积KqSP的大小来比较溶解度S的大小。但不同类型的难溶电解质则不宜直接用溶度积KqSP的大小来比较溶解度S的大小。
l 溶度积规则
Qi>KqSP时,溶液为过饱和溶液,沉淀析出;Qi=KqSP时,溶液为饱和溶液,处于平衡状态 。
Qi<KqSP时,溶液为未饱和溶液 ,沉淀溶解 。
l 影响难溶电解质溶解度的因素:本性、温度、同离子效应、盐效应(注意不在纯水中,溶解度的计算p198例7-3,p200 例7-7)
l 知道银量法的对应的名称和使用的指示剂
第八章 氧化还原平衡与氧化还原滴定法
l 氧化数、氧化还原电对、电极 、原电池
l 离子—电子法(半反应法)配平氧化还原反应方程式
l 电极电势的绝对值无法测定解决方法就是使用参比电极——标准氢电极
规定:标准氢电极的电极电势为0V
l 标准电极电势 标准电极电势:电极处于标准态时的电势
标准电极电势:电极处于标准态时的电势
标准电极电势表示在电极反应条件下,对某物质氧化型得电子或还原型失电子能力的量度
电极电势数值越小→还原型的还原能力(失电子倾向)越强
电极电势数值越大→氧化型的氧化能力(得电子倾向)越强
影响电极电势的因素:组成电极的氧化还原电对的性质、溶液的浓度、体系的温度
对于一个特定的电极,标准状态时,其组成、浓度(分压)、温度均唯一确定,所以一个电极的标准电极电势唯一确定
电动势和吉布斯函数变的关系△G =-nFε
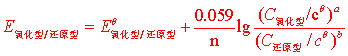
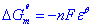 标准状态下:
标准状态下:
l 能斯特(Nernst)方程
应用Nernst方程的注意事项(p228 例8-10,p257 16题)
(1)电对中的固体、纯液体用1表示,溶液浓度为相对浓度,气体为相对分压,p/pq
(2) 如果还有其他物质参加电极反应,如H+、OH-,这些物质的浓度也应表示在能斯特方程式中。
l 判断氧化还原反应进行的方向
△rGm <0,电动势ε>0, E+> E- 反应正向进行
△rGm =0 ,电动势 ε=0, E+= E- 反应处于平衡
△rGm >0 ,电动势 ε<0, E+< E- 反应逆向进行
氧化还原反应的平衡常数的计算
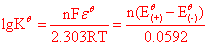 n------反应中转移的电子数
n------反应中转移的电子数
氧化还原滴定法
KMnO4的自动催化反应、诱导反应
氧化还原滴定突跃:化学计量点前后±0.1%范围内滴定剂和待测物两个氧化还原电对的电势的急剧变化
影响氧化还原滴定突跃范围的因素:氧化还原滴定中影响电势突跃的主要因素是反应完全程度,即是两个电对的条件电极电势差,两个电对的条件电极电势差越大,反应越完全。
氧化还原滴定法中的指示剂:自身指示剂(KMnO4)、特殊指示剂 (淀粉)、氧化还原指示剂
氧化还原指示剂的变色原理和变色范围及选择(与酸碱指示剂相似)
氧化还原指示剂指示剂的变色区间全部或部分存在于突跃区间内。由于指示剂的变色区间很小, 常直接用指示剂的条件电位来进行选择
常用的氧化还原滴定法:
碘量法(直接碘量法、间接碘量法、淀粉指示剂加入的时机)
碘量法指示剂加入的时机:
1.直接碘量法:滴定开始即加入淀粉,终点: 出现蓝色
2.间接碘量法:接近终点(浅黄色)时加入淀粉,终点: 蓝色消失
第九章 配位平衡与配位滴定
l 配位化合物的基本概念:形成体、配体、配位原子、单齿配位体、多齿配位体、配位数、命名
配离子在溶液中的解离平衡
外界与内界之间完全理解,形成体(中心)和配体之间部分解离(逐级解离)
思考:[Cu(NH3)4]SO4溶液的组成:SO42-,[Cu(NH3)4]2+,[Cu(NH3)3]2+,[Cu(NH3)2]2+,[Cu(NH3)]2+,Cu2+,NH3等
配离子的转化:一种配离子能转化为更稳定的另一种配离子
乙二胺四乙酸:简称EDTA ,通常用H4Y表示,由于乙二胺四乙酸溶解度小,所以滴定时用的是乙二胺四乙酸二钠,还是称为EDTA
l 酸度较高时,EDTA还可在接受两个质子,相当于六元弱酸H6Y2+,则溶液中EDTA用7种存在形式: H6Y2+, H5Y+, H4Y, H3Y-, H2Y2 -,HY3-,Y4-
l EDTA 有 6 个配原子:2个氨氮配位原子、4个羧氧配位原子
l EDTA金属配合物的特点:
1. 普遍性,EDTA几乎能与所有的金属离子形成络合物;2.组成一定,一般1:1配位;
2. 稳定性高,Kfθ较大(除去碱金属和部分碱土金属);4.可溶性
5. 颜色,EDTA与无色的金属离子形成无色的络合物,与有色的金属离子形成颜色更深的络合物
l
 副反应和副反应系数(了解)
副反应和副反应系数(了解)


产物MY发生副反应对滴定反应是有利的(其反应程度小),金属离子M和配位剂Y的副反应都不利于滴定反应。 一般忽略产物MY的副反应
副反应的程度用副反应系数α表示 αM ,αY
稳定常数:

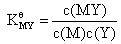
稳定常数是M与Y反应生成MY的平衡常数,平衡常数与浓度无关,那么发生副反应时,主反应的反应程度会发生变化,但是稳定常数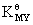 的数值不会改变。所以稳定常数
的数值不会改变。所以稳定常数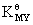 不能准确表示有副反应存在时主反应的进行程度,以及此时MY的稳定性;稳定常数
不能准确表示有副反应存在时主反应的进行程度,以及此时MY的稳定性;稳定常数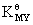 只能表示没有副反应时主反应的反应程度,以及没有副反应时MY的稳定性。
只能表示没有副反应时主反应的反应程度,以及没有副反应时MY的稳定性。
l 条件稳定常数
条件稳定常数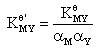
副反应越严重,副反应系数越大,条件稳定常数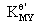 越小,所以条件稳定常数能准确表示有副反应的情况下,主反应进行的程度,以及有副反应的情况下,MY的稳定性。
越小,所以条件稳定常数能准确表示有副反应的情况下,主反应进行的程度,以及有副反应的情况下,MY的稳定性。
配位滴定法
配位滴定突跃:化学计量点前后±0.1%范围pM′(为参与主反应的金属离子各种存在形式总浓度的负对数)的急剧变化
l  影响滴定突跃的因素: (即滴定反应完全程度)
影响滴定突跃的因素: (即滴定反应完全程度)
CM越大,滴定突跃越大,  越大突跃范围也越大
越大突跃范围也越大
 金属离子能被准确滴定的条件是:
金属离子能被准确滴定的条件是:
l  金属指示剂的变色原理
金属指示剂的变色原理
滴定前加入指示剂:
 游离态颜色 络合物颜色
游离态颜色 络合物颜色
滴定开始至终点前:
MY无色或浅色,以MIn形成背景颜色
 终点:
终点:
络合物颜色 游离态颜色
络合物颜色(+MY的颜色)→游离态颜色(+MY的颜色)
l Ca2+、 Mg2+混合溶液中Ca2+的测定: 调节pH>12,Mg2+变成Mg(OH)2 ↓,从而不干扰 Ca2+的滴定——沉淀掩蔽
l Al3+的测定——返滴定法(Al3+与EDTA反应慢,Al3+要封闭指示剂, Al3+很容易水解)

(过量)

 (一定量过量)
(一定量过量)
