热力学一 试卷
一、选择题 ( 共15题 30分 )
1. 2 分 (0910)
在一容器(是由体积相等的两部分构成)内,置入1 mol理想气体,这1 mol理想气体分子全部处在一方的数学概率等于: ( )
(A) (1/2)L/[L] (B) 2L/[L]
(C) (1/2)L/[L] (D) 2L/[L]
2. 2 分 (0155)
非理想气体进行绝热自由膨胀时,下述答案中哪一个错误? ( )
(A) Q=0 (B) W=0
(C) ΔU=0 (D) ΔH=0
3. 2 分 (0983)
在一简单的(单组分,单相,各向同性)封闭体系中,恒压只做膨胀功的条件下,吉布斯自由能值随温度升高如何变化? ( )
(A) (¶G/¶T)p> 0
(B) (¶G/¶T)p< 0
(C) (¶G/¶T)p= 0
(D) 视具体体系而定
4. 2 分 (0074)
在一绝热箱中装有水,水中通一电阻丝,由蓄电池供电,通电后水及电阻丝的温度均略有升高,今以水和电阻丝为体系,其余为环境,则有: ( )
(A) Q < 0 , W = 0 , ΔU < 0
(B) Q = 0 , W < 0 , ΔU > 0
(C) Q > 0 , W = 0 , ΔU > 0
(D) Q < 0 , W = 0 , ΔU > 0
5. 2 分 (9031)
在101.325 kPa下,385 K的水变为同温下的水蒸气,对该变化过程,下列各式中哪个正确? ( )
(A) ΔS体+ΔS环>0 (B) ΔS体+ΔS环<0 (C) ΔS体+ΔS环=0 (D) ΔS体+ΔS环的值不能确定
6. 2 分 (0065)
有一高压钢筒,打开活塞后气体喷出筒外,当筒内压力与筒外压力相等时关闭活塞,此时筒内温度将: ( )
(A) 不变 (B) 升高
(C) 降低 (D) 无法判定
7. 2 分 (0890)
理想气体在绝热条件下,经恒外压压缩至稳定,此变化中的体系熵变DS体及环境熵变DS环应为: ( )
(A) DS体> 0 , DS环< 0
(B) DS体< 0 , DS环> 0
(C) DS体> 0 , DS环= 0
(D) DS体< 0 , DS环= 0
8. 2 分 (0424)
斜方硫的燃烧热等于 ( )
(A) SO2(g)的生成热
(B) SO3(g)的生成热
(C) 单斜硫的燃烧热
(D) 零
9. 2 分 (1003)
在标准压力p$下,383.15 K的水变为同温下的蒸气,吸热Qp。该相变过程中,哪个关系式不能成立? ( )
(A) ΔG < 0 (B) ΔH = Qp
(C) ΔSISO < 0 (D) ΔSISO > 0
*. 2 分 (0090)
下述说法中,哪一个错误? ( )
(A) 体系放出的热量一定等于环境吸收的热量
(B) 体系温度的降低值一定等于环境温度的升高值
(C) 热力学平衡时体系的温度与环境的温度相等
(D) 若体系1与体系2分别与环境达成热平衡,则此两体系的温度相同
11. 2 分 (0805)
2 mol H2和 2 mol Cl2在绝热钢筒内反应生成 HCl 气体,起始时为常温常压。则:( )
(A) ΔrU = 0,ΔrH = 0,ΔrS > 0,ΔrG < 0
(B) ΔrU < 0,ΔrH < 0,ΔrS > 0,ΔrG < 0
(C) ΔrU = 0,ΔrH > 0,ΔrS > 0,ΔrG < 0
(D) ΔrU > 0,ΔrH > 0,ΔrS = 0,ΔrG > 0
12. 2 分 (0278)
理想气体经历绝热不可逆过程从状态 1 (p1,V1,T1)变化到状态 2 (p2,V2,T2),所做的功为: ( )
(A) p2V2-p1V1
(B) p2(V2-V1)
(C) [p2V /(1-g)](1/V2g-1-1/V1g-1)
/(1-g)](1/V2g-1-1/V1g-1)
(D) (p2V2-p1V1)/(1-g)
13. 2 分 (0182)
下列的过程可应用公式ΔH=Q进行计算的是: ( )
(A) 不做非体积功,终态压力相同但中间压力有变化的过程
(B) 不做非体积功,一直保持体积不变的过程
(C) 273.15 K,p$下液态水结成冰的过程
(D) 恒容下加热实际气体
14. 2 分 (0238)
对于一定量的理想气体,下列过程可能发生的是: ( )
(1) 对外作功,同时放热
(2) 体积不变,而温度上升,并且是绝热过程,无非体积功
(3) 恒压下绝热膨胀
(4) 恒温下绝热膨胀
(A) (1),(4) (B) (2),(3)
(C) (3),(4) (D) (1),(2)
15. 2 分 (0085)
在体系温度恒定的变化中,体系与环境之间: ( )
(A) 一定产生热交换
(B) 一定不产生热交换
C) 一定产生热交换
(D) 温度恒定与热交换无关
二、填空题 ( 共10题 20分 )
16. 2 分 (9039)
对非缔合液体物质,在正常沸点时的蒸发熵约为 J·K-1·mol-1。
17. 2 分 (0258)
1 mol单原子分子理想气体,从p1=202 650 Pa,T1= 273 K在p/T=常数的条件下加热,使压力增加到p2= 405 300 Pa,则体系做的体积功W = J。
18. 2 分 (1282)
对于体系和环境之间既有能量又有物质交换的敞开体系来说,其熵的变化,一部分是由__________________________间相互作用而引起的,这部分熵称为熵流;另一部分是由___________________________的不可逆过程产生的,这部分熵变称为熵产生。
19. 2 分 (0257)
10 mol单原子分子理想气体的 (¶H/¶T)V = J·K-1 。
20. 2 分 (1034)
单原子理想气体的CV,m = (3/2)R, [(¶T/¶S)p] / [(¶T/¶S)V] 等于 _________ 。
21. 2 分 (0381)
在一绝热刚性容器中进行某一化学反应,该体系的内能变化为 ______ ,焓变化为 _______ 。
22. 2 分 (9026)
公式ΔS=nRln(V2/V1)+CVln(T2/T1)的适用范围是__________________________________
________________________。
23. 2 分 (0387)
300 K时,将2 mol Zn片溶于过量的稀硫酸中,若反应在敞口容器中进行时放热Qp,在封闭刚性容器中进行时放热QV,则QV -Qp= _______ J。
24. 2 分 (9029)
公式ΔmixS=-R∑BnBlnxB的应用条件是_________________________________
_______________________________________________________________________。
25. 2 分 (0839)
选择“>”、“<”、“=”中的一个填入下列空格:
若反应 C(s) + O2(g) = CO2(g) 在恒温、恒压条件下发生,其 ΔrHm< 0,若在恒容绝热条件下发生,则ΔrUm _____ 0,ΔrSm _____ 0。
三、计算题 ( 共 4题 40分 )
26. 10 分 (9009)
已知Hg(s)的熔点为234.15 K,熔化热为470 kJ·mol-1,Hg(l)的Cp, m/J·K-1·mol-1 =29.7-0.0067(T/K),
Hg(s)的Cp, m /J·K-1·mol-1 =26.78 。试求标准压力p$下,323.15 K的Hg(l)与223.15 K的Hg(s)的摩尔熵之差值。
27. 10 分 (0249)
某种理想气体从始态(p1,V1,T1)经由 (1) 1A2;(2)1B2;(3)1DC2 三种准静态过程 (quasi-static process) 变到终态(p2,V2,T2),如下图所示。试求各过程中体系所做的功、体系吸的热及体系内能的增量ΔU的表达式。假定其热容为一常数。
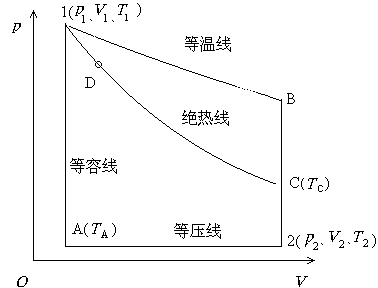
28. 10 分 (0984)
设有300 K的1 mol理想气体作等温膨胀,起始压力为15p$,终态体积为10 dm3。试计算该气体的DU, DH, DF, DS和DG。
29. 10 分 (1256)
请通过下列具体例子讨论偏摩尔量的测定方法,同时扼要叙述截距法要点。
在298 K,p$下,将物质的量为n2的NaCl溶于1000 cm3水中,所形成溶液的体积为V,
V与n2的关系由实验确定为:
四、问答题 ( 共 1题 10分 )
30. 10 分 (0766)
某气体状态的方程为 (p+a/V2)V=RT, 其中 a 是常数,在压力不很大的情况下, 试求出 1mol 该气体从p1,V1经恒温可逆过程至 p2,V2 时的 Q,W,ΔU,ΔH,ΔS和ΔG。
力学一答案
一、选择题 ( 共15题 30分 )
1. 2 分 (0910) [答] (C)
2. 2 分 (0155) [答] (D)
3. 2 分 (0983) [答] (B)
(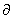 G/
G/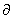 T)p= - S < 0
T)p= - S < 0
4. 2 分 (0074) [答] (B)
5. 2 分 (9031) [答] (A)
6. 2 分 (0065) [答] (C)
7. 2 分 (0890) [答] (C)
体系经历的变化为绝热不可逆变化,所以ΔS体> 0;环境与体系间没有热交换,
压力亦无变化,体积的变化可忽略,所以环境的状态未变, 即ΔS环= 0 (环境的体积变
化可忽略是基于下述认识,即一般情况下,总可以认为环境相对于体系是无穷大的)。
8. 2 分 (0424) [答] (A)
9. 2 分 (1003) [答] (C)
10. 2 分 (0090) [答] (B)
11. 2 分 (0805) [答] (C)
12. 2 分 (0278) [答] (D) 13. 2 分 (0182) [答] (C)
14. 2 分 (0238) [答] (A)
15. 2 分 (0085) [答] (C)
二、填空题 ( 共10题 20分 )
16. 2 分 (9039) [答] 88
17. 2 分 (0258)
[答] W=0 J
因为p/T=常数,当p2=2p1时,T2=2T1,即V2=V1
所以W=0
18. 2 分 (1282)
[答] 体系和环境 体系内部
19. 2 分 (0257)
[答] 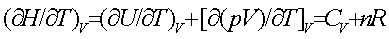 =208 J·K-1
=208 J·K-1
20. 2 分 (1034)
[答] 等于 0.6
因为 [(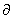 T/
T/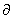 S)p]/[(
S)p]/[(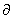 T/
T/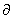 S)V] = CV/Cp= CV,m /Cp,m = 0.6
S)V] = CV/Cp= CV,m /Cp,m = 0.6
21. 2 分 (0381)
[答] 0;p2V2-p1V1
22. 2 分 (9026)
[答] 理想气体从始态p1,V1,T1经历任何过程到态终态p2,V2,T2。 (2分)
23. 2 分 (0387)
[答] QV -Qp=-ΔnRT= -4988 J
24. 2 分 (9029)
[答] 封闭体系平衡态、理想气体、等温混合,混合前每种气体单独存在时的压力都相等,且等于混合后的总压力。
25. 2 分 (0839)
[答] = >
三、计算题 ( 共 4题 40分 )
26. 10 分 (9009)
9009
[答]
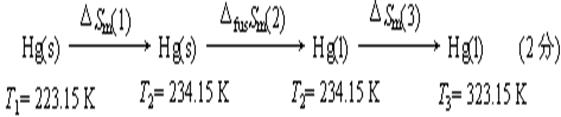
其摩尔熵之差为:
ΔSm=ΔSm(1) +ΔfusSm+ ΔSm(3 )
= p,m(S)dT/T+ ΔfusHm/T2+
p,m(S)dT/T+ ΔfusHm/T2+  p,m(l)dT/T (3分)
p,m(l)dT/T (3分)
=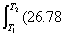 J·K-1·mol-1)dT/T +ΔfusHm/T2
J·K-1·mol-1)dT/T +ΔfusHm/T2
+ 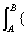 [29.7-0.0067(T/K)] J·K-1·mol-1}dT/T (2分)
[29.7-0.0067(T/K)] J·K-1·mol-1}dT/T (2分)
= (26.78 J·K-1·mol-1)ln(234.15 K/223.15 K)+470×103 J·mol-1 /234.15 K
+ (29.7 J·K-1·mol-1) ln(323.15 K/234.15 K)
- (0.0067 J·K2·mol-1)×(323.15 K-234.15 K)
= 2.02×103 J·K-1·mol-1 (3分)
27. 10 分 (0249)
[答] (1) Q1=CV (TA-T1)+Cp(T2-TA)
W1=p2(V2-V1)
ΔU1=Q1-W1=CV (T2-T1) (3分)
(2) Q2=ΔU2+W2=CV (T2-T1)+RTln(V2/V1)
W2=RTln(V2/V1)
ΔU2=CV (T2-T1) (3分)
(3) W3=(p2V2-p1V1)/(1-γ)= -CV(TC-T1)
ΔU3=CV (T2-T1)
Q3=ΔU3+W3=CV (T2-TC) (4分)
28. 10 分 (0984)
[答] 该过程是理想气体等温过程,故
ΔU =ΔH = 0
始态体积 V1为:
V1= nRT/p1
= (1mol)(8.314 J·K-1·mol-1)(300 K)/(15×101.325 kPa)
= 1.64 dm3 (2分)
ΔS = nRln(V2/V1)
= (1mol)(8.314 J·K-1·mol-1)ln(10 dm3/1.64 dm3)
= 15.0 J·K-1 (2分)
ΔF = nRTln(V1/V2)
= (1 mol)(8.314 J·K-1·mol-1)(300 K)ln(1.64 dm3/10 dm3)
= - 4.51 kJ (2分)
ΔG =ΔF = - 4.51 kJ (2分)
29. 10 分 (1256)
1256
[答] (1) 求V2与n2的关系式及V1与n1的关系式:
V2=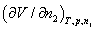
= { 16.6258 + 2.6607(n2/mol)1/2
+ 0.2388(n2/mol)} cm3·mol-1 (1分)
V1= (V-n2V2)/n1
其中 n1= (1000/18.02 ) mol = 55.50 mol (1分)
这样任何浓度下的偏摩尔体积便可求出。
(2) 截距法要点:
设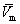 为体系的平均摩尔体积,则
为体系的平均摩尔体积,则
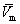 = V/(n1+n2) = (n1V1+n2V2)/(n1+n2)
= V/(n1+n2) = (n1V1+n2V2)/(n1+n2)
= x1V1+x2V2
= V1+ (V2-V1)x2 (1分)
故 (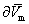 /
/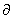 x2)T,p = V2- V1+ x1(
x2)T,p = V2- V1+ x1(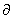 V1/
V1/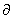 x1)T,p
x1)T,p
+ x2(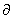 V2/
V2/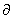 x2)T,p (1分)
x2)T,p (1分)
利用相关性,则 (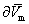 /
/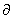 x2)T,p = V2- V1 (1分)
x2)T,p = V2- V1 (1分)
V1= V2- (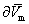 /
/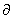 x2)T,p
x2)T,p
=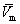 /x2- x1V1/x2- (
/x2- x1V1/x2- (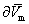 /
/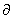 x2)T,p (1分)
x2)T,p (1分)
故 V1=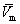 - x2(
- x2(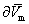 /
/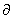 x2)T,p (1分)
x2)T,p (1分)
V2=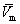 - x1(
- x1(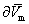 /
/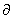 x2)T,p (1分)
x2)T,p (1分)
根据实验数据作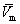 -x1图得一曲线,曲线上任一点切线与 x2= 0, x1= 1
-x1图得一曲线,曲线上任一点切线与 x2= 0, x1= 1
纵轴的截距即为V1,V2值。 (2分)
四、问答题 ( 共 1题 10分 )
30. 10 分 (0766)
0766
[答] p = (RT/V) -a/V2
W=∫pdV =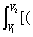 RT/V)-a/V2]dV
RT/V)-a/V2]dV
= RTln(V2/V1)+ a(1/V2-1/V1) (2分)
(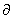 U/
U/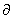 V)T = T(
V)T = T(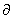 p/
p/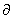 T)V- p = a/V2
T)V- p = a/V2
 =
=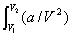 dV ΔU = a(1/V1- 1/V2) (3分)
dV ΔU = a(1/V1- 1/V2) (3分)
QR= ΔU + W = RTln(V2/V1) (1分)
ΔH =ΔU +Δ(pV) =ΔU + (p2V2- p1V1)
= ΔU + [(RT - a/V2) - (RT - a/V1)]
= a[(1/V1)-(1/V2)] + a[(1/V1)-(1/V2)]
= 2a[(1/V1)-(1/V2)] (2分)
ΔS = QR/T = Rln(V2/V1) (1分)
ΔG =ΔH - TΔS
= 2a[(1/V1- 1/V2)] - RTln(V2/V1) (1分)
